Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804On-line version ISSN 2357-3791
Rev.Colomb.Quim. vol.38 no.3 Bogotá Sep./Dec. 2009
LA ACTIVACIÓN DE LA VÍA DE SEÑALIZACIÓN PI3K/AKT POR EL FACTOR DE CRECIMIENTO SIMILAR A LA INSULINA TIPO II ESTIMULA LA EXPRESIÓN DEL mARN DE LA METALOPROTEINASA 9 EN CÉLULAS DE CORIOCARCINOMA
ACTIVATION OF THE PI3K/AKT SIGNALLING PATHWAY BY INSULIN-LIKE GROWTH FACTOR TYPE II STIMULATES METALLOPROTEINASE 9mRNA EXPRESSION IN CHORIOCARCINOMA CELLS
PERCURSO SINALIZAÇÃO PI3K/AKT ACTIVADO POR INSULINA-COMO FACTOR DE CRESCIMENTO TIPO II ESTIMULA METALOPROTEINASE 9 mARN EXPRESION CORIOCARCINOMA EM CÉLULAS
Martha L. Pinzón1,2, Luis E. Díaz1,3, Blanca L. Ortiz1, Adriana Umaña1, Stella C. de Rodríguez1, Myriam S. de Gómez1
1 Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia, sede Bogotá. Bogotá, Colombia. blortizq@unal.edu.co
2 Dirección actual: Unidad de Bioquímica, Facultad de Ciencias Naturales, Universidad del Rosario, Bogotá, Colombia. Martha.pinzon@urosario.edu.co
3 Dirección actual: Facultad de Ingeniería, Universidad de la Sabana, Chía (Cundinamarca), Colombia.
Recibido: 20/12/08 - Aceptado: 10/12/09
RESUMEN
Las metaloproteinasas 2 y 9 (MMP-2 y MMP-9) y el inhibidor-1 de MMP (TIMP-1) podrían contribuir a la regulación del comportamiento invasivo de las células trofoblásticas, efecto que podría ser mediado por el factor de crecimiento similar a la insulina tipo II (IGF-II), el cual regula el desarrollo y la función del trofoblasto en la interfase materno-fetal. El objetivo de este estudio fue investigar el rol de la vía de señalización PI3K/AKT activada por IGF-II en la expresión de MMP-2 y MMP-9 involucradas en el proceso de invasión en la línea celular JEG-3, de coriocarcinoma humano. La expresión del mARN de MMP-2, MMP-9 y TIMP-1 fue evaluada, en dichas células, por la técnica de RT-PCR empleando diferentes dosis de IGF-II y diferentes condiciones, mientras que la vía de señalización fue evaluada usando la técnica de Western blot. Se encontró que el IGF-II no contribuye a la proliferación de las células trofoblásticas; sin embargo, este promueve la expresión del mARN de MMP-9 y TIMP-1 pero no de MMP-2, de forma dependiente de la dosis. El efecto en la expresión de MMP-9 es mediado a través de IGF-II por la activación de la vía de señalización PI3K/ AKT después de la fosforilación del receptor de IGF-I (IGF-IR). De acuerdo con los resultados, se propone un modelo en el cual la interacción de IGF-II con IGF-IR conduce a la activación de PI3K/AKT y la subsecuente expresión y activación de MMP-9. Esta activación es un requisito esencial para el proceso invasivo.
Palabras clave: PI3K/AKT, metaloproteinasas, invasión, trofoblasto.
ABSTRACT
Metalloproteinases 2 and 9 (MMP-2 and MMP-9) and TissueInhibitor-1 ofMMPs (TIMP-1) could contribute to regulate the invasive behaviour of trophoblastic cells, effect which could be mediated by Insulin-like growth factor type II (IGF-II), which regulates the development and function of trophoblast at the foetal-maternal interface. The aim of this study was to investigate the role of the PI3K/AKT signalling pathway activated by IGF-II in the expression of MMP-2 and MMP-9 involved in the invasion process in the human choriocarcinoma cell line JEG-3. MMP-2, MMP-9 and TIMP-1 mARN expression in those cells were evaluated by RT-PCR using different IGF-II doses and conditions while signalling pathway was evaluated using Western blot. It was found that IGF-II does not contribute to trophoblastic cells proliferation, however, it promotes mARN expression of MMP-9 and TIMP-1, but not of MMP-2, in a dose-dependent way. The effect on MMP-9 expression is mediated through IGF-II activation of PI3K/AKT signalling pathway after phosphorylation of the IGF-I receptor (IGF-IR). According with the results a model is proposed in which the interaction of IGF-II with IGF-IR leads to PI3K/AKT activation and subsequent expression and activation of MMP-9. This activation is an essential requirement for the invasive process.
Key words: PI3K/AKT, metalloproteinases, trophoblast, invasion.
RESUMO
As metaloproteinasas 2 y 9 (MMP-2 y MMP-9) e o inibidor-1 de MMPs (TIMP-1) poderiam contribuir à regulação do comportamento invasivo das células trofoblásticas, efeito que poderia ser mediado pelo Factor de Crescimento Similar à Insulina tipo II (IGF-II), o qual regula o desenvolvimento e função do trofoblasto na interface materno-fetal. O objectivo deste estudo foi investigar o papel da via de sinalização PI3K/AKT activada por IGF-II na expressão de MMP-2 e MMP-9 envolvidos no processo de invasão na linha celular JEG-3, de coriocarcinoma humano. A expressão do mARN de MMP-2, MMP-9 y TIMP-1, foi avaliada, em ditas células, pela técnica de RT-PCR utilizando diferentes doses de IGF-II e diferentes condições, enquanto que a via de sinalização foi avaliada usando a técnica de Western-blot. Foi encontrado que o IGF-II não contribui à proliferação das células trofoblásticas, no entanto, este promoveu a expressão do mARN de MMP-9 e TIMP-1 mas não de MMP-2, de forma dependente da dose. O efeito na expressão de MMP-9 é mediado através de IGF-II pela activação da via de sinalização PI3K/AKT depois da fosforilação do receptor de IGF-I (IGF-IR). De acordo aos resultados é proposto um modelo, no qual a interacção de IGF-II com IGF-IR conduz à activação de PI3K/AKT e à subsequente expressão e activação de MMP-9. Esta activação é um requisito essencial para o processo invasivo.
Palavras-chave: PI3K/AKT, metaloproteinasas, invasão, trofoblasto.
INTRODUCCIÓN
Durante el embarazo, el proceso de invasión de las células trofoblásticas involucra la degradación y remodelación de la matriz extracelular, principalmente debido a las metaloproteinasas (MMP), una familia de enzimas proteolíticas dependientes de zinc. Las gelatinasas A/MMP-2 (metaloproteinasa 2) y B/MMP-9 (metaloproteinasa 9) degradan especialmente colágeno IV, el componente mayoritario de la matriz extracelular. Durante el primer trimestre, MMP-2 es expresada en las células del trofoblasto extravelloso, mientras MMP-9 es expresada principalmente en las células del citotrofoblasto velloso. Se ha establecido, in vitro, que las células citotrofoblásticas secretan MMP-2 y MMP-9, así como los inhibidores de metaloproteinasas TIMP-1 (Tissue Inhibitor of Metalloproteinase type 1) y TIMP-2 (Tissue Inhibitor of Metalloproteinase type 2) (1, 2). Estas secreciones son necesarias para la invasión del trofoblasto (3); sin embargo existe controversia en cuanto a cuál de las dos MMP es más importante en la invasión trofoblásti-ca. Librach y cols. aducen un papel más significativo de la MMP-9 frente a la MMP-2 en la invasión del trofoblasto (4), mientras que Staun-Ram y cols. sugieren que MMP-2 representa la principal gelatinasa en el trofoblasto temprano, y que podría ser la enzima clave de su invasión (5). La óptima migración y función invasiva de las células trofoblásticas son esenciales para el normal desarrollo de la placenta, asegurando un eficiente intercambio de moléculas clave entre la madre y el feto; de no ser así, es posible que se presente el desarreglo molecular que conduce a desórdenes hipoinvasivos del trofoblasto, tales como preclampsia, o a desórdenes hiperinvasivos, tal como ocurre en la enfermedad trofoblástica gestacional (ETG) que comprende, entre otros, a la mola hidatidiforme, la mola invasiva y el coriocarcinoma. Este último es un cáncer único en cuanto a que representa una transformación maligna de un tejido que tiene propiedades invasivas y metastásicas inherentes (6). Por esto es importante establecer los mecanismos que regulan la expresión de las metaloproteinasas como mediadores del proceso invasivo en la ETG, proceso complejo similar a la invasión tumoral que involucra la proteólisis local de la matriz extracelular, el ataque celular, la migración, y también la inhibición de estos procesos. Los trofoblastos, durante el proceso de implantación, derivan en varios tipos celulares: las células citotrofoblásticas, que se localizan en la zona más externa del vello de anclaje, o células del trofoblasto extravelloso que presentan propiedades invasivas, y las células citotrofoblásticas que fusionan para generar el sincitiotrofoblasto (7). La diferenciación del trofoblasto extravelloso es regulada por numerosos factores de crecimiento, así como también por proteínas de la matriz extracelular y moléculas de adhesión expresadas en la interfase materno-fetal. Estas moléculas regulatorias controlan la invasión celular a través de diferentes vías de señalización, modulando la actividad del sistema de proteasas que se adhieren y degradan la matriz ex-tracelular. Mientras que un número creciente de vías de señalización está siendo estudiado, los efectores corriente abajo, tales como factores de transcripción, aún se desconocen (8). Muchos factores estimulan la proliferación de las células trofoblásticas sin influir en su invasividad; no obstante, se ha demostrado que existen dos factores que estimulan sus funciones migratorias e invasivas, sin ningún efecto en la proliferación. El factor de crecimiento similar a la insulina tipo II (IGF-II), producido por el trofoblasto, y la proteína de unión a IGF (IGFBP-1), producida por la decidua, independientemente, estimulan la migración de estas células, como también la invasión (9). El IGF-II regula el desarrollo y la función del trofoblasto en la interfase materno-fetal. Durante el comienzo de la gestación, elIGF-II se expresaabundantementeenla placenta, y podría regular el comportamiento invasivo de las células trofoblásticas (10). Esta habilidad invasiva de las células citotrofoblásticas radica en su capacidad de secretar metaloproteinasas (MMP), e inhibidores de metaloproteinasas (TIMP). La expresión anormal de estas metaloproteinasas parece contribuir a varios procesos patológicos que incluyen el crecimiento tumoral, la invasión y la metástasis (11). Diferentes estudios han demostrado que los factores de crecimiento similares a la insulina (IGF), así como sus receptores, tienen un papel significativo en la promoción, progresión y recurrencia de varios tipos de cáncer (12, 13), y estas actividades pueden involucrar diversas vías de señalización activadas por los IGF. La señalización celular es controlada por proteínas tipo quinasas a través de pasos secuenciales de fosforilación. Entre estas proteínas, la subunidad regulatoria p85 de la fosfatidilinositol-3-quinasa (PI3K), predominantemente activada por receptores tirosina quinasa, regula funciones celulares importantes para la célula, tales como crecimiento, supervivencia y migración; la activación irregular de esta vía ha sido asociada con el desarrollo de enfermedades como el cáncer. El blanco corriente abajo más importante para PI3K es la proteína quinasa B (PKB o AKT) (serina/treonina-quinasa), la cual fosforila proteínas involucradas en supervivencia celular. La activación de AKT ha sido detectada en diferentes cánceres humanos, y su sobreexpresión ha sido descrita en cáncer deseno, colon, ovario, páncreas y próstata (14). En líneas celulares derivadas de coriocarcinoma están presentes receptores de IGF-I de alta afinidad, por lo cual se sugiere que IGF-I e IGF-II estarían involucrados en el crecimiento desmedido de estas células (15).
Empleando la línea celular JEG-3 como modelo celular de trofoblasto humano, este estudio tuvo como objetivo determinar si la vía de señalización PI3K/AKT medía la regulación de la expresión de las metaloproteinasas 2 y 9 (MMP-2 y MMP-9) por efecto del factor de crecimiento similar a la insulina tipo II (IGF-II) en células de coriocarcinoma. De esta manera se espera aportar al estudio de la ETG, a la vez que contribuir a ampliar el conocimiento de los factores que favorecen la invasividad celular, estrechamente relacionada con la agresividad del cáncer.
MATERIALES Y MÉTODOS
Cultivo celular
Se empleó la línea celular de coriocarcinoma JEG-3, procedente de la ATCC (American Type Cell Collection) y donada por el Instituto Karolinska (Suecia). La línea celular de coriocarcinoma humano JEG-3 fue establecida en cultivo en 1966 de un coriocarcinoma posparto, el cual ha sido trasplantado en forma seriada en hámsters. En cultivos continuados, estas células han mantenido varias características del trofoblasto normal, han sido ampliamente utilizadas como modelo de trofoblasto de placenta y 80-90% de ellas son citotrofoblasto (16).
La línea celular fue cultivada en medio DMEM (Dulbeco's Eagle Medium) (SIGMA) suplementado con suero fetal bovino al 10% (GIBCO), 2 mM L-glutamina, 1% aminoácidos esenciales, 50 UI/mL de penicilina, 50 ug/mL de estreptomicina y 25 ng/mL de anfotericina), mantenida a 37 °C en atmósfera húmeda y CO2 al 5%.
Ensayo de proliferación celular por efecto del IGF-II
Con el propósito de determinar el efecto del IGF-II sobre la proliferación de las células JEG-3, fue necesario eliminar el efecto propio de este factor contenido en el suero fetal bovino, el cual puede interferir. Se establecieron entonces las condiciones más favorables para que el proceso ocurriera sin que hubiese un estímulo diferente al ejercido por IGF-II. Con el fin de descartar efectos positivos sobre la proliferación celular, se realizó un ensayo de proliferación en ausencia y en presencia de los siguientes mitógenos: suero fetal bovino (SFB 0,1 y 10%), albúmina sérica bovina (BSA 0,5%) e IGF-II (10 nM). Se empleó la técnica del MTT (sales de tetrazolium), que consiste en la cuantificación de células vivas que son clivadas para generar sales de formazán que absorben a una longitud de onda de 550 y 600 nm. El ensayo se hizo sembrando 20.000 células en cajas de 96 pozos que, llevadas a un volumen final de 100, µL con medio de cultivo, se incubaron a 37 oC y 5% CO2. Las células fueron deprivadas de suero durante 12 horas y luego se incubaron por periodos de 24, 48 y 72 horas. Después de cada periodo de incubación, se añadieron 10, µL de MTT a cada pozo y se incubó por 4 horas en las mismas condiciones. Al cabo de este tiempo se adicionaron 100 ,µL de dimetil sulfóxido (DMSO) (ALDRICH) en cada pozo para solubilizar los cristales. Se revisó que hubiera una solubilización completa y se midió la absorbancia a 550 y 600 nm en un lector de Elisa. Los ensayos se hicieron por triplicado.
Para determinar el efecto del estímulo con IGF-II sobre la proliferación celular, se sembraron 20.000 células en cajas de 96 pozos en medio DMEM suplementado con SFB al 10%. Las células fueron deprivadas de SFB durante 12 horas, y posteriormente se adicionó IGF-II (0, 1, 10 y 100 nM), incubando por periodos de 24, 48 y 72 horas. Se utilizó la técnica del MTT, y los ensayos se hicieron por triplicado.
Efecto del IGF-II sobre la expresión de receptores IGF, MMP y TIMP-1
Se determinó el efecto del estímulo con IGF-II sobre la línea celular JEG-3 a diferentes concentraciones de IGF-II (0, 1, 10 y 100 nM) y a las 24 horas, sobre la expresión de los receptores del sistema IGF, de las metaloproteinasas 2y9yde TIMP-1, por la técnica RT-PCR (Transcripción reversa-Reacción en cadena de la polimerasa). Inicialmente se hizo una extracción del ARN total proveniente de las células estimuladas empleando el reactivo Trizol (Invitrogen), según instrucciones de la casa productora. A partir del ARN total extraído se realizó la síntesis del cADN empleando el kit de RT-PCR SuperScript II (Invitrogen).
Posteriormente se hizo la amplificación de los genes correspondientes a partir del cADN, empleando "iniciadores" específicos (Invitrogen). Como control se coamplificó un gen de expresión casero, como es el gen de la gliceraldehído-3-fosfato deshidrogenasa (GAPDH). Las condiciones de amplificación de cada uno de los genes por PCR se estandarizaron previamente. Los resultados se analizaron por densitometría empleando el programa de Biorad (Quantity One V. 4.1.1). Los programas para la PCR de cada gen y los iniciadores específicos seleccionados para la amplificación se muestran en la Tabla 1 (17-20).
Igualmente, se hizo la determinación de la expresión de los receptores del sistema IGF, como también de las metalopro-teinasas 2 y 9 y de TIMP-1, estimulando las células con IGF-II en una concentración de 10 nM a diferentes tiempos (0, 3, 6, 9, 12 y 24 horas), tomando como control las células sin estímulo a los diferentes tiempos. Estos ensayos se hicieron por triplicado.
Para evaluar si la regulación de la expresión del mARN de las metaloproteinasas 2 y 9 involucra la vía PI3K, las células fueron tratadas con LY294002 (inhibidor específico de esta vía) en una concentración de 20 µmol/L y con IGF-II 10 nM. En platos de 60 mm que contenían 500.000 células, se adicionó el inhibidor disuelto en DMSO una hora antes de la adición del estímulo de IGF-II (10 nM, 24 horas) y como controles se tomó un plato con DMSO, uno con IGF-II y uno con el inhibidor. Posteriormente se hizo la extracción del mARN y se obtuvo el cADN para hacer la amplificación de las MMP de interés utilizando la técnica de RT-PCR.
Determinación de proteínas involucradas en la señalización celular por efecto del IGF-II
Se empleó la técnica del Western blot para determinar la actividad de las proteínas IGF-IR y PI3K. Se tomaron extractos de proteína total de células estimuladas con IGF-II 10 nM a diferentes tiempos (0, 5, 15, 30 y 60 minutos), empleando para ello buffer RIPA (Tris-HCl 20 mM, pH 7,5, NaCl 150 mM, Igepal NP-40 1%, EDTA 5 mM, pirofosfato de sodio 10 mM, con 1 mM de ortovanadato de sodio, 2 µg/mL leupeptina, 2 µg/mL pepstatina y2 µg/mL aprotinina).
La inmunoprecipitación de proteínas fosforiladas se realizó partiendo de 0,5 mg de proteína obtenida de las células en cultivo, y se cuantificó por el método de Bradford (21). A esta proteína se le adicionó el anticuerpo primario, y se incubó toda la noche con rotación constante a 4 oC. Posteriormente, se le adicionó proteína-A-agarosa, dejando nuevamente en incubación por una hora a 4 oC. El inmuno complejo se lavó tres veces en buffer Tris-Cl 50 mM, pH 8,0, se le adicionó 30 µL de buffer carga 2x y se hirvió por 5 minutos. Los extractos proteicos se separaron por electroforesis en geles de poliacrilamida (SDS-PAGE) y se transfirieron a membranas de nitrocelulosa. Los análisis de Western blot se realizaron inicialmente bloqueando las membranas durante toda la noche, con leche descremada al 5% o con BSA al 5% (para análisis con antifosfotirosina PY-20) en TBS. Luego las membranas fueron incubadas con los respectivos anticuerpos primarios por una hora a temperatura ambiente, seguido de la incubación con anticuerpo secundario acoplado a peroxidasa. La detección de las proteínas se realizó utilizando el kit ECL (Amershan Pharmacia Biotech). En este caso se utilizaron anticuerpos contra el receptor de IGF-I (anti-IGFIR monoclonal 3B7), y contra la enzima PI3K (anti-PI3K monoclonal B-9 contra la subunidad p85), provenientes de Santacruz Biotechnologies. La fosforilación de cada una de estas proteínas se verificó usando los anticuerpos antifosfotirosina de cada una de las proteínas antes mencionadas. Con el fin de determinar la inhibición de la vía PI3K/AKT, esta fue bloqueada con el inhibidor de PI3K (LY294002 20 µM) durante una hora, y posteriormente se adicionó el estímulo con IGF-II 10 nM, durante 15 minutos (22).
Análisis estadístico
Los ensayos fueron hechos por triplicado en todos los casos. Los datos se reportan como el promedio +/- SEM. Los grupos experimentales se compararon por análisis de varianza (ANOVA). Las diferen-ciasseconsideraronsignificativasapartir de P < 0,05.
RESULTADOS Y DISCUSIÓN
En este trabajo se buscó establecer la relevancia que tiene el factor de crecimiento similar a la insulina tipo II (IGF-II) en los procesos de proliferación, invasión y expresión de las metaloproteinasas 2y9involucradas en el proceso invasivo, en células de citotrofoblasto. Inicialmente se evaluó la proliferación celular del trofoblasto por efecto del IGF-II de acuerdo con la Figura 1, comparando con la adición al medio de otros mitógenos (Figura 1A), y se encontró que la proliferación de las células trofoblásticas por efecto del factor de crecimiento tipo II, a diferentes tiempos, no se ve afectada. Sin embargo, se quiso considerar si variando la concentración de IGF-II, la proliferación variaba con el tiempo (24, 48 y 72 horas) (Figura 1B). Seencontróquealosdiferentes tiempos no hubo un aumento importante en la proliferación comparando entre grupos. Estos resultados están de acuerdo con lo reportado por Hamilton y colaboradores, quienes evaluando la proliferación por el método de incorporación de [3H]timidina (3H-TdR) demostraron igualmente que el IGF-II no altera la proliferación celular del trofoblasto (23).
¿Será más significativo entonces el efecto del IGF-II para la invasión que para la proliferación de las células trofoblásticas? ¿Cuál es la importancia del IGF-II para el proceso de implantación? Han y colaboradores expresan que el IGF-II es más abundante que el IGF-I en todo el periodo gestacional. IGF-II mARN se expresa en el citotrofoblasto velloso, en el trofobasto intermedio, mas no en el sincitiotrofoblasto durante el primer trimestre; la expresión de IGF-II en las células invasivas de citotrofoblasto sugiere que el IGF-II puede tener un papel significativo en el proceso invasivo de estas células. El hecho de que la línea celular de coriocarcinoma JEG-3 exprese mARN de IGF-II pero no mARN de IGF-I sería una evidencia adicional (24). Los distintos patrones espaciales de expresión tanto de IGF-II como de IGFBP-1 en la interfase materno-fetal sugieren una interacción paracrina entre el IGF-II expresado en las células citotrofoblásicas invasoras y la IGFBP-1 derivada de la decidua de la madre. Así es como la exitosa
implantación, el desarrollo de la placenta y el crecimiento fetal dependerán de una adecuada invasión del trofoblasto intermedio del vello de anclaje en la decidua materna para tener acceso a los vasos sanguíneos de la madre (25). La invasión del trofoblasto en la pared uterina es controlada por muchos factores. El efecto del IGF-II en la invasión de las células trofoblásticas usando la técnica de matrigel ha sido demostrado (24, 26). Tomando como referencia los resultados obtenidos en estos estudios, el tiempo máximo de invasión se encontró a las 24 horas después de haber aplicado el estímulo con IGF-II 10 nM. Posteriormente, variando las dosis de IGF-II, se halló que hay un efecto del IGF-II en la invasión trofoblástica, tal como fue reportado por Hamilton y cols., quienes emplearon trofoblasto extravelloso extraído de placentas de primer trimestre. El efecto del IGF-II sobre el proceso invasivo es dependiente de la dosis (23).
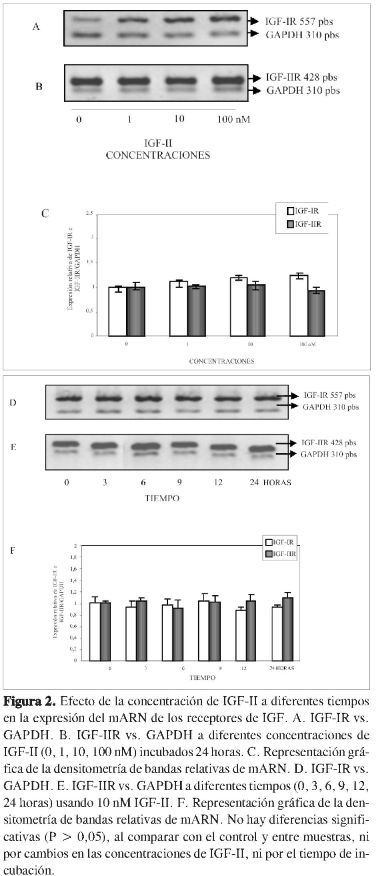
Se ha demostrado la expresión de receptores del sistema IGF en el trofoblasto extravelloso (27), así como en líneas celulares de coriocarcinoma. En este estudio, utilizando la línea celular JEG-3, se evaluó la expresión del receptor de IGF-I (IGF-IR) y del receptor de IGF-II (IGF-IIR), a diferentes concentraciones de IGF-II y a diferentes tiempos de estímulo, encontrando que no hay diferencias significativas en ninguno de los casos (Figura 2). En estudios paralelos se demostró que la vía de señalización PI3K estaría implicada en el proceso invasivo de las células JEG-3, pues al inhibir la vía, la invasión se reduce considerablemente. Se demostró también que al inhibir la vía de señalización MAPK, la invasión se reduce de forma notoria (26). Estos resultados demuestran que debe haber una regulación coordinada de estas vías en la invasión trofoblástica inducida por IGF-II, tal como ocurre con el factor de crecimiento epidermal, de acuerdo con Qing Qiu y cols. (20, 8). Igualmente Mckinnon T. y cols. (9) demostraron la importancia de la participación de la vía MAPK en la migración trofoblástica inducida por IGF-II. En otros tipos de cáncer, la vía de señalización PI3K ha mostrado ser la más relevante en la migración celular, como es el caso de las células de melanoma (28). Otros factores que afectan la invasión de las células trofoblásticas son el factor de crecimiento epidermal (EGF), que actúa a través de su propio receptor, así como también la hormona gonadotropina coriónica (hCG), la cual tiene receptores en el trofoblasto invasivo (20, 29).
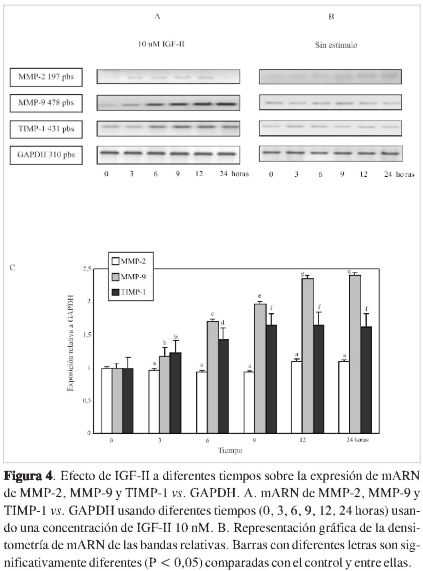
Utilizando diferentes líneas celulares de trofoblasto extravelloso, Lala y cols. (30) encontraron que los mecanismos moleculares responsables por su invasividad son idénticos a aquellos que utilizan las células de cáncer; sin embargo, en la placenta este mecanismo es controlado espacial y temporalmente. Es así como la expresión de las metaloproteinasas que degradan la matriz extracelular es regulada de forma precisa en la placenta, regulando a su vez la invasión trofoblástica. La actividad de las MMP es regulada a diferentes niveles por mecanismos tales como transcripción génica, secreción, activación, inhibición y glicosilación. De esta manera varias hormonas, como también algunos factores de crecimiento, regulan esta actividad. Las metaloproteinasas han sido reconocidas como elementos importantes de la invasión placental (3). Esto da lugar a la pregunta: ¿El efecto del IGF-II sobre el proceso invasivo se deberá a un incremento en la migración celular o a un incremento en la secreción de las metalo-proteinasas 2 y 9? Esto último fue lo que se quiso demostrar evaluando el efecto del IGF-II sobre la expresión de mARN de MMP-2 y MMP-9 variando la concentración de IGF-II (Figura 3) y variando el tiempo de estímulo (Figura 4), empleando las condiciones a las cuales se dio una invasión óptima (IGF-II 10 nM y 24 horas). Se demostró que se aumenta la expresión de mARN de la MMP-9, mas no la de MMP-2 por efecto del IGF-II, y que este aumento es dependiente de la dosis (Figura 3). Aunque MMP-2 y MMP-9 tienen similar especificidad por su sustrato, existen diferencias en su expresión en respuesta a IGF-II. Algunos reportes demuestran que esto ocurre igualmente por efecto de EGF en diferentes líneas celulares (31, 32). Por otra parte, se ha demostrado que interleukina-l(IL-l), leptina y el factor alfa de necrosis tumoral (TNF-a) incrementan la expresión de MMP-9, pero no tienen efecto alguno sobre la actividad de MMP-2 en células de citotrofoblasto humano (33). La MMP-2 puede ser una metaloproteinasa constitutiva de las células citotrofoblásticas; de ahí que no se vea afectada por ningún factor externo, como se ha visto generalmente en las diferentes investigaciones ya mencionadas.
En este estudio se encontró que hubo un incremento en la expresión de estas MMP, lo cual sugiere una regulación temporal de la invasión y de la expresión de MMP por IGF en estas células. Se ha visto que IGFBP-1 no modifica los efectos de IGF-II en el número de células o en la producción de MMP (3). De acuerdo con algunos autores, la expresión de mARN se correlaciona con la secreción de la enzima (34), lo cual permitiría correlacionar este resultado con el efecto de IGF-II en la invasión. De esta manera se puede concluir que la metaloproteinasa 9 es la que desempeña un papel más importante en el proceso de invasión de las células trofoblásticas derivadas de coriocarcinoma por efecto del IGF-II. Esto estaría más acorde con lo reportado por Librach y cols., quienes aducen un papel más significativo de la MMP-9 frente a la MMP-2 en la invasión del tro-foblasto (4); sin embargo, Staun-Ram y cols. sugieren que MMP-2 representa la principal gelatinasa en el trofoblasto temprano, y que podría ser la enzima clave de la invasión tanto para células de trofoblasto de 6 a 8 semanas, como para células de trofoblasto de la línea celular de coriocarcinoma JAR (5). En estudios realizados por Isaka y cols. utilizando células de citotrofoblasto de placenta normal, encuentran por inmunohistoquímica que hay expresión, principalmente, de MMP-2 en el trofoblasto extravelloso y de MMP-9 en el citotrofoblasto velloso, e inhibiendo con anticuerpo contra MMP-2 la invasión se redujo de forma dependiente de la dosis. Así, ellos sugieren que la habilidad invasiva de las células trofoblásticas estaría regulada por la actividad de la MMP-2 principalmente (1). Morgan y cols. han sugerido que la metaloproteinasa clave en el proceso invasivo es la MMP-9. Ellos comparan la línea celular de trofoblasto ED77 y la línea celular de coriocarcinoma BeWo, las cuales tienen un patrón de expresión de metaloproteinasas muy diferente, siendo la más representativa para ED77 la MMP-9 y para la BeWo la MMP-2. Los ensayos de invasión en matrigel demuestran que la línea celular ED77 tiene un índice de invasión mucho más alto que la línea celular BeWo, la cual por sí misma no invade (2). Esto demuestra igualmente que la metaloproteinasa clave en este proceso es la MMP-9.
En otros casos de cáncer se ha demostrado el efecto del IGF-II sobre la expresión de las metaloproteinasas 2 y 9, por ejemplo en células de cáncer de pulmón donde el estímulo con IGF II demostró un aumento en la expresión y en la actividad de la forma latente de MMP-2 y MMP-9 (35). De otro lado, la alta expresión de la MMP-9 ha sido encontrada en diferentes tipos de cáncer; de allí el interés en el estudio de la regulación del gen de MMP-9, el cual se ha propuesto como un blanco contra el cáncer y contra enfermedades inflamatorias (36).
La coexpresión de MMP y TIMP ha sido demostrada en trofoblasto, sugiriendo que la propiedad invasiva de las células citotrofoblásticas depende de un adecuado balance entre MMP y TIMP (3). Es así como se evaluó la expresión de mARN de TIMP-1 en las células de coriocarcinoma JEG-3 por efecto del estímulo con IGF-II (Figura 3). TIMP-1 inhibe la forma activa de todas las MMP y la forma latente de MMP-9 (pro-MMP-9), y es el inhibidor más ampliamente distribuido. La expresión de mARN de TIMP-1 ha sido observada en embriones en todos los estados de desarrollo preimplantación (37). De acuerdo con la Figura 3, se observa un incremento en la expresión de TIMP-1 a medida que aumenta la concentración de IGF-II, y por efecto del tiempo; sin embargo, al mantener constante la concentración de IGF-II (10 nM), también se presenta aumento. Este incremento, en ambos casos, es inferior al aumento de la MMP-9, pero con una tendencia muy parecida. La expresión simultánea de MMP-9 y TIMP-1 por efecto de IGF-II podría tener explicación en las diferentes funciones de TIMP-1; en principio este podría estar generándose como respuesta a una alta invasión, inducida por efecto del IGF-II. TIMP-1 tiene otras funciones celulares adicionales a la regulación de MMP-9, que incluyen el control del crecimiento y diferenciación celular y la apoptosis. Estas actividades son distintas a la inhibición de MMP, y su mecanismo aún no ha sido esclarecido (37). Asimismo, estos resultados podrían explicarse por el hecho de que el promotor de MMP-9yTIMP-1contiene AP-1 y sitios de unión para Ets (38,39), y estos sitios de unión podrían ser activados por IGF-II, tal como ocurre con EGF (40, 41). Tanto Ets como AP-1 se requieren para el control de la expresión génica de TIMP-1 y MMP-9; así mismo se ha demostrado que la activación del factor NF/kB, activado por proteina quinasas, es necesario en la regulación de MMP-9 (36).
En este estudio se demostró que la ge-latinasa B (MMP-9), inducida por IGF-II, media la invasión de células trofoblásticas, así como también la expresión de TIMP-1; es decir, la regulación temporal y espacial de la invasión no sólo parece estar mediada por factores uterinos, vía paracrina, sino por factores trofoblásticos vía autocrina, como es el caso del IGF-II, confirmando con ello que los productos deciduales y trofoblásticos son reguladores autocrinos y paracrinos del proceso de invasión. Pero, ¿cómo actúan estos reguladores?
El objetivo general del presente estudio fue establecer el posible papel de la vía de señalización PI3K/AKT, activada por IGF-II, en la expresión de las metalo-proteinasas 2 y 9 (MMP-2 y MMP-9) involucradas en el proceso de invasión en la línea celular de coriocarcinoma humano JEG-3. La vía de señalización PI3K se origina con una activación del receptor tirosina quinasa, el cual una vez recibe a su ligando, se fosforila desencadenando una serie de fosforilaciones de proteínas corriente abajo, entre otras la PI3K y posteriormente la AKT. En algunos casos de cáncer se ha demostrado que esta vía conduce a la activación de efectores transcripcionales que se dirigen hacia el núcleo y que conducen a favorecer la expresión de las metaloproteinasas 2 y 9 (42, 43). En células de coriocarcinoma se ha demostrado la expresión de los receptores tirosina quinasa del sistema IGF, lo cual igualmente se ve en la Figura 2, sugiriéndose que por efecto del estímulo con IGF-II esta vía sería activada, lo cual se demuestra en este estudio. Se evaluó, por Western blot, el efecto del IGF-II sobre la expresión del receptor IGF-IR y de la proteína PI3K fosforilada y total, encontrando que la fosforilación del IGF-IR desencadenada por IGF-II estimula a su vez la activación de PI3K (Figura 5). Así mismo, al evaluar el efecto del inhibidor LY294002, se mostró que la expresión de PI3K inducida por IGF-II se bloquea. La evaluación de la expresión de mARN de MMP-9 y de TIMP-1 utilizando el inhibidor LY294002 específico para PI3K, demostró que la expresión de MMP-9 y TIMP-1 se redujo notoriamente (Figura 6). Según la densitometría, la reducción en la expresión de mARN para MMP-9 es de 45% y para TIMP-1 es de alrededor de 40%. Se ha demostrado que NFc B es un elemento crítico en la regulación de MMP-9 (36). La vía de señalización PI3K/AKT conduce a la activación, corriente abajo, del factor NFc B, el cual se activa por fosforilación/degradación de Ic B, proteína inhibitoria de NFkB. De esta manera, NFkB migra al núcleo donde ejerce su actividad transcripcional. Es decir, que de acuerdo con nuestros resultados, la activación de esta vía estaría involucrada en el proceso de invasión de las células citotrofoblásticas por efecto del IGF-II, y a su vez en la inducción de la expresión de la metaloproteinasa 9 como encargada de la degradación de la matriz extracelular. La vía fosfatidilinositol 3-quinasa (PI3K-AKT) se ha reconocido como un nuevo blanco terapéutico (44), ya que regula un espectro muy amplio de procesos celulares, como son la proliferación, la supervivencia celular, la migración, la invasión, y, como también se ha demostrado en los últimos años, la expresión de las metaloproteinasas 2 y 9 en diferentes tipos de cáncer. En este estudio se demostró que en células de coriocarcinoma humano esta vía regula la expresión de ARNm de MMP-9 por efecto del estímulo con IGF-II. Factores transcripcionales regulados por la vía de señalización MAPK, implicados en la regulación de MMP-9, han sido demostrados: es el caso de Ets y AP-1 (39). Varios estudios han demostrado la intervención de esta vía en la regulación de la expresión de MMP-9 activada por factores de crecimiento, mi-togenos y hormonas, como también por otros mecanismos (36, 45). Uno de los primeros estudios que involucran a MAPK en la expresión génica de MMP-9 fue reportado por Gum y cols. (46). De acuerdo con los resultados obtenidos, en la Figura 6 se demostró la inhibición de la expresión de mARN de MMP-9 y TIMP-1 por efecto del inhibidor de la vía MAPK, PD98059, confirmando que esta vía también estaría involucrada en la regulación de la expresión de mARN de MMP-9 y TIMP-1. Estos resultados no serían atribuibles a efectos citotóxicos del inhibidor o del vehículo empleado, como es el DMSO, pues el control no se ve alterado, ni tampoco hay alteración en la expresión del GAPDH. De esta manera se sugiere que la expresión de TIMP-1 y MMP-9 podría estar regulada por diferentes vías de transducción coordinadas.
De acuerdo con la Figura 2, IGF-II no altera la expresión de mARN de IGF-IR e IGF-IIR; sin embargo, por el ensayo de Western blot, en la Figura 5 se pudo ver que IGF-IR como proteína se activa por efecto del estímulo con IGF-II, demostrado en la fosforilación del receptor, el cual es la forma activa del mismo. Esto estaría indicando que cambios en la expresión de los receptores no es posible notarlos por evaluación de la expresión de mARN, quizás porque la respuesta es muy rápida. IGF-II puede estimular la activación del receptor tipo I, pero también del receptor de insulina, isoforma A, el cual media efectos mitogénicos (47). En las muestras de tejido de mola hidatidiforme se demostró que la expresión del receptor tipo II no se altera en esta patología (17), situación que podría estar indicando que la acción del IGF-II sería mediada a través del IGF-IR o posiblemente a través del receptor de insulina isoforma A, pues estos dos receptores presentan alta homología, e incluso dan lugar a la formación de receptores híbridos entre ellos dos (48).
Este estudio, junto con los resultados obtenidos en trabajos realizados previamente (49) en los cuales se utilizó tejido de molas hidatidiformes, encontró una estrecha relación entre el IGF-II, la expresión de MMP y la respuesta invasiva, a través de la vía de señalización PI3K/ AKT; de ahí que se propone el siguiente modelo para explicar la acción del IGF-II en el tejido trofoblástico (Figura 7). El factor de crecimiento similar a la insulina tipo II (IGF-II) inicia su acción mitogénica por activación del receptor IGF-IR, el cual, una vez se fosforila, desencadena la fosforilación de PI3K y MEK, que a su vez promueven la activación de otras proteínas como AKT; esta fosforila activadores transcripcionales de la metaloproteinasa MMP-9 y del inhibidor de metaloproteinasa TIMP-1. La MMP-9, unida a TIMP-1 por acción de otras MMP, se activa y promueve finalmente la degradación de la matriz extracelular, paso necesario para la invasión tumoral.
AGRADECIMIENTOS
Las autoras agradecen al doctor Amílcar Flórez por la línea celular JEG-3, a Col-ciencias, a la Universidad Nacional de Colombia, y a los doctores Udo Markert y Gernot Dessoye, por su ayuda en la discusión de estos resultados.
REFERENCIAS BIBLIOGRÁFICAS
1. Isaka, K.; Usuda, S.; Ito, H.; Sagawa, Y.; Nakamura, H.; Nishi, H. et al. Expression and activity of matrix metalloproteinase 2 and 9 in human trophoblast. Placenta. 2003. 24: 53-64. [ Links ]
2. Morgan, M. Expression of metalloproteinases and their inhibitors in human trophoblast continous cell lines. Exp. Cell. Res. 1998. 242: 18-26. [ Links ]
3. Cohen, M.; Bischof, P. Metalloproteinases and human placental invasiveness. Placenta. 2006. 27 (8): 783-793. [ Links ]
4. Librach, C. L.; Werb, Z.; Fitzgerald, M. L.; Chiu, K.; Corwin, N. M.; Esteves R. A. et al. 92-kD type IV collagenase mediates invasion of human cytotrophoblasts. J. Cell. Biol. 1991. 113: 437-449. [ Links ]
5. Staun-Ram, E.; Goldman, S.; Gabarin, D.; Shaley, E. Expression and importance of matrix metalloproteinase 2 and 9 (MMP-2 and -9) in human trophoblast invasion. Reprod. Biol. Endocrinol. 2004. 2: 59. [ Links ]
6. Ezpeleta, M.; López, A. Enfermedad trofoblástica gestacional. Aspectos clínicos y morfológicos. Revista Española de Patología. 2002. 35 (2): 187-200. [ Links ]
7. Bischof, P.; Irminger-F., I. The human cytotrophoblastic cell, a mononuclear chameleon. Int. J. Biochem. CellBiol. 2005. 37: 1-16. [ Links ]
8. Polheimer, J.; Knofler, M. Signalling pathways regulating the invasive differentiation of human trophoblast: a review. Placenta. 2005. 26. Supplement A.: S21-30. [ Links ]
9. Mckinnon, T.; Chakraborty, Ch.; Gleeson, L. M.; Chidiac, P.; Lala, P. Stimulationofhumanextravillous trophoblast migration by IGF-II is mediated by IGF Type 2 Receptor involving inhibitory G protein(s) and phosphorylation of MAPK. J. Clin. Endocrin. Metabolism. 2001. 86 (8): 3665-3674. [ Links ]
10. Timothy, R. H.; de Vrijer, B.; Russell, A. The IGF-II-deficient placenta: aspects of its function. Trends in Endocrinology and Metabolism. 2002. 13 (10). December: 410-412. [ Links ]
11. Duffy, M. J. Metalloproteinases: role in breast carcinogenesis, invasion and metastasis. Breast Cancer Res. 2000. 2: 252-257. [ Links ]
12. Rong-Hao, Li; Lin-Zhi, Zhuang. The effects of growth factors on human placental cytotrophoblast cell proliferation. Human Reproduction. 1997. 12 (4): 830-834. [ Links ]
13. Yu, H.; Rohan, T. Role of the Insulin-like Growth Factor Family in Cancer Development and Progression. J. Nat. Cancer Inst. 2003. 92 (18): 1472-1489. [ Links ]
14. Wets, K. A.; Castillo, S. S.; Dennis, P. A. Activation of the PI3K/Akt pathway and chemotherapeutic resistance. Drug Resistance Updates. 2002. 5: 234-248. [ Links ]
15. Ritvos, O.; Rutanen, E. M.; Pekonen, F.; Jalkanen, J.: Suikkari, A. M.; Ranta, T. Characterization of Functional Type I Insulin-Like Growth factor Receptors from Human Choriocarcinoma Cells. Endocrinology. 1998. 123 (2): 395-401. [ Links ]
16. Grümmer, R.; Hohn, H. P.; Mareel, M. M.; Denker, H. W. Adhesion and invasion of three human choriocarcinoma cell lines into human endometrium in a three-dimensional organ culture system. Placenta. 1994. 15 (4): 411-429. [ Links ]
17. Bernal, Y. Expresión del factor de crecimiento similar a la insulina tipo II (IGF-II) en placenta normal. Trabajo final, Departamento de Química, Universidad Nacional de Colombia. 2004. p. 30. [ Links ]
18. O'Gorman, D. B.; Costello, M.; Weiss, J.; Firth, S. M.; Scott, C. D. Decreased Insulin-Like Growth Factor-II/Mannose 6-Phosphate Receptor Expression Enhances Tumorogenicity In JEG-3 Cells. Cancer Research. 1999. 59: 5692-5694. [ Links ]
19. Zhang, D.; Bar-Eli, M.; Meloche, S.; Brodt, P. Dual regulation of MMP-2 expression by the type 1 insulin-like growth factor receptor. J. Biol. Chem. 2004. 279 (19): 19683-19690. [ Links ]
20. Qiu, Q.; Yang, M.; Tsang, B. K.; Gruslin, A. Both mitogen-activated protein kinase and phosphatidylinositol 3-kinase signalling are required in epidermal growth factor-induced human trophoblast migration. Mol. Hum. Reprod. 2004. 10 (9): 677-684. [ Links ]
21. Sapan, C. V.; Lundblad, R. L.; Prince, N. C. Colorimetric protein assay techniques. Biotechnol. Appl. Biochem. 1999. Apr. 29: 99-108. [ Links ]
22. Hossenlopp, P.; Seutin, D.; Segovia-Quinson, B.; Hardouin, S.; Binoux, M. Analysis of serum insulin-like growth factor binding proteins using Western blotting: use of the method for tritation of the binding proteins and competitive binding studies. Anal. Biochem. 1986. 154: 138-143. [ Links ]
23. Hamilton, G. S.; Lysiak, J. J.; Han, V. K.; Lala, P. K. Autocrine-Paracrine regulation of Human trophoblast invasiveness by insulin-like growth factor (IGF)-II and IGF-Binding protein (IGFBP)-1. Experimental Cell Research. 1998. 244: 147-156. [ Links ]
24. Han, V. K.; Bassett, N.; Walton, J.; Challis, J. R. The expression of insulin-like growth factor (IGF) and IGF-binding protein (IGFBP) genes in the human placenta and membranes: evidence for IGF:IGFBP interactions at the feto-maternal interface. J. Clin. Endocrinol. Metab. 1996. 81: 2680-2693. [ Links ]
25. Nayak, N. R.; Giuduce, L. C. Comparative Biology of the IGF System in Endometrium, Decidua, and Placenta, and Clinical Implications for Foetal Growth and Implantation Disorders. Placenta. 2003. 24: 281-296. [ Links ]
26. Díaz, E. Niveles de expresión del sistema de factores de crecimiento similares a la insulina (IGFs) en tejido molar. Tesis de Doctorado, Departamento de Química, Universidad Nacional de Colombia. 2006. [ Links ]
27. Zumkeller, W. The Role of Growth Hormone and Insulin-Like Growth Factors for Placental Growth and Development. Placenta. 2000. 21: 451-467. [ Links ]
28. Neudauer, C. L.; McCarthy, J. B. Insulin-like growth factor I-stimula-ted melanoma cell migration requires phosphoinositide 3-kinase but not extracellular-regulated kinase activation. Exp. Cell. Res. 2003. 286 (1): 128-137. [ Links ]
29. Zygmunt, M.; Bischof, P. et al. Invasion of cytotrophoblastic JEG-3 cells is stimulated by hCG in vitro. Placenta. 1998. 19 (8): 587-593. [ Links ]
30. Lala, P. K.; Lee, B. P.; Xu, G.; Chakraborty, C. Human placental trophoblast as an in vitro model for tumor progression. Can. J. Physiol. Pharmacol. 2002. 80 (2): 142-149. [ Links ]
31. O-charoenrat, P.; Modjtahedi, H.; Rhys-Evans, P.; Court, W. J.; Box, G. M.; Eccles, S.A. Epidermal growth factor-like ligands differentially up-regulate matrix metalloproteinase 9 in head and neck squamous carcinoma cells. Cancer Research. 2000. 60: 1121-1128. [ Links ]
32. Liu, Z.; Klominek, J. Regulation of matrix metalloprotease activity in malignant mesothelioma cell lines by growth factors. Thorax. 2003. 58 (3); 198-203. [ Links ]
33. González, R. R.; Devoto, L.; Campana, A.; Bischof, P. Effects of leptin, interleukin-1alpha, interleukin-6, and transforming growth factor-beta on markers of trophoblast invasive phenotype: integrins and metalloproteinases. Endocrine. 2001.15: 157-164. [ Links ]
34. Xu, P.; Wang, Y. L.; Zhu, S. J.; Luo, S. Y.; Piao, Y. S.; Zhuang, L. Z. Expression of matrix metalloproteinase-2, -9 and -14, tissue inhibitors of metalloproteinase-1, and matrix proteins in human placenta during the first trimester. Biol. Reprod. 2000. 62: 988-994. [ Links ]
35. Bredin, C. G.; Liu, Z.; Klominek, J. Growth factor-enhanced expression and activity of matrix metalloprotea ses in human non-small cell lung cancer cell lines. Anticancer Res. 2003. 23: 53-72. [ Links ]
36. St-Pierre, Y.; Couillard,, J.; Van Tremsche, C. Regulation of MMP-9 gene expression for the development of novel molecular targets against cancer and inflamatory diseases. Review. Expert Opin Ther. Targets. 2004. 8 (5): 1-16. [ Links ]
37. Visse, R.; Nagase, H. Matrix Metalloproteinases and Tissue Inhibitors of Metalloproteinases, Structure, Function and Biochemistry. Circulation Research. 2003. 92: 827-839. [ Links ]
38. Borden, P.; Heller, R. Transcriptional control of matrix metalloproteinases and the tissue inhibitors of matrix metalloproteinases. Crit. Rev. Eukaryot Gene Expr. 1997. 7 (1-2): 159-178. [ Links ]
39. Bischof, P.; Meisser, A.; Campana, A. Control of MMP-9 expression at the maternal-fetal interface. J. Reprod. Immunol. 2002. 55 (1-2): 3-10. May-Jun. [ Links ]
40. Watabe, T.; Yoshida, K.; Shindoh, M.; Kaya, M.; Fujikawa, K.; Sato, H. et al. The Ets-1 and Ets-2 transcription factors activate the promoters for invasion-associated urokinase and collagenase genes in response to epidermal growth factor. Int J. Cancer. 1998. 77: 128-137. [ Links ]
41. Li, J.; Ma, C.; Huang, Y.; Luo, J.; Huang, C. Differential requirement of EGF receptor and its tyrosine kinase for AP-1 transactivation induced by EGF and TPA. Oncogene. 2003. 23: 211-219. [ Links ]
42. Bischof, P. Endocrine, paracrine and autocrine regulation of tropholastic metalloproteinases. Early pregnancy. 2001. 5 (1): 30-31. [ Links ]
43. Chung, T. W.; Lee, Y. C.; Kim, C. H. Hepatitis B viral HBx induces matrix metalloproteinase-9 gene expression through activation of ERKs and PI-3K/AKT pathways: Involvement of invasive potential. The FASEB Journal. 2004. 10: 1-24. [ Links ]
44. Lu, Y.; Wang, H.; Mills, G. B. Targeting PI3K/Akt pathway for cancer therapy. Rev. Clin. Exp. Hematol. 2003. 7(2): 205-228. [ Links ]
45. Logan, S. K.; Garabedian, M. J.; Campbell, C. E.; Werb, Z. Synergistic transcriptional activation ofthe tissue inhibitor of metalloproteinases-1 promoter via functional interaction of AP-1 and Ets-1 transcription factors. J. Biol. Chem. 1996. 271 (12): 774-782. [ Links ]
46. Gum, R.; Lengyel, E.; Juárez, J.; Chen, J. H.; Sato, H.; Seiki, M. et al. Stimulation of 92-kDa gelatinase B promoter activity by ras is mitogen-activated protein kinase 1-independent and requires multiple transcription factor binding sites including closely spaced PEA3/ets and AP-1 sequences. J. Biol. Chem. 1996. 271 (18): 10672-10680. [ Links ]
47. Kalli, K. R.; Falowo, O. I.; Bale, L. K.; Zschunke, M. A.; Roche, P. C.; Conover, C. A. Functional Insulin Receptors on Human Epithelial ovarian carcinoma cells: Implications for IGF-II Mitogenic Signaling. Endocrinology. 2002.143 (9): 3259-3267. [ Links ]
48. Deal, C. L.; Gyda, H. J. Insulin receptor of human term placental cells and choriocarcinoma (JEG-3) cells: characteristics and regulation. Endocrinology. 1983. 112 (4): 1512-1523. [ Links ]
49. Pinzón, M.; Ortiz, B. L. Relación de la expresión de mARN de las metaloproteinasas 2y9yel inhibidor TIMP-1 en mola hidatidiforme completa. Rev. Colomb. Quím. 2007. 36 (2): 137-149. [ Links ]