Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Agronómica
Print version ISSN 0120-2812
Acta Agron. vol.64 no.3 Palmira July/Sep. 2015
https://doi.org/10.15446/acag.v64n3.43087
http://dx.doi.org/10.15446/acag.v64n3.43087
Simbiosis de micorrizas arbusculares en plantas de arroz (Oryza sativa L.) en condiciones de inundación y secano
Arbuscular mycorrhizal symbiosis in rice plants in flooded and no flooded conditions
Michel Ruiz Sánchez1*; Yoerlandy Santana Baños2; Yaumara Muñoz Hernández2; Alexei Yoan Martínez2; Mileysis Benitez2; Beesham Vishnu Bharat2 y Yasmani Peña Chávez2.
1Instituto Nacional de Ciencias Agrícolas. San José de las Lajas, Mayabeque, Cuba.; 2Universidad Hermanos Saíz Montes de Oca, Pinar del Río, Cuba. *Autor para correspondencia: mich@inca.edu.cu
Rec.:21.04.2014 Acep.:18.09.2014
Resumen
En la Unidad Científico Tecnológica de Base Los Palacios, Cuba, a 22° 34’ 32.73” N y 83° 14’ 11.95” O, se evaluó el efecto de la inundación sobre la colonización de hongos micorrízicos arbusculares durante la fase vegetativa de plantas de arroz cultivar INCA LP-5. Se realizaron dos experimentos en condiciones de invernadero en macetas con una capacidad de 800 g de suelo, ambos experimentos en un diseño experimental completamente aleatorizado. Uno de ellos se realizó con Rhizophagus (=Glomus) intraradices (Ri), donde se evaluó la dinámica de colonización de la simbiosis micorrízica en condiciones de inundación y secano (no inundadas). En el segundo experimento se trabajó con Glomus cubense (Gc) y se evaluó la colonización micorrízica en plantas de arroz cultivadas con diferentes alturas de lámina de agua. En ambos experimentos se evaluaron altura de la planta, producción de masa seca y tasa absoluta de crecimiento. Como resultado se encontró que las plantas de arroz fueron colonizadas a partir del día 35 después de la germinación, tanto en condiciones inundadas como no inundadas, con una tendencia al incremento en el tiempo. Se comprobó que la colonización micorrízica disminuyó en condiciones de inundación y a medida que la altura de la lámina de agua fue superior se encontraron valores inferiores de este indicador. La colonización micorrízica incrementó el desarrollo de las plantas de arroz.
Palabras claves: Colonización micorrízica, Rhizophagus intraradices, Glomus cubense, arroz, inundación, secano.
Abstract
The research was conducted in the Scientific Technological Base Unit Los Palacios, Cuba, located at 22° 34’ 32.73” N and 83° 34’ 32.73”14’ 11.95” W, with the objective of evaluating the effect of flooding on colonization by arbuscular mycorrhizal fungi during the vegetative phase of rice plants, cultivar INCA LP-5. Two experiments under greenhouse conditions in pots with a capacity of 800 g of soil, both experiments in a completely randomized design were performed. An experiment was performed with Rhizophagus (=Glomus) intraradices (Ri), where the dynamics of colonization of mycorrhizal symbiosis in flooded conditions was evaluated and not flooded. In the second experiment, we worked with Glomus cubense (Gc) and mycorrhizal colonization was evaluated in rice plants grown with different levels of water depth. In both experiments, plant height, the absolute dry weight and growth rate are evaluated. The results showed that the rice plants were colonized from 35 days after germination, both flooded and non-flooded conditions, with an increasing trend over time. It was found that mycorrhizal colonization decreased in flood conditions and as the height of the water level was higher, lower values of this indicator was found. Mycorrhizal colonization increased the development of rice plants.
Key words: Mycorrhizal colonization, Rhizophagus intraradices, Glomus cubense, rice, irrigation.
Introducción
Los hongos formadores de micorrizas arbusculares (HMA) colonizan el tejido intrarradical de la planta hospedera, donde desarrollan estructuras características de la simbiosis (arbúsculos y vesículas), así como micelio extraradical, el cuál interactúa con el ecosistema de la rizósfora y es el encargado de la absorción de nutrientes del suelo (Smith y Read, 2008).
Las bases fundamentales sobre las que se establece la simbiosis micorrízica arbuscular son nutritivas. La planta suministra al hongo compuestos carbonados procedentes de la fotosíntesis, mientras que éste aporta a la planta nutrientes minerales, especialmente aquellos menos disponibles, en virtud de la mayor accesibilidad del micelio externo del hongo a recursos del suelo más distantes en el suelo (Barea et al., 2008).
Los HMA tienen un efecto marcado en las relaciones hídricas de la planta y del suelo, ya que modifican la conductancia estomática, la tasa fotosintética, el potencial hídrico foliar, la concentración de osmolitos, la eficiencia en el uso de agua y la asimilación de nutrimentos del hospedero (Harris-Valle et al., 2009); mientras que los exudados fúngicos promueven la cohesión de las partículas del suelo e incrementan la retención de agua en el sustrato (Rillig y Mummey, 2006). Los efectos del exceso de agua en los suelos sobre los HMA no han sido evaluados ampliamente, aunque se ha encontrado asociación micorrízica en plantas acuáticas y de zonas inundadas (Dhillion y Ampornpan, 1992), con excepción de aquellas pertenecientes a las familias Cyperaceae y Juncaceae.
El arroz tiene la particularidad evolutiva de ser semiacuático y convencionalmente crece bajo inundación continua durante la mayor parte de su ciclo de vida. Por tanto, tiene relativamente pocas adaptaciones a las condiciones de agua limitada y es extremadamente sensible a la sequía (Kamoshita et al., 2008), necesita volúmenes altos de agua, cuya escasez influye negativamente sobre el crecimiento de la planta y el rendimiento de grano (Vallino et al., 2009). Sin embargo, aproximadamente la mitad de la superficie de arroz en el mundo no dispone de agua suficiente para mantener condiciones de inundación y el rendimiento se reduce en cierta medida por la sequía (Bernier et al., 2008). Teniendo en cuenta lo anterior, la presente investigación se realizó con el objetivo de evaluar los efectos de la inundación sobre la colonización micorrízica y el desarrollo de plantas de arroz durante su fase vegetativa.
Materiales y métodos
La investigación se realizó en la Unidad Científico Tecnológica de Base “Los Palacios”, Cuba, a 22° 34’ 32.73” N y 83° 14’ 11.95” O, perteneciente al Instituto Nacional de Ciencias Agrícolas (INCA), donde se establecieron sendos experimentos en condiciones de invernadero en macetas con una capacidad de 800 g de suelo, el cual fue previamente tamizado (5 mm de diámetro) y desinfectado con formol a 4 %. Se utilizó un suelo Ferralítico Amarillo Típico Cuarcítico (Hernández et al., 2006) con pH = 7.43, M.O. = 2.46 %, P2O5 = 12.52, K2O = 9 (cmol/kg), Ca = 10, Mg = 2.71 y Na = 0.57 (ppm), utilizado en la producción de arroz por los campesinos que cultivan el cereal a orillas del Río Guamá en Pinar del Río. Durante la fase experimental las condiciones de temperatura estuvieron en un rango entre 18 y 27 °C, con una media de 22.5 °C y humedad relativa promedio entre 74 y 80 %.
Se utilizó el cultivar comercial de arroz INCA LP-5, el cual tiene un buen comportamiento agronómico en condiciones óptimas de producción y las cepas de HMA: Rhizophagus intraradices Schüßler y Walker (2011) y Glomus cubense Y. Rodr. y Dalpé, sp. nov., (Rodríguez et al., 2011), con una riqueza fúngica de 40 y 91 esporas.g-1 de inóculo, respectivamente, las que fueron certificadas por el Laboratorio de Micorrizas del Instituto Nacional de Ciencias Agrícolas, Cuba. En cada experimento se utilizó una sola cepa, la cual se seleccionó a partir de criterios en el uso de R. intraradices establecidos en investigaciones anteriores en el cultivo (Vallino et al., 2009) y en el caso de G. cubense por su alta adaptabilidad en los diferentes suelos de Cuba (Rivera et al., 2003). La inoculación se realizó por recubrimiento de la semilla con base en el 10 % de su peso (Fernández et al., 2003). Los tratamientos de no inundación (secano) se mantuvieron a capacidad de campo, entre 70 y 90 % de humedad.
Experimento 1
La dinámica de colonización de micorrizas R. intraradices se evaluó desde el momento de establecimiento de las condiciones inundadas y no inundadas. En el caso específico de la inundación, la altura de la lámina de agua no superó 5 cm sobre la superficie del suelo contenido en la maceta, la cual se restableció diariamente para compensar el consumo de agua por la planta y la evapotranspiración en las macetas. El experimento consistió en cuatro tratamientos y tres repeticiones, para un total de 108 macetas, considerando nueve evaluaciones entre 20 y 60 días después de la germinación (DDG) y antes del inicio de la fase reproductiva (Jarma et al., 2010), con una frecuencia de 5 días. Los tratamientos consistieron en: plantas inoculadas con HMA en condiciones inundadas (MA + Inund), plantas inoculadas con HMA en condiciones no inundadas (MA + noInund), plantas no inoculadas con HMA en condiciones inundadas (noma + Inund) y plantas no inoculadas con HMA en condiciones no inundadas (noma + noInund).
Experimento 2
Se realizó con G. cubense para evaluar el efecto de la inundación en la simbiosis micorrízica arbuscular en plantas de arroz inoculadas con HMA. El experimento consistió de ocho tratamientos, considerando diferentes niveles de inundación expresados en altura de lámina de agua (Tabla 1) y cuatro repeticiones. Se utilizaron en total 128 macetas y se realizaron cuatro evaluaciones entre los 35 y 50 días después de la germinación, antes del inicio de la fase reproductiva (Jarma et al., 2010), con una frecuencia de 5 días.
Cuantificación de la colonización micorrízica
Una vez se comprobó el establecimiento de la simbiosis micorrízica en las plantas inoculadas con Ri y Gc, se procedió a evaluar la colonización (%). Las raíces fueron teñidas siguiendo el método descrito por Phillips y Hayman (1970) que se basa en la aplicación del colorante azul de tripán. Para determinar la colonización micorrízica se utilizó el método de la cuadricula o intercepto, el cual consiste en cuadricular el fondo de una placa de Petri (1 x 1 cm) seguido de la observación de las raíces en microscopio estereoscopio binocular Novel®, para contabilizar las raíces micorrizadas y las no micorrizadas que tocaban las líneas verticales de la cuadricula, en total se contabilizaron 100 raíces (Giovanetti y Mosse, 1980).
Indicadores morfo-fisiológicos
Entre estos indicadores se cuantificaron los siguientes: (1) altura de la planta (cm) desde la superficie del suelo hasta el extremo superior de la hoja más larga proyectada en la dirección del tallo; (2) materia seca de la parte aérea y la raíz (g), despues de secadas las muestras con tiro forzado de aire a 70 °C, hasta alcanzar masa constante, la que se midió en una balanza técnica digital OHUS Adventurer® Pro de precisión 0.01 g; y (3) Tasa relativa de crecimiento (TRC) (g/g por día), definida a partir de las masas seca foliar en la primera y última evaluaciones en ambos experimentos. Los cálculos se realizaron según los criterios de Hunt (1982) citado por Barraza et al. (2004), modificando los términos de P por M en la ecuación: (lnM2-lnM1) / (t2-t1), donde: M1 = masa seca inicial, M2 = masa seca final, t2 - t1 = intervalo de tiempo transcurrido durante la evaluación.
Análisis estadístico de datos
Los datos obtenidas de cada experimento se procesaron mediante análisis de varianza de clasificación simple (ANOVA) (P < 0.05). Además en el Experimento 1 se realizó un análisis de regresión lineal para la variable altura. Todos los análisis fueron realizados con el programa estadístico SPSS de Windows, versión 21.0.
Resultados y discusión
Colonización micorrízica
Experimento 1. En este estudio se comprobó que las plantas no inoculadas (noMA) no presentaron estructuras fúngicas en la raíces, como resultado del proceso de esterilización a que fue sometido. Esto no se observó en las plantas inoculadas con R. intraradices, en las cuales la micorrización aumentó en la medida que trascurrió el tiempo y crecieron las plantas de arroz (Figura 1), comportamiento que se relaciona con la interacción entre simbiontes y la planta (Smith y Read, 2008). Treinta y cinco días después de la germinación se observó la colonización micorrízica en las plantas inoculadas con HMA, tanto en condiciones no inundadas como inundadas, en estas última a pesar de que los HMA son microorganismos aeróbicos estrictos (Smith y Read, 2008), tienen capacidad de establecer interacción entre simbiontes. Los valores más altos se observaron en las plantas cultivadas en condiciones no inundadas, lo cual es debido a que estas condiciones son favorecen la germinación de las esporas del hongo, a partir de una mejor relación presimbiótica entre los simbiontes (Barea et al., 2008).
Los porcentajes de colonización a 60 DDG se incrementaron 18.06 y 30.25 % con respecto a los encontrados 35 DDG para condiciones inundadas y no inundadas, respectivamente, lo que muestra el efecto negativo de la inundación en la colonización por micorrizas. Una posible causa de los bajos valores de colonización es la abundancia de tejido aerénquima en la raíz (Gutjahr et al., 2009) y por tanto, la reducción en el tejido cortical (Vallino et al., 2014), zona en la que ocurre la simbiosis (Smith y Read, 2008; Gutjahr et al., 2009; Vallino et al., 2014). Estos resultados son similares a los encontrados por Rodríguez et al. (2006) con valores entre 24 y 26 % a 35 DDG en cultivares de arroz (INCA LP7 y J-104) y una riqueza de inóculo de 250 esporas/g de inóculo. Vallino et al. (2009) obtuvieron una respuesta similar con porcentajes entre 14 y 51 %, cuando evaluaron 13 variedades de arroz; Kira y Bouldin (1991) afirmaron que observaron la formación de bolsas de aire en las raíces (aerénquima), por degradación de la corteza de la raíz, que permite al oxígeno alcanzar las puntas de la raíz y mantenerlas bajo condiciones inundadas.
Experimento 2. Los porcentajes de colonización en la raíz por G. cubense fueron diferentes entre ambos niveles de inundación (Figura 2); igualmente se encontraron diferencias entre las épocas de evaluación, lo que se confirma por el aumento de la colonización entre 35 y 50 DDG en el tratamiento no inundado, alcanzando valores superiores en comparación con el resto de los tratamientos.
El incremento de la altura de la lámina de agua afectó la micorrización, con valores menores que 15 %, aunque en el tratamiento MA + 3 cm se encontraron porcentajes de colonización superiores a los encontrados en las demás alturas de lámina de agua. Este comportamiento se debe a la mayor superficie foliar expuesta sobre la lámina de agua, la cual contribuye al transporte de oxígeno desde la parte aérea hacia la raíz. Solaiman y Hirata (1996) encontraron bajos porcentajes de colonización micorrízica en el cultivo del arroz en condiciones de inundación con una lámina de 5 cm.
En los tratamientos inundados se encontraron bajos porcentajes de colonización, comportamiento que puede estar determinado por la condición de anoxia en el suelo por efecto de la inundación (Ismail et al., 2009), lo cual limita el mecanismo de intercambio planta-HMA. Esta condición es más notoria en la medida la altura de la lámina de agua es mayor (Drew, 1997) debido a la presión hidrostática y la reducción de los espacios porosos en el suelo que limita la difusión y el intercambio de oxígeno. No obstante lo anterior, las plantas de arroz en condiciones inundadas son colonizadas por HMA debido fundamentalmente a que son capaces de transportar oxígeno a la raíces y el área alrededor de las mismas (Yoshida, 1981; Snyder y Slaton, 2002; Jarma et al., 2010).
Efecto de las micorrizas en la altura de planta y producción de MS
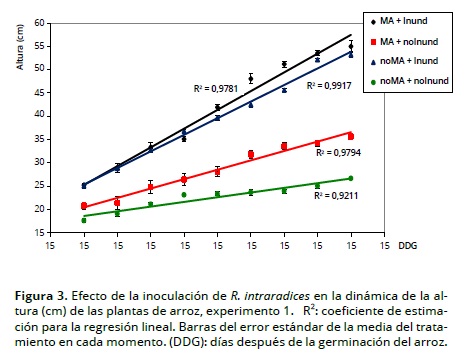
En las Figuras 3 y 4 se observa el efecto de la inoculación con HMA y la lámina de agua en la altura de planta, siendo ésta mayor en los tratamientos inoculados (MA) vs. no inoculados (noMA), y en los inundados vs. no inundados; estos resultados contrastan con los hallados Hernández et al. (2006) quienes no encontraron una relación consistente entre cepas de HMA y altura de plantas de arroz. Por otra parte dentro de los tratamientos inundados se observó un mayor crecimiento de planta en la medida que la altura de la lámina de agua fue igualmente mayor, independientemente de la inoculación micorrízica.
La reducción del crecimiento en altura de las plantas en los tratamientos no inundados, se pudiera interpretar como una inhibición en el alargamiento celular, ya que éste es más sensible a la reducción de la turgencia que la división celular (Panda y Khan, 2004); asociado a esta respuesta fisiológica de la planta también está el componente genético, el cual determina su adaptabilidad a condiciones de inundación o secano (Muthurajan et al., 2011). Resultados similares fueron obtenidos por Qin et al. (2010) en cultivos de arroz en condiciones inundadas y secano.
En el experimento 1 la producción de materia seca (MS) de la parte aérea 60 DDG (Tabla 2) fue más alta en condiciones de inundación (P < 0.05); mientras que la producción de MS de las raíces fue más alta en las plantas inoculadas con HMA y cultivadas en condiciones no inundadas. Estos resultados concuerdan con los hallados por Ruiz-Sánchez et al. (2010) en el cultivo de arroz y plantean un efecto a largo plazo de los HMA en el desarrollo de las plantas. En otros cultivos donde se ha inoculado hongos micorrízicos arbusculares, se ha encontrado incremento con respecto a los no inoculados en cuanto a la altura y masa seca en maíz y sorgo (Mena et al., 2011).
En el experimento 2 los valores más altos de MS tanto en la parte aérea como en la raíz se encontraron en las plantas micorrizadas (Tabla 3). Es importante señalar que el incremento en la lámina de agua disminuyó el desarrollo de las plantas, lo cual posiblemente está relacionado con la deficiencia de oxígeno en el medio radicular.
En las tablas 2 y 3 también se incluyen los valores de las tasas relativas de crecimiento para los tratamientos evaluados en ambos experimentos. Se observa un efecto positivo de la micorrización sobre este parámetro, aunque en condiciones inundadas no se observaron diferencias entre las plantas micorrizadas y no micorrizadas; lo anterior es debido a la capacidad de los HMA para absorber nutrientes del suelo (Smith et al., 2010). Resultado similar obtuvo Gañan (2011) al encontrar que la acumulación de biomasa estuvo relacionado con el porcentaje de colonización micorrízica.
Conclusiones
- En este estudio, después del día 35 de germinación las plantas de arroz fueron colonizadas con las cepas R. intraradices y G. cubense, tanto en condiciones de inundación como en secano, aunque la micorrización tendió a ser mayor en estas últimas.
- El establecimiento de la simbiosis en ambas condiciones tuvo un impacto positivo en la altura, la fitomasa y en la tasa relativa de crecimiento de las plantas.
Referencias
Barea, J. M.; Ferrol, N.; Azcon-Aguilar, C.; y Azcón, R. 2008. Mycorrhizal symbioses. En: P. J. White y J. P. Hammond (eds.). The ecophysiology of plant-phosphorus interactions. Dordrecht: Springer. Series. Plant Ecophysiol. 7:143 - 163. [ Links ]
Barraza, F. V.; Fischer, G.; y Cardona, C. E. 2004. Estudio del proceso de crecimiento del cultivo del tomate (Lycopersicon esculentum Mill.) en el Valle del Sinú Medio. Agron. Col. 22(1):81 - 90. [ Links ]
Bernier, J.; Atlin, G. N.; Serraj, R.; Kumar, A.; y Spaner, D. 2008. Breeding upland rice for drought resistance. J. Sci. Food Agric. 88:27 - 39. [ Links ]
Dhillion, S. y Ampornpan, L. 1992. The influence of inorganic nutrient fertilization on the growth, nutrient composition and vesicular - arbuscular mycorrhizal colonization of pretrasplant rice plants. Biol. Fert. Soils. 91:13 - 85. [ Links ]
Drew, M. C. 1997. Oxygen deficiency and root metabolim: injury and acclimation under hypoxia and anoxia. Ann. Rev. Plant Physiol. Plan Mol. Biol. 48:223-250. [ Links ]
Fernández, F. 2003. Avances en la producción de inoculantes micorrízicos arbusculares. En: Rivera, R. y Fernández, K. (eds.). El manejo eficiente de la simbiosis micorrízica, una vía hacia la agricultura sostenible. Estudio de caso: El Caribe. La Habana. Instituto Nacional de Ciencias Agrícolas. Ediciones INCA. Cap. 3. p. 97 - 98. [ Links ]
Fernández, F.; Dell'Amico, J. M.; Fernández, K.; De la Providencia, I.; y Rodríguez, Y. 2006. Funcionamiento de un inoculante líquido a base del hongo micorrízico arbuscular Glomus sp.1 (INCAM - 4) en arroz (Oryza sativa var. J-104) en suelo salino. Cultivos Tropicales. 27(2):27 - 33. [ Links ]
Gañan, L.; Bolaños-Benavides, M. y Asakawa, N. 2011. Efecto de la micorrización sobre el crecimiento de plántulas de plátano en sustrato con y sin la presencia de nematodos. Acta Agronómica. 60(4):297 - 305. [ Links ]
Giovanetti, M. y Mosse, B. 1980. An evaluation of techniques for measuring vesicular arbuscular infection in roots. New Phytol. 84:489 - 500. [ Links ]
Gutjahr Caroline; Casieri, L. y Paszkowski, U. 2009. Glomus intraradices induces changes in root system architecture of rice independently of common symbiosis signaling. New Phytol. 182:829 - 837. [ Links ]
Harris-Valle, C.; Esqueda, M; Valenzuela-Soto, E. M; y Castellanos, A. E. 2009. Tolerancia al estrés hídrico en la interacción planta-hongo micorrízico arbuscular: metabolismo energético y fisiología. México. Rev. Fitotec. 32(4):265 - 271. [ Links ]
Hernández, A.; Ascanio, M. O.; Morales, M.; Bojórquez, I. y García, N. E. 2006. Historia de la clasificación de suelos en Cuba. México: Universidad de Nayarit. p. 47. [ Links ]
Ismail, A. M.; Ella, E. S.; Vergara, G.; y Mackill, D. 2009. Mechanisms associated with tolerance to flooding during germination and early seedling growth in rice (Oryza sativa). Annals Botany 103(2):197 - 209. [ Links ]
Jarma, A. A.; Degíovanni, V. B. y Montoya, R. A. 2010. Índices fisiotécnicos, fases de crecimiento y etapas de desarrollo de la planta de arroz. Capítulo 5. Producción Eco-Eficiente del Arroz en América Latina. Tomo I. ed. Degíovanni, V. B.; Martínez, C. R. Motta, F. O. Centro Internacional de Agricultura Tropical (CIAT), p. 60-78. ISBN 978-958-694-103-7. [ Links ]
Kamoshita, A.; Babu, R. C.; Boopathi N. M.; y Fukai, S. 2008. Phenotypic and genotypic analysis of drought-resistance traits for development of rice cultivars adapted to rainfed environments. Field Crops Res. 109:1 - 23. [ Links ]
Kira, G. J.; y Bouldin, D. R. 1991. Speculation on the operation of the rice root system in relation to nutrient uptake. En: W. T. Penning de Vries et al. (eds.). Simulation and system anaylsis for rice production. p. 195 - 203. [ Links ]
Mena, A.; Fernández, K.; Jerez, E; Olalde, V.; y Serrato, R. 2011. Influence of Glomus hoi-like inoculation and a concentrated species of AMF on sorghum plant development submitted or not to water stress. Cultivos Tropicales. 32(1):11 - 17. [ Links ]
Muthurajan, R. y Zahra-Sadat, S. 2011. Physiological and proteomic responses of rice peduncles to drought stress. Mol Biotechnol. 48:173 - 182. [ Links ]
Panda, S. K. y Khan, M. H. 2004. Changes in growth and superoxide dismutase activity in Hydrilla verticillata L. under abiotic stress. Braz. J. Plant Physiol. 16(2):115 - 118. [ Links ]
Phillips, J. M. y Hayman, D. S. 1970. Improve procedures for cleaning root and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapic assesment of infections. Tranfer. Brit. Micol. Soc. 55: 158-161. [ Links ]
Qin, J. T.; Wang, X.; Hu, F.; y Li, H. 2010. Growth and physiological performance responses to drought stress under non-flooded rice cultivation with straw mulching. Plant Soil Environ. 56(2):51 - 59. [ Links ]
Rillig, M .C. y Mummey, D. L. 2006. Mycorrhizas and soil structure. New Phytol. 171:41 - 53. [ Links ]
Rivera, R.; Fernández, F.; y Fernández, K. 2003. La simbiosis micorrízica arbuscular. En: Rivera, R. y Fernández, K. (eds.). El manejo eficiente de la simbiosis micorrízica, una vía hacia la agricultura sostenible. Estudio de caso: El Caribe. La Habana: Instituto Nacional de Ciencias Agrícolas (INCA). Capítulo 1. p. 97 - 98. [ Links ]
Rodríguez, Y.; Quiñones, Y.; y Hernández, M. M. 2006. Efecto de la inoculación con tres cepas de hongos micorrízicos arbusculares sobre la aclimatación de vitroplantas de Solanum tuberosum (papa). Cultivos Tropicales. 27:19 - 24. [ Links ]
Rodríguez, Y.; Dalpé, Y.; Séguin, S.; Fernández, K.; Fernández, F.; y Rivera, R. A. 2011. Glomus cubense sp. nov., an arbuscular mycorrhizal fungus from Cuba. Micorryza. 118: 337 - 347. [ Links ]
Ruiz-Sánchez, M.; Armada, E.; Muñoz, Y.; García de Salamone, I. E. et al. 2010. Azospirillum and arbuscular mycorrhizal colonization enhance rice growth and physiological traits under well-watered and drought conditions. J. Plant Physiol. 168:1031 - 1037. [ Links ]
Schüßler , A. y Walker, C. 2011. Evolution of the plant-symbiotic fungal phylum, glomeromycota. evolution of fungi y fungal-like organisms, The Mycota XIV. Pöggeler, S. y Wöstemeyer, J. (eds.). © Springer-Verlag Berlin Heidelberg, p. 163-185. [ Links ]
Smith, S. E. y Read, D. J. 2008. Mycorrhizal symbiosis, 3rd ed. Nueva York. Elsevier, Academic Press. p. 236. [ Links ]
Smith, S. E.; Facelli, E.; Pope, S.; y Smith, F. A. 2010. Plant performance in stressful environments: interpreting new y established knowledge of the roles of arbuscular mycorrhizas. Plant Soil. 326:3 - 20. [ Links ]
Yoshida, S. 1981. Fundamentals of rice crop science. The International Rice Research Institute. Los Baños, Laguna, Philippines. P.O. Box 933, Manila, Philippines. p. 277. [ Links ]
Snyder, C. y Slaton, N. 2002. Effects of soil flooding and drying on phosphorus reactions. News and Views Newsletter. Potash and Phosphate Institute. Atlanta, Georgia. p. 158. [ Links ]
Solaiman, M. Z. y Hirata, H. 1996. Effectiveness of arbuscular mycorrhizal colonization at nursery stage on growth and nutrition in wetland Oryza sativa L. after transplanting under different soil fertility and water regimes. Soil Sci. Plant. Nutr. 42:61 - 71. [ Links ]
Vallino, M.; Greppi, D.; Novero, M.; Bonfante, P. y Lupotto, E. 2009. Rice root colonization by mycorrhizal and endophytic fungi in aerobic soil. Ann. Appl. Biol. 154:195 - 204. [ Links ]
Vallino, M.; Fiorilli, V.; y Bonfante P. 2014. Rice flooding negatively impacts root branching and arbuscular mycorrhizal colonization, but not fungal viability. Plant, Cell Environ. 37:557 - 572. [ Links ]