Introducción
La quinua, Chenopodium quinoa Willd., es un grano de la familia Quenopodiáceas originario de la región andina y cultivado en la cordillera de los Andes de Bolivia, Colombia, Ecuador y Perú. Se conoce como el alimento principal de poblaciones preincaicas e incaicas hasta el descubrimiento de América, y se ha determinado su alto valor nutricional, es rica en proteínas entre el 13.8 y 21.9 % dependiendo de la variedad, presenta además aminoácidos esenciales como fenilamina, metionina, lisina, treonina, triptófano y valina, contiene vitaminas C, E, tiamina, Complejo B y minerales como potasio y fósforo, aportando 350 cal/100 g. Se ha considerado tan nutritiva como la leche y con potencial para sustituir a la proteína de origen animal (Ministerio de Agricultura y Riego (MINAGRI), 2013; Montes et al., 2018).
De acuerdo con Trade Map del Centro de Comercio Internacional desde el 2014, Perú con el 44 % en exportaciones de quinua se mantienen como principal exportador a nivel mundial, seguido por Bolivia con el 29 %, alcanzando envíos hasta por US$ 124 millones alrededor de 70 países, especialmente a los mercados de EE. UU., Canadá, Reino Unido, Francia e Italia. Del total producido a nivel nacional, el 70 % proviene de los departamentos Puno y Ayacucho, y para el 2018, se obtuvo en promedio un rendimiento de 1.3 toneladas por hectárea (MINAGRI, 2019). La región de Puno es la originaria de este tipo de cultivo y presenta la mayor diversidad biológica y mayor área de superficie para la siembra (MINAGRI, 2017).
La quinua como cualquier otra planta, es propensa al ataque de plagas de insectos, hongos y bacterias, que causan una serie de enfermedades causantes de la disminución de la producción de los cultivos. Entre las más comunes, causadas por insectos el gusano cortador o gusano de tierra Agrotis ípsilon, el gusano ejército Spodoptera eridani, polilla de la quinua, Eurysacca spp.; el pseudohongo, Perenospora variabilis Gaum agente causal de la enfermedad de mildiu y otros hongos, como Phoma exigua var. foveata causante de la podredumbre marrón del tallo, Rhizoctonia solani, de la podredumbre radicular, Ascochyta hyalospora de manchas foliares, Cersospora sp. Causante de cercosporiosis, Phoma spp., causante de la mancha ojival del tallo, Cladosporium sp., causante del moho verde, entre otros; y en cuanto agentes bacterianos, el género Pseudomonas causa la mancha bacteriana o bacteriosis (Cruces y Callohuari, 2016).
El mildiu es la enfermedad más severa que sufren los cultivos de quinua, capaz de reducir el rendimiento de cultivares resistentes entre un 33 y 58 %, y hasta 99 % en cultivares susceptibles, como consecuencia de que en la región de Puno no se han implementado estrategias de control de fitopatógenos en los procesos de producción orgánica (León et al., 2018). Esta enfermedad se manifiesta en toda la planta (hojas, tallos, ramas, inflorescencias e incluso los granos), afectando principalmente las hojas y provocando la defoliación prematura y enanismo, por la reducción del área fotosintética. En las hojas se observan pequeñas manchas irregulares que, dependiendo del color de la variedad, se aprecian amarillas o cloróticas, rosadas o rojizas, con un micelio gris en el envés (Gómez y Aguilar, 2016), asimismo se ha reportado que esta enfermedad puede ser dispersada mediante las zoosporas que quedan prendidas en los epispermas de semillas de las plantas enfermas (El-Assiuty et al., 2019).
En relación con el control de estas enfermedades, además de estrategias culturales, como el uso de semillas de variedades resistentes, eliminación de malezas en la preparación del terreno y la rotación de los cultivos, se utilizan fungicidas de origen químico. No obstante, estos pueden ser fitotóxicos y dejar residuos que afectan la comercialización (Cruces y Callohuari, 2016; Gómez y Aguilar, 2016).
En relación con el empleo de pesticidas químicos, a nivel mundial se buscan estrategias alternativas que representen un menor impacto ambiental, opciones ecológicas que puedan ejercer un control eficiente, como el uso de otros patógenos naturales. En este sentido, microorganismos endófitos se presentan como alternativa de biocontrol, pues al habitar dentro de los tejidos vegetales sin causar daño, interfieren y alteran la acción patogénica de otros fitopatógenos, al mismo tiempo que pueden tener efectos antagonistas, induciendo resistencia a factores bióticos y abióticos, así como promover el crecimiento del cultivo (Toghueo et al., 2016).
Los hongos del género Trichoderma son hongos endófitos que se distribuyen en todo tipo de suelos y climas; han sido ampliamente empleados por demostrar su éxito en el biocontrol, cuyo efecto antagónico ha sido reportado sobre Sclerotinia spp., Macrophomina phaseolina, Rhizoctonia solani, Pythium spp., Phytophtora spp. y Fusarium spp., debido a que utiliza varios mecanismos de acción como, la competencia por el espacio y nutrientes, el micoparasitismo y la antibiosis (Mukherjee et al., 2012).
Por otra parte, se encuentran los microorganismos eficaces (ME), como un conjunto de bacterias (ácido lácticas, fotosintéticas, actinomicetos), levaduras y hongos filamentosos de actividad fermentativa, en mezclas líquidas que contienen hasta 80 microorganismos distintos, muchos de los cuales habitan en el interior de células vegetales en una asociación simbiótica (Morocho y Leiva-Mora, 2019; Aquino-Duran, 2020).
Los (ME) se consideran compuestos activos que eliminan muchos fitopatógenos e influyen en el desarrollo de las plantas, lo que, por supuesto garantiza el aumento en la producción de los cultivos. Se ha reportado que aceleran los procesos de crecimiento, floración y desarrollo de frutos, así como favorecen la reproducción y germinación de las semillas, al aumentar el nivel de absorción de agua y nutrientes y de la actividad fotosintética; asimismo, en los suelos optimiza su constitución física y fertilidad y en la preparación de abono orgánico reduce el tiempo de maduración (Morocho y Leiva-Mora, 2019).
El resultado de la interacción entre estos microorganismos benéficos y las plantas es difícil de predecir, pues depende del grado de compatibilidad bioquímica y fisiológica funcional entre ambos. La interacción es compleja pudiendo potenciarse efectos sinérgicos que favorezcan, sean antagónicos o sencillamente que no ejerce efecto alguno, y en el mismo sentido, se encontraría el resultado de la aplicación de una combinación determinada de componentes microbianos (Cano, 2011). Razón por la cual, deben de realizarse ensayos que determinen combinación y dosis adecuadas, cuando se persigue efectuar acciones de biocontrol. Motivo por el cual es objetivo de este estudio determinar el efecto de Microorganismos Eficaces y de cepas de Trichoderma sp. en el control biológico de mildiu y su efecto en la productividad del cultivo de quinua.
Materiales y métodos
Área de estudio
Se trabaja en el terreno experimental del Centro Internacional de la Papa (CIP) Camacani de la Universidad Nacional del Altiplano (UNA) del departamento de Puno, provincia homónima en el distrito de Platería, la cual se encuentra entre las coordenadas -15.8241 y -70.0163 a 3827 msnm, la campaña agrícola entre el 10 de noviembre de 2016 y 26 de mayo de 2017. Dentro del terreno se selecciona de manera aleatoria un área experimental de 530.4 m2. En ella se distribuyeron las unidades experimentales en tres bloques con nueve parcelas por bloque. Se definió como unidad experimental una parcela con cuatro hileras de 5 m de largo y un espacio entre las hileras de 0.6 m (un total de 1.8 m de ancho). La distancia entre las unidades experimentales dentro de cada bloque fue de 1.2 m.
Activación de Trichoderma sp. y microorganismos eficaces (ME).
Cultivos jóvenes (degradación de 12 a 18 horas) de cepas de Trichoderma sp. (TETO 2, TETQ 3, TRO 5, TETC-10) suministradas por el Laboratorio de Fitopatología adscrito a la Facultad de Ciencias Agrarias de la UNA, se repicaron en medios de cultivo PSA (Papa Sacarosa Agar) y bajo luz artificial se dejan incubando a 25 °C por siete días. Posteriormente se propagaron en sustrato arroz; el uso de los rayos de luz ultravioleta (U.V.) es eficaz para eliminar organismos que se encuentran sobre superficies, ya que este tipo de luz tiene poca penetración. En cuanto a ME, obtenido en el laboratorio con fermentación a 2 meses, a partir de la mezcla de melaza de caña o azúcar y agua no clorada en proporciones 5:5:90, 10:10:80 y 15:15:70, para obtener EM concentrado, activado al 5 %, 10 % y 15 % respectivamente.
Aplicación de los tratamientos con cepas de Trichoderma sp. y ME.
Se realizan nueve combinaciones de cepas de Trichoderma sp. y ME que se llaman tratamientos (T1 a T9) que son aplicados a las semillas y a cuatro fases del desarrollo fenológico ramificación, panoja, floración y grano lechoso del cultivo de quinua var. Salcedo INIA, considerándose cinco aplicaciones por cada tratamiento (Tabla 1).
Tabla 1 Identificación y origen de Las cepas de Trichoderma spp. y microorganismos eficaces (ME) aplicadas al cultivo de quinua var. Salcedo INIA en CIP Camacani de la UNA, durante la campaña agrícola 2016 - 2017.

Las semillas fueron paletizadas con cada tratamiento a una concentración de 1x106 ufc semilla-1, en el caso del abono y nivel foliar en cada fase fenológica del cultivo se aplicó 1x107 ufc por cada gramo de estiércol y a nivel foliar (cc).
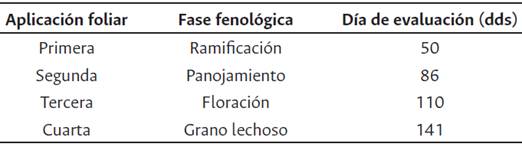
Posteriormente, durante la campaña agrícola, se realizan cuatro evaluaciones del efecto de los tratamientos sobre el mildiu, en plantas aisladas identificadas en la zona, común en los periodos con al menos 70-75 % de humedad relativa. De las dos hileras centrales de cada parcela son seleccionadas al azar 10 plantas y de cada una, tres hojas, del tercio superior, medio e inferior. Se tomó nota de las áreas afectadas de cada hoja, y siguiendo las recomendaciones de (Danielsen y Ames, 2000), se emplea la escala de porcentaje de daño foliar de los autores según i) escala 0 - 10, ii) Escala 0 - 5 y iii) incidencia, para calcular el valor del área bajo la curva de progreso de la enfermedad AUDPC (por sus siglas en inglés, area under disease progress curve), en función a una medida de severidad de la enfermedad, que exige como mínimo tres evaluaciones por campaña. En la Tabla 2 se muestra a los cuantos días después de la siembra (dds) se realizaron las evaluaciones.
Tabla 2 Esquema de evaluación de acuerdo a la fase fenológica del cultivo de quinua var. Salcedo INIA en CIP Camacani de la UNA, durante La campaña agrícola 2016 - 2017.
Cosecha. Luego de los 162 dds, las plantas alcanzan su madurez fisiológica y de cada parcela se seleccionan 10 plantas al azar de las dos hileras centrales, las cuales fueron cortadas a ras del suelo, para medirse la longitud de la planta y de la inflorescencia. Posteriormente, las plantas se colocan en sobres de papel y se trasladan al laboratorio de fitopatología de la UNA para secarlas a temperatura ambiente por dos meses bajo sombra.
Una vez secas, se determina el peso seco de la planta y se realiza la trilla en forma manual a cada una, limpiándose los granos que fueron almacenados en sobres de manila, debidamente rotulados. El resto de las plantas de las parcelas, fueron cortadas y se dejaron en el campo durante un mes, para permitir el secado normal, luego del cual se les hizo el trillado correspondiente, y se determinó el peso de semilla y rendimiento (RDT).
Procesamiento de datos. Los datos son procesados en porcentaje y transformados angularmente (arco seno VX) a AUDPC de acuerdo con la recomendación de (Montgomery, 2008) para conferir normalidad y homogeneidad de varianzas. Posteriormente, se aplica estadística inferencial mediante el software estadístico InfoStat, versión 2008 y se aplica análisis de varianza (ANDEVA) y la prueba de contraste de Tukey para las diferencias de medias, con 95 % de confianza.
Resultados
Todas las hojas de quinua evaluadas que reciben los diferentes tratamientos tanto por las distintas cepas de Trichoderma spp. y ME, presentan menores porcentajes de severidad de mildiu al compararse con la muestra control, en todas las fechas en que se lleva a cabo las evaluaciones (Tabla 3). Por otra parte, en el campo, el mildiu en las plantas de la parcela control, ocasiona defoliación al término de las evaluaciones.
Tabla 3 Severidad y área bajo la curva del progreso de la enfermedad (AUDPC) del mildiu en la quinua var. Salcedo INIA tratadas con ME y cepas de Trichoderma spp. en CIP Camacani de la UNA, durante la campaña agrícola 2016-2017.

*Diferencias significativas con respecto al control, valores p menores a alfa=0.05 ** No se evidenciaron diferencias significativas en el tratamiento, con relación al control
En relación con el análisis del indicador AUDPC, el área de daño bajo la curva, como se esperaba es significativamente mayor en el grupo control con respecto al resto de muestras y tratamientos aplicados (p < 0.05), asimismo el tratamiento menos efectivo, demuestra ser el T8, la mezcla de las cuatro cepas de Trichoderma spp. Y ME con el valor de AUDPC de 784.4 y el tratamiento de mayor efecto el T2 (TETQ3) y T5 EM 5 %, con AUDPC igual a 586.19 y 586.44, respectivamente.
En cuanto al comportamiento en campo, en donde se mide el rendimiento del cultivo, se repite el hecho de que todos los tratamientos promovieron un rendimiento significativamente mayor con p < 0.05, al compararse con el rendimiento de la parcela de plantas control, que fue de 2263 Kg/Ha, siendo T5 con el que se alcanzan los mayores valores en todos los parámetros medidos (Tabla 4). Mientras que, el tratamiento menos efectivo a nivel del rendimiento total con 2261 Kg/Ha es con EM al 15 %, mostrando los menores valores tanto en el peso seco como en la altura de la planta.
Tabla 4 Parámetros de rendimiento del cultivo de quinua var. Salcedo INIA tratadas con ME y cepas de Trichoderma spp. en ClP Camacani de la UNA, durante la campaña agrícola 2016 - 2017.

*Diferencias significativas con respecto al control=p < 0.05
La aplicación de ME y cepas del hongo Trichoderma sp. favorecen tanto la reducción de la severidad del mildiu y promueven el crecimiento y el rendimiento de la quinua variedad Salcedo INIA, siendo Trichoderma sp. cepa TETQ-3 el tratamiento que más redujo la severidad del mildiu, mientras que el mayor rendimiento se observa con ME al 5 %.
Discusión
El mildiu se comporta como un parásito de antigenicidad severa, al ocasionar defoliación total en los cultivos de la quinua en los terrenos del CIP Camacani de la UNA durante la campaña agrícola 2016-2017, sin embargo, se observa en cuanto a las hojas trasladadas a la evaluación del laboratorio, máximos de 50 % de severidad, explicado probablemente por la selección al azar de las hojas, por lo que no hayan sido seleccionadas aquellas con daños mayores.
En cuanto al rendimiento, en todos los casos, se alcanzan valores por encima de las 2000 Kg/Ha, valor que se ubica en un 62 % por encima del promedio regional de Puno en el 2016, que fue de 1230 Kg/ Ha (MINAGRI, 2017). Los rendimientos en cuanto a todos los tratamientos fueron significativamente superiores al alcanzado en la parcela control, lo que, a su vez, en esta parcela, donde no se aplica ningún tratamiento, recurriendo a una identificación del suelo de tipo cualitativa según el Gobierno Regional de Puno (2014), hace inferir que tanto la fertilidad del Suelo Ayabacas (Cryorthent) y el clima fueron favorables.
El biocontrol puede definirse como el uso de organismos vivos para disminuir la población de patógenos, así en este estudio, sobre el cultivo de quinua se evalua a varias cepas de Trichoderma spp. y ME. Con las cepas de Trichoderma spp. se obtienen aumentos en el rendimiento desde 14 % (TETQ-2) a un 63 % (TETC-10), y mientras que la mezcla de ME al 5 % arrojó un 71 % de aumento en el rendimiento, seguido de ME al 10 % con el que se obtiene un aumento del 65 % del rendimiento.
Resultados similares han sido reportados, donde diversas especies de Trichoderma spp. suprimen el crecimiento de fitopatógenos como la Pythiumarrhenomanes, Rhizoctonia solani, Fusarium oxysporum, Alternaria tenuis y Botrytis cinérea (Zin y Badaluddin, 2020). Así, por ejemplo, Lu et al. (2020) en cultivo de maíz obtienen un aumento en el rendimiento hasta del 11 %, en el control de patógenos como Fusarium graminearum y F. verticillioides, quienes redujeron su nivel de infestación entre 25 y 47 %. Seng et al. (2014), reportan reducción del 11 % de infestación del hongo fitopatógeno Moniliophthora roreri en cultivos de cacao en Costa Rica, al asperjar directamente sobre los árboles a Trichoderma spp. a los 35 días. Sin embargo, en cultivos de cacao en Colombia; (Rojas y Villa, 2017), si bien no observan aumento significativo en el rendimiento, si logran un control significativo sobre la infestación de cultivo.
Las especies endófitas de Trichoderma spp. crecen, penetran y colonizan el interior de las raíces, donde establecen una relación simbiótica que aumenta la concentración de sacarosa y otros nutrientes como Cu, P, Fe, Zn, Mn y Na proporcionando además inmunidad contra el invasor. Algunos autores señalan que se trata de la inducción de novedades transcriptómicas, para identificar a nivel molecular cómo se acopla todo el transcriptoma a las superestructuras de los tejidos y órganos, que favorecen no solo la eliminación del patógeno, sino que se mejora la habilidad fotosintética que contribuye al incremento del crecimiento, rendimiento y resistencia a los patógenos (Mukherjee et al., 2012; Zin y Badaluddin, 2020). Por otra parte, se reporta que estos hongos secretan factores estimulantes del crecimiento como el ácido indol acético y análogos, así como también el ácido cítrico y fumárico glucónico, que al reducir el pH del suelo solubilizan fosfatos haciendo disponibles minerales como el Fe, Mn y Mg (Toghueo et al., 2016).
En los ensayos realizados en este estudio sobre el cultivo de quinua, se obtienen mejores resultados con la aplicación del ME al 5 %. El efecto benéfico del uso de ME en la promoción del crecimiento de las plantas, así como su efecto fungicida, ha sido reportado en diversidad de cultivos. Kolima et al. (2016) en cultivo de maíz reporta un incremento en los rendimientos entre el 15 y 29 %, el cual se atribuye a que de alguna forma se acelera el reciclaje de nutrientes disponible en el sistema suelo-planta.
El uso de ME comienza desde los años 1960, a la fecha se conoce las bondades que representa el uso de mezclas de microorganismos bacterianos como lactobacillus, Rhodopseudomonas sp. y levaduras como Saccharomices. La literatura señala que estos microorganismos facilitan la disponibilidad de nutrientes a las plantas, participando en la solubilización de fosfatos que liberan metales pesados y aumentan niveles de fósforo y potasio; asimismo contribuyen a fijar el nitrógeno por lo que pueden asimilar más fácilmente. Esto contribuye a la promoción del crecimiento de las raíces y eventualmente mejora la nutrición de las plantas (Morocho y Leiva-Mora, 2019).
Los ME a nivel del suelo, como consecuencia de su crecimiento favorecen la degradación de la materia orgánica, reducen la porosidad de los suelos por lo que ayudan a retener el agua, así durante la sequía aumenta la resistencia de las plantas al estrés hídrico. Por otra parte, su actividad permite la degradación de compuestos de alta toxicidad provenientes de pesticidas (Morocho y Leiva-Mora, 2019).
El uso de hongos endófitos y otros microorganismos, además de ejercer una acción fungicida al suprimir el crecimiento de fitopatógenos, ejercen efectos como agentes de descomposición natural y de desintoxicación por efecto de plaguicidas y herbicidas, funciones que mejoran los procesos de compostaje, y por otra parte, actúan como promotores de crecimiento, lo que en cultivos a gran escala representa aumentos en la producción. Estas son aplicaciones muy importantes para la industria agrícola, pues con enfoque de control biológico, representan estrategias de uso sostenible que no solo contribuyen a la solución de problemas de contaminación, sino que favorecen el rendimiento y protección de cultivos, implicando una ventaja económica, ya que el empleo de agroquímicos es más costoso y perjudicial al medio ambiente.
Conclusiones
El tratamiento de cultivos de quinua con Trichoderma spp. y microorganismos eficaces contra el mildiu fue significativamente positivo, redujo la incidencia de la enfermedad y contribuyó al crecimiento de la planta, obteniéndose una mejora en el rendimiento.
En relación con el efecto fungicida, medido a través del área bajo la curva AUDPC, el tratamiento más efectivo se alcanzó con Trichoderma spp cepa TETQ-3, seguido de ME al 5 % con AUDPC de 586.19 y 586.44 respectivamente. En cuanto al efecto de promoción del crecimiento, fue ME al 5 % con el que se observaron mejores resultados con un rendimiento de 3872 Kg/Ha.
Se propone realizar más ensayos enriqueciendo ME al 5 % con la cepa TETQ-3 para valorar los posibles efectos sinérgicos que permitan el máximo de producción. Sin embargo, bajo las condiciones climáticas y del suelo que se tienen para la región de Puno, el uso de ME al 5 % se presenta como la alternativa más idónea para el biocontrol de uso sostenible de los cultivos de quinua.














