Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biomédica
Print version ISSN 0120-4157On-line version ISSN 2590-7379
Biomédica vol.32 no.1 Bogotá Jan./Mar. 2012
ARTÍCULO ORIGINAL
Laboratorio Clínico, Clínica Colsanitas, Bogotá, D.C., Colombia
Institución donde se llevó a cabo el trabajo:
Laboratorio de Citogenética, Clínica Universitaria Colombia, Clínica Colsanitas
Contribución de los autores:
Claudia Liliana Durán: autora principal, planificación y ejecución del proyecto, consolidación de la información, análisis y presentación de resultados, y redacción del manuscrito.
Olga Lucía Morales: planificación del proyecto, asesoría y seguimiento metodológico de la investigación, y preparación del manuscrito.
Sandra Johanna Echeverri: registro y consolidación de datos procedentes del programa de tamización neonatal, base de este estudio, y análisis de resultados.
Mario Isaza: asesoría y seguimiento a lo largo del proyecto, especialmente en aspectos epidemiológicos y análisis de resultados.
Recibido: 10/05/11; aceptado:10/11/11
Introducción. La mutación de la hemoglobina S (HbS) va acompañada por otras mutaciones en la región del cromosoma 11, conocida como conjunto de la globina beta(beta globin cluster). El patrón de combinación de estos polimorfismos da lugar a los haplotipos que se heredan junto con la mutación de la hemoglobina S, se denominan haplotipos de la mutación bs y revisten gran importancia epidemiológica y clínica.
Objetivo. Determinar la frecuencia de los principales haplotipos asociados al gen HBB en pacientes colombianos heterocigotos para hemoglobina S.
Materiales y métodos. En la Clínica Colsanitas se han estudiado a la fecha 1.200 muestras de sangre periférica de niños en busca de hemoglobinopatías, y se ha encontrado el rasgo falciforme como la hemoglobinopatía más frecuente. Se determinaron los haplotipos del gen HBB que presentaron la mutación beta-S en 33 niños con patrón electroforético de hemoglobina AS, mediante reacción en cadena de la polimerasa (PCR) y enzimas de restricción. Se determinaron el patrón electroforético de la hemoglobina, el nivel de hemoglobina fetal y los parámetros hematológicos de cada individuo.
Resultados. Los haplotipos de la hemoglobina S encontrados con mayor frecuencia en la muestra analizada son de origen africano y su orden de aparición fue mayor para el haplotipo Bantú (36,4 %), seguido por Senegal (30,3 %), Benín (21,2 %) y Camerún (12,1 %). La electroforesis de hemoglobina confirmó el fenotipo AS; la dosificación de hemoglobina fetal mostró niveles por debajo de 1 % y los parámetros hematológicos analizados mostraron valores normales en el 100 % de los individuos.
Conclusión. Los haplotipos de la HbS encontrados con mayor frecuencia en la muestra estudiada eran de origen africano y su distribución variaba de acuerdo con el lugar de prodedencia del individuo. La mayor frecuencia correspodió al haplotipo Bantú.
Palabras claves: haplotipos, globinas beta, anemia de células falciformes, polimorfismo genético, rasgo drepanocítico.
Beta globin haplotypes in hemoglobin S carriers in Colombia
Introduction. The hemoglobin S (HbS) mutation is accompanied by other mutations in the region of chromosome 11 known as "beta globin cluster". The pattern of combination of these polymorphisms giving rise to the haplotypes that co-inherit the HbS mutation, are called haplotypes bs, and are of great epidemiological and clinical significance.
Objective. The frequencies of major haplotypes associated with S beta-globin gene was determined in Colombian patients heterozygous for hemoglobin S.
Materials and methods. As part of the national neonatal screening program at Clínica Colsanitas, located in major cities of Colombia, nearly 1,200 children from different areas of the country were examined for hemoglobinopathies. The sickle cell trait was identified as the most common. S beta-globin gene haplotypes were determined by PCR and restriction enzymes in 33 children with AS hemoglobin electrophoretic patterns (carrier state). In addition, electrophoretic patterns of hemoglobin, fetal hemoglobin levels and hematologic parameters of each individual were identified.
Results. The most frequent haplotypes in Colombia were the Bantú haplotype (36.4 %), followed by Senegal (30.3 %), Benin (21.2 %) and Cameroon (12.1 %) haplotypes. Hemoglobin electrophoresis confirmed the AS phenotype in all patients, and fetal hemoglobin levels below 1%. Other hematological parameters were normal in all cases.
Conclusion. The HbS haplotypes found more frequently in the sample were of African origin, and their distribution varied according to the place of origin of the individual. The most frequent corresponded to the Bantu haplotype.
Keywords: Haplotypes, beta-globins; anemia, sickle cell; polymorphism, genetic; sickle cell trait.
Las cadenas de globinas alfa y beta que forman la hemoglobina humana del adulto son codificadas por genes independientes localizados en los cromosomas 16p13 y 11p15.5 (1). Las mutaciones en estos genes resultan en variantes estructurales de la hemoglobina y talasemias hereditarias. Se cree que el origen de la hemoglobina S se dio hace 30.000 años por la sustitución de una base nitrogenada adenina (A) por timina (T) en el nucleótido 20 del gen de la b globina (2). Todos los individuos con hemoglobina S presentan la misma mutación, y va acompañada por otras mutaciones en la región del cromosoma 11, conocidas como conjunto de la globina beta (beta globin cluster), que originan distintos polimorfismos. El patrón de combinación de estos polimorfismos da lugar a los haplotipos que se heredan junto con la mutación de la hemoglobina S y se denominan haplotipos de la mutación bs (1). Todos los haplotipos se heredan de modo autosómico junto con la mutación para la hemoglobina S y pueden ser diagnosticados en el laboratorio según el patrón de corte con enzimas de restricción específicas. Se conocen cinco haplotipos principales y 23 menores. Los principales son: Senegal (Sen), Camerún (Cam), Benín (Ben), Bantú o CAR (por Central African Republic) y Asiático o Árabe-Indio (3-8).
El descubrimiento de los haplotipos de la mutación bs ha permitido mejorar el conocimiento en torno a la heterogeneidad clínica de los individuos con anemia falciforme y permite determinar en gran medida el pronóstico de la enfermedad (3).
Desde el punto de vista evolutivo y epidemiológico, se ha postulado que la hemoglobina S surgió como respuesta a la presión ejercida por la malaria, lo cual podría explicar que la distribución de la mutación del gen bs y de la malaria sea la misma, y que en África obedezca a los desplazamientos de población y a barreras naturales (desierto) que limitan la dispersión de Plasmodium spp. (9,10). La distribución geográfica particular de los haplotipos africanos (Senegal, Bantú, Camerún, Benín) alrededor del mundo, se derivó de patrones migratorios ancestrales a través del desierto del Sahara hacia el continente americano (2,11); se cree que el haplotipo asiático tiene un origen distinto al africano y está localizado básicamente en el golfo Pérsico y la India (12).
En África, cerca de 90 % de los pacientes son homocigotos para estas variantes, pero en el resto del mundo existe un patrón de heterocigotos para estos haplotipos (1,2). En América, la mezcla de población hace que los individuos con anemia falciforme sean, por lo general, heterocigotos para dos de los tres haplotipos más comunes: Senegal, Benín y Bantú (13-17). En Panamá, contrario a lo observado en Brasil, Venezuela y México, el mayor porcentaje de la población ha sido reportada como principalmente homocigota para los haplotipos CAR, Benín y Senegal (18). La presentación es más grave en aquellos que heredan Benín/Bantú que en quienes heredan Senegal/Bantú. Camerún es poco frecuente y tiene gravedad intermedia (13).
En Colombia, un estudio realizado en población de la costa con anemia falciforme encontró los haplotipos Bantú, Benín y Senegal en el mismo orden de frecuencias encontradas en Brasil (11,16,19), mientras en Venezuela y Cuba su orden es: Benín, Bantú y Senegal (17,20). Los datos históricos indican que la mayoría de los africanos que llegaron a Colombia son originarios de Angola (Bantú) y de la isla de Santo Tomé (São Tomé) en la Bahía de Benín (11).
A pesar de que el descubrimiento de los haplotipos bs ha permitido explicar la heterogeneidad clínica de la anemia falciforme, que va desde anemia hemolítica crónica hasta falla orgánica y muerte, hasta ahora no se ha relacionado un haplotipo determinado con la aparición de síntomas propios de anemia leve, complicaciones vasculares con infarto visceral y hematuria en individuos con rasgo falciforme bajo ciertas condiciones de anoxia, acidosis, infección respiratoria o anestesia (21). La asociación entre los haplotipos y la gravedad clínica parece estar relacionada con el hecho de que la concentración de hemoglobina F es distinta en cada haplotipo. Estas diferencias están dadas por una tasa de sustitución más lenta de hemoglobina F por hemoglobina S en los haplotipos Senegal y asiático. La herencia de, al menos, un cromosoma Bantú está ligada a cuadros clínicos más graves, en los cuales la concentración de hemoglobina F es menor de 5 %, mientras que los relacionados con otros haplotipos (Senegal y asiático) son más leves y tienen concentración de hemoglobina F mayor o igual a 20 % (2,9,22,23).
En Colombia, los estudios relacionados con la hemoglobina S se han restringido a la población ubicada en las zonas de la costa o a individuos con anemia falciforme, lo que ha originado una brecha en cuanto al conocimiento epidemiológico y clínico del resto de la población colombiana portadora del gen bs.
El propósito de este estudio consistió en determinar la frecuencia de los principales haplotipos asociados al gen de la globina beta mutante (gen bS) en pacientes heterocigotos cuya tamización demostrara un patrón electroforético sugestivo de hemoglobina S.
Materiales y métodos
El estudio se llevó a cabo en el Laboratorio de Biología Molecular y Citogenética de la Clínica Colsanitas, ubicado en Bogotá. En esta institución el mayor porcentaje de pacientes atendidos corres-ponde a individuos con aseguramiento privado.
Se trata de un estudio descriptivo de serie de casos, en el que se incluyeron 33 niños previamente identificados como heterocigotos para hemoglobina S (fenotipo hemoglobina AS) en el tamización neonatal mediante electroforesis de hemoglobina.
Los pacientes incluidos eran procedentes de Barranquilla, Bogotá, Bucaramanga, Cali y Cartagena. Se incluyeron niños entre los 5 y 11 días de nacidos que habían participado en el Programa de Tamizaje (sic.) Neonatal de la Clínica Colsanitas en el período comprendido entre junio de 2000 y diciembre de 2006, con resultado positivo confirmado para hemoglobina S en el tamización para hemoglobinopatías. Se excluyeron los niños cuyo fenotipo correspondió a una hemoglobinopatía diferente de la hemoglobina S.
A partir de la base de datos del Programa de Tamizaje (sic.) Neonatal y previa autorización del Comité de Ética de Investigación de la Organización Sanitas Internacional, se obtuvo la información pertinente para ubicar a los pacientes, informarles del estudio e invitarlos a participar en el mismo. Se acordó una cita en la ciudad de domicilio del paciente y allí se diligenció el consentimiento informado, la encuesta con información general y se procedió a la toma de la muestra de sangre venosa con anticoagulante EDTA. Por cada niño se obtuvo una muestra de 2 ml de sangre venosa.
Parámetros hematológicos
Se determinaron la hemoglobina, el volumen corpuscular medio y la concentración de hemo-globina corpuscular media por métodos estándar de laboratorio.
Electroforesis de hemoglobina
El procedimiento para la determinación de la hemoglobina utiliza electroforesis en gel de agarosa a pH alcalino; consiste en tratar la muestra con una solución hemolítica, sembrarla junto con los controles en gel de agarosa al 1 % y hacer el corrido electroforético según el protocolo establecido en el software del sistema/equipo SPIFE 2000 (Helena Laboratories, Beaumont, TX, USA). Al finalizar este procedimiento el gel es pasado a la cámara de tinción y utilizando el equipo Quick Scan® (Helena Laboratories, Beaumont, TX, USA), se realiza un registro y por densitometría se establece el porcentaje de cada una de las bandas que se aprecian en el gel.
Dosificación de hemoglobina fetal
Se utilizó el método de Betke, basado en la resistencia de la hemoglobina fetal al álcali, para detectar pequeñas cantidades de hemoglobina fetal (24,25).
Determinación del haplotipo
El procedimiento para determinar los haplotipos tiene varias etapas que incluyen extracción del ADN, PCR, restricción y electroforesis. La extracción de ADN se hizo a partir de sangre total, siguiendo el protocolo Promega Wizard Genomic DNA Purification Kit® (Promega Corporation, Madison, WI, USA), que incluye lisis de la membrana celular, de la membrana nuclear y la precipitación de ADN. El ADN de cada individuo fue amplificado en siete PCR independientes, cada una con un juego de iniciadores, amplificando las secuencias que contienen los siete sitios polimorfos de interés en la región del grupo de genes de la globina beta. En la PCR se utilizan siete juegos de iniciadores (Invitrogen, Carlsbad, CA, USA), Go Taq polimerasa (Promega, Madison, WI, USA), dNTP (Bioline, London, UK) y agua de grado biología molecular (4).
Se digirieron siete productos de PCR utilizando cinco endonucleasas de restricción (Xmn I, Hind III, Hinc II, Hinf I, Hpa I), con las cuales se evidenció la presencia de siete sitios de restricción. Finalmente, se realizó una electroforesis en gel de agarosa, en la cual se cargaron el marcador de peso molecular (100 bp DNA Ladder de Invitrogen) y el producto de cada restricción en un gel que contiene SYBR Safe (Invitrogen, Carlsbad, CA, USA) (colorante para el ADN) para visualizar los fragmentos de ADN con luz ultravioleta. La presencia del sitio de restricción se determinó por el tamaño de los fragmentos y el análisis de los sitios de restricción permitió determinar los haplotipos (cuadro 1) (4).
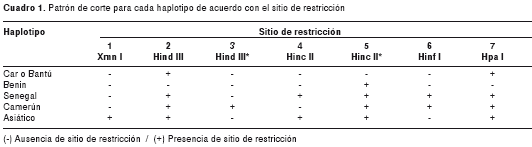
Análisis de la información
Para el manejo de los datos y el análisis de la información se utilizó el paquete estadístico SPSS® para Windows 11. A la edad, hemoglobina, volumen corpuscular medio, concentración de hemoglobina corpuscular media y hemoglobina fetal, se les calculó la media y los promedios. La electroforesis de hemoglobina se analizó por cálculo de frecuencias simples. A las variables sexo, procedencia y haplotipo, se les calculó la proporción de presentación en la muestra.
Resultados
La población analizada estuvo constituida por 33 niños, 63,6 % de sexo femenino y 36,4 % de sexo masculino. La edad media fue de 3,7 años y el 100 % fue población mestiza (cuadro 2).

La ciudad con mayor proporción de individuos estudiados fue Bogotá (54,5 %) del total de la muestra analizada, seguida por Barranquilla (21,2 %), Cali (12,1 %), Bucaramanga (6,1 %) y Cartagena (6,1 %). Cada ciudad mostró una distribución particular de haplotipos (cuadro 3).

La electroforesis de hemoglobina se hizo antes de la determinación de los haplotipos y confirmó la presencia de hemoglobina S en todos los individuos. En la dosificación de la hemoglobina fetal se encontró que todos los individuos tenían un porcentaje de hemoglobina fetal menor de 1 %, y los parámetros hematológicos analizados tenían valores normales en el 100 % de los individuos (cuadro 4).

La frecuencia general de los haplotipos muestra en primer lugar al haplotipo Bantú o CAR (36,4 %), seguido por Senegal (30,3 %), Benín (21,2 %) y Camerún (12,1 %). No se encontró el haplotipo asiático en la muestra analizada.
Los resultados de las electroforesis de los sitios de restricción para la determinación de los haplotipos en el control normal y el perfil de cada uno de los cuatro haplotipos encontrados, se presentan en las figuras 1 figura 2, figura 3, figura 4 a figura 5. Los tamaños de las bandas son aproximados y se basan en el patrón de peso molecular utilizado.





Discusión
En el presente estudio se destaca la mayor frecuencia del haplotipo Bantú (36,4 %), igual que en un estudio previo donde la frecuencia del haplotipo Bantú o CAR fue la más alta (58 %); mientras que la frecuencia de los haplotipos africanos Senegal (Sen), Benín (Ben) y Camerún (Cam) ocupa un orden diferente al mostrado en el mismo estudio (11).
Los estudios sugieren que la mayor proporción de individuos que llegaron a América provenientes de África tenían su origen en Benín (70 %) y proporciones pequeñas en la República Central Africana (CAR) (17 %) y Senegal (13 %) (20). Nuestros hallazgos, obtenidos a partir de una muestra de 1.200 infantes, entre los cuales 33 (2,75 %) presentaban alteraciones hematológicas asociadas a la hemoglobina S, revelan una mayor proporción del haplotipo Bantú y no del Benín. La modificación de las proporciones inicialmente establecidas para los grupos africanos puede ser consecuencia de procesos de migración interna y expansión, o bien, de cuellos de botella ocurridos desde la llegada de los grupos africanos y europeos hasta la actualidad, dando lugar a grupos mixtos de poblaciones (21). En México se ha informado la presencia de haplotipos Benín y Bantú (25), en Brasil, principalmente Bantú y Benín y en menor proporción Camerún, Senegal y Asiático (26), mientras que en Venezuela, en su orden de frecuencia, se han reportado los haplotipos Benín, Bantú, Senegal y Camerún, sin presencia del haplotipo asiático (27).
Diferentes estudios en Colombia muestran una prevalencia de hasta 10 % de hemoglobina S en población infantil (11,19,28,29), y la forma heterocigota (AS) es la presentación más común, igual que en otros países de América, como México, Venezuela, Costa Rica y Brasil (27,30-33).
Una importante diferencia entre el presente estudio y otros relacionados con hemoglobina S y haplotipos, radica en la población estudiada. Mientras que otros estudios previos en Colombia se han llevado a cbao en individuos con anemia falciforme ubicados en regiones de la costa, los resultados aquí mostrados corresponden a una población de individuos portadores de hemoglobina S procedentes de distintas regiones de Colombia.
Cada ciudad mostró una distribución particular de haplotipos. En los niños procedentes de Bogotá, se identificaron todos los haplotipos africanos, a diferencia de los niños provenientes de las ciudades de la costa como Cartagena y Barranquilla, donde se encontró Bantú y Senegal en similares proporciones, pero no Benín ni Camerún. En Bucaramanga sólo está presente el haplotipo Bantú, mientras en Cali la mayor proporción de individuos tiene haplotipo Benín. El haplotipo Camerún sólo está presente en Bogotá, mientras el Benín lo está en Bogotá y Cali.
La distribución de los haplotipos en las ciudades incluidas en este estudio sugiere que los individuos provenientes del centro de África (Bantú) se dispersaron a lo largo del territorio colombiano y, por lo tanto, constituye el haplotipo más frecuente en Colombia. Esta aproximación de la distribución de haplotipos por ciudades establece una base para futuros estudios de población que tengan en cuenta la gran movilidad de la población contemporánea.
La presencia de un haplotipo determinado se ha correlacionado con la gravedad de los síntomas en los individuos con anemia falciforme y se cree que puede también alterar el curso clínico del rasgo falciforme (24,33,34). Se ha observado que la presentación de los síntomas es más seria en aquellos homocigotos para hemoglobina S que heredan los haplotipos Benín y Bantú, que en quienes heredan Senegal y Bantú; Camerún es poco frecuente y tiene gravedad intermedia (35,36).
En la población estudiada, los individuos hasta el momento no manifiestan haber tenido ningún síntoma de anemia y la determinación de los parámetros hematológicos indicó que todos los sujetos heterocigotos para hemoglobina S, tienen valores normales de hemoglobina, volumen corpuscular medio y concentración de hemoglobina corpuscular media, independientemente de la edad, el sexo o el haplotipo que porten. Los resultados de los parámetros hematológicos también fueron normales al momento del estudio.
Una de las razones para que los individuos analizados no muestren alteraciones en los parámetros hematológicos, es que sus eritrocitos sólo tomen la forma falciforme en casos de anoxia y ninguno de ellos refirió haber estado bajo condiciones de acidosis, infección respiratoria, anestesia o falla cardiaca congestiva, en las que la afinidad de la hemoglobina del oxígeno se ve disminuida y se desencadenan los signos y síntomas de anemia que incluyen alteración de los valores hematológicos (33-36). Otra razón para que los portadores de hemoglobina S no muestren cambios en los parámetros hematológicos evaluados, es el mayor porcentaje de hemoglobina A que compensa la presencia de hemoglobina S, sin que el haplotipo presente pueda por sí mismo causar signos o síntomas como ocurre en los individuos con anemia falciforme.
Los niveles de hemoglobina fetal fueron menores de 1 %. Este valor es similar al encontrado en los individuos sin hemoglobina S, es decir que el haplotipo en individuos heterocigotos parece no afectar el nivel de hemoglobina fetal, como se ha observado en homocigotos (35,36).
Por otro lado, en la edad de los niños estudiados ya se han alcanzado niveles inferiores al 4 % de hemoglobina fetal. En sujetos heterocigotos probablemente el nivel de hemoglobina A (60 %) es suficiente para compensar la presencia de hemoglobina S y, por lo tanto, la síntesis de cadenas gamma para la producción de hemoglobina fetal no se estimula (2,35,36).
Otra razón para que la hemoglobina fetal no persista en los individuos estudiados, es que el nivel de hemoglobina fetal no surja como respuesta directa a un haplotipo dado sino a la presencia de un alto porcentaje de cadenas mutadas beta propia de los individuos homocigotos (hemoglobina SS). La persistencia de hemoglobina fetal en los individuos homocigotos surge como respuesta compensatoria a la presencia de hemoglobina S, ya que la primera tiene sus cadenas gamma intactas, a diferencia de la hemoglobina S cuyas cadenas beta están mutadas. Esta persistencia de hemoglobina fetal relacionada con algunos haplotipos podría ser la consecuencia de mutaciones adicionales sobre el agrupamiento de genes beta no detectadas por ninguno de los métodos utilizados en el diagnóstico de hemoglobinopatías (35,36). Los haplotipos se heredan junto con la mutación de globina beta, pero los polimorfismos (mutaciones) pueden no ocurrir exclusivamente cuando la mutación globina beta está presente; por lo tanto, resulta interesante determinar si los polimorfismos que dan lugar a los haplotipos pueden afectar de algún modo el gen gamma, de modo que la producción de estas cadenas siga aún después de la edad fetal o que la regulación en la expresión cronología de este grupo de genes se vea alterada por alguna de estas mutaciones hasta ahora "silenciosas".
El nivel de hemoglobina S permaneció alrededor de 40 % en los sujetos con rasgo falciforme, mientras la hemoglobina A se encontró en un promedio de 60 %, probablemente porque como mecanismo de compensación es ligeramente mayor la producción de cadenas beta normales que la de cadenas beta mutadas (35,36).
A Helena Groot por dirigir, asesorar y apoyar este proyecto. A María Fernanda Ríos, Yazmín Rocío Arias, Rocío Bocanegra, Juliana Rodríguez y Zuli Yepes, por su permanente consejo durante la ejecución de esta investigación.
Los autores manifestamos que no existen conflictos de interés.
La investigación motivo de este artículo fue financiada por la Clínica Colsanitas
Correspondencia:
Olga Lucía Morales, Carrera 69C Nº 99-45, Bogotá D.C., Colombia. Teléfono: (571) 605-8799, extensión 164; fax: (571) 605-8799, extensión 208 olmorales@colsanitas.com
1. De Galiza GC, Da Silva M. Aspectos moleculares da anemia falciforme. Bras Patol Med Lab. 2003;39:51-6. [ Links ]
2. Rodríguez WE, Sáenz GF, Chávez MA. Haplotipos de la hemoglobina S: importancia epidemiológica, antropológica y clínica. Rev Panam Salud Pública.1998;3:1-8. [ Links ]
3. Josiah Macy Jr. Foundation. Manual da oficina práctica de genética, genoma e biotecnología. Diagnóstico molecular de anemia falciforme. 2004. Fecha de consulta: 5 de noviembre de 2011. Disponible en: http://www.ygyh.org/sickle/whatisit.htm. [ Links ]
4. Sutton M, Bouhassira EE, Nagel RL. Polymerase chain reaction amplification applied to the determination of b-like globin gene cluster haplotypes. Am J Hematol. 1989;32:66-9. [ Links ]
5. Bustamante Z, García R, Martínez G. Genetics, characteristics of hemoglobin S, sickle-cell anaemia and haplotypes (thesis). Cochabamba, Bolivia: Universidad Mayor de San Simón; 2002. [ Links ]
6. Lee YJ, Park SS, Kim JY, Cho HI. RFLP haplotypes of b globin gene complex of b thalassemic chromosomes in Koreans. J Korean Med Sci. 2002;17:475-8. [ Links ]
7. Waterfall CM, Cobb BD. Single tube genotyping of sickle cell anaemia using PCR- based SNP analysis. Nucleic Acids Res. 2001;29:E119. [ Links ]
8. Shimizu K, Hashimoto T, Harihara S, Tajima K, Sonoda S, Zaninovic V. Beta-globin gene haplotype characteristics of Colombian Amerindians in South America. Hum Hered. 2001;51:54-63. [ Links ]
9. El-Hazmi MAF, Warsy AS, Bashir N, Beshlawi A, Hussaim IR, Temtamy S, et al. Haplotypes of the b-globin gene as prognostic factors in sickle cell disease. East Mediterr Health J. 1999;5:1154-8. [ Links ]
10. Powars DR, Schroeder WA, Weiss JN, Chan LS, Azen SP. Lack of influence of fetal hemoglobin levels or erythrocyte indices on the severity of sicle cell anemia. J Clin Invest. 1980;65:732-40. [ Links ]
11. Cuellar-Ambrosi F, Mondragón MC, Figueroa M, Prehu C, Galacteros F, Ruiz-Linares A. Sickle cell anaemia and beta-globin gene cluster haplotypes in Colombia. Hemoglobin. 2000;24:221-5. [ Links ]
12. Currant M, Trabuchet G, Rees D, Perrin P, Harding RM, Clegg JB, et al. Molecular analysis of the b globin gene cluster in Niokholo Mandenka population reveals a recent origin of the bs Senegal mutation. Am J Genet. 2002;70:207-23. [ Links ]
13. Labie D, Srinivas R, Dunda O, Dode C, Lapoumeroulie C, Devi V, et al. Haplotypes in tribal Indians bearing the sickle gene: Evidence for the unicentric origin of the beta S mutation and the unicentric origin of the tribal populations of India. Hum Biol. 1989;61:479-91. [ Links ]
14. Rahimi Z, Karimi M, Haghshenass M, Merat A. Beta-globin gene cluster haplotypes in sickle cell patients from southwest Iran. Am J Hematol. 2003;74:156-60. [ Links ]
15. Hanchard N, Elzein A, Trafford C, Rockett K, Pinder M, Jallow M. Classical beta-globin sickle haplotypes exhibit a high degree of long-range haplotype similarity in African and Afro-Caribbean populations. BMC Genet. 2007;8:52. Fecha de consulta: 5 de noviembre de 2011. Disponible en: http://www.biomedcentral.com/1471-2156/8/52. [ Links ]
16. Gonçalves MS, Bomfim GC, Maciel E, Cerqueira I, Lyra I, Zanette A, et al. beta s haplotypes in sickle cell anaemia patients from Salvador, Bahia, Northeastern Brazil. Braz J Med Biol Res. 2003;36:1283-8. [ Links ]
17. Moreno N, Martínez JA, Blanco Z, Osorio L, Hackshaw P. Beta-globin gene cluster haplotypes in Venezuelan sickle cell patients from the state of Aragua. Genet Mol Biol. 2002;25:21-4. [ Links ]
18. Rusanova I, Cossio G, Moreno B, Perea FJ, De Borace RG, Perea M, et al. b-globin gene cluster haplotypes in sickle cell patients from Panamá. Am J Hum Biol. 2011;23:377-80. [ Links ]
19. Pereira FD, Sáenz I. Hemoglobinopatías en niños. Colombia Médica. 1996;27:146-9. [ Links ]
20. Muñiz A, Puig A, Cabrera M, Fernández J, Martínez G. Marcadores genéticos en pacientes con anemia drepanocítica de la provincia de Cienfuegos: haplotipos del bloque alpha y b - talasemia. Rev Cubana Hematol Inmunol Hemoter. 2000;16:142-4. [ Links ]
21. Nagel RL. The origin of the haemoglobin S gene: Clinical, genetic, and anthropological consequences. Einsten Q J Med. 1984;2:53-62. [ Links ]
22. Powars DR. Sickle cell anemia: Beta s-gene-cluster haplotypes as prognostic indicators of vital organ failure. Semin Hematol. 1991;28:202-8. [ Links ]
23. Sarnaik SA, Ballas SK. Molecular characteristics of pediatric patients with sickle cell anemia and stroke. Am J Hematol. 2001;67:179-82. [ Links ]
24. Henry JB. Clinical diagnosis and management by laboratory methods. 19th edition. Philadelphia: W. B. Saunders; 1996. p. 1556. [ Links ]
25. Old JM. Screening and genetic diagnosis of haemoglobin disorders. Blood Rev. 2003;17:43-53. [ Links ]
26. Adorno E, Zanette A, Lyra I, Oliveira SM, Galvao RM, Goncalvez M. Clinical and molecular characteristics of sicle cell anemia in the northeast of Brazil. Genet Mol Biol. 2008;31:621-5. [ Links ]
27. Arends A, Chacín M, Bravo-Urquiola M, Montilla S, Guevara JM, Velasquez D, et al. Hemoglobinopatías en Venezuela. Interciencia. 2007;32:516-21. [ Links ]
28. Silva JR. Tamizaje de hemoglobinopatías en una muestra de la población infantil de Cartagena. 1996. Fecha de consulta: 15 de noviembre 2005. Disponible en: http://www.encolombia.com/33-2_pediatria_tamizaje.htm. [ Links ]
29. Bernal M, Giraldo A, Bermúdez A, Moreno E. Estudio de la frecuencia de hemoglobinopatías en las islas de San Andrés y Providencia, Colombia. Biomédica. 1995;15:5-9. [ Links ]
30. Peñalosa-Espinosa RI, Buentello-Malo L, Hernández-Maya MA, Nieva-García B, Lisker-Yurkowirzki R, Salamanca-Gómez F. Frecuencia de la hemoglobina S en cinco poblaciones mexicanas y su importancia en la salud pública. Salud Pública Mex. 2008;50:325-9. [ Links ]
31. Saénz-Renauld GF. Hemoglobinas anormales. Acta Med Costarric. 2005;47:173-9. [ Links ]
32. Pignarato M, Soares E, Pereira W, Dantas T. Prevalência de hemoglobinas anormais em recêm-nascidos da cidade de Natal, Rio Grande do Norte, Brasil. Cad Saúde Pública. 2004;20:123-8. [ Links ]
33. Lyra IM, Gonçalves MS, Pellegriinei JA, Gesteira M, Carvalho MH, Olalla ST, et al. Clinical, haematological, and molecular characterization of sickle cell anemia pediatric patients from two different cities in Brazil. Cad Saúde Pública. 2005;21:1287-90. [ Links ]
34. Platt OS, Brambilla DJ, Rosse WF, Milner PF, Castro O, Steinberg MH, et al. Mortality in Sickle cell disease - life expectancy and risk factors for early death. N Engl J Med. 1994;330:1639-44. [ Links ]
35. Yamaja BN, Kulkarni S, Dampier CD, Stuart MJ. Fetal hemoglobin in sickle cell anemia: Relationship to erythrocyte adhesion markers and adhesion. Blood. 2001;97:2568-73. [ Links ]
36. Lu ZH, Steinberg MH. Fetal hemoglobin in sickle cell anemia: Relation to regulatory sequences cis to the b-globin gene. Blood. 1996;87:1604-11. [ Links ]














