Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Biológica Colombiana
Print version ISSN 0120-548X
Acta biol.Colomb. vol.13 no.1 Bogotá Jan./Apr. 2008
DIATOMEAS PERIFÍTICAS EN DIFERENTES TRAMOS DE DOS SISTEMAS LÓTICOS DE ALTA MONTAÑA (PÁRAMO DE SANTURBÁN, NORTE DE SANTANDER, COLOMBIA) Y SU RELACIÓN CON LAS VARIABLES AMBIENTALES
Perifitic Diatoms in Different Reach of Two Lotic Systems in High Mountain (Páramo de Santurbán, Norte de Santander, Colombia) and Their Relation with Environmental Variables
ANGÉLICA M. RAMÍREZ C.1,2, Biología, Estudiante de Maestría en Ciencias - Biología - Ecología.; YASMÍN PLATA-DÍAZ1,, Bióloga.
1 Grupo de estudios en Biodiversidad. Laboratorio de Limnología. Escuela de Biología. Universidad Industrial de Santander. Calle 9 Carrera 27. A.A. 678. Bucaramanga, Colombia.
2 Universidad Nacional de Colombia. Sede Bogotá Carrera 30 No.45-03, Bogotá. aramirezc@tux.uis.edu.co - yasplad@tux.uis.edu.co
Presentado el 12 de agosto de 2007, aceptado 2 de octubre de 2007, correcciones 15 de febrero de 2008.
RESUMEN
En dos sistemas lóticos del páramo de Santurbán, durante lluvia y sequía, se seleccionaron tres tramos de muestreo: nacimiento, zona media y río, evaluando en cada tramo la influencia de las variables ambientales en la estructura del ensamblaje de diatomeas perifíticas. Un nálisis de componentes principales evaluó la variación ambiental y mediante una matriz de correlaciones se estableció la importancia de los factores ambientales en las especies registradas. La conductividad, el potencial redox, el pH y el caudal fueron factores determinantes de la variación ambiental y de las diferencias en la estructura del ensamblaje; el género Eunotia es tolerante a pH ácido, y la polución orgánica favoreció el desarrollo de los géneros Nitzschia y Navícula. Seis especies reportaron una abundancia significativa: Navicula tantula, Achnanthidium minutissimum, Achnanthidium lanceolatum, Gomphonema parvulum, Navicula cryptocephala y Gomphonema lagenula. Los tramos de los ríos presentaron valores altos de caudal y conductividad, que influyeron en la baja diversidad de estas zonas mientras que los valores bajos de caudal y la ausencia de condiciones químicas extremas en las zonas medias explicaron la mayor diversidad y la similitud del ensamblaje entre estas zonas. El ensamblaje no registró variación estacional significativa, presentando mayores diferencias entre los tramos que entre períodos de muestreo, indicando que las diatomeas perifíticas fueron afectadas principalmente por diferencias en el hábitat entre los tramos y enfatizando la importancia de las condiciones ambientales en los sistemas acuáticos tropicales de alta montaña sobre la composición y abundancia de diatomeas perifíticas.
Palabras clave: diatomeas perifíticas, sistemas lóticos, páramo de Santurbán.
ABSTRACT
Three sample zones: the headwater zone, the mid flow zone and the stream zone were selected in two lotic system of the Páramo de Santurbán, during rainy and dry season. In each zone the influence of physical, chemical and hydrological variables on the structure of the benthic diatom assemblage were evaluated. A component principal analysis evaluated the environmental variation. A correlation matrix established the importance of the environmental factors in the registered species. Conductivity, redox potential, pH, and flow, were determinant factors on the environmental variation and on the assemblage structure differences between the zones. Acidity allowed the high occurrence of Eunotia species, and organic pollution allowed the abundance of Nitzchia and Navicula species. Six species were abundant: Navicula tantula, Achnanthidium minutissimum, Achnanthidium lanceolatum, Gomphonema parvulum, Navicula cryptocephala and Gomphonema lagenula. The stream zones registered high values of flow and conductivity, which were related with their lower diversity. Low flow and little stress condition on the mid flow zones were correlated with the highest values of diversity and with the similarity found in the dominant species between these zones in the two systems. The assemblage did not register seasonal variation; dissimilarity of diatom assemblages was larger among samples from different reach, compared with samples of different periods of the same reach, indicating that benthic diatom assemblages in the Páramo de Santurbán were mainly affected by habitat differences between zones. Our results highlight the importance of environmental factors in the composition and abundance of benthic diatoms in tropical aquatic systems.
Key words: periphytic diatoms, lotic systems, Páramo de Santurbán.
INTRODUCCIÓN
Las diatomeas (Bacillariophyta) constituyen un grupo taxonómico representativo dentro de la comunidad perifítica, principalmente debido a la facilidad que este grupo de algas tiene para formar colonias y adherirse al sustrato (Cox, 1996; Peterson, 1996). Los ecosistemas lóticos, en los cuales se desarrolla este ensamblaje presentan un movimiento constante de agua con características hidrológicas, químicas y biológicas determinadas por el clima, la geología y la vegetación de la cuenca (Payne, 1986; Allan, 1995), registrando desde las cabeceras hasta las regiones bajas un gradiente de condiciones que incluye ancho del cauce, profundidad, velocidad, volumen de flujo, temperatura y entropía. Según el Concepto de río Continuo (Vannote et al., 1980) de manera análoga a estas características, la estructura y función de las comunidades se desarrolla ajustándose para un uso eficiente de la energía del sistema; de acuerdo con este modelo, las comunidades perifítica y briofita estarán encargadas de la productividad en las cabeceras de los ríos, las macrófitas ocuparán las regiones medias, y en los grandes ríos pueden desarrollarse también las comunidades fitoplanctónicas (Allan, 1995). Con base en esta hipótesis se han realizado estudios para determinar el grado de influencia de las condiciones del medio en la estructura de las comunidades en los sistemas lóticos. Para las diatomeas se ha reportado una amplia heterogeneidad espacial y temporal, representada en variaciones en la composición, biomasa y productividad del ensamblaje respondiendo a factores ambientales como corriente, (Mosisch y Bunn, 1997; Ghosh y Gaur, 1998; Francoeur y Biggs, 2006) luz, (Hill, 1996; Tuji, 2000) temperatura, (DeNicola, 1996) tipo de sustrato, (Townsend y Gell, 2005) concentración de nutrientes (Reavie y Smol, 1998; Rott et al., 1998; Rosemond et al., 2000), conductividad (Potapova y Charles, 2003) y pH (Kwandras, 1993; Battarbee et al., 1997, Hirst et al., 2004). Por otra parte los estudios multifactoriales han puesto en evidencia la comple-jidad en las interacciones que se presentan entre las diatomeas y su ambiente (Pan et al., 1999; Sabater, 2000; Potapova y Charles, 2002; Potapova y Charles, 2003; Leira y Sabater, 2005). En Colombia, aunque existen trabajos en ríos enfocados en las algas bénticas (Martínez y Donato, 2003; Díaz y Rivera, 2004; Rivera y Díaz, 2004; Zapata y Donato, 2005; Sala et al., en prensa; Plata et al., comunicación personal) nada se conoce sobre la estructura de las diatomeas en nacimientos de agua en la zona de vida paramuna, y teniendo en cuenta que la mayoría de estudios y generalizaciones se han realizado para regiones templadas, aún falta más profundización en el estudio de los factores influyentes en la estructura del perifiton en ríos tropicales. En este trabajo se busca evaluar la variación espacio-temporal en la estructura del ensamblaje de diatomeas perifíticas, su relación con la fluctuación pluviométrica e hidrológica y la influencia de algunas variables físicas y químicas del agua, en diferentes tramos de dos sistemas lóticos del páramo de Santurbán (noreste de Colombia). La información suministrada permitirá ampliar el conocimiento sobre la diversidad de la diatomoflora en ríos de montaña tropical, así como las características ambientales de los sistemas acuáticos estudiados, conformando una línea base para el desarrollo de estudios posteriores de bioindicación de sistemas lóticos de alta montaña en Colombia.
MATERIALES Y MÉTODOS
DESCRIPCIÓN DEL ÁREA DE ESTUDIO
El páramo es una zona de vida que se caracteriza por una alta humedad, radiación y variabilidad en la temperatura diaria, presencia de niebla y precipitación horizontal, así como una marcada variación climática anual dada por períodos de máxima y mínima precipitación. Estas características le confieren a este sistema un papel importante en el almacenamiento de agua y en la regulación hídrica de Colombia (Sturm y Mora-Osejo, 1995). El páramo de Santurbán es un páramo húmedo, ubicado en el departamento de Norte de Santander, en la vertiente occidental de la Cordillera Oriental Andina entre los 3.000 y los 4.000 msnm (Rangel, 2000). Presenta un régimen pluviométrico unimodal, con un período de precipitación máxima de abril a noviembre y un período de menor precipitación de diciembre a marzo (Ideam, 2005; Ideam, 2006). En esta zona se encuentran gran cantidad de nacimientos de agua, asociados principalmente a relictos de bosque de niebla. En la zona subparamuna, entre los 3.000 y 3.500 msnm., estos nacimientos de agua se forman por el fenómeno de precipitación horizontal que se produce por la condensación de la niebla en los relictos boscosos (Corponor, 2002). Aunque estos sistemas lóticos presentan un cauce pequeño, se encuentran en gran número, lo que les confiere importancia como reserva hídrica y fuente de abastecimiento de la zona nororiental colombiana (Corponor, 2002). Para este estudio, fueron seleccionados dos sistemas lóticos de primer orden (sistema A y B en adelante), desde la naciente de cada sistema hasta la desembocadura en los ríos La Plata y La Venta respectivamente, abarcando una longitud de 500 m aproximadamente en este recorrido. En cada sistema fueron ubicados tres tramos de muestreo de 20 m cada uno, los cuales se establecieron teniendo en cuenta diferencias en caudal y profundidad (Figura 1).

Nacimiento: corresponde a los tramos superiores de cada sistema, es la zona donde brota el agua y se forman pozetas con poca profundidad y poco caudal. El tramo 1 del sistema A (T1a) se ubica a 7º15'43"N, 72º46'29"W y el tramo 1 del sistema B (T1b) a 7º15'50"N, 72º45'45"W. Zona media: hay un flujo constante de agua y no se presentan pozetas, corresponde a los tramos 2a (T2a) a 7º15'56"N, 72º46'69"W y 2b (T2b) a 7º15'50"N, 72º45'37"W respectivamente. Zona de río: zona donde el nacimiento desemboca en el río; presenta caudal y profundidad considerable y corresponde a los tramos 3a (T3a) a 7º15'51"N, 72º46'35"W y 3b (T3b) a 7º15'50"N, 72º45'37"W.
MÉTODOS
Se realizaron cuatro muestreos, distribuidos en épocas de lluvias (octubre y noviembre de 2005, precipitación: 134 y 194 mms respectivamente) y sequía (enero y marzo de 2006, precipitación: 17 y 19 mms respectivamente). En cada tramo se tomó una muestra de cada uno los sustratos disponibles (rocas, sedimento y material vegetal), seleccionando cinco puntos de muestreo, sin tener en cuenta el área (Barbour et al., 1999), preservando con 1% solución Lugol (Apha, 1998). El registro de las variables físicas y químicas in situ (oxígeno disuelto, porcentaje de saturación de oxígeno, temperatura ambiente, temperatura del agua, pH, conductividad y potencial rédox) se realizó con una sonda portátil (Eijkelkamp). Para cuantificar la velocidad superficial de la corriente y el caudal se siguió el método del flotador (Wetzel, 2001). Con el fin de caracterizar el estado trófico de los sistemas evaluados, en el último muestreo se tomaron muestras en cada uno de los tramos para el análisis de nutrientes (Apha, 1998). Para abarcar una composición taxonómica más amplia, se procedió a integrar las muestras obtenidas en cada tramo (rocas, sedimento y material vegetal), tomando una alícuota de 15 mL de cada una. La limpieza del material se realizó mediante el método de oxidación en peróxido (CEN/TC 230, 2002) y se realizaron preparados fijos en Naphrax®. Este material se depositó en la Colección Limnológica del Laboratorio de Limnología de la Universidad Industrial de Santander (UIS-ML: 1228-1273; UIS-PF: 119-141). Para el análisis cuantitativo se realizó un conteo de valvas por especie hasta lograr una eficiencia de conteo del 95% (Bate y Newall, 1998). El material se determinó siguiendo las claves de Krammer (1982), Krammer (1992), Krammer y Lange-Bertalot (1986), Krammer y Lange-Bertalot (1991a), Krammer y Lange-Bertalot (1991b), Lange-Bertalot (2001), Metzelin y Lange-Bertalot (1998), Rumrich et al. (2000) y el material de referencia con fotografías al MEB de la colección limnológica del Laboratorio de Limnología de la Universidad Industrial de Santander. El análisis taxonómico fue realizado siguiendo el criterio de clasificación de Round et al. (1990). El análisis de datos incluyó desde la exploración descriptiva hasta un análisis de varianza (ANDEVA) o Kruskall Wallis (previa comprobación de supuestos), con prueba post hoc Tukey o Nemenyi, según el caso. La importancia de las variables ambientales se evaluó mediante un análisis de componentes principales (ACP) (STATISTICA 6.0). La descripción de la diversidad se realizó con los índices de Shannon-Wiener, Riqueza numérica, equidad y dominancia de Simpson (BioTools 0.1) Las diferencias en diversidad entre los tramos y épocas de muestreo se evaluaron mediante un análisis de varianza y se empleó un análisis de ordenación (DCA) para evaluar los cambios espacio-temporales en la estructura del ensamblaje (PCORD 3.7). Para evaluar la interacción entre las especies y las variables ambientales se realizaron gráficas de rango de distribución de especies en relación con las variables más significativas, así como una matriz de correlaciones.
RESULTADOS
VARIACIÓN FÍSICA, QUÍMICA E HIDROLÓGICA
El resumen de las variables físicas, químicas e hidrológicas evaluadas para cada uno de los tramos, se resume en la Tabla 1. Las variables físicas y químicas presentaron poca variación estacional. Sin embargo, a nivel espacial, se encontraron diferencias significativas entre los tramos estudiados; el oxígeno registró valores bajos en los nacimientos y la zona media (< 7mg/L), con diferencias significativas entre los tramos T3a y T1b (p< 0,01). En relación al pH se encontraron valores neutros en la mayoría de los tramos, excepto en el tramo T1b donde se registraron valores ácidos (< 6) y en T3b con valores medianamente básicos (≥8). El tramo del río del segundo sistema (T3b) presentó los valores más altos de conductividad (275_S cm-1) y potencial rédox (474 mV), alcanzando diferencias altamente significativas (p< 0,01) en relación con los demás tramos, principalmente en la época de sequía. El caudal presentó cambios estacionales solo en los tramos de los ríos (T3a y T3b p< 0,05), alcanzando valores altos en lluvias; las nacientes y las zonas medias presentaron valores similares de caudal, registrando amplias diferencias con los tramos de los ríos (p<0,01). De acuerdo con el análisis denutrientes realizado, los valores más altos de nitrógeno amoniacal (NH3=6,33 mg L-1) y ortofosfatos (PO4= 0,72 mg L-1) se registraron en el tramo T3b.

Según el ACP realizado, los tres primeros ejes de ordenación explicaron el 83,25% dela variación. La primera tendencia de variación explicó el 38,32% y se asoció con laconductividad (r2=0,78), el pH (r2= 0,72) y el oxígeno (r2= 0,67). La segunda tenden-cia resumió el 28,62% y se asoció con las variables hidrológicas: caudal (r2=-0,84),velocidad superficial, (r2=-0,84) y precipitación (r2=-0,61), mientras que el tercer ejese relacionó con el potencial redox (r2= 0,66) resumiendo el 16,30% de la variación(Fig. 2a). De acuerdo con este análisis se establece que dentro del grupo de factoresevaluados la mayor variación se presentó en la química y física del sistema, seguida dela variación hidrológica y la climática. La distribución de los tramos en el análisismuestra la importancia de T3a y T3b en la variación registrada (Fig. 2b); los puntosmás alejados del eje 1 para T3b corresponden a los muestreos de sequía en los quese registraron altos valores de conductividad y potencial rédox; mientras que lavariación hidrológica en caudal y velocidad superficial estuvo dada principalmentepor el tramo T3a en el primer muestreo de lluvias, que se ubica en el cuarto cuadrantealejado de los demás tramos. En general los tramos de los nacimientos (T1a, T1b) ylas zonas medias (T2a, T2b) presentaron valores bajos de conductividad, potencialredox y caudal, y se agruparon en una zona reducida del eje de ordenación.

VARIABLES BIOLÓGICAS
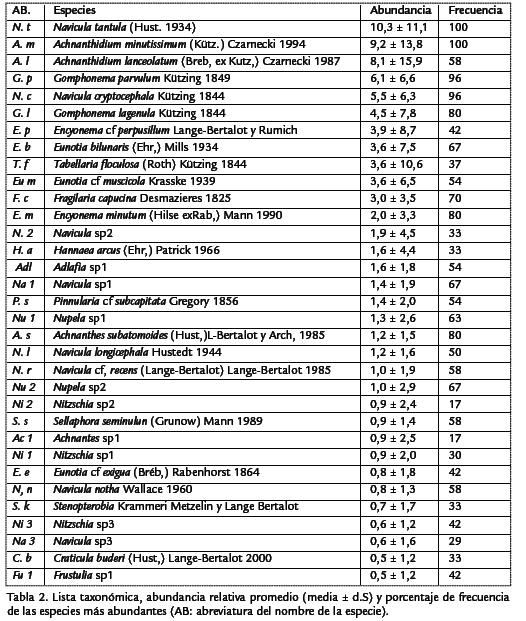
Se registraron un total de 157 especies distribuidas en 16 familias y 30 géneros. Losgéneros más diversos fueron Nitzschiay Eunotia(25 y 24 especies respectivamente), conuna mayor riqueza para Eunotiaen T1b (20 especies) y para Nitzschiaen T3b (18especies). Otros géneros con alto número de especies fueron Navicula(20 especies) yGomphonema(13 especies). La Tabla 2 registra los valores de frecuencia y abundanciarelativa de las especies con abundancia superior al 5% en al menos uno de los mues-treos. En el total de las muestras, solo seis especies presentaron abundancia superioral 5%, estas fueron Navicula tantula(Hust, 1934; 10,3%), Achnanthidium minutissimum(Kütz.) Czarnecki1994) (9.2%), Achnanthidium lanceolatum(Breb. ex Kutz.) Czarnecki 1987; 8,1%), Gomphonema parvulum (Kützing, 1849; 6,1%), Navicula cryptocephala (Kützing 1844; 5,5%), Gomphonema lagenula (Kützing 1844; 4,5%). Las especies dominantes en cada tramo fueron las mismas en los cuatro muestreos (Figura 3), por lo cual no se observaron diferencias estacionales importantes. Los nacimientos (T1a, T1b) y los ríos (T3a, T3b) de los dos sistemas no reportaron especies dominantes comunes, mientras que N. cryptocephala, G. parvulum y G. lagenula, fueron especies codominantes y comunes en las zonas medias de los dos sistemas (T2a, T2b).

ESTRUCTURA DEL ENSAMBLAJE
Los valores más altos de diversidad y riqueza, se registraron en las zonas medias; los tramos T2a y T2b fueron los más diversos con un promedio de riqueza de 54 especies y con los valores de dominancia más bajos (D=0,05 a 0,17); mientras que los ríos registraron los valores más bajos de riqueza (T3a=30 especies y T3b=35 especies). La diversidad no presentó diferencias significativas entre los nacimientos, y las zonas medias de los dos sistemas (p>>0,1), pero sí entre los ríos (p< 0,01). El ensamblaje no presentó cambios estacionales evidentes, como puede verse en el análisis de ordenación (DCA), el cual agrupó los cuatro muestreos para cada tramo (Figura 4a), justificando la similitud del ensamblaje de diatomeas durante los cuatro períodos muestreados. Los tramos del sistema B se distribuyeron separadamente en el espacio de ordenación a lo largo del eje 1, mientras que los tramos del sistema A se agruparon en el mismo cuadrante, presentando una menor distancia entre ellos (Figura 4a). Las zonas medias de los dos sistemas (T2a, T2b) revelaron mayor similitud, agrupándose cerca en el espacio de ordenación, mientras que los tramos de los nacimientos (T1a, T12b) y los ríos (T3a, T3b) fueron más distantes entre sí. La Figura 4b muestra la agrupación por especies y registra un grupo formado por los géneros Eunotia, Encyonema y Cymbella del tramo T1b, así como un grupo formado por los géneros Nitzschia y Navícula del río T3b, y un grupo central que evidencia la similitud por especies compartidas entre los tres tramos del sistema A, y entre las zonas medias de los dos sistemas.

INTERACCIÓN ESPECIE- AMBIENTE
La conductividad se relacionó positivamente con la abundancia de N. tantula,(Figura 5a)Sellaphora seminulun(Grunow; Mann 1989), Naviculaaff. recens(Lange-Bertalot 1985; Figura 5b), Naviculasp1. (r2=0,5, p<0,01), A. subatomoides(r2=0,5, p<0,01) y con ocho especiesdel género Nitzschiacomo Nitzschiasp2. (r2=0,7, p<0,01) y Nitzschiasp3. (r2=0,6, p<0,01),mientras que A. minutissimum, A. lanceolatum(Figura 5c), G. parvulumy G. lagenulapresen-taron un comportamiento inverso, registrando menor abundancia a valores altos de206 Artículo - Diatomeas perifíticas en diferentes tramos de dos sesta variable. El pH fue otro factor que se relacionó significativamente con la abundancia de varias especies, especialmente con especies del género Eunotia como E. bilunaris ((Ehr.) Mills, 1934), E. cf. muscicola (Krasske, 1939; Figura 5d) y E. cf. tenella ((Bréb.) Rabenhorst, 1864; r2=-0,72, p < 0,01); el mismo patrón se observó para Stenopterobia krammeri (Metzelin y Lange Bertalot; r2=-0,60, p<0,01) y Navicula sp2. (r2=-0,55, p < 0,05). En relación con el caudal, este presentó correlación significativa con la diversidad, la riqueza (r2=-0,5, p< 0,05) y la dominancia (r2= 0,5, p< 0,01), y en especial con la abundancia de T. floculosa (r2= 0,9, p<0,01), A. minuttisimun (r2=0,6, p<0,05) y G. parvulum (r2=-0,5, p< 0,05).

DISCUSIÓN
COMPORTAMIENTO FÍSICO, QUÍMICO E HIDROLÓGICO DE LOS DOS SISTEMAS ESTUDIADOS
Los dos sistemas difieren en cuanto a las variables ambientales evaluadas: para el sis-tema A, el caudal fue el factor determinante de la variación, mientras que para el sistema B lo fue la variación física y química. Los tramos T3a y T3b, fueron los principales responsables de las diferencias entre los dos sistemas, ya que los tramos T1a, T1b, T2a y T2b registraron un comportamiento similar (excepto por el pH). Esta diferencia en el comportamiento de los dos ríos se da por el tipo de impacto que recibe cada uno de los sistemas, ya que T3a recorre un área de explotación agrícola a pequeña escala con algunos asentamientos humanos, mientras que T3b recibe descargas domésticas de un caserío cercano, condición que se refleja en los valores altos de conductividad, potencial redox y nutrientes registrados en este tramo, principalmente en los períodos de sequía, como consecuencia de la concentración de iones y materiales dada la disminución del caudal en este período. Un comportamiento similar para la conductividad en relación con la estacionalidad en ríos de alta montaña tropical fue reportado por Martínez y Donato (2003) en el río Tota. El pH también fue una variable importante, registrando valores ácidos en T1b. Los valores ácidos en este tramo pueden asociarse con el alto contenido de materia orgánica procedente de la vegetación circundante, así como con las condiciones geológicas de la microcuenca. El nacimiento del sistema B presenta una alta cobertura vegetal, lo que genera un alto ingreso de material vegetal al agua, que en su proceso de mineralización contribuye al aumento de ácidos húmicos creando un ambiente ácido en este tramo. Por otro lado, este tramo presenta un suelo lodoso, que permitiría la disolución de iones en el agua alterando de manera significativa su composición química. Estos dos factores (vegetación y litología) ejercen una influencia importante en la composición química de los sistemas lóticos, ya que determinan los iones presentes, afectando significativamente en el pH del sistema (Allan, 1995).
DIVERSIDAD Y ESTRUCTURA DEL ENSAMBLAJE EN LOS DIFERENTES TRAMOS
Los valores de diversidad de Shannon-Wiener fueron similares a los rangos reportados para otros ríos andinos (Martínez y Donato, 2003; Díaz y Rivera, 2004; Zapata y Donato, 2005; Plata et al., comunicación personal), aunque el número de especies totales fue comparativamente alto, posiblemente como resultado del tipo de muestreo, y las diferencias de hábitat entre los tramos. En las zonas medias, la diversidad y la riqueza fue superior a la encontrada en los ríos; varios estudios reportan una relación inversa entre el caudal y la corriente con la diversidad, densidad y biomasa de diatomeas (Lamb y Lowe, 1987; Mosisch y Bunn, 1997; Ghosh y Gaur, 1998; Ryder et al., 2006) y se ha llegado a plantear que en regiones de caudal medio se presenta un mejor desarrollo del ensamblaje (Martínez y Donato, 2003; Díaz y Rivera, 2004). La similitud en la composición de especies para las zonas medias, es otro indicador de la importancia del caudal en la estructura del ensamblaje, ya que las tres especies codominantes: G. parvulum, G. lagenula y N. cryptocephala han reportado mayores abundancias en zonas de baja corriente, por su morfología y débil adherencia al substrato (Lamb y Lowe, 1987; Ghosh y Gaur, 1998). Esta semejanza así como los valores altos de diversidad y riqueza en estas zonas pueden ser un reflejo de la similitud en el hábitat y de la baja fluctuación de las variables físicas, químicas e hidrológicas. Sin embargo, otra posible explicación para este patrón podría estar relacionada con el efecto de la interacción biológica que se da con los herbívoros, debido a la eficiencia diferencial en el consumo de algas y a la importancia de la herbivoría en el mantenimiento de la diversidad y en el control sobre las poblaciones (McCauley y Briand, 1979; Cuker, 1983), principalmente en ambientes moderados con bajo flujo (Menge y Sutherland, 1987; Rosemond et al., 2000). Un reflejo de esto se observa en el registro de especies pequeñas en estas zonas, que por su tamaño presentan ventaja contra los consumidores, respaldando el planteamiento de que cuando la interacción biótica principal es la herviboría, las especies dominantes son competitivamente inferiores por su tamaño, pero menos vulnerables a ser consumidas (Cuker, 1983; Bronmark et al., 1992; Rosemond et al., 2000; Ulrich, 2000). Aunque la interacción con los herbívoros no se evaluó en este estudio, Castellanos y Serrato (comunicación personal) realizaron un estudio de la comunidad de macroinvertebrados en los mismos tramos y épocas de muestreo del sistema A y registraron la presencia de Hyalella sp., un género del orden Amphipoda cuyo principal alimento es el fitobentos (Poretti et al., 2003), este género fue particularmente abundante en el nacimiento y la zona media, lo cual respalda el planteamiento de que la herbivoría puede ser un factor importante en la estructuración del ensamblaje de diatomeas en estas zonas.
En el caso de los ríos, el caudal fue un factor importante para T3a, donde se registró un desarrollo de especies con adaptaciones a alta corriente como T. floculosa que desarrolla un mucílago formando cadenas de valvas, A. minutissimun que se adhiere fuertemente al substrato, así como especies de la familia Cymbellaceae características de zonas de alto flujo: E. minutum y Cymbella affinis (Kützing, 1844) y tres especies de la familia Fragilariacea: H. arcus ((Ehr.) Patrick, 1966), F. capucina (Desmazieres, 1825), Ulnaria ulna ((Nitzs.) Compère, 2001; Cox, 1996; Peterson, 1996; Stevenson, 1996; Potapova y Charles, 2002). Soininen (2004) plantea que la corriente es un factor importante en la estructuración de las diatomeas en ríos claros, donde se evidencia la necesidad de adaptaciones morfológicas para una mejor adherencia al substrato, mientras que en ríos turbios, debido a las partículas disueltas en el agua y a las condiciones ambientales, pueden desarrollarse especies sin adaptaciones a alta corriente. La composición de especies en los tramos de los ríos soporta este planteamiento: T3a es un sistema con baja turbidez, nutrientes y conductividad (Tabla 1), en el cual se registraron especies con adaptaciones a alta corriente, mientras que T3b corresponde a un sistema hipereutrófico, con valores altos de amonio, ortofosfatos, conductividad y potencial rédox (Tabla 1), en donde se registraron especies que han sido reportadas como tolerantes a la polución, entre ellas especies del género Nitzschia así como Navicula tantula, N. aff. recens, S. seminulun y A. subatomoides (Díaz et al., 2000; Sabater, 2000; Lange-Bertalot, 2000; Wetzel et al., 2002; Kelly, 2003; Potapova y Charles, 2003; Rimet et al., 2004; Leira y Sabater, 2005; Plata et al., comunicación personal). Lo anterior evidencia que para T3b la física y química del sistema fueron factores importantes en la estructuración del ensamblaje, mientras que para T3a, lo fue la hidrología, respaldando así el planteamiento de Soininen (2004). La baja diversidad encontrada en las nacientes podría asociarse con la limitación de luz que se presenta en las primeras zonas de los ríos debido a la alta cobertura vegetal. Los nacimientos paramunos se forman gracias a la combinación del nivel freático y la precipitación horizontal, que se genera por la intersección de la niebla en el bosque, alimentando de manera constante el influjo de agua. Ante esta situación, una alta cobertura vegetal aunque asegura una entrada constante de agua al sistema, limita la penetración de la luz al nacimiento, y limita el desarrollo de las especies fotosintéticas. En T1b el pH influyó en la composición de especies, permitiendo una alta diversidad del género Eunotia, registrándose un total de seis especies y 14 morfoespecies. Sólo en este punto E. bilunaris alcanzó abundancias superiores al 20% en todos los muestreos, mientras que la abundancia de E.muscicola fluctuó entre el 13-24%; en los demás tamos estas especies no superaron el 3% de la abundancia total registrada. De igual manera, la presencia de Frustulia, Neidium y la alta abundancia de Stenopterobia krammeri en este tramo, confirma la amplia tolerancia de estos géneros a la acidez (Kwandrans, 1983; Pan et al., 1996; Battarbee et al., 1997; Potapova y Charles, 2002; Wetzel et al., 2002; Hirst 2004; Rimet et al., 2004).
VARIACIÓN ESTACIONAL DEL ENSAMBLAJE DE DIATOMEAS
Aunque para el perifiton se ha reportado una alta incidencia de la estacionalidad en la biomasa y productividad (Mosisch y Bunn, 1997; O'Reilly, 2006), para las diatomeas se ha registrado que la variación espacial en la composición de especies es mayor que la variación estacional, aún si se presentan cambios estacionales en ciertos factores ambientales (Lamb y Lowe, 1987; Stevenson y Hashim, 1989; Sherwood et al., 2000). Sin embargo algunos trabajos reportan que los períodos hidrológicos y los cambios estacionales juegan un papel importante en la estructuración de la comunidad algal, determinando cambios en la abundancia relativa de las especies (Hameed, 2003; Martínez y Donato, 2003; Zapata y Donato, 2005; Gottlieb, 2006). En este estudio, aunque algunas variables ambientales registraron variación estacional, los cambios en la estructura general del ensamblaje entre períodos no fueron significativos. Lavoie et al. (2005) plantearon que la principal fuente de variación en la composición de las diatomeas está asociada con diferencias en las condiciones químicas y físicas del hábitat acuático, presentándose mayor variación entre ríos diferentes, seguida de variación entre zonas del mismo río y poca variación en un mismo tramo como consecuencia de características ambientales similares. Nuestros resultados respaldan este esquema de variación, revelando más variación espacial entre tramos y entre los dos sistemas, que variación estacional en un mismo tramo. En síntesis, las variables ambientales que determinaron de manera significativa el ensamblaje de diatomeas perifíticas en el páramo de Santurbán fueron, en su orden, la conductividad, el pH y el caudal, influyendo de manera particular en cada uno de los tramos. Cuando las variables físicas y químicas alcanzaron valores altos, éste fue el factor determinante en la abundancia y composición de especies, pero en ausencia de condiciones físicas y químicas extremas, el caudal fue el factor más influyente en las especies encontradas. Los periodos hidrológicos aunque influyeron en la variación estacional del caudal, no jugaron un papel importante en la estructuración del ensamblaje de diatomeas, ya que no se registró una variación estacional significativa en la abundancia y composición de especies. Nuestros resultados respaldan nuevamente el potencial de algunas especies de diatomeas como indicadores biológicos de condiciones como pH y polución orgánica, evidenciando una vez más la importancia de incluir las diatomeas perifíticas en estudios de monitoreo ambiental. Por último, cabe proponer para estudios posteriores la inclusión de las interacciones biológicas, con el fin de proporcionar una visión más completa de los factores influyentes en la estructura del ensamblaje de diatomeas perifíticas.
AGRADECIMIENTOS
Los autores agradecen a la Dra. Rosa Aura Gavilán (Laboratorio de Limnología. Universidad Industrial de Santander) por la asesoría durante todo el proyecto y por la financiación del mismo; a la Dra. Sully Gómez y al Grupo en Predicción y Modelamiento Hidroclimático (GPH-UIS), por la colaboración durante las salidas de campo y al Laboratorio de Patología-UIS y Laboratorio de Biología Reproductiva -UIS por el apoyo logístico durante la fase de laboratorio de esta investigación.
BIBLIOGRAFÍA
ALLAN D. Stream ecology. Structure and Function of Running Waters. Londres: Chapman & Hall; 1995. [ Links ]
APHA. Standard Methods for Examination of Water and Wastewater. 19 Ed. Washington: Amer Pub Health Ass; 1998. [ Links ]
BARBOUR MT, GERRITSEN J, ZINDER BD, STRIBLING JB. Rapid bioassessment protocols for use in streams and wadeable rivers: periphyton, benthic macroinvertebrates and fish. 2 ed. Washington: Environmental Protection Agency Office of Water; 1999. [ Links ]
BATTARBEE RW, FLOWER RJ, JUGGINS S, PATRICK ST, STEVENSON AC. The relationship between diatoms and surface water quality in the Høylandet area of Nord-Trøndelag, Norway. Hydrobiologia. 1997;348(1):69-80. [ Links ]
BATE N, NEWALL P. Techniques for the use of diatoms in water quality assessment: how many valves? Diatom symposium. 1998;153-158. [ Links ]
BRONMARK C, KLOSIEWSKI S, STEIN R. Indirect effects of predation in a freshwater benthic food chain. Ecology. 1992;73(5):1662-1674. [ Links ]
CEN/TC 230. Water quality-Guidance standard for the routine sampling and pre-treatment of benthic diatoms from rivers. European Standard. CEN/TC 230 prEN 13946: Committee on European Normalization; 2002. [ Links ]
CORPONOR. Estudios de caracterización y zonificación ambiental de la Unidad Biogeográfica de Santurbán. Cúcuta: CORPONOR; 2002. [ Links ]
COX E. Identification of Freshwater Diatoms from Live Material. Londres: Chapman & Hall; 1996. [ Links ]
CUKER B. Grazing and nutrient interactions in controlling the activity and composition of the epilithic algal community of an arctic lake. Limnol. Oceanogr. 1983;28(1):133-141. [ Links ]
DÍAZ-Q C, RIVERA-R C. Diatomeas de pequeños ríos andinos y su utilización como indicadoras de condiciones ambientales. Caldasia. 2004;26(1):381-394 [ Links ]
DÍAZ V, QUEIMALIÑOS C, MODENUTT B, AYALA V. Effects of fish farm effluents on the periphyton of an Andean stream. Arch Fish Mar Res. 2000;48(3):283-294. [ Links ]
DENICOLA D. Periphyton responses to Temperature at Different Ecological Levels. En: Stevenson RJ, Bothwell ML, Lowe RL, editors. Algal ecology: freshwater benthic ecosystems. San Diego: Academic Press; 1996. p.150-181. [ Links ]
FRANCOEUR S, BIGGS B. Short-term effects of elevated velocity and sediment abrasion on benthic algal communities. Hydrobiologia. 2006;561(1):59-69 [ Links ]
GHOSH M, GAUR J. Current velocity and the establishment of stream algal periphyton communities. Aquat Bot. 1998;60(1):1-10. [ Links ]
GOTTLIEB A,. RICHARDS J, GAISER E. Comparative study of periphyton community structure in long and short-hydroperiod Everglades marshes. Hydrobiologia. 2006;569(1):195-207. [ Links ]
HAMEED HA. The colonization of periphytic diatom species on artificial substrates in the Ashar canal, Basrah, Iraq. Limnologica. 2003;33(1):54-61. [ Links ]
HILL W. Factores affecting benthic algae: Effets of light. En: Stevenson RJ, Bothwell ML, Lowe RL, editors. Algal ecology: freshwater benthic ecosystems. San Diego: Academic Press; 1996. p.121-148. [ Links ]
HIRST H, CHAUD F, DELABIE C, JUTTNER I, ORMEROD SJ. Assessing the short-term response of stream diatoms to acidity using inter-basin transplantations and chemical diffusing substrates. Freshwater Biol. 2004; 49:(8)1072-1088. [ Links ]
IDEAM. Datos históricos de precipitación. Estación La Caldera. IDEAM; 2005 [ Links ]
IDEAM Datos diarios de precipitación 2005-2006. Estación la Caldera. IDEAM; 2006 [ Links ]
KELLY M. Short term dynamics of diatoms in an upland stream and implications for monitoring eutrophication. Environ Pollut. 2003;125(2):117-122. [ Links ]
KRAMMER K. Valve morphology in the genus Cymbella. En: Helmcke JG, Krammer K, editors. Micromorphology of diatom valves. vol. 11. Cramer Vaduz; 1982. p. 11-299. [ Links ]
KRAMMER, K. Die Gattung Pinnularia in Bayern. Hoppea. 1992;52(1):5-291 [ Links ]
KRAMMER K, LANGE-BERTALOT H. Bacillariophyceae.1Teil: Naviculaceae. Jena: VEB Gustav Fisher; 1986. [ Links ]
KRAMMER K, LANGE-BERTALOT H. Bacillariophyceae. 3 Teil: Centrales, Fragilariaceae, Eunotiaceae, Achnanthaceae. Jena:VEB Gustav Fisher;1991a. [ Links ]
KRAMMER K, LANGE-BERTALOT H. Bacillariophyceae. 4 Teil: Achnanthaceae, Kritische Erganzungen zu Navicula (Lineolatae) und Gomphonema. Jena:VEB Gustav Fisher; 1991b. [ Links ]
KWANDRANS J. Diatom communities of acidic mountain streams in Poland. Hydrobiologia. 1993;269(1):335-342. [ Links ]
LAMB MA, LOWE RL. Effects of current velocity on. the physical structuring of diatom Bacillariophyceae communities. Ohio J Sci. 1987;87(3):72-78. [ Links ]
LANGE-BERTALOT H. Diatoms of Europe. Diatoms of the European Inland Waters and Comparable Habitats. Alemania: Gantner K.G.; 2001. [ Links ]
LAVOIE I, SOMERS KM, PATERSON AM, DILLON PJ. Assessing scales of variability in benthic diatom community structure. J Appl Phycol. 2005;17(6):509-513. [ Links ]
LEIRA M, SABATER, S. Diatom assemblages distribution in Catalan Rivers, NE Spain, in relation to chemical and physiographical factors. Water Res. 2000;39(1):73-82. [ Links ]
MARTÍNEZ L, DONATO JC. Efectos del caudal sobre la colonización de algas en un río de alta montaña tropical (Boyacá, Colombia). Caldasia. 2003;25(1):337-354. [ Links ]
McCAULEY E, BRIAND F. Zooplankton grazing and phytoplankton species richness: Field tests of the predation hipótesis. Limnol Oceanogr. 1979;24(2):243-252. [ Links ]
MENGE BA, SUTHERLAND PJ. Community Regulation: Variation in Disturbance, Competition, and Predation in Relation to Environmental Stress and Recruitment. Am Nat. 1987;130(5):730-757. [ Links ]
METZELIN D, LANGE-BERTALOT H. Tropical Diatoms of South America I. Alemania: Koeltz S.B.; 1998. [ Links ]
MOSISCH TD, BUNN SE. Temporal patterns of rainforest stream epilithic algae in relation to flow-related disturbance. Aquatic Bot.1997;58(2):181-193 [ Links ]
O'REILLY CM. Seasonal dynamics of periphyton in a large tropical lake. Hydrobiologia. 2006;553(1):293-301. [ Links ]
PAN Y, STEVENSON RJ, HILL BH, HERLIHY AT, COLLINS GB. Using diatoms as indicators of ecological conditions in lotic systems a regional assessment. J N Am Benthol Soc. 1996;(4)15:481-495. [ Links ]
PAN Y, STEVENSON RJ, HILL BH, KAUFMANN PR, HERLIHY AT. Spatial patterns and ecological determinants of benthic algal assemblages in Mid-Atlantic streams, USA. J Phycol. 1999;35(3):460-468 [ Links ]
PAYNE AI. The ecology of tropical lakes and rivers. Londres: John Wiley & Sons; 1986. [ Links ]
PETERSON CG. Response of benthic algal communities to natural physical disturbance. En: Stevenson RJ, Bothwell ML, Lowe RL, editors. Algal ecology: freshwater benthic ecosystems. San Diego: Academic Press; 1996. p. 375-403. [ Links ]
PORETTI TI., CASSET MA, MOMO F. Composición química y dinámica poblacional de Hyalella curvispina en el arroyo las flores (Cuenca del río Luján). Biol acuát. 2003;20(1):45-48 [ Links ]
POTAPOVA MG, CHARLES DF. Benthic diatoms in USA rivers: distributions along spatial and environmental gradients. J Biogeogr. 2002;29(1):167-187. [ Links ]
POTAPOVA MG, CHARLES DF. Distribution of benthic diatoms in US rivers in relation to conductivity and ionic composition. Freshwater Biol. 2003;48(8):1311-1328. [ Links ]
RANGEL-CH JO. Localidades paramunas y altoandinas de Colombia, En: Rangel-Ch. JO, editors. Colombia Diversidad Biótica III. La región de vida paramuna. Bogotá: Instituto de Ciencias Naturales-Instituto Alexander von Humboldt; 1995. p. 837-866. [ Links ]
REAVIE E, SMOL J. Epilithic diatoms of the St. Lawrence River and their relationships to water quality. Can J Bot. 1998;76(2):251-257. [ Links ]
RIMET F, ECTOR L, CAUCHIE HM, HOFFMANN L. Regional distribution of diatom assemblages in the headwater streams of Luxembourg. Hydrobiologia. 2004;520(1-3):105-117. [ Links ]
RIVERA-R C, DÍAZ-Q C. Grandes Taxones del fitobentos y su relación con la hidrología, física y química de pequeños ríos andinos. Universitas Scientiarum. 2004; 9(1):75-86. [ Links ]
ROSEMOND AD, MULHOLLAND PJ, BRAWLEY SH. Seasonally shifting limitation of stream periphyton: Response of algal populations and assemblage biomass and productivity to variation in light, nutrients, and herbivores. Can J Fish Aquat Sci. 2000;57(1):66-75. [ Links ]
ROTT E, DUTHIE HC, PIPP E. Monitoring organic pollution and eutrophication in the Grand River, Ontario, by means of diatoms. Can J Fish Aquat Sci. 1998;55(6):1443-1453. [ Links ]
ROUND F, CRAWFORD RM, MANN DG. The diatoms. Biology & morphology of the genera. Cambridge: Cambridge University Press; 1990. [ Links ]
RUMRICH U, LANGE-BERTALOT H, RUMRICH M. Diatomeen der Anden von Venezuela bis Patagonien/Feuerland Und zwei weitere Beiträge. Alemania: Gantner Verlag K.G; 2000. [ Links ]
RYDER D, WATTS R, NYE E, BURNS A. Can flow velocity regulate epixilic biofilm structure in a regulated floodplane river? Marine and Freshwater Research. 2006;57(1):29-36. [ Links ]
SALA S, RAMÍREZ JJ, PLATA Y. Diatoms from lentic and lotic systems in Antioquia, Chocó and Santander Departments in Colombia. Rev Biol Trop. En prensa 2008. [ Links ]
SABATER S. Diatom communities as indicators of environmental stress in the Guadiamar River, SW Spain, following a major mine tailing spill. J Appl Phycol. 2000;12(2):113-124. [ Links ]
SHERWOOD AR, RINTOUL TL, MÜLLER KM, SHEATH RG. Seasonality and distribution of epilithic diatoms, macroalgae and macrophytes in a spring-fed stream system in Ontario, Canada. Hydrobiologia 2000;435(1-3):143-152. [ Links ]
SOININEN J. Assessing the current related heterogeneity and diversity patterns of benthic diatom communities in a turbid and a clear water river. Aquatic Ecology. 2004;38(4):495-501. [ Links ]
STEVENSON RJ, HASHIM S. Variation in diatom community structure among habitats in Sandy Streams. J Phycol. 1989; 25(4):678-686. [ Links ]
STEVENSON RJ. An introduction to algal ecology in freshwater benthic habitats. En: Stevenson RJ, Bothwell ML, Lowe RL, editors. Algal ecology: freshwater benthic ecosystems. San Diego: Academic Press; 1996. p. 3-30. [ Links ]
STURM H, MORA-OSEJO L. Clima de la Región Paramuna. En: Rangel JO, editors. Estudios Ecológicos del páramo y del Bosque Altoandino. Tomo I. Santa fe de Bogotá: Academia Colombiana de Ciencias Exactas y Naturales; 1995. p. 375-403. [ Links ]
TOWNSEND SA, GELL PA. The role of substrate type on benthic diatom assemblages in the Daly and Roper Rivers of the Australian wet/dry tropics. Hydrobiologia. 2005;548(1):101-115 [ Links ]
TUJI A. The effect of irradiance on the growth of different forms of freshwater diatoms: implications for sucesión in attached diatom communities. J Phycol. 2000;36(4):659-661. [ Links ]
ULRICH S. Benthic microalgal diversity enhanced by spatial heterogeneity of grazing. Oecologia. 2000;122(2):284-287. [ Links ]
VANNOTE R, MINSHALL GW, CUMMINS KW,. SEDELL JR, CUSHING CE. The river continuum concept. Can J Fish Aquat Sci. 1980;37:130-137. [ Links ]
WETZEL R. Limnology. Lake and river ecosystems. 3 ed. San Diego: Academic Press; 2001. [ Links ]
WETZEL CE, LOBO EA, OLIVEIRA MA, BES D, HERMANYG. Diatomáceas Epilíticas Elacionadas a fatores ambientais em diferentes trechos dos Rios Pardo e Pardinho, Bacia Hidrográfica Do Río Pardo, Rs, Brasil: Resultados Preliminares. Cad pesqu, Sér biol. 2002;14(1):17-38. [ Links ]
ZAPATA AM, DONATO JC. Cambios diarios de las algas perifíticas y su relación con la velocidad de corriente en un río tropical de montaña (río Tota -Colombia) Limnetica. 2005;24(1-2):327-338. [ Links ]














