Introducción
La leucemia linfoblástica aguda (LLA) es la neoplasia más frecuente en niños y adultos jóvenes; se caracteriza por la proliferación descontrolada de un progenitor linfoide (células precursoras B o T) que desplaza la hematopoyesis normal sustituyéndola por una hematopoyesis clonal maligna que provoca anemia, trombocitopenia, con un potencial infiltrativo a diferentes aparatos y sistemas como piel y sistema nervioso central1. Su origen es multifactorial e implica tanto a genes reguladores de la linfopoyesis (Ikaros (IKZF1), PAX5, EGF, RUNX1, DUX4-), alteraciones citogenéticas específicas (trisomía 21) y diferentes mutaciones derivadas de una catástrofe cromosómica como el cromosoma Philadelphia (LAL-Ph+)2,3. Estas anormalidades han permitido identificar poblaciones de riesgo, las cuales se asocian a un fracaso ante el tratamiento estándar con quimioterapia; las anormalidades citogenéticas también se relacionan con la edad; por ejemplo, las alteraciones asociadas al cromosoma 11 (KMT2A) son más frecuentes en menores de un año, mientras que el cromosoma Philadelphia está presente en un tercio de los adultos y en más de la mitad de los adultos mayores de 60 años4,5.
La aparición de los síntomas es súbita (2-3 semanas), y provoca un síndrome anémico, hemorrágico, febril e infiltrativo (hepato-esplenomegalia, linfadenopatías y ensanchamiento mediastinal) y un riesgo de desarrollar lisis tumoral, en especial en los casos con leucocitosis al diagnóstico. Otras manifestaciones incluyen alteraciones neurológicas asociadas a la invasión al sistema nervioso central, infiltración cutánea o infiltración hepática. Al combinar la edad al diagnóstico, el conteo de leucocitos, las anormalidades citogenéticas y moleculares clasifican a la enfermedad en riesgos de recaída (estándar, alto y muy alto) por lo que obligan a modificar la intensidad del tratamiento acorde al tipo de riesgo6-10.
El tratamiento requiere la combinación de diferentes esquemas, basados en su mayoría en quimioterapia (antraciclinas, alcaloides de la vinca, alquilantes, antimetabolitos), divididos en una etapa de inducción a la remisión, consolidación y mantenimiento; estos se pueden combinar con anticuerpos monoclonales (anti-CD20; Rituximab), inhibidores de tirosina kinasa en contra de BCR-ABL111,12o más recientemente esquemas basados en anticuerpos bi-específicos como Blinatumomab13.
A pesar de lograr una alta tasa de remisiones compuestas, el 70 % de los adultos se considera de riesgo desfavorable debido a la combinación de diferentes tipos de anormalidades citogenéticas y moleculares14. Fielding y colaboradores reportaron en 2007 la experiencia de un estudio prospectivo en pacientes con recaída a médula ósea del protocolo MRCUKALL12/ECOG 2993. La supervivencia global posterior a la recaída fue 7 % a 5 años (95 % IC = 4 -9 %); la edad al momento de la recaída, al igual que la curación de la primera remisión completa, fueron los principales factores para una buena respuesta para el tratamiento de rescate15. Semejante a esto, Oriol y colaboradores del grupo PETHEMA, en su ensayo prospectivo, longitudinal evaluaron la supervivencia de 263 adultos posterior a la primera recaída medular. La supervivencia global registrada posterior a la recaída fue de 4,5 meses (95 % IC, 4-5 meses) con una supervivencia global a 5 años de 10 % (95 %IC, 8-12 %)16. Ambos estudios coinciden en que los principales factores de buen pronóstico posterior a la recaída fueron la edad menor de 30 años y una mayor duración de la primera remisión completa17.
Entre los aspectos que se deben considerar durante una recaída son el tiempo de duración de la primera remisión completa, la presencia de anormalidades moleculares al diagnóstico, al igual que si la recaída se presenta de manera aislada o combinada18 (ver Figura 1). Dependiendo de la duración de la primera remisión (1RC), se pueden utilizar fármacos que formaron parte del tratamiento de inducción (57 % de respuestas en pacientes con RC > 18 meses), mientras que en los casos menores a 6 meses se deben de considera otros tipos de tratamiento (14 % de 2RC)19.

Fuente: autores
Figura 1 Factores de riesgo asociados a falta de respuesta al tratamiento o recaída. EMR: enfermedad mínima residual. Para el desarrollo de una recaída se combinan diversos factores como los dependientes de los pacientes (edqd, adherencia al tratamiento y polimorfismos), los asociados a fármacos que se metabolizan a nivel intracelular (citarabina, vincristina y metrotexato), los que se relacionan directamente con el tratamiento (toxicidades generales y específicas, interacciones farmacológicas) y los que se asocian directamente con la leucemia (mutaciones de mal pronóstico al diagnóstico BCR-ABL-1 y KMT2A, mutaciones acompañantes y adquiridas como la de p53). Todos estos factores son evaluados con la enfermedad medible, considerada como la principal herramienta pronóstica para una recaída en leucemia linfoblástica.
Se consideró relevante realizar este estudio, ya que existe disparidad en cuanto al manejo de pacientes con LLA en recaída alrededor del mundo, por lo que los resultados pueden ser de gran utilidad en la práctica médica. El objetivo de este estudio fue sintetizar la evidencia publicada en la última década en relación con el tratamiento de la recaída en pacientes con LLA alrededor del mundo.
Metodología
Estrategia de búsqueda para identificación de estudios
El 18 de julio de 2022 se realizó una búsqueda sistemática de la literatura de estudios retrospectivos y prospectivos, usando base de datos de PubMed, EMBASE y Cochrane entre junio 2012 y junio 2022. Se decidió investigar sobre los avances en el tratamiento de la LLA en la última década. Se utilizaron los siguientes términos de búsqueda: (chemotherapy AND acute lymphoblastic leukemia;relapse AND acute lymphoblastic leukemia; immunotherapy AND acute lymphoblastic leukemia; fludarabine AND acute lymphoblastic leukemia; citarabine AND acute lymphoblastic leukemia; mitoxantrone AND acute lymphoblastic leukemia). Se analizaron 60 ensayos clínicos aleatorizados en los que se incluyeron pacientes en recaída que describieran el tipo de quimioterapia y/o inmunoterapia utilizada. Además, se decidió incluir 2 artículos de serie de casos que describían la sinergia de nuevas opciones terapéuticas en pacientes con leucemia linfoblástica aguda que estuvieran en etapa de recaída. La búsqueda de la literatura fue realizada independientemente por dos autores; las discrepancias entre ambos se resolvieron por consenso.
Criterios de elegibilidad
Se decidió incluir en esta revisión estudios que cumplieran con los siguientes criterios: (1) diseño de ensayos clínicos aleatorizados o serie de casos; (2) pacientes en recaída con diagnóstico de leucemia linfoblástica aguda; (3) utilización de algún tipo de quimioterapia, inmunoterapia o combinación; (4) estudios realizados en poblaciones adultas y pediátricas; (5) seguimiento posterior al tratamiento de recaída mínimo de 3 meses; (6) el tratamiento se llevó a cabo durante hospitalización y/o de manera ambulatoria; (7) estudios en español o inglés.
Los criterios de exclusión fueron: (1) artículos en los que se incluyeran pacientes con algún otro tipo de leucemia aguda o enfermedad crónico-degenerativa; (2) estudios que incluyeran pacientes pertenecientes a poblaciones con discapacidad o vulnerables; (3) estudios que no contaran con la dosis de quimioterapia y/o inmunoterapia correctamente especificada; (4) estudios que incluyeran pacientes que hayan recibido combinaciones de anticuerpos monoclonales bi-específicos. Todos los resúmenes y textos completos fueron analizados para su elegibilidad por dos de los autores de este estudio (ver Figura 2).
Desarrollo de tema
Los fármacos utilizados para el tratamiento de una recaída pueden clasificarse en fármacos que no son incluidos en la etapa de inducción, como los análogos de purina (fludarabina, clofarabina, nelarabina), dosis superiores de quimioterapia (por ejemplo, el HyperCVAD aumentado), o fármacos utilizados en ensayos clínicos.
Esquemas basados en análogos de purina
Los esquemas de quimioterapia pueden considerarse en aquellos que incluyen fludarabina, clofarabina y nelarabina. El esquema considerado con mayor frecuencia es el esquema FLAG (fludarabina, citarabina, factor de crecimiento derivado de granulocitos); este se utiliza tanto en leucemia mieloide como en linfoide, de manera única o combinado con Idarrubicina (IDA-FLAG).
En las primeras series de pacientes tratados únicamente con FLAG, la proporción de remisiones completas fue del 67 % (8/12 casos), con una media de duración de 22,5 semanas, a la par, in vitro, se demostró que la incorporación intracelular de citarabina fue mucho mayor al asociarse con fludarabina, en especial en las variantes mieloides20. Esta sensibilidad permitió la combinación con otros fármacos como la mitoxantrona, o modificaciones del esquema original como el esquema FLANG (citarabina 1 gr/m2 x 3 días, mitoxantrona 10 mg/m2 X 3 días al final de la administración de citarabina)21. Se resumen los principales resultados de algunos estudios que han incorporado novedosas estrategias intensivas de quimioterapia (ver Tabla 1).
Dentro de los objetivos principales de estos esquemas se busca restituir la hematopoyesis (normalización del conteo de plaquetas, neutrófilos y eritrocitos), integrar una segunda remisión completa (<5 % de blastos) y alcanzar una enfermedad residual medible negativa, con el objetivo de acceder a un trasplante de progenitores hematopoyéticos alogénico (de donador relacionado o no relacionado) o de tipo haploidéntico, con la finalidad de alcanzar la curación.
Uno de los estudios que se encargó de evaluar esta combinación (esquema de rescate seguido de un trasplante de progenitores hematopoyéticos) fue el de Clavio et al, en donde un total de 65 % de los casos de LLA integraron una RC, con una supervivencia a 5 años del 28 % para aquellos que completaron la estrategia completa (FLAD+TCPH)29. Otro análogo de la deoxiadenosina (2-chlorodeoxyadenosine [2-CdA]) es la cladribina; su mecanismo se basa en la acumulación de fosfato de cladribina intracelularmente interfiriendo con la síntesis y reparación del DNA. Al momento, la principal indicación es para el tratamiento de la leucemia de células peludas34, pero aún se encuentra en estudio su potencial combinación con citarabina y factor estimulante de colonias de granulocitos (CLAG) para el tratamiento de la LLA-refractaria35.
La clofarabina es un análogo deoxiadenosina de siguiente generación, desarrollado a partir de la fludarabina y la cladribina; su mecanismo principal se basa en la inhibición de la síntesis de DNA y del ribonucleótido reductasa causando apoptosis36. En 2004, se aprobó su uso para el tratamiento de neoplasias hematológicas (LLA-pediátrica en recaída)37. Acorde a los estudios fase I (4-55 mg/m2/día 1-5) y fase II (40 mg/m2/día 1-5) en adultos, la proporción de RC fue de un 15 y 17 %, respectivamente38. Recientemente, Choi y colaboradores reportaron los resultados de 60 pacientes (rango de edad de 2-26 años) con al menos 2 regímenes previos, y que recibieron como mínimo un ciclo de clofarabina; un 45 % integró RC estricta o sin recuperación de plaquetas, alcanzando una media de duración de la remisión de 16,6 semanas (2 a 167,6 semanas) y semejante a los esquemas de fludarabina, considerado como una estrategia puente para un TCPH30.
A diferencia de la población pediátrica, la dosis de Clofarabina es menor (52 mg/m2 vs. 40 mg/m2)39; a esta dosis, el grupo PETHEMA evaluó 31 pacientes adultos con LLA y linfoma como esquema de rescate, alcanzando 31 % de RC con una media de duración de 3 meses. Se recalca que esta puede ser una opción en pacientes sin tantos esquemas previos31. Huguet y colaboradores evaluaron la combinación de clofarabina con otros fármacos (asparaginasa, ciclofosfamida, mitoxantrona, etopósido, dexametasona; estudio ENDEVOL o VANDEVOL), alcanzando remisiones en 50 % de los 55 casos en recaída o refractarios, complementando con un trasplante a casi un tercio de los casos40.
Esta potencial combinación con quimioterapia permitió considerar la adición de clofarabina a un esquema de inspiración pediátrica como parte de la primera línea de tratamiento. Sobre este concepto, Rijneveld y colaboradores evaluaron la combinación en el ensayo HOVON-100, en donde, a pesar de alcanzar una mayor proporción de enfermedad mínima residual (EMR) negativa, la adición de clofarabina no impactó en la proporción de RC, al igual que en la supervivencia global, pero sí aumentó los eventos adversos41, sugiriendo que este tipo de combinaciones puede reservarse para esquemas de segunda o tercera línea de tratamiento.
Tabla 1 Resumen de estudios que utilizaron nuevos esquemas de segunda línea para el tratamiento de LAL
| Referencia | País | Tipo de tratamiento | Población (M/F) Edad (rango) | Esquema de tratamiento | % RC | Supervivencia (meses) | Consideraciones especiales |
|---|---|---|---|---|---|---|---|
| Visani, Giuseppe, et al.20 (1996) | Italia | FLAG | n=12 5/8 25-57 años | Fludarabina 30 mg/m2 días 1-5 4 horas después, Citarabina 2 gr/m2 días 1-5 Con G-CSF | 8/12 (67%) | 22,5 | Neutropenia, recuperación en el día 16,3 Trombocitopenia |
| Specchia, G, et al.22 (2005) | Italia | IDA-FLAG | n=23 14/9 32 años (21-66) | Fludarabina 30 mg/m2 días 1-5 Citarabina 2 gr/m2 días 1-5 Idarrubicina 10 mg/m2 días 1-3 Con GCS-F | 9/23 (39,1%) | 4,5 (1-38) | Infección Grado I/II (56,5%), Grado III-IV (21,7%) |
| Montillo, Marco, et al.23 (1997) | Italia | FLAG-GCSF | n=12 8/4 44 años (15-69) | Fludarabina 30 mg/m2 días 2-6 Citarabina 2 gr/m2 días 1-6 Con GCS-F | 10/12 | 26,8 (2-120) | Neutropenia febril 10/12 |
| Yavuz, Sinan, et al. 24 (2006) | Turquía | IDA-FLAG | LLA=22 12/10 25 años (15-48) | Fludarabina 25 mg/m2 días 1-5 Citarabina 2 gr/m2 días 1-5 Idarrubicina 12 mg/m2 días 1-3 Con GCS-F | 8/22 (42,2%) | 16 semanas (2-100 semanas) | Toxicidad hematológica en todos los casos, tiempo de recuperación de leucocitos entre 13-27 días |
| Bengoa, Çebnem Yilmaz, et al.25 (2017) | Turquía | FLAG con o sin IDA | LLA=10 LMA=8 15/3 (9-17 años) | Fludarabina 30 mg/m2 días 1-4 Citarabina 2 gr/m2 días 1-4 Idarrubicina 12 mg/m2 días 2-4 Con GCS-F | 7/18 (38,8%) | Pacientes no trasplantados 2,7 meses (0-5 meses) | RC con IDA 28,6% y 50% sin IDA |
| Alwan, Alaa Fadhil, et al.26 (2014) | India | FLAG | LLA=9 6/3 26 años (18-48) | Fludarabina 25 mg/m2 días 1-5 Citarabina 2 gr/m2 días 1-5 Con GCS-F 300 mcg/día SC | 33,3% | 19 semanas (4-36 semanas) | Toxicidad grado IV en 100%, con neutropenia febril en 100%, tiempo promedio de recuperación de 16 días (12-26d) |
| Hassan, Inaam Bashir, et al.27 (2018) | Emiratos Árabes Unidos | FLAG-mitoxantrona | LLA=22 LAM=24 28/19 30.4 años | Fludarabina 30 mg/m2 días 1-5 Citarabina 1 gr/m2 días 1-5 Mitoxantrona 10 mg/m2 días 13, 5 Con GCS-F | 64,4% | 13,1 | Neutropenia febril 35/45 25,5 días para recuperación hematológica |
| Demichelis-Gómez, Roberta, et al.28 (2015) | México | Fludarabina IV vs vía oral | n=44 25/19 26,6 años | Fludarabina 30 mg/m2 IV o 40 mg/m2 VO día 1-5 Citarabina 2 gr/m2 día 1-5 Con GCS-F | 31,8% | 3,17 | Neutropenia febril (88,6%) |
| Clavio, Marino, et al.29 (2004) | Italia | FLAD | n=62 34/28 60 años (13-76) | Fludarabina 30 mg/m2 Citarabina 2 gr/m2 Daunorrubicina liposomal 80 mg/m2 Día 1-3 | 62% | 8 | Mielosupresión Sepsis |
| Choi, Jung Yoon, et al.30 (2021) | Corea | Clofarabina en monoterapia vs terapia combinada | n=60 37/23 12 años (2-26) | Clofarabina 52 mg/m2 día 1-5 | 45% | 6 | Neutropenia febril |
| Barba, Pere, et al.31 (2012) | España | Clofarabina | n=33 16/17 33 años | Clofarabina 52 mg/m2 día 1-5 | 32% | 12 | Reacción adversa infecciosa y hematológica grado 3-5 (100%) |
| Liedtke, Michaela, et al.32 (2014) | Estados Unidos | MEC | n=40 25/15 35,5 años (18-68) | Mitoxantrona 8 mg/m2 Etopósido 100 mg/m2 Citarabina 1 gr/m2 días 1-5 | 30% | 11,2 | Mielosupresión |
| Faderl, Stefan, et al.33 (2011) | Estados Unidos | Hyper-CVAD Aumentado | n=90 34 años (14-70) | Ciclofosfamida 300 mg/m2 cada 12 horas día 1-3 Mercaptoetanosulfonato (MESNA) 600 mg/m2 día 1-3 Doxorrubicina 50 mg/m2 día 4 Vincristina 2 mg días 1, 8 y 15 Dexametasona 80 mg días 1-4 y 15-18 L-asparaginasa 20,000 UI 1, 8 y 15 Metotrexato 1 gr/m2 día 1 Citarabina 3 gr/m2 cada 12 horas día 2-3 | 47% | 6,3 | Mielosupresión Reacción anafiláctica (4%) |
M: masculino; F: femenino; RC: remisión completa; FLAG: fludarabina, citarabina y filgrastim; FLAG IDA: FLAG más Idarrubicina; G-CFS: factor estimulador de colonia de granulocitos (Filgrastim) FLAD: fludarabina, citarabina y daunorrubicina liposomal; MEC: mitoxantrona, etopósido y citarabina; Hyper CVAD: ciclofosfamida, vincristina, corticosteroide y doxorrubicina.
Fuente: autores
La nelarabina es una prodroga del arabinofuranosiguanina (ara-G) que metaboliza en las células en el metabolito citotóxico ara-G trifosfato (ara-GTP), compitiendo para su incorporación al DNA con el deoxiguanosin trifosfato, inhibiendo la síntesis de DNA, causando fragmentación del material genético y la muerte celular42. Su principal indicación es en el tratamiento de la leucemia o linfoma T, como estrategia de rescate previo al trasplante de progenitores hematopoyéticos. Candoni y colaboradores evaluaron los resultados de 118 pacientes que recibieron nelarabina como esquema de rescate (promedio de ciclos de 1-4). Un 36 % integraron RC, 14 % se consideraron en respuesta parcial y 50 %, como refractarios; el 40 % de los casos que recibieron nelarabina pudo acceder a un trasplante de progenitores hematopoyéticos alcanzando una expectativa de vida del 38 % a 5 años43. A pesar de contar con una toxicidad aceptable, los principales eventos adversos son hematológicos y neurológicos, en especial neuropatía periférica, somnolencia y alteraciones en la conciencia44.
Quimioterapia sistémica
Otro enfoque de tratamiento incluye el uso de fármacos que no sean semejantes a fludarabina, entre ellos la combinación de antimetabolitos, inhibidores de topoisomerasa o inclusive modificaciones al esquema de inducción inicial, principalmente. Dentro de las combinaciones se encuentra el esquema denominado MEC (mitoxantrona, etopósido y citarabina), que logra una 2RC en un tercio de los individuos estudiados32.
Una modificación fue realizada por el grupo coreano para el tratamiento de leucemia del adulto; en su serie, 36 pacientes recibieron el esquema MC (mitoxantrona, citarabina) con o sin etopósido (19 y 27 respectivamente). El 48 % de los pacientes integraron una RC, pero al comparar el efecto del etopósido no existieron diferencias significativas (48 % vs. 47 %), salvo la mortalidad temprana que fue mayor en el grupo del etopósido (11 % vs. 21 %)45. Una segunda modificación es la reducción en la dosis de los diferentes fármacos, denominado miniMEC (mitoxantrona 8 mg/m2/d por 1-3 días, etopósido 100mg/m2/d por 1-5 días, citarabina 100 mg/m2/d por 1-5 días). Yamamoto y colaboradores evaluaron esta modificación en pacientes con leucemia aguda (13 casos con LLA y 44 LMA), alcanzando 61,5 % de RC en los individuos con variantes linfoides, siendo la neutropenia el principal evento adverso asociado46.
Otra estrategia incluye el aumento de la dosis de los esquemas convencionales de inducción como Hyper-CVAD. El esquema Hyper-CVAD aumentado se basa en adicionar a la estructura del esquema una dosis intensificada de vincristina, dexametasona y asparaginasa (L-asparaginasa o pegasparaginasa). Faderl y colaboradores, en el MD Anderson CC, estudiaron a 90 pacientes que recibieron el esquema HyperCVAD aumentado en su mayoría LLA-B; de los 88 pacientes evaluables, el 47 % integró RC con una media de duración de 5 meses, permitiendo que un 32 % pudiera acceder a un trasplante de progenitores hematopoyéticos33. En conclusión, uno de los aspectos por considerar si el rescate se basara en quimioterapia es tanto el tiempo de duración de la 1RC, al igual que el esquema que recibió de manera inicial, el número de ciclos acumulados y los potenciales efectos tóxicos; todo esto con la finalidad de reducir el riesgo de muerte y alcanzar una posible respuesta.
La selección del esquema depende tanto del momento de la recaída (temprana o tardía), así como de la funcionalidad del paciente, que puede ser evaluada a través de la escala ECOG (Eastern Cancer Oncology Group), así como de las toxicidades asociadas. Se resumen las posibles opciones para el tratamiento de una LLA en recaída basado en quimioterapia (ver Figura 3).
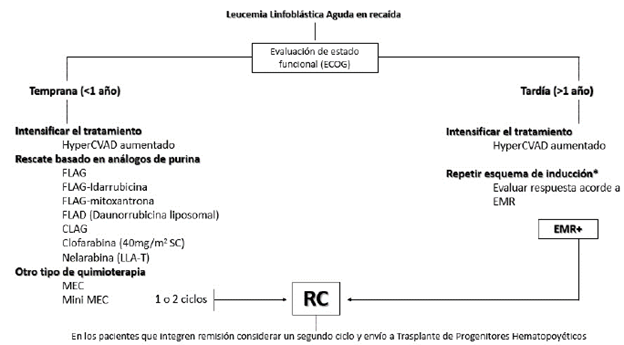
La selección del tratamiento de recaída teniendo en cuenta la quimioterapia considera el tiempo de la recaída y la selección de fármacos, con respecto a su mecanismo de acción dentro de los que se incluyen los análogos de purinas (esquemas basados en fludarabina), la intensificación de esquemas de inducción o la combinación de fármacos no incluidos en los esquemas troncales de tratamiento: mitoxantrona y etopósido.
Fuente: autores
Figura 3 Opciones de tratamiento basado en quimioterapia acorde al tiempo de recaída. RC: remisión completa, EMR: enfermedad mínima residual.
Asociación de la quimioterapia con inhibidores del proteosoma (Bortezomib, Carfilzomib, Ixazomib)
Bortezomib es un inhibidor de proteosoma de primera generación, utilizado para el tratamiento del mieloma múltiple y linfoma no Hodgkin de células del manto. Su mecanismo de acción se basa en la disminución de la expresión del factor nuclear kappa-B (NF-kB) mediante el bloqueo del proceso de ubiquitinación del inhibidor del factor nuclear kappa-B, bloqueando la proliferación y diferenciación de las diferentes células tumorales47,48.
El factor nuclear Kappa-B es un factor de transcripción nuclear que codifica para diferentes proteínas útiles para la supervivencia de la célula; en modelos in vitro ha mostrado su eficacia en diferentes líneas de células de tipo linfoide (incluida la leucemia linfoblástica) y en diferentes células de tumores sólidos49-51. La utilidad de su inhibición se extiende hasta líneas celulares que expresan genes de resistencia a drogas como la glicoproteína P52. Debido a los hallazgos en las diferentes líneas celulares linfoides, se consideró su uso tanto en pacientes en recaída como en pacientes con enfermedad mínima residual positiva.
La primera evidencia de su actividad se identificó en un paciente pediátrico de 8 años con recaídas múltiples; se le adicionó bortezomib con dexametasona (Bortezomib 1,2 mg/m2 días 1, 4, 8, 11) mostrando respuesta53. Posterior a esto, diferentes grupos alrededor del mundo han combinado el uso de Bortezomib (1,3 mg/m2 dos veces por semana) con el esquema de tratamiento estándar para el tratamiento principalmente de leucemias en recaída o refractarias al tratamiento54,55, por ejemplo, en México, Nachmias y colaboradores evaluaron el perfil de toxicidad de Bortezomib reportando la ausencia de eventos adversos serios e inclusive sin modificaciones en la frecuencia de neuropatía56.
Carfilzomib es un inhibidor irreversible del proteosoma, utilizado al igual que el bortezomib para el tratamiento del mieloma múltiple. En leucemias, se ha demostrado la eficacia de carfilzomib en líneas celulares de LLA pediátrica que expresan KMT2A, haciendo sinergia con drogas como vincristina, daunorrubicina y dexametasona; esto abre la oportunidad de su uso a nivel clínico en este tipo de variantes57. Finalmente, ixazomib (IXA) es un inhibidor del proteosoma oral utilizado especialmente en pacientes mayores con mieloma múltiple. Su eficacia en leucemias se ha comparado con Bortezomib demostrando que IXA puede inhibir de manera más potente la subunidad ß1 del proteosoma reduciendo en un 50 % el crecimiento tumoral, pero sin demostrar un efecto sobre las líneas resistentes a BTZ58. Recientemente, Amrein y colaboradores evaluaron su efecto (2,3 mg/d 1, 8, 15) en adición a un esquema de inducción con prednisona, vincristina y doxorrubicina en adultos mayores con LLA, alcanzando un 79 % de RC y una supervivencia del 47 % a 2 años59. De este modo, estos resultados abren la oportunidad de usarse en líneas subsecuentes de tratamiento.
Combinación de agentes hipometilantes
Los agentes hipometilantes son parte fundamental del tratamiento de la leucemia aguda mieloblástica y los síndromes mielodisplásicos. La decitabina (5-aza-2'-deoxycytidine) es un agente hipometilante que cuenta con un mecanismo de acción dual: reactiva genes silenciados e induce citotoxicidad a una dosis alta60. Su utilidad se ha planteado en leucemias con anormalidades genéticas específicas como KMT2A, pudiendo combinarse con drogas como anti-bcl261.
Tratamiento basado en inmunoterapia
El tratamiento basado en estrategias que modifican o potencializan la respuesta inmune es una nueva opción para el tratamiento de la LLA en recaída. Tanto la reducción de la expresión de antígenos de superficie en conjunto con un ambiente inhibitorio son las causas de que las células de leucemia evadan y escapen del sistema inmune62,63. En 2014 y 2017 la FDA aprobó el uso de Blinatumomab e inotuzumab ozogamicin, respectivamente, al igual que en 2017 se aprobó el uso de tisagenlecleucel para el tratamiento de la LLA refractaria o en recaída64.
El tratamiento basado en quimioterapia alcanza en general entre un 20 a un 30 % de respuestas y pocos casos pueden acceder a una estrategia de trasplante de progenitores hematopoyéticos, debido a esto la inmunoterapia es una opción en todos los pacientes tanto en recaída como con enfermedad mínima residual positiva; esta se divide tanto en anticuerpos bi-específicos (Bites), anticuerpos conjugados o terapia basada en células T con receptor quimérico (CART)65. Se describen los efectos de la inmunoterapia en el tratamiento de la leucemia (ver Figura 4).
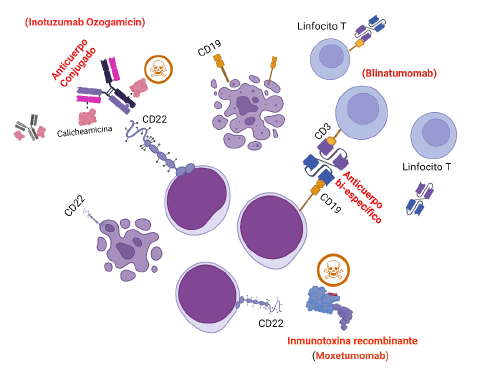
Fuente: autores
Figura 4 Opciones terapéuticas basadas en inmunoterapia para el tratamiento de la leucemia linfoblástica aguda en recaída. Nuevas estrategias basadas en anticuerpos monoclonales y bi-específicos para el combate de la leucemia linfoblástica aguda en recaída o con enfermedad residual medible, Blinatumomab anticuerpo bi-específico que une a CD3 en el linfocito T con CD19 en el linfocito B, eficaz en el tratamiento de LLA con enfermedad residual medible positiva, Inotuzumab; anticuerpo monoclonal conjugado que se a CD22 en el linfocito B liberando en su interior el compuesto citotóxico denominado calicheamicina liberándose dentro de la célula, Moxetumomab pseudotox también es un compuesto anti CD22 que libera una toxina bacteriana recombinante dentro de la célula con alta función citotóxica.
Anticuerpos bi-específicos anti-CD19 (Blinatumomab)
Blinatumomab es un anticuerpo bi-específico CD3/ CD19 con una alta eficacia en contra de las células leucémicas B, en especial con una enfermedad limitada. El estudio multicéntrico TOWER (TOWER ClinicalTrials.gov NCT02013167) demostró la superioridad sobre la quimioterapia estándar en pacientes que ya contaban con múltiples esquemas previos (RC 34 % versus 16 %, p<0,001) extendiendo la supervivencia (7,7 meses versus 4 meses, p=0,001) en especial en aquellos casos en primera recaída66,67.
En un análisis de seguimiento a largo plazo de los estudios fase 2 que incluyeron el uso de Blinatumomab, la media de supervivencia libre de recaída en los pacientes que integraron remisión en los primeros 2 ciclos fue de 7,7 meses (6,2-10 meses, 95 % IC), con una supervivencia global a 3 años de 17,7 %, pero en aquellos que alcanzaron a ser trasplantados la supervivencia fue mayor (37,2 %a3 años)68. Dentro de los principales efectos se encuentra tanto las citopenias como la neurotoxicidad. Kiyoi y colaboradores evaluaron en población japonesa los efectos asociados a la dosis, y reportaron un 96 % de eventos adversos >grado 3, pero sin obligar a reducir la dosis69. Esto coincide con los hallazgos iniciales en donde un 25 % presentó neutropenia febril; 14 %, anemia, y 2 %, un síndrome de liberación de citocinas70.
Finalmente, los adultos mayores son un grupo vulnerable debido a la toxicidad del tratamiento de rescate; en el subanálisis de los pacientes mayores (>60 años) tratados con Blinatumomab se demostró un 56 % de RC con un 19 % de síndrome de liberación de citocinas, y no se reportaron muertes asociadas a eventos adversos71. La presencia del cromosoma Philadelphia es uno de los factores que determina el riesgo de recaída al diagnóstico e impacta con la respuesta a un segundo tratamiento. El estudio ALCANTARA (NCT02000427) analizó la respuesta en pacientes LLA-Ph+ recaída/refractario que fueron resistentes a un inhibidor de segunda generación; en el análisis primario un 35,6 % de los casos alcanzó respuesta completa (RC)/RC hematológica con dos ciclos de tratamiento con un 87,5 % de enfermedad residual medible negativa en los pacientes respondedores con una supervivencia libre de recaída de 6,8 meses72.
Inotuzumab ozogamicin (INO)
Inotuzumab ozogamicin es un anticuerpo intravenoso conjugado dirigido al marcador de superficie CD22, indicado como monoterapia por contener una citotoxina para el tratamiento de la LLA-recaída o refractaria. El marcador de superficie CD22 se expresa en hasta un 90 % de las LLA-B y se encarga de regular el tráfico de señales, la migración y el mantenimiento de la tolerancia periférica73. Posterior a la unión a CD22, un derivado citotóxico de calicheamicina se libera dentro de la célula causando daño en el DNA y activando la apoptosis; su principal indicación es en individuos en recaída que expresen el marcador LLA-B CD22+74. Acorde a los resultados de 12 ensayos con 644 pacientes analizados (LLA y Linfoma No Hodgkin), 67 % de los pacientes con LLA integraron remisión completa, reportándose en global un 8 % de eventos adversos significativos que incluyeron trombocitopenia y neutropenia severa al igual que enfermedad veno-oclusiva75. La expresión de CD22 también impacta con el pronóstico; acorde a los resultados del estudio INO-VATE, los casos que expresaban >90 % de positividad mostraron mejores resultados, pero sin modificar la proporción de eventos adversos76.
Al analizar los resultados finales del ensayo INO-VATE, el cual comparó el uso de inotuzumab ozogamicin con el tratamiento estándar a elección, se identificó que la proporción de remisiones completas fue mayor en los pacientes expuestos a INO en comparación con el tratamiento con quimioterapia (73,8 % vs. 30,9 %, p<0,001). Semejante a otros ensayos, la enfermedad veno-oclusiva es el evento adverso esperado con la exposición a INO; en este ensayo se reportó en un 14 %77. Finalmente, la supervivencia fue mayor en los expuestos a INO brindando la oportunidad de ser tratados posteriormente con un trasplante de progenitores hematopoyéticos.
Moxetumomab pasudotox (MOX)
Moxetumomab pasudotox es una proteína de fusión con una exotoxina de Pseudomonas cuyo anclaje es el marcador CD2278. Los primeros ensayos fase 1 identificaron que su mayor toxicidad es hepática (hiperbilirrubinemia, hipoalbuminemia, síndrome de fuga capilar, ganancia ponderal) siendo esta la mayor limitante de su eficacia. Al analizar la respuesta, un 32 % de los individuos alcanzaron alguna respuesta (23 % con RC y EMR negativa) permitiendo continuar con los ensayos fase 2. Shah y colaboradores, en el estudio internacional fase 2, evaluaron el efecto de MOX en 32 niños portadores de LLA en recaída, donde 28,6 % de los casos alcanzaron RC y 17,9 % alcanzó una respuesta parcial con un 33,3 % (n=10) de eventos adversos asociados incluyendo el síndrome de fuga capilar79. Debido a que MOX no alcanzó las expectativas y su perfil de toxicidad es considerable, aún se mantiene en espera para combinarse con otros fármacos o de nuevos ensayos para determinar su eficacia.
Finalmente, el futuro del tratamiento de la LLA consistirá en la reactivación del sistema inmune, ya sea a través de anticuerpos bi-específicos o inmunoconjugados, con la finalidad de evadir los diferentes mecanismos de resistencia de las células tumorales presentes en pacientes que se encuentran con varias líneas de tratamiento80. Cada vez son más los agentes que pueden ser incorporados a estos inmunoconjugados, incluida la combinación con diferentes nanopartículas, que generen una citotoxicidad irreversible activada por mecanismos físicos o químicos y causen una apoptosis irreversible de las células leucémicas81.
Conclusión
Desde hace más de una década, la quimioterapia ha sido el principal tratamiento para una leucemia tanto al diagnóstico como en recaída. Las combinaciones basadas en análogos de purina son las utilizadas con mayor frecuencia (FLAG), seguidas de esquemas basados en mitoxantrona o el aumento de esquemas de inducción como el HyperCVAD. Debido a los pobres resultados asociados a los esquemas basados en quimioterapia, la inmunoterapia con blinatumomab o inotuzumab son opciones más eficaces tanto para alcanzar una segunda remisión como para negativizar la enfermedad residual medible. Finalmente, la experiencia con inhibidores del proteosoma o agentes hipometilantes es aún poca y se necesitan más ensayos clínicos para evaluar su eficacia en el tratamiento de LLA en recaída.
















