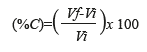INTRODUCCIÓN
El medio marino representa más de la mitad de la diversidad global y se estima que contiene hasta 500 millones de especies distintas, ofreciendo una inmensa fuente de diversos compuestos con actividad biológica potencialmente útiles (Tziveleka et al., 2003; Blunt et al., 2013). Las esponjas son una excepcional fuente productora de compuestos con características estructurales, de los cuales la mayoría han demostrado una amplia variedad de actividades farmacológicas (Faulkner, 2002), que han alcanzado fase de evaluación preclínica e incluso clínica en algunos casos. Sin embargo, este potencial se ve afectado por la limitada disponibilidad del compuesto en los organismos, así como lo poco abundante y dispersos que se encuentran estos en el medio natural (Page et al., 2005; Carballo et al., 2009; Duckworth, 2009). Por lo tanto, en la búsqueda de alternativas para solucionar la dificultad de obtener compuestos (productos naturales marinos), y llevarlos a un nivel sostenible, se han planteado estrategias como síntesis química del metabolito, el cultivo del organismo bajo diferentes condiciones artificiales: cultivo de líneas celulares en laboratorio (células disociadas o disgregadas "primorfos") y el cultivo de organismos en el mar (Sipkema et al., 2006).
De estas estrategias, la acuicultura en el mar es considerada el método más efectivo por su bajo costo y eficiencia, donde se aprovecha las condiciones naturales del hábitat del organismo (Ruíz et al., 2013). Así, se recolectan fragmentos de poblaciones naturales, a los cuales se les permite recuperarse en campo para posteriormente fijarlos a un sustrato para su desarrollo. Con esta alternativa, se ha demostrado que se pueden tener tasas de crecimiento importantes, garantizando un constante suministro de biomasa y por ende de los compuestos de interés (Muller et al., 1999; Duckworth y Battershill, 2003a, 2003b; Treeck et al., 2003; Page et al., 2005).
Se han realizado estudios pilotos de maricultura con esponjas, donde han establecido al menos tres criterios para la evaluación de la eficiencia de los cultivos: la supervivencia, el crecimiento, y la concentración del metabolito; sin embargo, los resultados hasta el momento indican que el éxito depende de factores como la especie, la localidad, el tamaño del fragmento, la estación, la profundidad, la epibiosis, entre otros. Se han obtenido porcentajes de supervivencia desde 23 % (Duckworth y Battershill, 2003a) hasta 100 % (Voogd, 2007), y porcentajes de crecimiento que indican desde pérdidas de peso (Duckworth et al., 1997) hasta crecimientos de 960 % (Duckworth y Battershill, 2003a). En algunos trabajos la manipulación de la esponja aumenta la concentración del metabolito de interés (Hadas et al., 2005), y estudios donde la concentración del metabolito no cambia significativamente con respecto a la concentración de la esponja en ambientes naturales e incluso algunos donde el metabolito o no se produjo o la concentración disminuyó significativamente (Voogd, 2007). Así, algunos cultivos de esponjas han mostrado ser promisorios para la obtención de biomasa y producción de metabolitos; sin embargo, a la fecha no han sido escalados para su producción industrial.
La esponja Discodermia dissoluta se destaca por la producción del compuesto (+)-discodermólido, una lactona de la familia de los policétidos con fuerte actividad antitumoral, antimitótica, antifúngica e inmunosupresora (Gunasekera et al., 1990). Este compuesto fue patentado por el Harbor Branch Oceanographic Institution -HBOI (Longley et al, 1998, Patente US 5840.750) y licenciado por éste, a la empresa farmacéutica Novartis Pharma para su desarrollo como medicamento comercial. Durante la Fase I de investigación clínica desarrollada con pacientes humanos que sufrían de tumores sólidos, éste mostró ser eficiente, pero también presentó cierta toxicidad pulmonar secundaria en 3 de 32 pacientes (Mita et al., 2004). Sin embargo, se han continuado investigaciones de tipo preclínico con animales, tendientes a determinar el farmacóforo de la molécula y la viabilidad de algunos de sus análogos sintéticos o derivados semisintéticos. No obstante, el problema de suministro sigue siendo una limitante en estos estudios (Ruiz et al., 2013), debido a la baja concentración del compuesto (0.002 % en peso), así como la baja densidad de la esponja y la gran profundidad de su hábitat (> 30 m). Por lo anterior, este tipo de investigaciones se han llevado a cabo con material obtenido por síntesis total, siendo esta estrategia costosa y poco práctica (Smith et al., 2003; Florence et al., 2008).
A diferencia del resto del Caribe, en el área de Santa Marta la esponja D. dissoluta se encuentra en aguas someras entre 12 a 25 m de profundidad, con una densidad poblacional moderada de dos a cinco individuos en 50 m2 (Zea, 1987; Ruiz, 2009), la cual no puede sostener una explotación directa, pero sí permitir experimentos de cultivo, con miras a mediano o largo plazo a la obtención y producción de (+)-discodermólido con fines de pruebas clínicas (Ruiz, 2009). Por esta razón, el presente trabajo es el primer avance estudiando dos diferentes estrategias de sistemas de cultivo, evaluando la supervivencia, crecimiento y producción del (+)-discodermólido con variables ambientales.
MATERIALES Y MÉTODOS
Recolección de fragmentos
Los fragmentos fueron recolectados mediante buceo autónomo (SCUBA) a una profundidad entre 18-25 m, en la localidades del Morro de Santa Marta (11°15'01.1" N y 74°13'47.8" O) y Ensenada de Granate (11°17'43.3" N y 74°11'47.9" O), en las inmediaciones de la costa de la ciudad de Santa Marta, Magdalena, Colombia (Figura 1). Una vez identificados los fragmentos, se tomaron los de mayor tamaño, cortando con un cuchillo metálico por encima de la zona basal, para permitir su regeneración. Posteriormente, los fragmentos fueron introducidos en bolsas selladas, y en la superficie en neveras plásticas de 40 L, para transportarlos hasta los viveros submarinos instalados a 10 m de profundidad en Punta de Betín (PB) y Nenguange (NG) para su recuperación y adaptación durante 16 días (Figura 2).

Figura 1 Ubicación de las localidades (Punta de Betín y Nen sturdy autoclave sa 300vfguange, Santa Marta Caribe colombiano) donde se realizaron los experimentos de cultivo de fragmentos de D. dissoulta.

Figura 2 Vivero para la adaptación y recuperación de los fragmentos recolectados (profundidad 10 m); sistemas de cultivo suspendido y fijo instalados a 15 m de profundidad para evaluar crecimiento y supervivencia de fragmentos de la esponja D. dissoluta. Obsérvese la marca (arandela de acero) para diferenciar cada fragmento, el “HOBO” (termómetros electrónicos de precisión para registrar la temperatura y radiación solar), el sedimentador para la tasa de sedimentación y esferas de yeso para el flujo del agua.
Sistemas de cultivo
El cultivo se evaluó de dos maneras: sistema fijo, compuesto de un cuadrante o panel de 1 m2, construido en tubería y accesorios de PVC de media pulgada, cubierto de malla plástica de 3 cm2 de abertura (reforzada internamente con tubería de PVC), que sirvió de sustrato para mantener los fragmentos fijos a la malla, en un área específica construida con cuerda de polietileno de 3 mm (Figura 2), y sistema suspendido, basado en el mismo cuadrante o panel de 1 m2, compuesto con un refuerzo horizontal con cinco líneas de cuerdas de polietileno de 3 mm (Figura 2), las cuales sirvieron para colgar las bolsas con medidas de 18 x 18 cm2 de alto y ancho elaboradas con malla plástica de 3 cm2 de abertura. Se construyeron 4 cuadrantes por sistema (8 en total), instalando dos para fijo y dos para suspendido a una profundidad de 15 m en las dos localidades de Punta de Betín (PB) y Nenguange (NG).
Medición de la talla (en volumen)
Finalizado el periodo de recuperación y adaptación (16 días), los fragmentos fueron recolectados e introducidos en bolsas selladas y en neveras plásticas de 40 L (que contenían agua de mar) y trasladados hasta el laboratorio de bioprospección marina del Invemar (LabBIM). A cada fragmento se le midió la talla (volumen) inicial y final mediante el desplazamiento del agua de mar, utilizando un dispositivo volumétrico fabricado por Ruiz y Zea (2013), que consiste en un cilindro graduado de 250 mL adherido a un recipiente de 860 mL con cierre hermético, con un error de ±2 mL. Adicionalmente, se tuvo en cuenta el origen de los fragmentos sembrados, considerando fragmentos directamente del medio natural (F0) y fragmentos provenientes de experimentos realizados 1.5 meses con anterioridad para estandarizar los experimentos en este trabajo (F2). Posteriormente se continuó con el marcaje, que consistió en una arandela de acero inoxidable con un código establecido, amarrada con cable de teléfono a cada fragmento para el sistema fijo y en las bolsas de malla para el suspendido (Figura 2).
Para determinar la biomasa inicial de cultivo, fue aplicada la siguiente ecuación:
Donde:
B I : Biomasa inicial
E I : Numero de fragmentos iniciales
WI: Peso promedio en volumen
Siembra y cosecha de los fragmentos
Una vez medidos y marcados, los fragmentos se introdujeron en bolsas selladas y colocados en neveras plásticas de 40 L, y mediante buceo SCUBA se trasladaron y ubicaron en cada sistema de cultivo, sembrando un total de 160 fragmentos: 80 en cada estación y 20 por sistema de cultivo, manejando dos réplicas por sistema.
Al momento de la siembra, los fragmentos a cultivar en el sistema fijo se colocaron en el panel sobre la malla y encima se puso otra malla plástica de ojo de 2 cm, mientras que los fragmentos del sistema suspendido fueron introducidos dentro de las bolsas de malla y se colgaron con ayuda de sunchos plásticos a las cuerdas de polietileno instaladas en el panel (Figura 2).
Los fragmentos se cultivaron durante nueve meses (marzo a noviembre de 2013), realizando una limpieza cada quince días, que consistió en generar corrientes fuertes de agua con el movimiento de la mano, con el propósito de remover la sedimentación y fouling adherido a las mallas y fragmentos. Finalizado el tiempo de cultivo, mediante buceo autónomo (SCUBA) se recolectaron los fragmentos, los cuales una vez en la superficie fueron introducidos en neveras plásticas de 40 L y transportados desde el sitio de recolección hasta el LabBIM, para determinar su talla (volumen desplazado). Paralelamente, se recolectaron 12 fragmentos del total cosechado o recuperado al final del cultivo (tres por cada sistema y localidad de cultivo) para llevar a cabo la extracción del (+)-discodermólido, preservando las muestras a -15 °C hasta el momento de la extracción y cuantificación.
En cuanto al porcentaje de crecimiento de los fragmentos expresado en volumen, se tuvo en cuenta el volumen ganado o perdido de la esponja durante el tiempo de cultivo. Este porcentaje fue calculado como:
Dónde:
%C= Porcentaje de crecimiento
Vi = Volumen inicial
Vf = Volumen final
Adicionalmente, se calculó el crecimiento mensual a través de la fórmula:
Dónde,
%Cm= Porcentaje de crecimiento mensual
Vi= Volumen inicial
Vf= Volumen final
Δt= Tiempo de cultivo en meses
La supervivencia se evaluó visualmente teniendo en cuenta el color de los fragmentos, debido a que las esponjas vivas presentan un color intenso (rojo-marrón) mientras que las muertas su color es blanco y el esqueleto recubierto de algas, esponjas y otros invertebrados y sedimento.
El porcentaje de supervivencia se calculó a partir del número total de fragmentos sembrados en relación con el número de fragmentos muertos presentes en el cultivo después de los ocho meses, expresándose como:
Variables ambientales
Con el propósito de conocer la influencia de las variables ambientales sobre el crecimiento (Biomasa) y supervivencia de los fragmentos cultivados, se evaluó la temperatura y radiación solar con termómetros electrónicos de precisión conocidos como "HOBOS" de la marca Onset (Figura 2), los cuales fueron programados para registrar la información cada hora, y se remplazaron mensualmente por nuevos dispositivos. La salinidad se registró cada 15 días por triplicado utilizando una sonda multiparámetro marca YSI. El análisis de materia orgánica particulada se llevó a cabo mediante la técnica de sólidos totales de acuerdo con Garay et al. (2003). La sedimentación fue evaluada utilizando trampas de sedimento de acuerdo con Huang et al. (2011) con algunas modificaciones. Brevemente, se usaron tubos de PVC de 3.8 cm de diámetro y 30 cm de longitud, y se dejaron las trampas por un periodo de dos meses (Figura 2). Finalmente, el flujo del agua se estimó indirectamente a través de la pérdida de masa de esferas de yeso (Figura 2) (Nishizaki y Ackerman, 2007). El yeso utilizado fue tipo IV comercial para odontología, y se obtuvieron esferas de 4.5 cm de diámetro mediante el empleo de moldes apropiados. Las esferas, una vez compactas, se secaron a 38°C por tres horas y luego se registró su masa inicial antes de instalarlas en las localidades de cultivo. Luego de 48 h de inmersión, las esferas fueron recolectadas y secadas en estufa para determinar la pérdida de peso.
Cuantificación de (+)-discodermólido
Para la extracción y cuantificación se siguió la metodología de acuerdo con Valderrama et al. (2010), utilizando HPLC LC Agilent 1260 Infinity (Agilent Technologies) y un detector DAD Agilent 1260 Infinity G1315C. Para este análisis, en primer lugar, se aisló el metabolito de individuos silvestres y a partir de este se construyó una curva de calibración con soluciones en metanol, comprendidas entre 1.4 y 118 |ig/mL. A partir de esta curva de calibración, se realizó la cuantificación del metabolito en los12 fragmentos seleccionados.
En todo el proceso de análisis del contenido de (+)-discodermólido en los tejidos de D. dissoluta estudiados, tanto del medio natural como de los sistemas de cultivo, se empleó un patrón de la sustancia pura, para verificar la presencia del metabolito en las muestras procesadas, este patrón fue suministrado por el HBOI.
Análisis estadístico
Para determinar el desempeño del cultivo, se utilizó un modelo lineal generalizado (MLG), teniendo como variable dependiente el crecimiento mensual y como factores predictivos las localidades (Nenguange y Punta de Betín), sistemas de cultivo (fijo y suspendido), el origen (F0 y F2) y considerando las variaciones de tamaño de los fragmentos mediante las clases de talla (pequeña ≤ 20 mL; mediana: 21-39 mL y grande: ≥40 mL), tomando como factor cuantitativo la talla inicial de los fragmentos cultivados. Por último, se realizó una regresión lineal simple entre la talla inicial y el crecimiento, para determinar si el crecimiento dependió de la talla inicial del fragmento.
Así mismo, para evaluar la mortalidad, se cuantificó su número total, y se determinó el porcentaje que correspondía a los cuatros factores (sitios, sistemas de cultivo, clases de talla y origen), posteriormente se realizó una prueba de independencia de la frecuencia de fragmentos vivos v/s muertos, en relación a los factores mencionados, mediante el software estadístico Statgraphics Plus versión 5.1.
También fueron aplicados ANOVAS a dos y tres vías, utilizando como factor los sistemas de cultivo, las dos localidades y el origen del fragmento (F0 y F2), tomando como covariable la talla inicial de siembra, una vez comprobado los supuestos de normalidad y homogeneidad de las varianzas. Así mismo, se realizó una regresión lineal simple entre la talla inicial y el crecimiento, para determinar si el crecimiento en volumen dependió del volumen inicial de los fragmentos.
Finalmente, para evaluar la posible relación entre la mortalidad presentada en los diferentes sistemas de cultivo con la variación de las variables ambientales, se procedió a realizar un análisis de correlación utilizando como predictor estadístico la prueba de Pearson (valor de significancia de p >0.05) mediante el software SPSS 20.
RESULTADOS
Supervivencia y crecimiento de fragmentos
En los primeros meses se presentó alta mortalidad en ambos sistemas de cultivo (fijos y suspendidos) (Figura 3). A partir de abril la supervivencia de los fragmentos en la localidad de Punta de Betín fue relativamente estable, disminuyendo ligeramente al final del cultivo. Sin embargo en Nenguange este comportamiento se presentó en el sistema suspendido, ya que en el fijo hubo un descenso continuo de la supervivencia, alcanzando 55 % al final del experimento (Figura 3). En cuanto al sistema de cultivo, los fragmentos que se mantuvieron suspendidos presentaron un crecimiento ligeramente superior (Figura 3).

Figura 3 Supervivencia acumulada de fragmentos de D. dissoluta cultivados en dos sistemas fijo (A) y suspendido (B) (NG = Nenguange; PB= Punta de Betín).
Teniendo en cuenta el efecto del origen del fragmento, independiente de la localidad del cultivo, las mayores mortalidades se presentaron en FO (extraída directamente del medio natural) con relación aquellas que venían de experimentos previos (F2) (Figura 4).

Figura 4 Porcentaje de mortalidad de fragmentos de D. dissoluta cultivados en dos sistemas (fijo y suspendido) y considerando el factor de origen (F0 y F2).
Para las pruebas de independencia, solo las clases de talla combinadas para los sistemas de cultivo, mostraron variación en la frecuencia de mortalidad (chi-cuadrado =11.6; grados de libertad =2; p <0.05), siendo el valor para las pequeñas de 63.26 %, seguida de las medianas con 55.25 % y las grandes con 33.36 %.
El crecimiento de los fragmentos sobrevivientes al final del cultivo fue variable, encontrando valores desde -10.9 a 109.4 % de la talla inicial, con un promedio de 2.1 ± 1.0 % de incremento mensual (±1 error estándar); 58.94 % de los casos resultó negativo, y solo 21.85 % superó 5 % mensual. Es importante mencionar, que para el sistema fijo instalado en Punta de Betín, el crecimiento mensual fue negativo (- 0.968 %) (Figura 5).

Figura 5 Porcentaje promedio de crecimiento mensual de fragmentos de D. dissoluta, cultivados en dos sistemas (fijo y suspendido) y localidades (NG = Nenguange; PB = Punta de Betín) a 15 m de profundidad. La barra indica el error estándar.
En cuanto a las clases de talla (pequeña: ≤ 20 mL; mediana: 21-39 mL; grande: ≥ 40 mL) según el sistema de cultivo, se observó que los fragmentos en el suspendido evidenciaron mejores resultados en las tres tallas que en el fijo, estableciendo mediante la ANOVA a dos vías, una diferencia significativa (F = 3.44, p =0.03; pequeña: 7.5 ± 5.0 %, n = 23; mediana: - 0.0 ± 0.6 %, n = 60, y grande: 2.1 ± 1.3 %, n = 68) (Tabla 2), siendo los mayores crecimientos en los fragmentos de talla pequeña, con un promedio de 13.9 % ± 13.8 % (n=8); tendencia que fue evidente a través de los resultados de la regresión lineal (p =0.04), pero con una muy pequeña variabilidad explicada por la talla inicial (R2 = 2.9 %).
Tabla 1 Análisis de Varianza (ANOVA) a dos vías, comprando el porcentaje de crecimiento (mensual) de fragmentos de D. dissoluta cultivados en dos sistemas (fijo y suspendido), tres tallas (pequeña: ≤ 20 mL; mediana: 21-39 mL; grande: ≥40mL), utilizando la talla inicial como covariable. G.L=Grados de libertad; P=Probabilidad.

Tabla 2 Análisis de varianza (ANOVA) a tres vías comparando el porcentaje de crecimiento (mensual) de fragmentos de D. dissoluta cultivados en dos sistemas (fijo y suspendido), dos sitios (NG = Nenguange; PB = Punta de Betín) y origen (F0 y F2), utilizando el volumen inicial como covariable. G.L = Grados de libertad; P = Probabilidad.

Sin embargo, el análisis de varianza (ANOVA) a tres vías, comparando los sistemas de cultivo (fijo y suspendido), sitios (NG 15 y PB 15 m), y origen (FO y F2), donde se incluyó como covariable la talla inicial, indicó que los factores no fueron significativos (p > 0.05) sobre el crecimiento, como tampoco sus interacciones (Tabla 2), probablemente debido a que al evaluar un mayor número de variables la distribución de los fragmentos pequeños fue de carácter homogénea, generando al final un resultado similar entre los tratamientos evaluados.
Variables ambientales
La temperatura durante el cultivo fue similar en ambas localidades, con un promedio de 27 °C, iniciando con una temperatura de 24 °C en marzo, aumentando paulatinamente hasta noviembre, alcanzando su valor más alto en octubre con 29 °C. Con relación a la radiación solar, se observó un comportamiento variable, con los mayores registros en junio en Neguange con 2.36 watt/m2 y septiembre en Punta de Betín con 0.48 watt/m2 (Figura 6). La salinidad disminuyó de 37 a 35 en Punta de Betín y de 37 a 36 en Nenguange. La materia orgánica en las dos estaciones fue muy variable entre 11.1 a 5.1 mg/L, resaltando Punta de Betín con los mayores valores de materia orgánica durante gran parte del estudio (Figura 6). En cuanto a la tasa de sedimentación, se encontraron tendencias opuestas entre las dos estaciones; en Punta de Betín el valor más alto fue en mayo con 421.8 mg/m2/dia; sin embargo, a partir de ese mes la tasa de sedimentación disminuyó, al contrario a Nenguange que la tasa aumento paulatinamente con el valor más alto en noviembre 265.6 mg/m2/dia. Finalmente, el flujo de agua no tuvo variaciones importantes, solo se resalta junio en Nenguange como el más bajo con 1 df y el más alto para Punta de Betín en abril con 2.7 df (Figura 6).

Figura 6 Variables ambientales evaluadas durante el cultivo de los fragmentos de D. dissoluta ((NG = Nenguange; PB = Punta de Betín). La barra indica la desviación estándar.
Los resultados de correlación entre las variables ambientales y la supervivencia de los fragmentos no mostraron significancia (p >0.05). Se resalta la correlación negativa entre la temperatura y la superviencia observada en Punta de Betín para los dos sistemas de cultivo (n = 9; p <0.05; PB15 Supendido C= - 0.9 y PB15 Fijo C= - 0.9) (Tabla 3).
Obtención de (+)-discodermólido
La determinación del contenido de (+)-discodermólido en las localidades y sistemas, mostraron que en Punta de Betín el sistema fijo presentó la mayor producción promedio del metabolito con 132.9 ug/g de peso seco libre de cenizas; sin embargo, no se observaron diferencias significativas (p >0.05) entre la cantidad de metabolito producido por los fragmentos según la localidad, así como tampoco al sistema de cultivo (Figura 7).
DISCUSIÓN
El trabajo tuvo en cuenta la localidad, tipo de cultivo y variables ambientales, con el propósito de conocer si afectaban el crecimiento y supervivencia de los fragmentos como la concentración de (+)-discodermólido. Las altas mortalidades de los fragmentos al inició del cultivo se atribuyó al estrés por la manipulación fuera del agua durante el proceso del pesaje, mareaje y siembra, afectando a la esponja y la comunidad de bacterias simbiontes asociadas (Webster et al, 2008), causando un debilitamiento del organismo, necrosis del tejido y muerte del fragmento y los que sobrevivieron un consumo de energía durante el proceso de cicatrización para recuperarse (Van Treeck et al, 2003). Aunque el porcentaje de supervivencia para los dos sitios y sistemas fue de 55-72 %, no se puede afirmar que sea promisorio, si se compara con el porcentaje (93%) obtenido por el estudio realizado por Ruiz et al. (2013) usando cultivo suspendido (bolsillos) a 18 m de profundidad y otros estudios realizado con Negombata magnifica que variaron entre 17 y 84 % (Hadas et al, 2005). Sin embargo, si se ajustan aspectos como el tiempo fuera del agua para los procedimientos mencionados, y se usa solo el cultivo suspendido, aumentaría probablemente el porcentaje de supervivencia de los fragmentos.
Duckworth (2009) describe que las bolsas de malla poseen aberturas que maximizan el área superficial para la alimentación y respiración, obteniendo altas tasas de supervivencia en varias especies de esponjas. Los resultados obtenidos concuerdan con los fragmentos cultivados en bolsillos, los cuales presentaron mayor supervivencia y un crecimiento mensual superior para ambas localidades, indicando que este sistema permite mayor flujo de agua y por ende más alimento y menor sedimentación. Adicionalmente los fragmentos cultivados en Punta de Betín usando el sistema fijo corroboran lo observado como la alta sedimentación y por ende alta colonización por otros organismos. Otra consideración es que, al estar Punta de Betín expuesta a descargas residuales provenientes de los ríos Gaira y Manzanares (Parra y Zea, 2003; Roa et al, 2007), es de esperar una mayor sedimentación, y por consiguiente más alimento, lo cual eventualmente pudo resultar negativo para la esponja e impedir su crecimiento y producción del metabolito (+)-discodermólido ya que ambos sistemas de cultivo, principalmente el fijo, aunque se realizaron limpiezas periódicas con el propósito de remover la sedimentación adherida a las mallas y los fragmentos, se colmataron con mucha facilidad cubriendo la malla.
Otras investigaciones de cultivo de esponjas {Polymastia croceus y Latrunculia wellingtonensis), señalan que las bolsas de malla aumentan las posibilidades de crecimiento, teniendo en cuenta, que el organismo puede tener inicialmente baja competencia interespecífica en relación con el alimento y espacio (Caralt, 2007). Otros autores sugieren las ventajas del crecimiento en sistemas de malla fija, en cuanto a una mayor protección al oleaje (Van Treeck et al, 2003; Duckworth, 2009), así como a una mayor exposición a la luz, que favorecería la translocación de nutrientes provenientes de la fotosíntesis realizada por parte de cianobacterias simbiontes (Schirmer et al, 2005). Sin embargo, este trabajo no evidenció un comportamiento destacado de este sistema de cultivo (fijo); ya que por el contrario favoreció el crecimiento de organismos incrustantes, generando el taponamiento de la malla que disminuyó el flujo del agua.
Las variables ambientales evaluadas no mostraron significancia (p >0.05) con el crecimiento, supervivencia y en cuanto al contenido de (+)-discodermólido. Adicionalmente, se encontró que la procedencia de los fragmentos resulta determinante para la supervivencia de la esponja, presentando mejores resultados aquellos provenientes del experimento previo (F2) de cultivo sobre los extraídos directamente del medio natural (F0). Duckworth y Battershill (2003a) y Ferrati et al. (2006) observaron que las tasas de crecimiento de Agelas oroides y Petrosiaficiformis no están relacionadas con la talla inicial de la esponja, mientras que en otras especies el tamaño del explante es determinante (Reiswig, 1973; Leys y Lauzon, 1998). En nuestro caso, los fragmentos pequeños crecieron más, comportamiento que también se presentó en los fragmentos de D. dissoluta en el trabajo realizado por Vásquez (2011), los cuales duplicaron y hasta cuadruplicaron su volumen, mencionando que fragmentar esponjas donantes en un mayor número de fragmentos pequeños, es una muy buena estrategia, para obtener mejores y más rápido crecimiento.
El estudio evaluó la mejor condición del cultivo que maximizará el crecimiento de los fragmentos, y por ende mayor concentración del metabolito, teniendo en cuenta que se debían escoger condiciones que se adaptaran a la recolección de los fragmentos, la profundidad, la localidad que garantizaran la viabilidad de la ejecución del trabajo. Los resultados han sido disimiles, con porcentaje de crecimiento mensual positivo y negativo, que dependen de muchas variables en primera instancia de la forma de crecimiento y la capacidad de regeneración, y en segunda de los métodos de amarre, la ubicación de los fragmentos y las condiciones ambientales. Estudios de cultivo realizados con especies como Geodia cydonium, Latinculia wellingtonensis, Polymastia croseus, Axinella corrugata, Negombata magnifica, Callyspongia (Euplacella) biru, Mycale hentscheli (Duckworth et al., 1997; Müller et al., 1999; Duckworth y Battershill, 2003a; Hadas et al., 2005; Page et al., 2005; Voogd, 2007; Duckworth, 2009), mencionan que los mejores resultados se han obtenido al ubicar las estructuras en ambientes con buena circulación de agua, poniendo los fragmentos por encima del sustrato, para maximizar la obtención de alimento y minimizar los efectos del sustrato, y manteniéndolos en bolsas de malla ancha o atravesándolos con nylon.
Duckworthe y Battershill (2003a) y Voogd (2007) mencionan que para hacer sustentable o potencial el cultivo de estos organismos, es necesario además de una adecuada producción de biomasa y alta supervivencia, un buen suministro del metabolito. En el caso de D. dissoluta el (+)-discodermólido se encuentra en baja concentración, por lo que implementar una estrategia de cultivo sería efectiva para esta especie (Valderrama, 2009). Varios estudios con otras especies de esponjas y mediante diversos métodos de análisis, la concentración de los compuestos han estado por encima o debajo a las encontradas en condiciones naturales, ejemplo: Callyspongia (Euplacella) biru, concentraciones de los fragmentos en cultivo (0.03 y 0.17 % en peso) no fueron significativamente menor a las de las poblaciones naturales (0.06 y 0.22 % en peso) (Voogd, 2007); mientras Latriculia wellingtonesis y Polymastin croceus (Duckworth y Battershill, 2003a) y Mycele hentscheli (Page et al., 2005) las concentraciones de cultivo fueron mayores a la población natural. Esto demuestra la variabilidad de producción de estos compuestos, la cual puede depender de la especie y del tipo de prueba que se esté desarrollando.
CONCLUSIONES
La poca variación de las condiciones ambientales durante el cultivo no fue un factor determinante para el crecimiento y supervivencia de D. dissoluta. Las mayores supervivencias se obtuvieron en el sistema suspendido: mayor flujo de agua, disponibilidad de alimento, fácil limpieza (eliminación del sedimento y fouling) y cosecha de los fragmentos. A pesar que los fragmentos de la esponja D. dissoluta son capaces de sanar, sobrevivir y crecer, factores como la manipulación excesiva conllevan al estrés del animal, causando debilitamiento, infecciones, muerte del tejido e incluso la muerte del fragmento. Esto a su vez, se ha se considerado como la principal causa de variación de crecimiento, que estuvo entre - 10.9 a 109.4 % para los sitios y sistemas de cultivo. Adicionalmente, se encontró que la procedencia de los fragmentos resulta determinante para la supervivencia de la esponja, presentando mejores resultados aquellos provenientes del experimento previo de cultivo, sobre los extraídos directamente del medio natural para el experimento. En cuanto al contenido de (+)-discodermólido, se observó una variación muy alta y no diferencias significativas entre las localidades y sistemas de cultivo, fue difícil establecer que sistema de cultivo fue el más eficiente.
Se recomienda trabajar con fragmentos pequeños cuyo crecimiento es más rápido, con sistemas de bolsillos suspendidos, minimizando el tiempo de exposición al aire y cuidado en el proceso del corte, pesaje y marcaje de los fragmentos.











 text in
text in