Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Biotecnología
Print version ISSN 0123-3475
Rev. colomb. biotecnol vol.16 no.1 Bogotá Jan./June 2014
https://doi.org/10.15446/rev.colomb.biote.v16n1.38259
http://dx.doi.org/10.15446/rev.colomb.biote.v16n1.38259
ARTÍCULO DE INVESTIGACIÓN
Caracterización morfológica y evaluación de resistencia a Fusarium oxysporum en especies silvestres del género Solanum sección Lycopersicon
Morphological characterization and resistance evaluation to Fusarium oxysporum in wild species Solanum genera Lycopersicon section
Título corto: Caracterización morfológica y evaluación de resistencia a Fusarium oxysporum
María Natalia Morales Palacio1, Georgina Espinosa López2, Ángel Rafael Morales Astudillo3, Byron Rafael Sánchez Masache4, Ángel Miguel Jiménez Castillo4 y Yoamel Milián-García5.
1 Ingeniera Agrónoma, Magister en Biotecnología, Centro de Biotecnología, Universidad Nacional de Loja, Ciudadela "Guillermo Falconí Espinosa" sector La Argelia, Loja-Ecuador, Teléfono (593) 0998885879, nataliamorales88@yahoo.es
2 Bióloga, PhD en Ciencias Biológicas, Facultad de Biología, Universidad de la Habana, Ciudad de la Habana- Cuba, Teléfono (537-830 9821), georgina@fbio.uh.cu
3 Ingeniero Agrónomo, PhD en Ciencias Naturales, Profesor Titular, Universidad Nacional de Loja, Teléfono (593) 2579077, amoralesastudillo@yahoo.es
4 Ingeniero Agrónomo, Universidad Nacional de Loja.
5 Licenciado en Bioquímica, Magister en Bioquímica, Facultad de Biología, Universidad de la Habana, Ciudad de la Habana- Cuba, Teléfono (537-830 9821), yoamel@fbio.uh.cu
Recibido: agosto 5 de 2013 Aprobado: abril 21 de 2014
Resumen
Con el objetivo de evaluar la variación morfológica y la resistencia a Fusarium oxysporum en la colección del banco de germoplasma de la Universidad Nacional de Loja (UNL), 146 accesiones de cuatro especies silvestres fueron seleccionadas (Solanum pimpinellifolium, S. neorickii, S. habrochaites, S. lycopersicum var. cerasiforme); y, 20 accesiones de tomate cultivado (S. lycopersicum). Un total de 723 plántulas se transplantaron al campo y se evaluaron morfológicamente durante todo su ciclo biológico, con un descriptor que incluyó 20 caracteres cuantitativos y 25 cualitativos. Se estimó la variabilidad morfológica y se detectaron diferencias fenotípicas relacionadas con el fruto, características vegetativas de las plantas y los componentes del rendimiento. Las variables morfológicas mostraron que S. habrochaites es la especie más diferenciada con relación a las restantes. La podredumbre vascular causada por F. oxysporum es responsable de enormes pérdidas en la producción de tomate en el mundo; sin embargo, las especies silvestres que originaron las variedades cultivadas poseen genes de interés agronómico, utilizados por décadas para la generación de variedades resistentes. Por ello, entre 64 y 228 individuos por especie, se evaluaron por tres procedimientos de inoculación. Todas las especies fueron significativamente diferentes en los niveles de resistencia, tolerancia o susceptibilidad. S. neorickii fue más resistente y tolerante, seguida de S. pimpinellifolium y S. lycopersicum var. cerasiforme, mientras que todas las variedades cultivadas (S. lycopersicum) fueron susceptibles. Tales circunstancias permitieron determinar sin lugar a dudas, que las plantas sobrevivientes y tolerantes poseen un genotipo particular que determina esa característica.
Palabras clave: Ecuador, tomate, tolerancia, susceptibilidad, inoculación.
Abstract
In order to evaluate the morphological variation and Fusarium oxysporum resistance in the National University of Loja (UNL) genebank collection, 146 wild accessions of four species were selected (Solanum pimpinellifolium, S. neorickii, S. habrochaites , S. lycopersicum var. cerasiforme) and 20 accessions of cultivated tomato (S. lycopersicum). For a total of 723 seedlings were transplanted to the field and evaluated morphologically throughout its life cycle, with a descriptor that included 20 quantitative and 25 qualitative characters. Morphological variability was estimated were detected phenotypic differences related the fruit, plant vegetative characteristics and yield components. Morphological variables showed that S. habrochaites is the most differentiated with respect to the others. Vascular rot caused by F. oxysporum is responsible for huge losses in tomato production in the world, but the wild species that gave rise to the cultivated varieties have agronomic interest genes used for decades to generate resistant varieties. Therefore, between 64 and 228 individuals per species were evaluated for three inoculation procedures. All species were significantly different between levels of resistance, susceptibility or tolerance. S. neorickii was more resistant and tolerant, followed by S. pimpinellifolium and S. lycopersicum var. cerasiforme, while all cultivars (S. lycopersicum) were susceptible. Such circumstances allowed undoubtedly determine that survivors and tolerant plants have a particular genotype that determines the characteristic.
Key words: Ecuador, tomatoe, tolerance, susceptibility, inoculation.
Introducción
El centro primario de origen del tomate y de las especies silvestres emparentadas se halla en las regiones situadas a lo largo de la Cordillera de los Andes de Ecuador y Perú. Particularmente el Ecuador reconocido como "mega diverso", es custodio de una parte considerable de la variabilidad genética de especies de interés económico y social; no obstante, dicha diversidad es poco conocida, miles de especies continúan desconocidas para la ciencia o subutilizadas para la humanidad y sólo aprovechadas por la fauna silvestre, desconociéndose su potencialidad como fuente de alimento, materia prima y medicamentos (Bernal y Correa1990).
Un caso puntual en donde reside toda la variabilidad genética disponible y fundamental para el desarrollo de programas de mejora genética, lo constituyen las especies silvestres de la sección Lycopersicon. Estas han sido y continúan siendo utilizadas de forma potencial para el mejoramiento genético de las variedades cultivadas por investigadores de otros países. Las potencialidades de su empleo estriba en características de gran interés agronómico tales como: tolerancia a la humedad, resistencia a hongos e insectos, mejora del color de los frutos, tolerancia a la salinidad del suelo, tolerancia a heladas, resistencia a la sequía, alto contenido de licopeno, entre otros (Nuez 1995).
En Ecuador el tomate se cultiva ampliamente, tanto en la costa como en la sierra, donde constituye única fuente de ingresos para muchos agricultores; sin embargo las semillas que se emplean provienen por lo general de variedades generadas en países europeos.
El principal problema con estas variedades ha sido durante décadas, la incidencia de plagas y enfermedades, situación que ha llevado al abuso de productos pesticidas en su mayoría de alta peligrosidad, realizándose entre 30 y 35 aplicaciones por ciclo (INIAP 2001). Este manejo irracional del cultivo, conlleva un alto riesgo tanto para los consumidores, como para la salud del agricultor, ruptura del equilibrio biológico, falta de efectividad de los insecticidas por el desarrollo de resistencia, y encarecimiento de los costos de producción (Valarezo 2002). Particularmente, Fusarium oxysporum es un hongo cosmopolita que existe en muchas formas patogénicas, parasitando más de 100 especies de plantas gimnospermas y angiospermas, gracias a los diversos mecanismos que tiene el hongo para vencer las defensas de muchas plantas (Bosland 1988).
La marchitez vascular del tomate producida por el hongo, es una enfermedad importante en el mundo (Hartman y Fletcher 1991). El patógeno causa pudrición radical y lesiones necróticas extensivas en el cuello y base del tallo, marchitez y muerte. Las lesiones necróticas con frecuencia ascienden hasta 30 cm a partir del cuello de la planta, las cuales mueren generalmente al inicio de la maduración de los frutos, causando la pérdida total de la producción (Jarvis 1988).
Tomando en cuenta que las variedades actualmente comercializadas en el mundo, provienen de especímenes silvestres colectados desde su hábitat natural Peralta et al. (2006), y que en el proceso, se han relegado genes de enorme interés agronómico y de resistencia específica a las razas fisiológicas locales, este material puede ser empleado para incorporar a los cultivos comerciales genes de resistencia específicos para las condiciones del país.
El Centro de Biotecnología de la Universidad de Loja, provincia de Loja-Ecuador, posee uno de los bancos de germoplasma de especies silvestres del género Solanum más grandes y completos del mundo, cuyo material ha sido caracterizado parcialmente a nivel morfológico.
Es así que este trabajo se propone caracterizar desde el punto de vista morfológico, cuatro especies silvestres del género Solanum y evaluar su comportamiento ante la inoculación controlada de Fusarium oxysporum.
Materiales y métodos
Material vegetal
La diversidad morfológica fue estimada en un total de 166 accesiones de la colección del banco de germoplasma del Centro de Biotecnología de la Universidad Nacional de Loja-Ecuador (UNL). La colección incluyó 146 accesiones colectadas en Ecuador y Perú, pertenecientes a cuatro especies silvestres del genero Solanum sección Lycopersicon [dos del grupo Lycopersicon (Solanum pimpinellifolium L., Solanum lycopersicum var. cerasiforme Dunal), una del grupo Eriopersicon (Solanum habrochaites S. Knapp and D.M. Spooner) y una del grupo Arcanum (Solanum neorickii D.M. Spooner, G.J. Anderson and R.K.Jansen)]; y, 20 accesiones de variedades comerciales de tomate cultivado (Solanum lycopersicum L.), provenientes de cinco países (Chile, Argentina, Brasil, España, Francia y Holanda).
Análisis morfológico
Dependiendo de la disponibilidad, entre dos y diez semillas (medios hermanos) de cada una de las accesiones, fueron germinadas en condiciones controladas bajo invernadero a 2134 msnm. Las plántulas con cuatro a cinco hojas verdaderas, fueron posteriormente trasplantadas a campo abierto en el Centro Binacional de Formación Técnica-Zapotepamba, provincia de Loja-Ecuador de la UNL, ubicado a 950 msnm, en la zona de vida Bosque muy seco Tropical (bms-T), con temperaturas entre 18 a 24° C y precipitación media anual de 600 mm.
En una área total de 1000 m2 las plantas fueron sembradas en un diseño completamente aleatorizado a distancias de 1.0 x 1.5 m, bajo riego por goteo, sin fertilización, con tutorado.
De un total de 997 plantas, se raleó hasta dejar 723 plantas pertenecientes a 166 accesiones (en promedio 4 plantas por accesión), evaluándose cada carácter durante cinco meses.
Los caracteres morfológicos cuantitativos (20) y cualitativos (25), fueron medidos desde el inicio de la floración hasta el final del ciclo. Los caracteres fueron seleccionados de Rick (1983) y de observaciones personales que incluyeron caracteres de la planta en general, tallo, hojas, inflorescencias, frutos, plagas y enfermedades (tabla 1).
Evaluación de la resistencia a Fusarium oxysporum
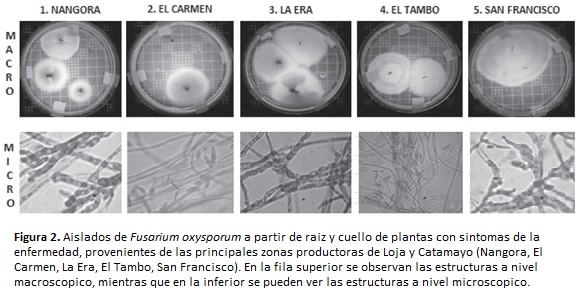
El inóculo fue colectado en cultivares de tomate con síntomas de la enfermedad, en las principales zonas productoras de la provincia de Loja-Ecuador (Nangora, El Carmen, La Era, El Tambo y San Francisco). Las plantas enfermas fueron arrancadas de raíz, empacadas en papel húmedo y en plástico. El hongo fue aislado, purificado e identificado Barnet y Hunter (1972); Puhalla (1985); Nelson et al., (1994) y posteriormente fue masificado en sustrato de arroz, incubándose a 25 °C durante 15 a 20 días, hasta que el micelio cubrió la superficie total del sustrato.
La caracterización e identificación del patógeno a nivel de género y especie se realizó en el laboratorio de Fitopatología de la UNL, mediante observaciones microscópicas y comparación con claves taxonómicas Leslie y Summerell (2006). Para obtener datos cruzados, réplicas de cada una de las cepas madre fueron analizadas en el laboratorio de Fitopatología de la Agencia ecuatoriana de aseguramiento de la calidad del agro (AGROCALIDAD).
Paralelamente y bajo condiciones de invernadero, se germinaron tres semillas previamente desinfectadas (carboxín 0, 3 %) y sometidas a imbibición con ácido giberélico (0,1 %) por24 horas. Se utilizó un sustrato 1:2:1 (suelo:arena:humus) desinfectado químicamente con Captan 80 % y Carbofurán 20 %.
Posterior a la germinación, se raleó hasta dejar una plántula por accesión. Cuando las plántulas desarrollaron tres hojas verdaderas, se inoculó mediante inyección Okiror (1998), una suspensión conidial concentrada a 2x106 conidios/ml. Las plantas fueron mantenidas en baldes plásticos a 2134 msnm, a cielo abierto, con temperatura promedio de 16± 6 °C, 800 mm de precipitación y humedad relativa de 60-70 %.
Debido a la ausencia de sintomatología con el método antes descrito, se realizó la inoculación por inmersión, en plántulas germinadas y raleadas bajo las condiciones antes descritas, en un sustrato de turba desinfectado con calor a 100 °C. Cuando las plántulas desarrollaron tres hojas verdaderas, fueron inoculadas por inmersión con 200 ml de un macerado de raíces de plantas con síntomas de la enfermedad (200 g de raíces lavadas y desinfectadas para un volumen final de un litro de agua destilada). Las plantas fueron mantenidas bajo condiciones de invernadero, a temperatura diurna de 25 ± 1°C con diferencias de -8 °C durante la noche, humedad relativa del 60 % y fotoperiodo de 10 horas por día.
Para ratificar los resultados obtenidos con el método antes descrito, se probó el método de inoculación en medio hidropónico, para lo cual, tres semillas por accesión fueron germinadas entre dos papeles filtro (sándwich) humedecido con una solución enriquecida con micro y macronutrientes. Siete días después de la germinación, se adicionaron 200 ml de inóculo (200 g de raíces lavadas y desinfectadas para un volumen final de un litro de agua destilada) y se mantuvieron en estufa bajo condiciones controladas: temperatura 28 °C, humedad relativa 60% y luz artificial 200 lux (ciclo alternado: 12 horas luz-12 horas oscuridad).
La resistencia, tolerancia o susceptibilidad a F. oxysporum, se evaluó diariamente a partir del tercer día de inoculación. Según la sintomatología presentada y el avance de la enfermedad, se evaluó cada planta en escala del 1 al 3: Resistente (1) sin sintomatología; Tolerante (2) flácida o amarillamiento de hojas; y, Susceptible (3) muerte de la planta.
Porciones de raíz y cuello de las plantas muertas procedentes de los diferentes ensayos, fueron aisladas para ratificar que el agente causal de la sintomatología fuera efectivamente F. oxysporum.
Análisis estadístico
Cada uno de los datos cuantitativos fue sometido al test de normalidad, y, al comprobar su incumplimiento, se realizó un ANOVA no paramétrico de Kruskal-Wallis, y se aplicó el test de comparación múltiple de Dunn's, mediante el paquete GraphPad InStat (GraphPad Software, San Diego, California, USA), determinando las variables no correlacionadas. A los datos cuantitativos de medios hermanos se calculó la media aritmética y se generó un valor medio para cada accesión. Se realizó un análisis de clasificación, de componentes principales y otro de coordenadas principales, mediante el paquete estadístico PAST (Hammer et al., 2007).
Con las variables cualitativas se elaboró una matriz binaria y se obtuvo la moda de los datos de medios hermanos, generándose así un dato por cada accesión. Se realizó un análisis de agrupamiento por coordenadas principales a través del programa PAST (Hammer et al., 2007).
Se estimaron las frecuencias relativas de las plantas resistentes, tolerantes y susceptibles a F. oxysporum para las diferentes especies, mediante una prueba de Chi cuadrado (X2) aleatorizada por el método de Monte Carlo para 1000 repeticiones, utilizando el programa CHIRXC (Zaykin y Pudovkin 1993).
Resultados
Análisis Morfológico
Caracteres cuantitativos
La evaluación del material vegetal, considerando las 45 variables descritas, permitieron estimar la variabilidad morfológica en las especies analizadas, donde se detectaron diferencias fenotípicas relacionadas con el fruto y las características vegetativas de las plantas, así como en los componentes del rendimiento.
Según se informa en la tabla 2, las variables cuantitativas que caracterizan morfológicamente la planta en general, muestran que S. habrochaites es la más diferenciada. Las variedades cultivadas son las de menor altura y tienen el menor número de ramificaciones, en comparación con S. habrochaites que presenta más del doble de ramificaciones, así como mayor cantidad de frutos por racimo, frutos por planta y mayor tamaño de la planta.
Las distancias de entrenudos son mayores en S. habrochaites; mientras que en S. lycopersicum var. cerasiforme, S. neorickii y en las variedades cultivadas, estos son más cortos y no hay diferencias significativas entre estas especies.
Las variables que caracterizan morfológicamente la hoja, muestran diferencias significativas para S. neorickii, S. lycopersicum var. cerasiforme y S. pimpinellifolium.
S. habrochaites presenta pétalos de mayor longitud, mientras que los más pequeños se encuentran en S. neorickii, que a su vez posee los sépalos más pequeños, al igual que S. pimpinellifolium, ya que el resto los duplican en tamaño.
S. pimpinellifolium presenta la primera inflorescencia a menor altura con respecto al suelo, en relación al resto de especies, sin embargo S. habrochaites la presenta al doble de altura. La inflorescencia de estas dos especies es también más larga y muestran el más alto número de flores por inflorescencia, en contraste con las variedades cultivadas que presentan valores menores.
S. neorickii y S. pimpinellifolium producen la mayor cantidad de inflorescencias por planta y se diferencian significativamente de las variedades cultivadas, quienes producen una cantidad reducida tanto de flores por inflorescencia como de frutos por racimo. Sin embargo, S. habrochaites presenta el doble de frutos por racimo, en relación a las dos especies silvestres antes mencionadas.
Las variables para caracterizar morfológicamente el tamaño del fruto y el rendimiento, muestran diferencias no significativas entre S. habrochaites y S. pimpinellifolium, mientras que el resto de las especies son diferentes. El diámetro del fruto, varía significativamente en todas las especies.
La matriz de correlación generada por comparación de las medias de las variables cuantitativas, muestra que las variables que caracterizan la hoja (ancho de la hoja, longitud del nervio principal, longitud del pecíolo) están alta y significativamente correlacionadas, al igual que aquellas que caracterizan el fruto (número de lóculos, longitud del fruto, diámetro del fruto, peso de frutos en campo, número de flores por planta). Sin embargo, las variables cuantitativas que caracterizan la planta en general (altura de la planta, diámetro del tallo principal), muestran muy baja correlación con aquellas que caracterizan la hoja y la inflorescencia (longitud de la nervadura principal, longitud del peciolo, longitud de sépalos, altura a la primera inflorescencia). De igual manera, las variables que caracterizaron la hoja (ancho de la hoja, longitud del nervio principal, longitud de peciolo), están correlacionadas con valores bajos, respecto de aquellas que caracterizaron la inflorescencia, el fruto y el rendimiento (longitud de la inflorescencia, número de frutos por planta, número de lóculos, longitud del fruto, diámetro del fruto, número de frutos por inflorescencia, número de frutos por planta, número de frutos por racimo, peso promedio de 20 frutos).
Los caracteres no correlacionados fueron: longitud de la inflorescencia y altura a la primera inflorescencia; y, los correlacionados con un valor inferior a 0.7 fueron: diámetro del tallo principal, distancia de entrenudos, número de flores por inflorescencia, número de inflorescencias por planta, longitud de sépalos, longitud de pétalos, número de frutos por racimo, número de lóculos por fruto. Las relaciones entre las especies, construidas con las variables no correlacionadas se muestran en la figura 1 (A y B).
Los análisis de componentes y coordenadas principales, realizados con la media de los medios hermanos para los datos cuantitativos (figura 1, A y B) separaron únicamente a S. habrochaites, el cual forma un conglomerado bien diferenciado, mientras que las especies restantes se encuentran muy relacionadas morfológicamente.
Caracteres cualitativos
De un total de 24 variables cualitativas analizadas, siete de ellas fueron monomórficas para todas las especies silvestres y las variedades cultivadas; así, todas presentaron la base de la hoja en forma abierta, el ápice de la hoja en forma aguda, tanto la disposición de sépalos como de pétalos fue gamosépala, la disposición del ovario súpero, todos los frutos inmaduros fueron de color verde claro; y, la cicatriz peduncular se observó siempre tapada por el cáliz.
Para las variables cualitativas restantes que presentaron diferentes categorías, se calcularon sus frecuencias relativas para cada una de las especies, así como se estimó el valor de chi cuadrado (X2) y su probabilidad, los cuales resultaron diferentes para todas las variables (tabla 3).
Las variedades cultivadas (S. lycopersicum) presentan un tipo de crecimiento determinado, y en menor frecuencia lo presenta también S. lycopersicum var. cerasiforme, mientras que el resto de especies silvestres, son de tipo indeterminado.
S. neorickii y S. lycopersicum presentan el follaje más pequeño, mientras que todas las plantas de S. habrochaites se destacaron por presentar follaje grande.
Todas las especies mostraron el borde de la hoja dentado y el color de la hoja verde intenso, mientras que la variedad cerasiforme y la mayoría de S. pimpinellifolium tienen el borde entero (85 %) y color verde claro (100 %).
En general, todas las especies presentan un tipo de ramificación de la inflorescencia simple, diferenciándose únicamente S. habrochaites con su inflorescencia de tipo bifurcada y su pistilo exerto, mientras que las especies restantes presentan pistilos insertos.
En las especies silvestres se encuentran más frecuentemente frutos con forma redonda, tanto en el corte transversal como en el longitudinal, mientras que S. lycopersicum es de forma redonda y alargada y S. lycopersicum var. cerasiforme redonda y aplastada.
Todos los frutos maduros de S. lycopersicum y S. pimpinellifolium son rojos, mientras que el color naranja lo presentan con mayor frecuencia S. lycopersicum var. cerasiforme. Los frutos maduros de S. habrochaites y S. neorickii son de color verde claro, al igual que su pulpa.
La intensidad de hombros y acostillado de los frutos de S. lycopersicum es media, en S. lycopersicum var. cerasiforme ligera; y, el resto de especies silvestres mostraron ausencia para éstas dos variables.
La cicatriz estilar apenas se nota en S. neorickii, S. habrochaites y S. pimpinellifolium, mientras que en las restantes se aprecia claramente.
Finalmente los áfidos estuvieron presentes en todas las plantas de todas las especies, presentándose en menor frecuencia únicamente en S. lycopersicum var. cerasiforme (30,26 % de las plantas).
Prodiplosis longifila (liendrilla) y Oidium lycopersicum (oidio) no estuvieron presentes en S. neorickii ni S. lycopersicum. Sin embargo todas las plantas de S. habrochaites y S. pimpinellifolium estuvieron infectadas.
S. lycopersicum y las especies silvestres S. lycopersicum var. cerasiforme, y S. neorickii no presentaron incidencia de Fusarium sp. ni Meloidogyne sp.; sin embargo todas las plantas de S. habrochaites y S. pimpinellifolium fueron infectadas por los dos patógenos.
Las relaciones entre las especies, construidas sobre la base de presencia y ausencia de las variables cualitativas analizadas mediante componentes principales, separa dos especies del resto: S. habrochaites y S. pimpinellifolium y se muestran en la figura 1 (C).
Evaluación de la resistencia a Fusarium oxysporum
Con las plantas colectadas con síntomas de la enfermedad, provenientes de cinco localidades de la provincia de Loja, se realizaron dos aislamientos por sector, para un total de diez. Todos los aislados fueron identificados dentro del género Fusarium, especie oxysporum, en base a sus características coloniales a nivel macroscópico (forma del micelio y color) y microscópico (morfología de conidias) (figura 2).
A nivel macroscópico, el micelio joven presentó un aspecto transparente incoloro, posteriormente tornó hacia un color crema; y, finalmente adquirió una tonalidad púrpura, acorde a lo descrito por Agrios (2007).
Con la inoculación por inyección, los primeros síntomas observables se presentaron 15 días post inoculación; de forma generalizada para las cinco especies se inició con un leve marchitamiento, seguido de amarillamiento en las hojas bajeras, hasta que alrededor del día 32 se produjo una ligera defoliación de las hojas más bajas, acompañada de marchitamiento generalizado de la planta en las horas más calurosas, recuperándose lentamente hacia el final del día, sin producir la muerte de ninguna planta.
Además de los síntomas antes mencionados, algunas plantas presentaron un halo oscuro en la zona de inyección; sin embargo ninguna de ellas llegó a morir, categorizándose en total como resistentes el 47 % de las plantas y como tolerantes el 53 %. A nivel de especie, S. habrochaites presentó la mayor cantidad de plantas resistentes (133 entre 209 plantas), S. neorickii de plantas tolerantes (48 entre 76); mientras que por el contrario, las variedades cultivadas de S. lycopersicum fueron las menos resistentes (13 entre 77 plantas).
Con la inoculación por inmersión, los primeros síntomas se observaron a partir del día 10 posterior a la inoculación, con similar sintomatología a la descrita anteriormente; sin embargo a partir del día 17, un elevado número de plantas desarrolló síntomas de mayor gravedad. Se observaron chancros a nivel de cuello y raíz principal, contabilizando el 57,8% de plantas susceptibles que terminaron muriendo, y, el 34,2 % resistentes; las restantes se categorizaron como tolerantes. A nivel de especie, la mayoría de las plantas de S. lycopersicum fueron susceptibles (66 entre 77 plantas), mientras que la mayor resistencia se observó en S. habrochaites (150 entre 209 plantas).
Para la inoculación bajo hidroponía, entre los 5 y 8 días posteriores a la inoculación, se observaron los primeros síntomas que incluyeron marchitez y amarillamiento generalizados. Estos aumentaron exponencialmente, hasta que finalmente entre los días 12 y 20 se produjo la muerte de la mayoría de plantas.
La reacción de la patogenicidad fue rápida para éste método, en el que se produjo una generalizada colonización del hospedante en los haces vasculares del hospedero, que llevó a la obstrucción del xilema, necrosis a nivel de cuello y muerte de las plantas.
El 78,9 % del total de las plantas fueron susceptibles, mientras que el 13,7 % resultaron tolerantes y solamente el 7,4% fueron resistentes. La mayor frecuencia de plantas resistentes resultaron pertenecer a S. pimpinellifolium (16 entre 147 plantas), S. lycopersicum var. cerasiforme (26 entre 242) y S. neorickii (8 entre 76 plantas), mientras que ninguna planta de S. lycopersicum sobrevivió. La mayor frecuencia de plantas tolerantes correspondieron a S. neorickii y S. habrochaites (16 entre 76 y 44 entre 209 plantas, respectivamente).
Por lo antes mencionado, el método hidropónico fue más eficaz y rápido y por tanto el más adecuado para la evaluación de material vegetal a la patogenicidad de Fusarium oxysporum.
A nivel de especie, entre el 68 y el 78 % de las plantas pertenecientes a las especies silvestres fueron susceptibles, sin embargo las variedades cultivadas resultaron susceptibles en un 97,4 %, las cuales terminaron muriendo en su totalidad (tabla 4).
Las frecuencias más altas y a su vez similares de plantas resistentes se observaron en S. lycopersicum var. cerasiforme, S. neorickii y S. pimpinellifolium. De igual manera, comparten frecuencias de plantas más tolerantes S. habrochaites y S. neorickii (tabla 4).
Las colectas de S. lycopersicum var. cerasiforme de Loja y de Ica (Perú) presentaron mortalidad en todas las plantas, mientras que las de Morona Santiago resultaron ser las más resistentes.
En cuanto a las colectas de S. pimpinellifolium, Carchi y Esmeraldas fueron en su totalidad susceptibles, mientras que las colectas peruanas, seguidas de Imbabura y Manabí resultaron más frecuentemente resistentes. Las plantas de Galápagos fueron las más tolerantes (tabla 5).
Discusión
Todas las especies silvestres de tomate son nativas del oeste de Sur América y están distribuidas desde Ecuador central, a través del Perú hasta el Norte de Chile, incluyendo las Islas Galápagos (Darwin et al., 2003). Estas plantas crecen en una gran variedad de hábitats, desde el nivel del mar en la costa árida del Pacífico, hasta sobre los 3300 msnm en numerosos valles del lado oeste de los Andes (Rick 1973; Taylor 1986).
El Centro de Biotecnología de la Universidad Nacional de Loja, en colaboración con el Parque Nacional de Galápagos, la Universidad Nacional de Piura, la Universidad Nacional Pedro Ruiz Gallo (Lambayeque, Perú), y el Instituto de Conservación y Mejora de la Agrodiversidad Valenciana (COMAV), ejecutaron varias colectas de especies silvestres del genero Solanum, desde su hábitat natural. Esta colección incluye una gran cantidad de accesiones ecuatorianas, que han sido tradicionalmente subrepresentadas en estudios previos Rick et al., (1977); Caicedo y Schaal (2004); Sifres et al., (2010) y que han mostrado diferencia en relación a las accesiones colectadas en territorio peruano (Zuriaga et al., 2009).
El presente trabajo incluyó entre 76 y 228 individuos de cada una de las cuatro especies silvestres colectadas en su hábitat natural en territorio ecuatoriano, cuya caracterización morfológica permitió examinar la variabilidad existente entre las especies analizadas. Se detectaron diferencias fenotípicas relacionadas con el fruto, el rendimiento, y las características vegetativas de las plantas.
Las variables morfológicas, muestran que S. habrochaites es la especie más diferenciada con relación a las otras analizadas. Dicha especie desarrolla plantas más altas, con mayor follaje, distancias de entrenudos más largas, el doble de altura a la primera inflorescencia y más del doble de ramificaciones. Las plantas de esta especie producen inflorescencias más largas, con mayor cantidad de flores por inflorescencia, frutos por racimo y de frutos por planta. Estos resultados son concordantes con los reportados por Peralta et al. (2008), quienes señalan que esta especie es fácil de distinguir del resto de las especies silvestres de tomate. Plantas más altas, muy robustas y pubescentes caracterizan a S. habrochaites (Peralta y Spooner 2005).
S. neorickii produce un alto número de frutos por planta (segundo después de S. habrochaites), sin embargo el peso total de los frutos por planta es el menor de todos, debido a que su fruto es el más pequeño, así como también su follaje, hojas y flores. Los resultados antes mencionados son coincidentes con la caracterización previa de la especie en que se informa que en general S. neorickii puede ser reconocido por sus pequeñas flores e inflorescencias y por su alto número de flores y plantas menos robustas Peralta et al. (2008), presentando las partes florales más pequeñas y estigmas incluidos en el tubo de la antera (Peralta y Spooner 2005).
Las variedades cultivadas (S. lycopersicum) presentan un tipo de crecimiento determinado, y en menor frecuencia lo presenta también S. lycopersicum var. cerasiforme, mientras que el resto de especies silvestres, son de tipo indeterminado, situación que coincide con lo previamente descrito por Nuez (1995), para estas especies silvestres.
S. lycopersicum y S. pimpinellifolium están estrechamente relacionadas, sugiriendo un reciente origen y rápida diferenciación morfológica (Peralta y Spooner 2001). S. pimpinellifolium puede ser diferenciada por el tipo de flor (Darwin et al., 2003). En los individuos analizados, los pétalos de S. pimpinellifolium tienen la misma longitud que los de S. lycopersicum, sin embargo los sépalos tienen la mitad de longitud al igual que las de sus congenéricas silvestres, variable que permite diferenciar la especie.
Un estudio de accesiones peruanas encuentra que S. pimpinellifolium está muy estrechamente relacionada con S. lycopersicum, con la cual hibrida libremente y su identificación puede ser problemática debida a la introgresión mutua de genes, lo cual requiere el uso de caracteres diagnóstico para identificar a S. pimpinellifolium (Peralta et al., 2008). Sin embargo, las poblaciones autógamas de S. pimpinellifolium tienen flores más pequeñas que aquellas alógamas, producto de entrecruzamiento (Georgiady y Lord 2002). Los genotipos alógamos de S. habrochaites, S. pennellii, y S. pimpinellifolium, también despliegan caracteres de atracción para la polinización. Corolas más largas, amarillo brillante, anteras curvadas y asimétricas y estilos exertos son características que probablemente se correlacionan con las altas tasas de cruzamiento interespecífico encontrado en S. peruvianum (Rick et al., 1977).
Las variables morfológicas cuantitativas permiten en general diferenciar las especies más eficazmente que las variables cualitativas, no obstante la importancia de aquellas relacionadas con el tamaño y color del fruto, así como el tamaño y posición de los componentes florales Garzón (2011), que constituyen el primer medio para definir la especie en campo.
En este estudio se ratificó la resistencia, tolerancia o susceptibilidad a F. oxysporum de cada una de las plantas, mediante tres procedimientos distintos.
La inoculación por inyección a la planta con suspensión conidial, producto del aislamiento y masificación del hongo causó una leve sintomatología y ninguna mortalidad, sin embargo esto es en extremo inconcebible, dada la agresividad del hongo, quien en estado de plántula causa la muerte masiva de individuos. La pérdida de la virulencia del patógeno por el proceso de aislamiento pudo haber sido la causa principal, agravada por la falta de condiciones climáticas para el desarrollo del hongo, ya que las plantas se mantuvieron en baldes plásticos a cielo abierto. En general, con este método se observaron marchitez, amarillamiento y decoloración del xilema. Resultados similares reporta Velásquez et al. (2002) en un estudio realizado en frijol (Phaseolus vulgaris) inoculado con F. oxysporum f. sp. phaseoli, atribuyéndole tales síntomas a la variación de temperatura entre el suelo (16-26 °C) y la del aire (21-32 °C), cuya oscilación pudo haber afectado la expresión de síntomas, así como la extensión de la decoloración del xilema.
En los otros dos métodos de inoculación ensayados no se empleó el hongo aislado, y de esta forma se descartó la posibilidad de pérdida de virulencia del patógeno. El macerado de raíces de plantas con síntomas de la enfermedad provenientes de campos infestados, causaron la muerte de un considerable número de plantas, tanto por el método de inmersión como el de hidroponía. Sintomatología similar se ha observado en tabaco (Nicotiana tabacum) inoculado con F. oxysporum f. sp. nicotinae, en las que los síntomas de marchitez, amarillamiento y muerte eventual de hojas se asociaron con el rápido movimiento del hongo a través de la planta Mueller y Morgham (1996), de manera que la expresión de síntomas foliares estuvo relacionada con la infección de los pecíolos (Gao et al., 1995).
La inoculación en condiciones de hidroponía sirvió para confirmar los resultados, ya que permitió incluir los 723 individuos al mismo tiempo en las mismas condiciones estrictamente controladas para el desarrollo del hongo. El inóculo en estas condiciones, presenta un micelio con los cuerpos fructíferos del hongo Carrillo (2003) y su desarrollo e infección se garantiza con las condiciones controladas específicamente para ello.
La caracterización morfológica de los aislados de las plantas muertas provenientes de los métodos evaluados, fueron coincidentes con las estructuras morfológicas de Fusarium oxysporum, tanto en el laboratorio de fisiología vegetal de la UNL, como en el laboratorio de AGROCALIDAD, lo cual garantizó que la muerte de las plantas fue producida por el hongo en cuestión. Según Obreque y Mabel (2004), el color de las colonias en medio PDA varía a medida que el cultivo envejece, así, en los cultivos jóvenes una tonalidad rosa pálida, y los más envejecidos con una coloración púrpura, estos se presentan coincidente con lo observado en este estudio.
En todos los casos, a nivel microscópico se observaron microconidias con su forma redonda típica, constituidas por una o dos células; y, las macroconidias en forma de media luna, integradas por tres a cinco células, coincidentes con las claves taxonómicas de Barnet y Hunter (1972) y con lo descrito por Agrios (1998), para estructuras propias de F. oxysporum. Tales circunstancias permitieron determinar sin lugar a dudas, que las plantas sobrevivientes y tolerantes poseen un genotipo particular que determina esa característica.
Todas las especies fueron significativamente diferentes en los niveles de resistencia, tolerancia o susceptibilidad al hongo, observándose una mortalidad generalizada. Sin embargo, S. habrochaites y S. neorickii presentaron mayor frecuencia de plantas tolerantes, respecto de las especies restantes.
En el estudio se consideraron entre 2 y 7 individuos de una misma accesión (medios hermanos), de los cuales la mayoría murieron durante los tres primeros días, otros resistieron al ataque del parásito y después de 20 días murieron; y, finalmente una gran minoría venció el poder patógeno de F. oxysporum, presentando gran vitalidad a los 20 días post inoculación. Esta situación es consistente en el caso de un carácter controlado por varios genes donde cada uno de ellos tiene una función, sea complementaria o diferente, pero cada uno aportando a la tolerancia o a la resistencia; favorecida por la alogamia que presentan las especies silvestres, lo cual genera una alta heterocigosidad y por tanto genes en segregación entre los medios hermanos.
Esta situación nos permite plantear la hipótesis de que hay varios genes responsables de la resistencia a F. oxysporum y a sus distintas razas fisiológicas, las cuales actualmente no están bien determinadas en el caso de Ecuador, donde su condición topográfica y variados climas, permiten seleccionar nuevas mutaciones en los seres vivos, incluyendo los parásitos. Sería necesario en el futuro definir cuáles son esos genes de resistencia y cuáles los genes del patógeno que están en juego.
Conclusiones
Los caracteres morfológicos cuantitativos y cualitativos analizados en las especies Solanum pimpinellifolium, S. neorickii, S. habrochaites, S. lycopersicum var. cerasiforme en su conjunto, sólo diferencian a la especie S. habrochaites.
Entre las especies evaluadas la más resistente y tolerante a Fusarium oxysporum fue Solanum neorickii, seguida de S. pimpinellifolium, y S. lycopersicum var. cerasiforme. Todas las accesiones de las variedades cultivadas (S. lycopersicum) fueron susceptibles a Fusarium oxysporum.
Recomendación
Se recomienda el empleo de marcadores moleculares para comparar las especies silvestres de tomate Solanum pimpinellifolium, S. neorickii, S. habrochaites, S. lycopersicum var. cerasiforme.
Se recomienda el empleo de Solanum neorickii como progenitor, para programas de cruzamiento interespecíficos, que permitan la generación y selección de híbridos con resistencia y tolerancia a Fusarium oxysporum.
Referencias bibliográficas
1 Agrios, G.N. 1998. Fitopatología. México D.F: Limusa, p. 67-91, 93-107, 109-125, 425 - 427, 444. [ Links ]
2 Agrios, G.N. 2007. Plant Pathology, 5e. San Diego, California, Elsevier (A Division of Reed Elsevier India Pvt. Limited): Academic Press. p. 238. [ Links ]
3 Barnet, H.L., y Hunter, B.B. 1972. Illustrated Genera of Imperfect Fungi. Burguess Publishing Company. Minneapolis. Minnesota, USA. p. 241. [ Links ]
4 Bernal, H; Correa, J. 1990. Especies promisorias vegetales de los países del Convenio Andrés Bello. Tomo IV. SECAB Ciencia y Tecnología. pp. 149-322. [ Links ]
5 Bosland, P.1988. Fusarium oxysporum a pathogen of many plant species. Advances in plant pathology. 6: 281-289. [ Links ]
6 Caicedo, A.L. Schaal, B.A. 2004. Heterogeneous evolutionary processes affect R gene diversity in natural populations of Solanum pimpinellifolium. Proc. Natl. Acad. Sci. 101: 17444-17449. [ Links ]
7 Carrillo L. 2003. Los hongos de los alimentos y forrajes. Universidad Nacional de Salta ISBN 987-9381-19. [ Links ]
8 Darwin C. S.; Knapp S.; Peralta E. I. 2003. Taxonomy of tomatoes in the Galápagos Islands: native and introduced species of Solanum section Lycopersicon (Solanaceae). Systematics and Biodiversity. 1 (1): 29-53. [ Links ]
9 Gao, H.; Beckman, C.H.; Mueller, W. C. 1995. The rale of vascular colonization as a measure of the genotypic interaction between various cultivars of tomato and various former or races of Fusarium oxysporum. Physiological and Molecular Plant Pathology. 46: 29-43. [ Links ]
10 Garzón, J.P. 2011. Caracterización y evaluación morfoagronómica de la colección de tomate tipo cherry de la Universidad Nacional de Colombia sede Palmira. Tesis Magister en Ciencias Agrarias. Facultad de Ciencias Agropecuarias. Universidad Nacional de Colombia. Palmira. 35-4456. [ Links ]
11 Georgiady, M. S. y Lord, M. 2002. Evolution of the inbread form in the currant tomato, Lycopersicon pimpinellifolium. Int. J. Plant Sci. 163: 531-541. [ Links ]
12 Hammer, O., D. A. T. Harper y P. D. Ryan. 2007. PAST- Paleontological Statistics software package. ver. 1.75. [ Links ]
13 Hartman, J.R.; Fletcher, J.J. 1991. Fusarium crown and root rot of tomatoes in the U.K. Plant Phathology. 40:85-92. [ Links ]
14 INIAP. 2001. Proyecto diagnóstico, biotecnología y manejo sostenible de la negrita Prodiplosis longifila en el Ecuador. Informe anual. Convenio. INIAP-PROMSA - CEDEGE. Departamento Nacional de protección vegetal. Sección Entomología. Estación Experimental Portoviejo. Ecuador. p. 13. [ Links ]
15 Jarvis, W.R. 1988. Fusarium crown and root rot of tomatoes. Phytoprotection. 69:49-64. [ Links ]
16 Leslie, J.F., Summerell, B.A. 2006. The Fusarium laboratory manual. Blackwell Publishing: Iowa, USA. [ Links ]
17 Mueller, W.C.; Morgham, A.T. 1996. Ultrastructure of the vascular responses of tobaco to Fusarium oxysporum f. sp. nicotianae. Canadian Journal of Botany.74: 1273-1278. [ Links ]
18 Nelson, P.E., Digman, M.C., y Anaissie, E.J. 1994. Taxonomy, Biology, and Clinical Aspects of Fusarium Species. Clinical Microbiology Reviews. 7: 479-504. [ Links ]
19 Nuez, F.1995. El Cultivo del Tomate, obra colectiva. España. Ediciones Mundi Prensa, p. 27-28, 65-67. [ Links ]
20 Obreque D., Mabel X. 2004. Evaluación de aplicaciones preinfección del fungicida Benomilo y del Bicontrolador Trichoderma harzianum en el control de Fusarium sp. en proteáceas. Universidad de Talca-Chile. p. 96. [ Links ]
21 Okiror, M.A. 1998. Screening techniques for Fusarium wilt of pigeon pea. African Crop Science Journal. 1021-9730, p. 345-350. [ Links ]
22 Peralta, I.; Spooner, D.M. 2001. Granule-bound starch synthase (GBSSI) gene phylogeny of wild tomatoes (Solanum L. section Lycopersicon [Mill.] Wettst. Subsection Lycopersicon). American Journal of Botany. 88: 1888-1902. [ Links ]
23 Peralta, I.E. y Spooner, D.M. 2005.Morphological characterization and relationships of wild tomatoes (Solanum L. section Lycopersicon) Monogr. Syst. Bot. Missouri Bot Gard. 104: 227-257. [ Links ]
24 Peralta, I.E., Knapp, S. y Spooner, D.M. 2006. (en línea). Nomenclature for wild and cultivated tomatoes (Vol. 26). University of Wisconsin. http://ddr.nal.usda.gov/bitstream/10113/2773/1/IND43943768 (consulta: 18 de noviembre 2012). [ Links ]
25 Peralta, I.E.; Spooner, D.M. y Napp, S. 2008. The Taxonomy of tomatoes: a revision of wild tomatoes (Solanum L. section lycopersicon) and their outgroup relatives in sections juglandifolium and lycopersicoides. Syst. Bot. Monogr. 84: 1-186. [ Links ]
26 Puhalla, J.E. 1985. Classification of strains of Fusarium oxysporum on the basis of vegetative compatibility. Canadian Journal of Phytopathology. 63: 179-183. [ Links ]
27 Rick, C.M. 1973. Potential genetic resources in tomato species: Clues from observations in native habitats. Genes, Enzymes, and Populations. Plenum, New York, pp. 255-269. [ Links ]
28 Rick, C.M., Fobes, J.F. y Holle, M. 1977. Genetic variation in Lycopersicon pimpinellifolium: Evidence of evolutionary change in mating systems. Plant Systematics and Evol. 127: 139-170. [ Links ]
29 Rick, C.M. 1983. Genetic variation and evolution of Galápagos tomatoes. In Bowman, R.I., Berson, M. & Leviton, A.E. (eds), Patterns of Evolution in Galápagos Organisms. Pacific Division, AAAS, San Francisco, California. pp. 97-106. [ Links ]
30 Sifres, A.; Blanca, J. y Nuez, F. 2010. Pattern of genetic variability of Solanum habrochaites in its natural area of distribution. Genetic Resources and Crop Evolution. 58:347-360 [ Links ]
31 Taylor, I. B. 1986. Biosystematics of the tomato. The Tomato Crop: A Scientific Basis for Improvement. Chapman and Hall. pp. 1-34. [ Links ]
32 Valarezo, O. E. 2002. Recomendaciones para el manejo de la negrita en el tomate en el Ecuador. Convenio INIAP-PROMSA-CEDEGE. Departamento Nacional de protección vegetal. Sección Entomología. Estación Experimental Portoviejo-Ec., 2002. Plegable divulgativo. 191. [ Links ]
33 Velásquez V. R.; Medina A. M.; Schwartz, H. 2002. Expresión de síntomas y decoloración vascular en líneas de fréjol inoculadas con aislamientos de Fusarium oxysporum f. sp. phaseoli de diferente origen geográfico. Revista Mexicana de Fitopatología. Vol. 20: 1, p. 8-11. [ Links ]
34 Zaykin, D. V., and A. I. Pudovkin. 1993. 2 Programs to Estimate Significance of Chi-2 Values Using Pseudo-Probability Tests. J. Hered. 84:152-152 [ Links ]
35 Zuriaga, E.; Blanca J.M.; Cordero, L.; Sifres, A.; Blas-Cerdán W.G.; Morales, R. y Nuez, F. 2009. Genetic and bioclimatic variation in Solanum pimpinellifollium. Genetic Resources and Crop Evolution. 56:39-51. [ Links ]