INTRODUCCIÓN
Las medusas son organismos marinos que tienen un gran potencial para su uso en acuicultura y acuarifilia (Merquiol et al. 2019). Son organismos con ciclo de vida relativamente corto y con requerimientos básicos para su mantenimiento, lo que las hace ideales para su estudio y cría (Duarte et al. 2022). Por lo tanto, estos organismos se utilizan como modelos biológicos en una gran variedad de campos, incluyendo, la biomedicina, la cosmética y la farmacología (Duarte et al. 2022). Las toxinas de estos organismos se almacenan en los nematocistos, que contienen una variedad de compuestos bioactivos con potencial para su uso en el tratamiento de enfermedades (Merquiol et al. 2019).
Las medusas del género Lychnorhiza aff. lucerna hacen parte del orden Rhizostomeae, son organismos que carecen de tentáculos, y poseen una boca central, ocho brazos orales con múltiples aberturas bucales y una cavidad gastrovascular en forma de cruz (Kramp, 1961). La familia Lychnorhizidae se encuentra constituida por tres géneros, Anomalorhiza Light, 1921, registrada para las costas de Filipinas, Pseudorhiza von Lendenfeld, 1882, para el sur de Australia y Lychnorhiza Haeckel, 1880, que se reporta para el archipiélago Indo-Malayo, Uruguay, Brasil, Argentina y Colombia (Cedeño-Posso & Lecompte, 2013). Actualmente, se registran tres especies para el género: L. malayensis, L. arubae y L. lucerna. En la costa Caribe de Colombia, específicamente, en el departamento del Magdalena, se ha registrado la presencia de la medusa Lychnorhiza aff. lucerna. En los últimos años, los pescadores artesanales han presenciado afloramientos de esta especie, que pueden afectar sus labores de pesca y la afluencia turística de la región (Cedeño-Posso & Lecompte, 2013).
L. aff. lucerna se presenta durante todo el año y los aumentos repentinos en sus poblaciones pueden ocasionar cambios en la estructura de los ecosistemas (Arai, 1997; Bosch-Belmar et al. 2020); por ejemplo, disminuyen algunas poblaciones de peces, afectando directamente los niveles tróficos superiores (Purcell & Sturdevant, 2001; Bosch-Belmar et al. 2020). No se conocen las causas precisas de estos afloramientos, pero se especula que pueden estar asociados con el cambio climático global, tal como ocurre con otras especies de medusas (Dong, 2019).
El mantenimiento y reproducción en cautiverio de las medusas puede proporcionar información base para entender la ecología y biología de estos organismos, así como, información que permita entender las dinámicas que influyen en el crecimiento de sus poblaciones. En general, las medusas son difíciles de mantener en cautiverio, pero, se han hecho avances significativos en los últimos años, por lo esta es un área de investigación emergente. El mantenimiento de las medusas tiene el potencial de proporcionar una fuente sostenible de estos organismos para su uso en investigación y aplicaciones comerciales (Purcell et al. 2013). Mantener la medusa Lychnorhiza aff. lucerna en condiciones de laboratorio sigue siendo un desafío, debido a que es necesario satisfacer sus requerimientos nutricionales y replicar las condiciones de su hábitat (Ramondenc et al. 2019).
El sistema para el mantenimiento en cautiverio puede inhibir el crecimiento y el desarrollo de las medusas, por lo que es importante tener el flujo de agua constante y a baja velocidad, para evitar fricciones con las superficies del acuario (Purcell et al. 2013). Actualmente, los sistemas para el mantenimiento de las medusas en cautiverio se basan en tanques Kreisel (Greve, 1968), que mantienen a los organismos en suspensión en la columna de agua, gracias a corrientes circulares (Widmer, 2008), pero la forma de los contenedores se modifica de acuerdo con la especie criada. En el caso de Lychnorhiza aff. lucerna por su mecanismo de captura de las presas que son atrapadas por los cnidocitos presentes en la cavidad gastrovascular, los requerimientos funcionales de los acuarios son menores (Arai, 1997).
Son pocos los estudios centrados en la biología reproductiva, la alimentación y el mantenimiento en cautiverio de otras especies de medusas. Cargo et al. (1980) observaron la reproducción asexual del escifistoma de la medusa Chrysaora quinquecirrha, encontrando que, a bajas temperaturas alrededor de los 18 °C se generaban nuevos pólipos y al elevar las temperaturas, estos pólipos fueron inducidos a la estrobilación. Avian (1986) realizó experimentos in vitro del desarrollo de las etapas reproductivas y la fertilización de Pelagia noctiluca, encontrando que la temperatura afecta el desarrollo de este organismo, el cual, disminuye a temperaturas cercanas a los 14 °C en comparación con pruebas a 19 °C. Lucas & Lawes (1998) estudiaron la reproducción sexual del escifozoo Aurelia aurita en relación con la temperatura y la alimentación, encontrando que estas dos variables influían en las características y estrategias reproductivas, además, evidenciaron que la variación en la calidad y cantidad de huevos depende de factores genéticos.
Por otro lado, se han realizado experimentos de inducción a la reproducción en la especie L. lucerna, en donde se sometieron a una disminución de la temperatura de 22 a 16 (Schiariti et al. 2008). En general, las diferentes etapas de vida de las medusas se mantienen con diferentes organismos, como Artemia sp. copépodos y microalgas (Schiariti et al. 2008).
En la presente investigación se evaluó la viabilidad de la reproducción y mantenimiento en cautiverio de la medusa Lychnorhiza aff. lucerna, para establecer los protocolos básicos de mantenimiento y reproducción de estos organismos.
MATERIALES Y MÉTODOS
Se recolectaron ejemplares de la medusa Lychnorhiza aff. lucerna en la Isla de Salamanca, en el municipio de Puebloviejo (departamento de Magdalena), ubicado en 10º59'05'' N, 74º18'16'' O. La porción costera de la Isla de Salamanca se comunica directamente con la gran marisma “Ciénaga Grande de Santa Marta”.
Se seleccionaron medusas maduras con un diámetro de la umbrela entre 10 y 14 cm y con gónadas de coloración naranja y verde, para aumentar la probabilidad de elegir hembras y machos, respectivamente (Schiariti et al. 2008). Los especímenes fueron rápidamente transportados en contenedores con agua de mar y refrigerados con bolsas de hielo a 20 °C hasta las instalaciones del laboratorio de acuicultura de la Universidad del Magdalena. Una vez en el laboratorio, se midieron y pesaron; el sexo se determinó mediante biopsias de tejido gonadal, analizadas al microscopio (Schiariti et al. 2008). Se tomaron medidas del diámetro y la altura de la umbrela una vez a la semana, para monitorear el crecimiento (Acevedo et al. 2013).
Se ensayaron dos metodologías para llevar a cabo la fecundación: 1) Método in vitro: porciones de gónadas de hembras y machos, lavadas con agua de mar microfiltrada, fueron mezcladas en cajas de Petri, con el fondo previamente recubierto con agar-agar y conteniendo agua de mar microfiltrada y autoclavada (Schiariti et al. 2008), 2) Método de incubación: porciones de gónadas fueron colocadas directamente en contenedores de 500 ml, con agua de mar microfiltrada y con aireación moderada (Schiariti et al. 2008). En los dos métodos se mantuvieron a la temperatura y salinidad registradas en la zona de estudio al momento de la captura (27 °C y 30 de salinidad). Ambos métodos fueron monitoreados cada 2 horas.
Por otro lado, las medusas se mantuvieron en tres acuarios (100 L), con dimensiones de 90x90x30 cm (Hamner et al. 1995). Dentro de cada acuario, se instaló una lámina circular de acrílico de 10 mm de espesor y un tubo horizontal, con orificios, conectado al sistema de bombeo, con la finalidad de generar un flujo de agua laminar, lento y circular (Hamner et al. 1995). Un sistema de circulación secundario se ubicó en el fondo del acuario, dentro de un espacio separado de la cámara principal por medio de una lámina acrílica de 5 mm de espesor, con un orificio de 50 mm y protegida con una malla de 500 μm, para evitar la succión de las medusas. Un sistema de filtración se ubicó junto a los acuarios para ayudar a eliminar las impurezas en el cultivo, como restos de comida, heces y material orgánico (Acevedo et al. 2013). Los parámetros fisicoquímicos del agua, temperatura (°C) y salinidad (UPS) se midieron diariamente, con un refractómetro (Aichose) y un multiparámetro. Las medusas se alimentaron con nauplios de Artemia sp. y microalgas del género Nannochloropsis sp.
RESULTADOS Y DISCUSIÓN
Durante diciembre de 2020 y marzo de 2021 se capturaron 74 medusas maduras. 55 organismos se utilizaron en ensayos de mantenimiento en cautiverio y 19 en ensayos de fecundación in vitro. La talla de todas las medusas capturadas varió entre 45,78 y 120,91 mm de diámetro de la umbrela (media de 77,31 ± 14,95 mm); la longitud de los brazos orales varió entre 47,71 y 179,58 mm (93,79 ± 28,15 mm) (Figura 1)
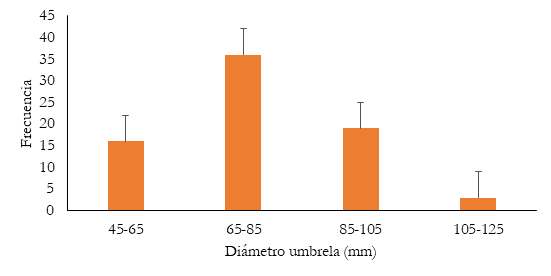
Figura 1 Estructura de tallas del diámetro de la umbrela de la medusa Lychnorhiza aff. lucerna en el sector costero de la Isla de Salamanca, Colombia.
Ensayo de reproducción in vitro de Lychnorhiza aff. lucerna. Como resultado de los ensayos de reproducción in vitro solo se logró comprobar la fecundación con la observación de embriones después del primer clivaje, pero ninguno logró superar este estadio. En ninguno de los cinco ensayos de fertilización in vitro se logró el desarrollo hasta el estado de plánula. En los tres ensayos realizados en cajas de petri, en las primeras 4 horas, la salinidad y la turbidez aumentaron rápidamente, ocasionando la formación de cristales de sal y la destrucción de los huevos sin ser fecundados. En los dos ensayos restantes, que se realizaron en frascos de 500 ml con poca aireación, las condiciones del agua se mantuvieron más constantes y se logró la fecundación, observándose embriones en su primer clivaje holoblástico y otros con clivaje irregular (Figura 2). Sin embargo, en ningún caso, se observaron estados más avanzados de desarrollo.
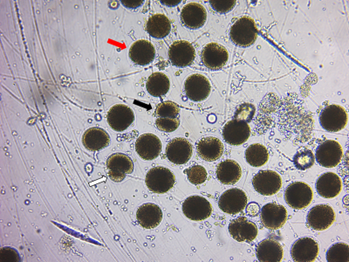
Figura 2 Ensayo de fertilización in vitro de la medusa Lychnorhiza aff. lucerna. Flecha de color rojo indica huevos no fecundados; flecha de color negro indica embriones en etapa de primer clivaje holoblástico; flecha blanca embriones con clivaje irregular.
Ensayo de mantenimiento de Lychnorhiza aff. lucerna. Los especímenes de ambos sexos se mantuvieron en los tanques Kreisel y Pseudo-Kreisel por un período de 60 días. Durante este tiempo, las medusas disminuyeron progresivamente de tamaño, las gónadas, la umbrela y los brazos orales disminuyeron con el tiempo. El diámetro inicial de la umbrela de la medusa estaba entre 65,74 y 100,03mm y al final del período de 60 días, la umbrela disminuyó en más de un 40 % en machos y hembras.
A pesar de esto, los organismos mostraron estar en buenas condiciones y no se evidenciaron deformaciones. Se observó un correcto funcionamiento del sistema de cultivo, debido a que las corrientes de agua permitieron el movimiento de las medusas y la suspensión de estas en la columna de agua, evitando la fricción con las paredes del acuario y el estancamiento. En general, la temperatura y salinidad de los sistemas de acuarios varió entre 25,10 a 28,20 °C (26,24 ± 0,59 °C) y 30,00 a 40,00 UPS (35,58 ± 2,52), respectivamente. Por otro lado, los valores de pH, amoniaco (NH3-NH4+), nitrito (NO2-) y nitrato (NO3) fueron de 8,4, < 0,25, < 0,25 y < 0,40, respectivamente. Finalmente, no se observaron huevos, larvas o pólipos de las medusas cautivas, ni en el sistema, ni en el filtro de depuración de agua.
A nivel mundial, el cultivo de medusas se remonta a 1932 en el viejo continente, esta idea surgió con el objetivo de observar a estos organismos, promover su uso como especies ornamentales y potenciar su uso como modelos científicos (Lange et al. 2016). En Colombia existen pocos trabajos enfocados en este tema y solo existen dos lugares donde se tienen acuarios especializados en medusas, el Parque Explora de la ciudad de Medellín y las instalaciones del Mundo Marino de la Universidad Jorge Tadeo Lozano (Lecompte et al. 2010).
El cultivo de medusas en laboratorio requiere simular las condiciones de los ecosistemas donde viven las medusas. Los sistemas de mantenimiento deben generar corrientes que mantengan a las medusas suspendidas en la columna de agua y sin generar burbujas, debido a que, estas pueden alojarse bajo la umbrela, obligando a las medusas a salir a la superficie. Además, los sistemas no deben tener elementos sólidos dentro del acuario, la calidad del agua debe ser constante y el sistema de filtración del agua debe ser óptimo. Finalmente, una dieta variada de organismos es fundamental para el mantenimiento de las medusas (Raskoff et al. 2003; Purcell et al. 2013), características que se consideraron durante el desarrollo de esta experiencia.
Este estudio se realizó con medusas capturadas entre los meses de enero y marzo, momento, en el cual, las medusas tienen el tamaño promedio de madurez, las gónadas se encuentran visiblemente desarrolladas y la fecundidad relativa es máxima (Schiariti et al. 2008). Aunque las pruebas realizadas no tuvieron éxito, se observaron algunos huevos fertilizados, que indican que el proceso de fertilización es posible. Los mejores resultados se obtuvieron en las pruebas de fertilización utilizando recipientes de 500 ml, ya que es más fácil controlar la salinidad y la temperatura.
Las pruebas de fertilización del presente trabajo se realizaron con base en el trabajo de Schiariti et al. (2008), donde los autores probaron la fertilización manteniendo las condiciones fisicoquímicas de los cultivos como las obtenidas en campo, las cuales estuvieron entre 19-22 °C de temperatura y salinidades de 17 UPS. En el presente estudio, la temperatura y la salinidad estuvieron entre 27,30-34,50 °C y 28,00-36,00 UPS, respectivamente, casi el doble del estudio mencionado anteriormente; el elevado aumento de la salinidad se debió a la rápida evaporación del agua, lo que imposibilitó el correcto desarrollo de los embriones. Se considera que es posible realizar el ciclo de vida de la medusa Lychnorhiza aff. lucerna, manteniendo la salinidad a <20 UPS y la temperatura entre 20-28 °C.
En el presente trabajo se alimentó a la medusa con Artemia sp. y como complemento (suplemento) microalgas del género Nannochloropsis sp.; a pesar de ello, el tamaño de los organismos disminuyó en más de un 30 % en un periodo de 60 días, resultados que difieren con trabajos como el de Lilley et al. (2014) en donde lograron la fecundación in vitro de los huevos de la medusa Pelagia noctiluca y los especímenes fueron mantenidos por aproximadamente dos años, alcanzando un diámetro de umbrela de 0 a 7 cm. Esto, probablemente, se deba a la alimentación, ya que la medusa Pelagia noctiluca se mantuvo con una mezcla de organismos, como copépodos, una mezcla de arrastre de zooplancton y otras especies de medusas.















