Introducción
El cáncer colorrectal es uno de los tipos de cáncer más prevalentes en el mundo, es el tercero en incidencia y el segundo en mortalidad. Una proporción significativa de estos (33 %) corresponde al cáncer de recto, cuya incidencia calculada es de 34 casos por cada 100.000 habitantes en países desarrollados. En Colombia, la incidencia se ha reportado de 10 casos por cada 100.000 habitantes 1. A pesar de los avances en tratamientos como la quimioterapia y la radioterapia, la base fundamental para el manejo del cáncer de recto continúa siendo la cirugía. La escisión mesorrectal total (EMT) ha demostrado ser efectiva en reducir las tasas de recurrencia y mejorar la supervivencia global 2-4.
Históricamente, la resección abdominoperineal (RAP) fue el estándar de manejo, pero los avances en la comprensión de la biología tumoral y la tecnología han impulsado la adopción de la resección anterior baja de recto (RAB) en varios casos, sin encontrar diferencias en desenlaces oncológicos, pero mejorando la calidad de vida de los pacientes 5,6. No obstante, este enfoque también ha llevado al desarrollo del síndrome de resección anterior baja de recto (LARS, por sus siglas en inglés), que se define como una alteración en la función intestinal después de la resección rectal. Su prevalencia oscila entre el 19 y el 52 % según las diferentes series 7-9.
Los síntomas gastrointestinales reportados con mayor frecuencia son incontinencia fecal, aumento de la frecuencia de las deposiciones, urgencia defecatoria, disfunción evacuatoria y alteración en la discriminación entre gases y heces 10.
En el 2012, Emmertsen KJ y Laurberg S 11, idearon y validaron un sistema de puntuación para LARS (denominado LARS score), el cual tiene en cuenta todos estos síntomas, dando a los pacientes un diagnóstico de no LARS, LARS menor o LARS mayor. El LARS mayor se define como una mayor afectación de la calidad de vida del paciente posterior a una RAB. En un estudio retrospectivo en China, que incluyó 100 pacientes sometidos a cirugía preservadora de órgano para cáncer de recto, se concluyó que la historia de radioterapia, la distancia del tumor al margen anal, la distancia de la anastomosis al margen anal y la historia de ileostomía, se asociaron con LARS mayor 12. Aunque el LARS score ha sido validado mundialmente 13-17, hasta la fecha solo Chile ha realizado una adaptación transcultural en América Latina 18. Actualmente, en Colombia no encontramos estudios que identifiquen y caractericen los pacientes con LARS. El objetivo de este estudio fue caracterizar la población con cáncer colorrectal y LARS atendida en nuestra institución a partir de la encuesta LARS.
Métodos
Se realizo un estudio observacional descriptivo de corte transversal con intención analítica. Se incluyeron todos los pacientes con cáncer de recto, llevados a resección anterior baja de recto en el Instituto de Cancerología de la Clínica Las Américas AUNA, en Medellín, Colombia, en el periodo comprendido entre enero de 2016 y diciembre de 2022, con las siguientes características: mayores de 18 años, que hubieran sido diagnosticados con adenocarcinoma de recto, que hubieran sido llevados a resección anterior baja con anastomosis colorrectal o que se les hubiera realizado estoma con posterior cierre de este. Se excluyeron los pacientes con estoma definitivo o necesidad de nueva ostomía posterior.
Se revisaron las historias clínicas de los pacientes (fuente secundaria). A este grupo de pacientes se les aplicó como instrumento el cuestionario LARS score (fuente primaria) entre enero y julio de 2023. El instrumento utilizado fue la adaptación de la versión en español neutro del LARS score, realizada por el grupo de la Unidad de coloproctología del Hospital Clínico Universidad de Chile (Anexo 1) y facilitada por Emmertsen KJ y Laurberg S, quienes aprobaron la utilización de la encuesta. A los pacientes se les aplicó una única vez, la encuesta vía telefónica. En caso de no obtener una respuesta, la encuesta se aplicó de forma presencial a los pacientes que asistieron a su control en la institución, con el fin de atenuar la perdida de información.
El cuestionario consta de 5 preguntas, las cuales incluyen incontinencia a gases, incontinencia a líquidos, frecuencia de las deposiciones, fraccionamiento de y urgencia defecatoria. A cada pregunta se le otorga un puntaje según la respuesta (Anexo 2). El puntaje total puede ir de 0 a 42 puntos. Según el puntaje se clasifican los pacientes en dos grupos: sin LARS, los cuales corresponden a puntajes entre 0 y 20 puntos, y con LARS, que van de los 21 a los 42 puntos. Este último se subdivide en LARS leve o menor (21 a 29 puntos) y LARS severo (30 a 42 puntos). Previamente, se realizó una prueba piloto de forma presencial con 10 pacientes, buscando identificar dificultades en el diligenciamiento y midiendo el tiempo para el adecuado desarrollo.
Para las variables cualitativas, se utilizó la distribución de frecuencias absoluta y relativa de cada una de las categorías. Para las variables cuantitativas, se utilizaron las medidas de tendencia central, como la media con su desviación estándar o la mediana con su rango intercuartil, según la distribución de los datos con la prueba de Kolmogorov-Smirnov. Para relacionar dos variables cualitativas se utilizó el Chi cuadrado o la prueba exacta de Fisher. Para relacionar dos variables cuantitativas o una cualitativa y una cuantitativa se utilizó la prueba t de Student o la U de Mann-Whitney, según la distribución de los datos. Se consideró la diferencia como estadísticamente significativa si p<0,05.
Se realizó un análisis por subgrupos, obedeciendo al tiempo desde la realización de la cirugía índice o el cierre del estoma. Se categorizaron en dos grupos, mayores de 12 meses y menores de 12 meses. El análisis estadístico se realizó con el programa Stata/MP (StataCorp LLC., College Station, EE.UU.) versión 14.0.
Resultados
Durante el tiempo del estudio, 323 pacientes se sometieron a resección anterior baja de recto, 234 de los cuales cumplían los criterios de inclusión. De estos pacientes elegibles, 110 (47 %) respondieron la encuesta y se incluyeron en el análisis estadístico. Las características clínicas y demográficas se presentan en la Tabla 1.
Tabla 1. Características sociodemográficas, clínicas y patológicas de los pacientes sometidos a resección anterior baja de recto.
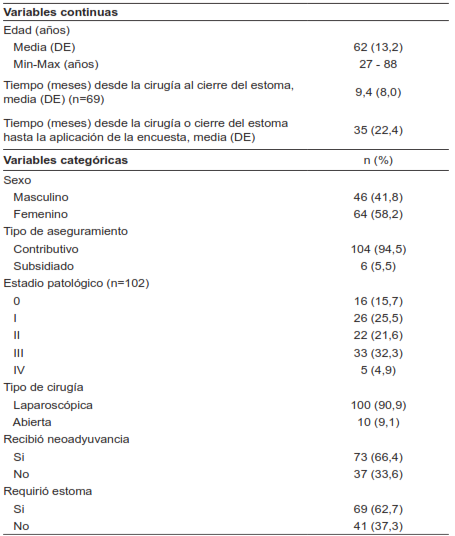
* DE: desviación estándar; Min: mínimo; Max: máximo.
La edad promedio fue de 62 años, con una desviación estándar de 13,2. La distribución por género mostró que la mayoría eran mujeres (58,2 %). De los 110 pacientes incluidos, 102 tenían diagnóstico de cáncer de recto y el estadio patológico que más se presento fue el estadio III. De los 8 pacientes restantes, seis se llevaron a cirugía en contexto de citorreducción por cáncer de ovario y dos pacientes por endometriosis profunda. En lo referente al abordaje quirúrgico, al 90 % de los pacientes se les realizó cirugía laparoscópica.
Con relación a la neoadyuvancia, se documentó que dos tercios de los pacientes recibieron terapia neoadyuvante, sin diferenciar qué tipo de terapia. Al 62 % se le realizó ostomía derivativa o de protección al momento de la resección anterior baja de recto. El tiempo promedio para el cierre fue de 9,4 meses. El cierre se hizo tempranamente (entre 6 a 8 semanas) en el 11,5 % de los pacientes.
El tiempo promedio de aplicación de la encuesta desde el momento de la cirugía índice o cierre del estoma, en caso de tenerlo, fue de 35 meses. La evaluación de los síntomas mediante el LARS score reveló que 23 pacientes (20,9 %) presentaban síntomas mayores. La prevalencia general de LARS en la muestra analizada en nuestra institución entre los años 2016 y 2022 fue de 47 % (porcentaje de pacientes No LARS de 52,7 %; IC95% 43,4 - 62,0), dividida en LARS menor en 26,4 % (IC95% 18,2 - 34,6) y LARS mayor en 20,9 % (IC95% 13,3 - 28,5).
Al momento de la aplicación del LARS score, el 80,9 % de los pacientes llevaban más de 12 meses de haber sido intervenidos. La tabla 2 muestra la relación del LARS score y los diferentes grupos de análisis. Se encontró que la edad mayor de 65 años, el estadio patológico y el requerimiento de estoma mostraron significancia estadística con respecto a la aparición de LARS. Con respecto a la neoadyuvancia, el abordaje quirúrgico, el tiempo de cierre del estoma y el tiempo de la aplicación del cuestionario desde la cirugía índice o el cierre del estoma, no hubo diferencias estadísticamente significativas.
Tabla 2. Análisis bivariado según presencia o no de síndrome de resección anterior baja de recto (LARS).
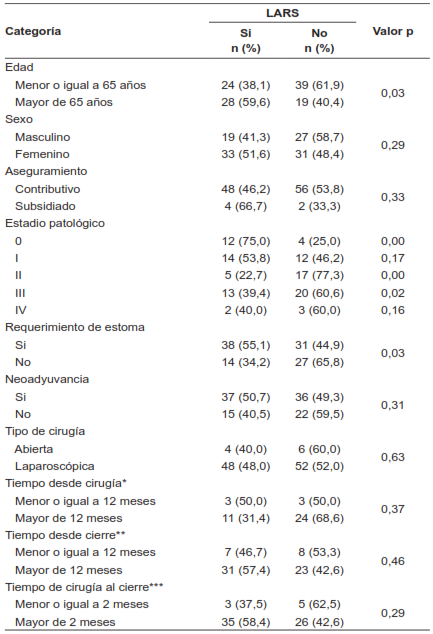
*Tiempo desde la cirugía: Tiempo en meses desde la cirugía índice hasta la aplicación de la encuesta, **Tiempo desde el cierre: Tiempo en meses desde el cierre del estoma hasta la aplicación de la encuesta, ***Tiempo de cirugía al cierre: Tiempo en meses desde la cirugía índice al cierre del estoma.
Discusión
Los pacientes elegibles para el estudio fueron 234, sin embargo, la tasa de respuesta a la encuesta del LARS score fue del 47 %, un porcentaje por debajo de la tasa de respuesta de otros estudios, que osciló entre el 70 y el 100 %. La prevalencia global del LARS ha sido difícil de identificar, debido principalmente las diferentes herramientas utilizadas para su diagnóstico 19. En un metaanálisis realizado por Croese y colaboradores, se analizaron 11 artículos desde el 2012 al 2018, con un total de 4007 pacientes en quienes se aplicó el LARS score; la prevalencia fue de 41 % (IC95% 34 - 48), con un rango que osciló ampliamente entre 17,8 y 56 % 20.
En nuestro estudio se identificó que la prevalencia de LARS fue del 47,3 % (IC95% 37,7 - 56,3 %), con un tiempo de seguimiento promedio de 35 meses, donde menos del 20 % tenían menos de 1 año de haber sido intervenidos, que se podría interpretar como la funcionalidad intestinal de nuestros pacientes a mediano y largo plazo. Esto es importante, ya que las diferentes series han identificado que, durante la evolución natural de este síndrome, un porcentaje importante de los pacientes tienden a mejorar después del año con respecto a su función intestinal. Se considera que antes del año los síntomas son debidos a irritabilidad neorrectal de corta duración en el postoperatorio, en cambio, los síntomas a largo plazo (después del año de la intervención) están más asociados a cambios permanentes 6.
La prevalencia de LARS mayor (LARS que tiene un mayor impacto en la calidad de vida) en nuestra población fue del 20,9 % (IC95% 13,3 - 28,5 %), siendo similar a la prevalencia de algunos artículos del metaanálisis realizado por Croese, con el que compartimos un numero de muestra similar, donde la prevalencia de LARS mayor entre los estudios tuvo un rango entre 20,5 % y el 52 %.
En este estudio se encontró que la edad mayor de 65 años (p=0,03), la presencia de estoma derivativo (p=0,03) y el estadio patológico II y III (p<0,001 y 0,02, respectivamente), presentaron LARS con una diferencia estadísticamente significativa. La edad es un tema controversial en la literatura; un estudio publicó que una cirugía preservadora de esfínter a la edad de 70 años tenía más probabilidad de desarrollar LARS mayor, sin embargo, hay otros donde no se identificaron diferencias estadísticamente significativas 20.
En lo referente al estadio patológico, es entendido que los estadios II y III corresponden al grueso de pacientes que serán llevados a cirugía, en la mayoría de los casos con intención de preservación de órgano, por lo que en sí van a tener una mayor tasa de LARS. Con respecto a la mayor tasa de LARS en pacientes con ileostomía derivativa, se considera que es debido predominantemente a la causa subyacente de la ileostomía más que a la ileostomía en sí misma. Lui F y colaboradores identificaron que la historia de radioterapia, una localización baja del tumor (más cercana del margen anal) y el ser mujer tenían más probabilidad de desarrollar LARS mayor 12.
Usualmente las ileostomías temporales son confeccionadas en pacientes que requieren resecciones más bajas (más cercanas al margen anal) y/o con antecedente de radioterapia, por lo que se considera que probablemente esto genere una mayor asociación de LARS con la presencia de ileostomías. Referente al tiempo del cierre de la ileostomía, tuvimos un promedio de 9,4 +/- 8 meses. En la literatura un mayor tiempo al cierre está asociado a una peor función intestinal al momento de reversarla 21, explicado principalmente por la colitis por desuso que sobreviene de una derivación fecal, que conlleva a perdida de la fuerza muscular del órgano y cambios propios en la mucosa, con un mayor tiempo de adaptación intestinal.
Nosotros no encontramos diferencias estadísticamente significativas con respecto al cierre temprano (6-8 semanas) o el cierre tardío (después de 8 semanas), aunque esto puede estar explicado por el pequeño número de pacientes a quienes se les cerró la ileostomía antes de las 8 semanas en nuestro estudio. El retraso en el cierre usualmente está asociado a la necesidad de iniciar terapia adyuvante prontamente o en el contexto de fugas anastomóticas. Hain E, et al., llevaron a cabo un estudio de casos y controles en el 2017, con 46 pacientes (23 casos con fuga anastomótica sintomática y 23 casos con fuga anastomótica asintomática), encontrando que los pacientes con fuga anastomótica sintomática tienen más disfunción intestinal que los que no tienen fuga anastomótica o los que tienen fuga anastomótica asintomática 22.
La radioterapia en el contexto neoadyuvante o adyuvante es un factor independiente para la presencia de LARS y específicamente de LARS mayor 20,23,24. En nuestro estudio se identificaron los pacientes con terapia neoadyuvante, aunque no se especificó si se trató de quimioterapia o quimioradioterapia; sin embargo, no se documentó una diferencia estadísticamente significativa (p=0,31). Algunos autores han descrito el género femenino como un potencial riesgo para LARS 6, pero en nuestro análisis no se encontró una diferencia estadísticamente significativa (p=0,29), en concordancia con otros estudios 21,25.
Dentro de las limitaciones de este estudio está su naturaleza retrospectiva y el pequeño número de pacientes encuestados durante los primeros 6 meses de la cirugía índice o el cierre del estoma, que no nos permitió sacar conclusiones acerca de los resultados a corto plazo con respecto al LARS score.
Con los hallazgos de este estudio se pudo tener un mayor conocimiento de nuestra población con cáncer de recto y una aproximación a los factores de riesgo en los cuales se debe poner más atención al momento de la planeación quirúrgica. Es indispensable tener una comunicación asertiva sobre las expectativas del paciente, toda vez que un estoma o el LARS son problemáticos para los pacientes de forma similar 26. Este estudio sirve como base para futuras investigaciones con otros diseños de índole prospectiva, utilizando el LARS score, con varios momento de medición para una mejor caracterización de la población, la identificación de factores de riesgo independientes y, por qué no, la respuesta a las intervenciones.
Conclusiones
La prevalencia de LARS en nuestra población, medida a través del LARS score, fue del 47 %, y el LARS mayor afecta el 20 % de los pacientes llevados a cirugía preservadora de esfínteres. Al momento de la planeación quirúrgica es importante comunicar al paciente las posibilidades de presentar LARS y su evolución con respecto al tiempo. Se debe prestar especial atención a los pacientes mayores de 65 años, con estadio patológico III o a quienes se les realice un estoma derivativo. Aún son necesarios estudios adicionales para identificar los factores de riesgo independientes para desarrollar LARS. El LARS score se presenta como un cuestionario interesante por la practicidad para su aplicación en cada consulta de seguimiento.

















