Revista de Ciencias
ISSN 0121-1935
Síntesis de un nuevo sistema de transferencia de carga basado en trifenilamina y 5-etinilfurano, usando, como fragmento electro-aceptor, el fullereno C60
Synthesis of new charge-transfer system based on triphenylamine and 5-ethynylfurane using fullerene C60 as electro-acceptor fragment
Alejandro Ortiz G.
Departamento de Química, Universidad del Valle, Cali - Colombia
E-mail: alejandro.ortiz@correounivalle.edu.co
Fabián E. Rodríguez G.
Departamento de Química, Universidad del Valle, Cali - Colombia
E-mail: fabian.rodriguez.gonzalez@correounivalle.edu.co
Braulio Insuasty O.
Departamento de Química, Universidad del Valle, Cali - Colombia
E-mail: braulio.insuasty@correounivalle.edu.co
Received: May 23, 2016
Accepted: June 28, 2016
Resumen
Reportamos la síntesis y la caracterización espectroscópica de un nuevo compuesto de transferencia de carga 5. Como unidad electro-dadora se usó la molécula de trifenilamina (TPA), la cual se enlazó covalentemente al 5-etinil-2-furanocarbaldehído como un espaciador rico en electrones, por medio de una reacción del tipo Sonogashira. Seguido, se realizó una cicloadición [1,3]-dipolar (reacción de Prato), con fullereno C60 como fragmento electro-aceptor, para formar el compuesto objetivo con estructura del tipo Donor-Cable-Aceptor (D-J-A), la cual es una especie molecular destacada en nuevas aplicaciones en química de materiales. Además, se estudiaron los espectros de absorción y emisión de la molécula D-J-A y de sus unidades individuales para identif car los procesos fotofísicos de esta especie química. Se realizaron experimentos de voltametría cíclica con el propósito de conocer su comportamiento redox, estableciendo sus picos de oxidación-reducción característicos. Finalmente, se determinó la geometría del estado fundamental y se describieron los fenómenos en el estado excitado, por medio de cálculos mecano-cuánticos a nivel DFT.
Palabras clave: Trifenilamina, furano, transferencia electrónica, fullereno C60.
Abstract
In this research, we report the synthesis and spectroscopic characterization of a charge transfer compound 5. Triphenylamine (TPA) was used as electro-donor molecule, which was covalently linked to a rich-electron spacer as 5-ethynyl-2-furan-o-carbon-aldehyde by a Sonogashira crosscoupling palladium-catalyzed reaction, then, a 1,3-dipolar cycloaddition reaction (Prato reaction) was performed with fullerene C60 electron-acceptor fragment to form the target compound with Donor-wire-Acceptor structure (D-J-a), which is a type of molecular species prominent in new chemical material applications. In addition, the absorption spectra and emission of the molecule D-J-A and its individual units were studied to identify photophysical processes of this chemical species. Later, cyclic voltammetry experiments were performed in order to know its redox behavior, establishing its oxidation-reduction characteristic peak. Finally, quantum mechanical calculations at DFT level were performed to determine the geometry of the ground state and describe phenomena in the excited state.
Keywords: Triphenylamine, furane, Electron-Transfer, fullerene C60.
1. Introducción
La separación de carga fotoinducida es el proceso principal realizado en sistemas biológicos para convertir la luz en energía química. El estudio de modelos relativamente simples para imitar dichos procesos ha sido de gran relevancia tanto para la vida como para el desarrollo de sistemas artifciales de alto impacto tecnológico como la fotosíntesis artifcial, nuevos materiales fotovoltaicos o en electrónica molecular (Ortizet al., 2008). El sistema artifcial más simple en los procesos de separación de carga es una combinación de dos componentes donador-aceptor, donde la unidad donora (D), después de absorber la luz visible, induce una transferencia de electrones a la unidad aceptora (A) conduciendo a un estado de separación de carga de larga vida comparable a los observados en los sistemas fotosintéticos naturales. Modelos donde las unidades electro-activas se unen covalentemente a espaciadores J-conjugados (D-JJ-A) se han convertido en los más utilizados para simular procesos de transferencia electrónica fotoinducida a nivel molecular.
Los sistemas del tipo D-J-A, donde el grupo electro-donor es un derivado de la trifenilamina (TPA), han sido ampliamente estudiados (Li et al., 2008). Se han empleado modifcaciones químicas recientes a la unidad de TPA para ajustar las propiedades físicas y ópticas en los compuestos de transferencia electrónica. La introducción de grupos alcoxi y aromáticos a dicha unidad han presentado un ajuste en los niveles de energía. Además, se ha observado un desplazamiento batocrómico en el espectro de absorción con la incorporación de espaciadores con grupos excedentes en electrones. Este hecho mejora la recolección de luz y la fotocorriente generada en dispositivos fotovoltaicos (Hagberget al., 2008; Moon et al., 2009). Es importante destacar que la TPA tiene estructura de hélice y no planar, esto evita la agregación alta en el estado condensado (Jiang et al., 2009). La extensión de la conjugación p sobre toda la molécula es pobre debido a los ángulos diedros relativamente grandes entre los anillos de fenilo y el plano del nitrógeno enlazado a los átomos de carbono (Sobolevet al., 1985). La TPA acoplada con diversos cables moleculares que provean una buena conjugación, muestran mejores efciencias de conversión de energía (Yen et al., 2012).
Como complemento, el fullereno C60 es un excelente aceptor de electrones ya que cuenta con estados tripletes degenerados de baja energía LUMOs y además es capaz de aceptar hasta seis electrones. El C60 exhibe bajas energías de reorganización en los procesos de transferencia electrónica, lo cual es esencial para realizar procesos de separación de carga ultrarrápidos y recombinación de carga lenta (Kirneret al., 2015). Por lo tanto, se espera que la combinación entre la unidad de C60 y TPA puedan presentar excelentes bloques de construcción para los sistemas fotosintéticos artifciales y para los dispositivos fotovoltaicos moleculares.
En esta investigación se plantea la síntesis de un compuesto del tipo D-J-A, usando como unidades electro-activas TPA y fullereno enlazadas covalentemente al espaciador etinilfurano, obtenido por medio de una sustitución electrofílica seguido de un acoplamiento cruzado catalizado con Pd del tipo Sonogashira y, fnalmente, se realiza una cicloadición 1,3-dipolar del tipo Prato. Para el compuesto obtenido se realizaron medidas de absorción, emisión, voltametría cíclica con el fn de elucidar y entender los procesos de transferencia electrónica fotoinducida. Para describir dichos procesos, se realizaron cálculos teóricos a nivel DFT.
2. Resultados y métodos
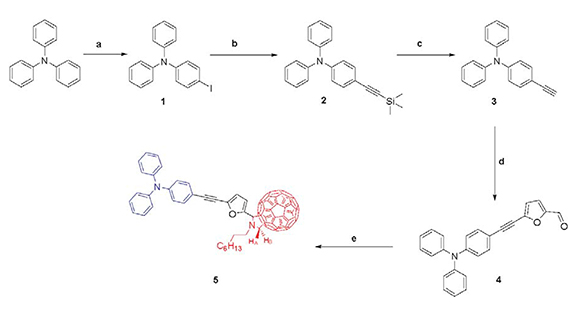
En este trabajo llevamos a cabo la síntesis del compuesto 5 a través de una metodología de múltiples pasos, los cuales se presentan en el Esquema 1. Inicialmente, partiendo de TPA y N-iodosuccinimida (NIS) en ácido acético como disolvente, se efectuó una reacción de sustitución electrofílica aromática, obteniendo 75.5% de 4-iodotrifenilamina 1.
Esquema 1. Síntesis del compuesto 5. Reactivos y condiciones. a) NIS, ácido acético, refujo, 2 h, 75.5% rendimiento; b) 1, Pd(PPh), CuI, i-PrNH, trimetilsililacetileno, tolueno, refujo, atmosfera de argón, 18 h, 342 23.8% rendimiento; c) 2, K2CO3, THF/MeOH, 1 h, 83.5% rendimiento; d) 5fBromof2ffuraldehido, Pd(PPh3)4, CuI, i-PrNH, tolueno, atmosfera de argón, 18 h, 80.2% rendimiento; e) 4, fullereno C260, N-octilglicina, tolueno, refujo, 5 h, 44.5% rendimiento
Los compuestos obtenidos se caracterizaron por RMN-1H, 13C y espectrometría de masas. En el espectro RMN-1H del compuesto 1, se observan, a campo bajo, las señales correspondientes a los 14 protones del sistema aromático, donde se evidencia la introducción de un átomo de iodo en la posición para-, se presentan dos señales con igual constante de acoplamiento que integran, cada una, dos protones y, mediante espectrometría de masas, se corroboró la estructura, m/z 371 [M]+.
Una vez obtenido el precursor 1, se procedió a realizar un acoplamiento del tipo Sonogashira, inicialmente el catalizador Pd[P(C6H5)3]4 es oxidado por la adición del haluro de arilo sintetizado en el paso anterior formando asíel respectivo complejo de paladio, posteriormente se da una alquinilación por acción del trimetilsililacetileno (TMS) en presencia de CuI y diisopropilamina obteniendo un derivado de acetiluro. Luego, mediante la eliminación reductiva de los productos de sustitución, es regenerado el catalizador y es obtenido el compuesto esperado 2 con un rendimiento del 23.8%. Con el fn de confrmar la obtención del compuesto 2, se sometió a análisis espectroscópico. En el espectro de RMN–1H, se observaron las mismas señales de los protones del sistema aromático obtenidas a campo bajo para el precursor 1 y además, la aparición del singlete característico a 0.28 ppm para los nueve protones del grupo trimetilsililo. La presencia del enlace acetilénico fue confrmada mediante el espectro de IR, donde se observó una banda alrededor de 2150 cm-1. La estructura de 2 se corroboró mediante espectrometría de masas, la cual mostró el pico de ion molecular a m/z 269 [M]+.
A continuación, se realizó la desprotección del grupo acetiluro en el compuesto 2, controlando el tiempo de reacción por cromatografía de capa delgada (CCD), con este propósito se utilizó una disolución saturada de K2CO3 en una mezcla de THF/MeOH, de esta manera se logró desproteger el grupo voluminoso trimetilsilano para obtener el compuesto 3 con un rendimiento del 83.5%. Con el fn de confrmar la estructura de este último compuesto, se sometió a análisis espectroscópico de RMN-1H, observando la desaparición de la señal a campo alto de los 9 protones de los grupos metilo, la aparición de una nueva señal a 3.06 ppm correspondiente al protón del grupo acetiluro y además, se observa claramente el patrón de desdoblamiento de dos dobletes para dos protones correspondientes a los hidrógenos adyacentes cuando existe sustitución para-.
Para la síntesis de la molécula 4, se realizó un acoplamiento del tipo Sonogashira (descrita anteriormente), entre el precursor 3 y el compuesto 5-bromofuran-2-carbaldehido con un rendimiento del 80.2%. El producto obtenido se sometió a análisis espectroscópico de RMN-1H, observando la señal del protón del grupo formilo a 9.64 ppm y dos dobletes correspondientes a los protones del furano a 7.02 ppm y 6.75 ppm, además de las señales de los protones de la TPA las cuales conservan las características espectroscópicas de este sistema descritas para los compuestos anteriores (Figura 1). Mediante la técnica de espectrometría de masas se corroboró la obtención de 4, debido a la presencia del pico de ion molecular a m/z 363 [M]+.
Figura 1. RMN-1H (400 MHz, CDCl3) del compuesto 4
Al conocer la funcionalización química de la molécula de C60 para obtener fulleropirrolidinas y la metodología más efciente para la síntesis de nuevos derivados fullerénicos, el método más utilizado consiste en una cicloadición 1,3-dipolar entre un iluro de azometino y uno de los dobles enlaces del fullereno, para formar un anillo de pirrolidina sobre su superfcie (Maggini et al., 1993). Prato y col. fueron los primeros científcos en estudiar dicha metodología conocida como la reacción de Prato. En esta reacción, el iluro de azometino es generado in situ por descarboxilación de las sales de iminio derivados de la condensación de un a-aminoácido (N-octilglicina) y el aldehído 4 por calentamiento convencional a refujo en tolueno. La posterior adición de C60 al iluro intermedio formado genera la fulleropirrolidina sustituida 5, la cual se purifcó por cromatografía de columna en sílica gel, utilizando CS2 como fase móvil; obteniendo un sólido de color negro con un 44.5% de rendimiento (Esquema 1). Es de resaltar que la introducción de una cadena alquílica larga en el nitrógeno de la pirrolidina, aumentó signifcativamente la solubilidad del compuesto en una amplia variedad de disolventes, desde hexano como disolvente apolar hasta etanol como disolvente polar.
En el espectro de RMN-1H para el compuesto 5, se observa la señal del protón quiral de la pirrolidina a d = 5.31 ppm y las señales de los protones diasterotópicos HA y HB a d = 4.18 y 5.08 ppm respectivamente, como dos dobletes con J = 9.4 Hz. Adicionalmente, las señales de los protones de la cadena alifática se presentan a campo alto en el intervalo de 0.5-3.5 ppm (Figura 2).
Figura 2. RMN-1H (400 MHz, CDCl3) del compuesto 5
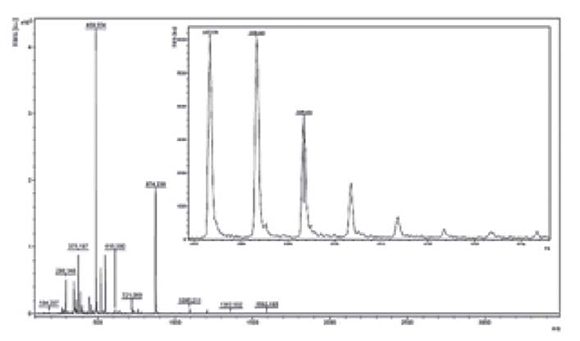
En el espectro de RMN-13C es importante señalar la presencia de dos señales a 81.7 ppm y 86.9 ppm, las cuales pertenecen a los carbonos cuaternarios del fragmento acetileno. Finalmente, la estructura química del monoaducto 5 se confrmó a través de espectrometría de masas realizada por la técnica MALDI-TOF (Figura 3). El análisis de masas muestra la presencia del pico del ion molecular a m/z 1208.34 [M]+ calculado para la formula molecular CHNO, asícomo el pico de Ca miz 721.06. Es importante destacar el pico a miz 489.35 correspondiente a la perdida de Cdel compuesto [M-C]. Esta fragmentación es característica en sistemas fulleropirrolidínicos (Fazio et al., 2008).
Figura 3. Espectro de masas (MALDI) del compuesto 5 y expansión del pico de ion molecular a m/z 1208.34
El estudio de los espectros electrónicos del compuesto 5 y sus respectivos cromóforos se llevó a cabo mediante espectroscopia UV-Vis en cloroformo a una concentración de 4.0 x 10-6 M. El espectro de absorción del compuesto 5 muestra valores altos de absorbancia para la banda correspondiente a la transición π-π* a una longitud de onda de 256 nm y una banda medianamente intensa a una longitud de onda de 350 nm atribuida a procesos de transferencia electrónica desde el fragmento electro-dador hasta el fragmento electroaceptor; los espectros de absorción son la adición de las bandas de los cromóforos individuales lo que indica una pobre comunicación entre las especies D y A en el estado fundamental necesaria en este tipo de sistemas. Es importante destacar para el compuesto 4 una nueva banda a 395 nm, la cual se atribuye a un proceso de transferencia de carga intramolecular (ICT) entre el nitrógeno de la TPA y el carbonilo del furano en el estado fundamental. El desplazamiento de la banda ICT para el compuesto 5 se encuentra a longitudes de onda menores comparadas con las del compuesto 4, debido a que el proceso de transferencia electrónica para la primera molécula se ve interrumpido ya que el carbono del grupo carbonilo una vez se enlaza covalentemente con la fulleropirrolidina cambia su hibridación de sp2 a sp3 (figura 4); todos los datos de los espectros de absorción se encuentran en la tabla 1.
Figura 4. Espectros de absorción para los compuestos 4, 5, C60, furano y TPA
Tabla 1. Datos de absorción de los compuestos 4, 5, C60, furano y TPA
Debido a que antes de que ocurra el proceso de separación de carga intramolecular se llega al estado excitado, el cual se puede desactivar por fuorescencia; se hicieron estudios de fuorescencia con el fn de poder conocer su comportamiento en dicho estado y evaluar la competencia de este proceso con el proceso de separación de carga intramolecular para el compuesto 5. Las medidas se hicieron en cloroformoihexano variando la proporción de estos disolventes con el fn de variar la polaridad del medio.
Los espectros de forescencia del compuesto 5 mostrados en la Figura 5 se estudiaron en soluciones equilibradas de aire a 298 K y a una longitud de onda de excitación de 350 nm. Dichos espectros no cambian signifcativamente su longitud de onda al incrementar la polaridad de la mezcla de disolventes. La transferencia electrónica fotoinducida inicia con la foto-excitación de D en donde se genera el estado excitado (D*-A) que posteriormente puede relajarse al estado fundamental (D-A) por los diferentes tipos de relajación conocidos o puede generar un estado de separación de cargas extremadamente polarizable [D+-A-] a través de una transferencia electrónica entre las unidades electro-activas [1]. Ambientes de solvatación polares disminuyen la emisión debido a la estabilización de dicho estado dipolar. Como la polaridad del disolvente aumenta este efecto, se evidencia con una desactivación de la emisión por fuorescencia signifcativa. En general, se puede afrmar que el rendimiento cuántico de fuorescencia decrece marcadamente con el incremento de la polaridad del disolvente, la cual es una propiedad común de los compuestos que exhiben una larga separación de carga en el estado excitado (García et al., 2013), viéndose favorecido el proceso de transferencia electrónica intramolecular sobre la desactivación por emisión.
Figura 5. Espectros de fuorescencia del compuesto 5 en diferentes proporciones de una mezcla de disolventes CHCl3/Hexano
La molécula de C60 y sus propiedades electrónicas la convierten en una unidad con capacidad aceptora buena. Cálculos teóricos realizados sobre dicha molécula muestran un LUMO relativamente bajo en energía y triplemente degenerado, por lo que es capaz de aceptar hasta 6 electrones en disolución a una temperatura aproximada de 5 oC. Medidas de voltametría cíclica llevadas a cabo en disolución, confrman que la reducción es fácil y transcurre por etapas, implicando cada una de ellas un proceso de transferencia de un electrón, favorecido por la baja energía de reorganización (Xie et al., 1992).
Con el fn de corroborar de manera experimental el acoplamiento electrónico entre las unidades electro-activas en el estado fundamental, se estudiaron las propiedades Redox por voltametría cíclica para el compuesto 5 (Figura 6), las cuales fueron comparadas con las propiedades redox del C60 bajo las mismas condiciones electroquímicas, estas medidas se llevaron a cabo a temperatura ambiente usando o-diclorobenceno como disolvente, desoxigenado con argón, además hexafuorofosfato de tetra-butilamonio (TBAPF6 0.1 M) como electrolito soporte y ferroceno como referencia interna. El montaje de la celda con tres electrodos consistió en: Un electrodo de carbón vitrifcado de 1 mm de diámetro como electrodo de trabajo, un alambre de plata como electrodo de pseudo-referencia y un alambre de platino como electrodo auxiliar o contra-electrodo.
Figura 6. Voltamperograma cíclico del compuesto 5
Como primera característica para el compuesto 5, podemos observar un primer potencial de oxidación a +0.498 V que se atribuye a la oxidación del fragmento de trifenilamina (Onitsukaet al., 2006), un segundo potencial de oxidación observado a 1.676 V, lo que se debe a la oxidación del fragmento de furano incorporado en su estructura. En la zona catódica se observan tres potenciales de reducción, los cuales se atribuyen a las tres primeras reducciones del fragmento de fullereno C60. En general, las propiedades electroquímicas de este compuesto muestran un primer potencial de reducción desplazado alrededor de 100 mV hacia valores más negativos respecto al C60 sin funcionalizar como consecuencia de la saturación de uno de sus dobles enlaces, cambiando su hibridación sp2 a sp3. Por último, dicho desplazamiento evidencia una disminución en la capacidad aceptora del fullereno funcionalizado y además, permite la predicción de la formación de un estado de separación de carga por foto-excitación, evidenciando la generación de un complejo de cargas separadas. Los datos de estos experimentos electroquímicos se encuentran en la tabla 2.
Tabla 2. Potenciales de oxidación y reducción para el compuesto 5 y el C60
Para constatar el comportamiento estructural y electrónico del compuesto obtenido desde el punto de vista computacional, se llevaron a cabo cálculos teóricos de optimización geométrica y cálculos de energía en el estado excitado. Para ello se utilizó el software comercial GAUSSIAN 09® con la interface gráfca Gauss View 05® empleando la teoría del funcional de densidad DFT con el funcional hibrido B3LYP y el conjunto de bases de orbitales atómicos 6-31G para la molécula 5. En la estructura de mínima energía se puede observar la forma de hélice que toman los anillos fenílicos de la trifenilamina, además, una conformación cuasi-planar con un pequeño ángulo de torsión entre el plano del fragmento electro-donor y el del electro-aceptor, lo que signifca, que existe una pequeña distorsión de la conjugación J. Los hechos anteriores demuestran que es muy factible que ocurra un proceso de separación de carga foto-inducida, como se demostró en los experimentos de absorción, emisión y de electroquímica (Figura 7).
Figura 7. Estructura de más baja energía calculada para el compuesto 5
Una característica importante mostrada por los cálculos computacionales es la topología de los orbitales moleculares de frontera en el estado excitado, encontrándose en el nivel HOMO la contribución de la densidad electrónica localizada principalmente sobre el fragmento electro-dador y parte de la contribución sobre el sistema conjugado, en el caso del orbital LUMO, la densidad electrónica se concentra sobre la unidad de C60. Este fenómeno evidencia que el proceso de transferencia electrónica es favorable, donde interviene el sistema conjugado. Estos resultados concuerdan con los resultados experimentales de absorción y emisión discutidos anteriormente (Figura 8).
Figura 8. Contorno de densidades electrónicas para los orbitales de frontera para el compuesto 5
3. Parte experimental
Todos los disolventes se secaron de acuerdo con los procedimientos estándar, llevando a cabo las reacciones sensibles al aire bajo atmosfera inerte de argón. Los compuestos utilizados de fuentes comerciales fueron utilizados sin purifcación adicional. El control de las reacciones se realizó por cromatografía de capa delgada (TLC) usando placas de sílica gel 60 F254, se empleó una lámpara manual de Ultravioleta como fuente reveladora con dos longitudes de onda (254 y 365 nm).
Los espectros de RMN se tomaron en un espectrómetro Bruker Avance 400 MHz a 298 K, usando como disolvente CDCl3. Los espectros FT-IR se tomaron en un espectrómetro Shimadzu FT-IR IR Affnity-1 y los espectros de UV-Vis en un espectrómetro Shimadzu PharmaSpec 1700, usando como disolvente CDCl3 a una concentración aproximada de 4x10-6M. El experimento de ionización-desorción laser asistida por matriz (acoplado a un analizador de tiempo de vuelo) (MALDI-TOF) para el compuesto 5 se realizó en un espectrómetro Bruker Microfex LT series. Los espectros de masas se obtuvieron en un espectrómetro Shimadzu GCMS-DI 2010 (equipado con una sonda de inyección directa) e impacto electrónico a 70 eV. Los espectros de emisión se tomaron en un espectrofuorímetro Jasco FP-8500 usando cloroformo y hexano como disolventes. La longitud de excitación se escogió de acuerdo al máximo de absorción establecido para el sistema.
La voltamperometría cíclica se llevó a cabo en un potenciostato-galvanostato METRON AUTOLAB 300N, usando un sistema de confguración de tres electrodos, las mediciones se hicieron en o-diclorobenceno usando como electrolito soporte una solución de TBAPF6 a una concentración de 0.1 M, el sistema de tres electrodos fue compuesto por un electrodo de carbono vitrifcado como electrodo de trabajo, un electrodo de pseudo-referencia de platino y un contra-electrodo de platino.
3.1 4-yodo-N,N-difenilanilina (1)
Una disolución de trifenilamina (3 g, 12.23 mmol) y NIS (2.6 g, 11.54 mmol) en 40 mL de ácido acético se calentó (60°) durante 2 horas. El crudo de reacción se neutralizó con una solución de K2CO3 al 10 %. Durante dicho proceso, se observó la formación de un sólido amarillo. Se llevó a pH neutro, se decantó y el sólido obtenido se extrajo con porciones de DCM. El disolvente se removió a presión reducida y el producto se purifcó por cromatografía de columna utilizando sílica gel con hexanoicloroformo 3:1 como fase móvil para obtener 3.428 g (75.5%) de un sólido de color blanco.
FT-IR (ATR) u = 1587, 1476, 1308, 1257 cm-1; RMN-1H (CDCl3, 400 MHz): ( = 6.88 (dd, J = 8.8, 3.0 Hz, 2H), 7.04-7.16 (m, 6H), 7.30 (dd, J = 13.5, 7.6 Hz, 4H), 7.56 (t, J = 8.5 Hz, 2H) ppm; RMN-13C (CDCl3, 100 MHz): d = 77.4, 123.4, 124.6, 125.3, 129.4, 138.1, 147.2, 147.3 ppm; MS (IE): m/z 371 [M]+.
3.2 N,N-difenil-4-((trimetilsilil)etinil)anilina (2)
Una disolución de 4-yodo-N,N-difenilanilina (1500 mg, 4.04 mmol), Pd(PPh3)4 (233 mg, 0.20 mmol), CuI (38.5 mg, 0.20 mmol) en tolueno (23 mL anhidro) y di-isopropilamina (8 mL) fue desoxigenada con argón durante 15 minutos. Posteriormente se adicionó trimetilsililacetileno (528 mg, 5,4 mmol). La mezcla de reacción se agitó y se calentó a refujo durante 18 horas bajo atmósfera inerte. El crudo de reacción se extrajo con DCM y posteriormente se lavó con soluciones saturadas de NH4Cl y salmuera, la fase orgánica se secó con MgSO4. El disolvente se removió a presión reducida y el producto fnalmente se purifcó por cromatografía de columna utilizando sílica gel y hexanoicloroformo 30:1 como fase móvil para obtener 355 mg (23.8 %) de un aceite de color amarillo.
FT-IR (ATR) u = 2958, 2150, 1587, 1487, 1274 cm-1; RMN-1H (CDCl3, 400 MHz): ( = 0.28 (s, 9H), 6.98-7.14 (m, 8H), 7.26-7.32 (m, 4H), 7.36 (t, J = 8.2 Hz, 2H) ppm; RMN13C (CDCl3, 100 MHz): ( = 0.14, 93.1, 105.4, 116.0, 122.2, 123.5, 124.2, 129.4, 132.9, 147.2, 148.1 ppm; MS (IE): m/z 341 [M]+.
3.3 4-etinil-N,N-difenilanilina (3)
En un balón se agregó N,N-difenil-4-((trimetilsilil)etinil) anilina 2 (343 mg, 1.0 mmol), K2CO3 (1382 mg, 10 mmol), THF (4 mL) y metanol (4 mL), la mezcla se agitó a temperatura ambiente durante 1 hora. Luego el crudo de reacción se adicionó en agua y se extrajo con DCM, la fase orgánica se secó con MgSO4. Seguidamente, se fltró el disolvente, se removió a presión reducida y el producto se purifcó por cromatografía de columna utilizando sílica gel y hexanoiDCM 30:1 como fase móvil para obtener 225 mg (83.5 %) de un sólido de color blanco.
FT-IR (ATR) u = 3263, 2100, 1585, 1485, 1284, 829 cm-1; RMN-1H (CDCl3, 400 MHz): d = 3.06 (s, 1H), 7.01 (d, J = 8.7 Hz, 2H), 7.09-7.15 (m, 6H), 7.29-7.33 (m, 4H), 7.38 (d, J = 8.7 Hz, 2H) ppm; RMN-13C (CDCl3, 100 MHz): 76.2, 83.9, 114.8, 122.0, 123.6, 125.0, 129.4, 133.1, 147.1, 148.4 ppm; MS (IE): m/z 269 [M]+.
3.4 5-((4-(difenilamino)fenil)etinil)furan-2-carbaldehido (4)
En un balón de dos bocas se agregó 4-etinil-N,N-difenilanilina 3 (300 mg, 1.11 mmol), 5-bromo-2-furaldehido (233 mg, 1.33 mmol), Pd(PPh3)4 (64 mg, 0.06 mmol), CuI (11 mg, 0.06 mmol), di-isopropilamina (10 mL) y tolueno (10 mL). La mezcla se agitó bajo atmosfera inerte a temperatura ambiente durante 18 horas. La mezcla de reacción se extrajo con DCM, se lavó con NH4Cl acuoso y salmuera. La fase orgánica se secó con MgSO4; posteriormente, el disolvente se evaporó a presión reducida. El crudo de reacción se purifcó por cromatografía de columna, utilizando sílica gel y hexano como fase móvil para obtener 323 mg (80.2 %) de un sólido de color amarillo.
RMN-1H (CDCl3, 400 MHz): d = 6.75 (d, J = 3.7 Hz, 1H), 7.02 (d, J = 8.7 Hz, 2H), 7.12-7.17 (m, 6H), 7.28 (d, J = 3.7 Hz, 1H), 7.33 (t, J = 7.8 Hz, 4H), 7.40 (d, J = 8.7 Hz, 2H), 9.64 (s, 1H) ppm; RMN-13C (CDCl3, 100 MHz): d = 77.9, 97.3, 113.0, 116.3, 120.9, 121.2, 124.2, 125.5, 129.5, 132.8, 146.7, 149.2, 152.2, 177.0 ppm; MS (IE): m/z 363 [M]+.
3.5 Triada electro-activa (5)
Una solución de fullereno C60 (561 mg, 0.78 mmol) en tolueno (190 mL), N-octilglicina (222.3 mg, 0.75 mmol) y el compuesto 4 (150 mg, 0.41 mmol) se agregaron a un balón de dos bocas. La reacción se agitó a refujo con una trampa de Dean-Stark durante 5 horas. Luego, el disolvente se evaporó a presión reducida, el crudo de reacción se purifcó por cromatografía de columna utilizando sílica gel y disulfuro de carbono como fase móvil para obtener 221 mg (44.5 %) de un sólido de color negro.
FT-IR (ATR) u = 2920, 2328, 2196, 1583, 1489, 1275 cm-1; RMN-1H (CDCl3, 400 MHz): d = 1.87-2.05 (m, 2H), 2.70-2.77 (m, 1H), 3.26-3.33 (m, 1H), 4.18 (d, J = 9.4 Hz, 1H), 5.08 (d, J = 9.4 Hz, 1H) 5.31 (s, 1H) 6.70 (d, J = 3.4 Hz, 1H), 6.77 (d, J = 3.4 Hz, 1H), 7.00 (d, J = 8.7 Hz, 2H), 7.08-7.14 (m, 6H), 7.28-7.32 (m, 6H), 7.37 (d, J = 8.7 Hz, 2H) ppm; RMN-13C (CDCl3, 100 MHz): d = 15.3, 21.6, 28.4, 29.5, 29.6, 30.7, 32.0, 32.0, 54.4, 55.3, 68.1, 69.0, 78.3, 98.4, 113.1, 117.0, 120.3, 121.6, 124.0, 126.1, 129.5, 133.1, 146.0, 151.3, 152.9 ppm; MS (MALDI-TOF): Calculado para CHNO 1208; 94352 encontrado 1208.34 [M]+.
4. Conclusiones
Se sintetizó una triada molecular del tipo D-p-A, basada en TPA, furano y fullereno utilizando reacciones de sustitución electrofílica aromática, acoplamiento cruzado del tipo Sonogashira y reacciones de cicloadición 1,3-dipolar con N-octilglicina. El espectro de absorción mostró una banda de transferencia electrónica intramolecular (ICT) en la región visible del espectro UV-Vis. El espectro de emisión de 5 confrmó el carácter de la banda ICT. El análisis electroquímico reveló interacciones signifcativas entre las unidades electro-activas. Estos hallazgos revelaron que existe una comunicación electrónica signifcativa entre la unidad electro-donadora y el fragmento electro-aceptor a través del espaciador p-conjugado. Este hecho se confrmó mediante cálculos mecanocuánticos a nivel DFT y TD-DFT con un funciona B3LYP, para el compuesto 5 obtenido.
Agradecimientos
Los autores agradecen a COLCIENCIAS (Colombia) y a la Universidad del Valle (Colombia) por el soporte financiero.
Referencias
Fazio, M. A., Lee, O. P., & Schuster, D. I. (2008). First Triazole-Linked Porphyrin-Fullerene Dyads. Organic Letters, 10, 4979-4982. [ Links ]
García, G., Adamo, C., & Ciofni, I. (2013). Evaluating push-pull dye effciency using TD-DFT and charge transfer indices. Physical Chemistry Chemical Physics, 15(46), 20210-20219. [ Links ]
Hagberg, D. P., Yum, J. H., Lee, H. J., De Angelis, F., Marinado, T., Karlsson, K. M., et al. (2008). Molecular Engineering of Organic Sensitizers for Dye-Sensitized Solar Cell Applications. Journal of the American Chemical Society, 130 (19), 6259-6266. [ Links ]
Jiang, Z., Chen, Y., Yang, C., Cao, Y., Tao, Y., Qin, J., et al. (2009). A Fully Diarylmethylene-Bridged Triphenylamine Derivative as Novel Host for Highly Effcient Green Phosphorescent OLEDs. Organic Letters, 11(7), 1503-1506. [ Links ]
Kirner, S. V., Arteaga, D., Henkel, C., Margraf, J. T., Alegret, N., Ohkubo, K. et al. (2015). On-off switch of charge-separated states of pyridine-vinylene-linked porphyrin-C60 conjugates detected by EPR. Chemical Science, 6(10), 5994-6007. [ Links ]
Li, G., Jiang, K. J., Li, Y. F., Li, S. L., Yang, L. M. (2008). Effcient Structural Modifcation of Triphenylamine-Based Organic Dyes for Dye-Sensitized Solar Cells. The Journal of Physical Chemistry C, 112 (2), 11591-11599. [ Links ]
Li, R., Liu, J., Cai, N., Zhang, M., & Wang, P. (2010). Synchronously Reduced Surface States, Charge Recombination, and Light Absorption Length for High-Performance Organic Dye-Sensitized Solar Cells. The Journal of Physical Chemistry B, 114(13), 4461-4464. [ Links ]
Maggini, M., Scorrano, G., & Prato, M. (1993). Addition of azomethine ylides to C60: synthesis, characterization, and functionalization of fullerene pyrrolidines. Journal of the American Chemical Society, 115(21), 9798-9799. [ Links ]
Moon, S.-J., Yum, J.-H., Humphry-Baker, R., Karlsson, K. M., Hagberg, D. P., Marinado, T., et al. (2009). Highly Effcient Organic Sensitizers for Solid-State Dye-Sensitized Solar Cells. The Journal of Physical Chemistry C, 113 (38), 16816-16820. [ Links ]
Onitsuka, K., Ohara, N., Takei, F., & Takahashi, S. (2006). Synthesis and redox properties of trinuclear ruthenium-acetylide complexes with tri(ethynylphenyl)amine bridge. Dalton Transactions, 2 (30), 3693-3698. [ Links ]
Ortiz, A., Insuasty, B., y Illescas, M. (2008). Transferencia electrónica y nanocables moleculares orgánicos. Anales de la Real Sociedad Española de Química, 104 (4), 270-275. [ Links ]
Sobolev, A. N., Belsky, V. K., Romm, I. P., Chernikova, N. Y., & Guryanova, E. N. (1985). Structural investigation of the tri aryl derivatives of the Group V elements. IX. Structure of tri phenylamine, C18H15N. Acta Crystallographica Section C: Structural Chemistry, 41(6), 967-971. [ Links ]
Xie, Q., Perez-Cordero, E., & Echegoyen, L. (1992). Electrochemical detection of C6-and C6-: Enhanced stability of fullerides in solution. Journal of the American Chemical Society, 114, (10), 3978-3980. [ Links ]
Yen, Y.-S., Chou, H.-H., Chen, Y.-C., Hsu, C.-Y., & Lin, J. T. (2012). Recent developments in molecule-based organic materials for dye-sensitized solar cells. Journal of Materials Chemistry, 22(18), 8734-8747. [ Links ]
Zhang, G., Bala, H., Cheng, Y., Shi, D., Lv, X., Yu, Q. et al. (2009). High effciency and stable dye-sensitized solar cells with an organic chromophore featuring a binary J-conjugated spacer. Chemical Communications, (16), 2198. [ Links ]

Revista de Ciencias por Universidad del Valle se encuentra bajo una licencia Creative Commons Reconocimiento 4.0.