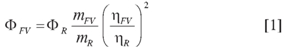Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804On-line version ISSN 2357-3791
Rev.Colomb.Quim. vol.39 no.3 Bogotá Sept./Dec. 2010
RENDIMIENTO CUÁNTICO DE FLUORESCENCIA EN SISTEMAS FENILVINILIDENO
FLUORESCENCE QUANTUM YIELDIN PHENYLENEVINYLENE SYSTEMS
RENDIMIENTO QUANTICO DE FLUORESCENCIA EM SISTEMAS FENILVINILIDENOS
Diego M. Alzate1, Ricaurte Rodríguez1, César A. Sierra1,2
1 Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia, sede Bogotá. Bogotá, Colombia.
Recibido: 22/09/10 - Aceptado: 22/11/10
RESUMEN
En el presente trabajo se reporta la síntesis y caracterización optoelectrónica de tres sistemas fenilvinilideno con sustituyentes electrodonores tipo alcoxilo (-OR). Los sistemas fueron obtenidos por medio de la reacción de acoplamiento de Heck, con rendimientos superiores a 95%, una conjugación de configuración totalmente trans y con altos rendimientos cuánticos de fluorescencia de color verde-azul. La gran estereoselectividad de la metodología de síntesis utilizada se ve reflejada en la obtención de rendimientos cuánticos superiores a los reportados para sistemas fenilvinilideno de estructuras químicas similares, lo cual hace de estos sistemas fenilvinilideno estereoselectivos, materiales de alto atractivo comercial dentro de las nacientes tecnologías de la electrónica de polímeros.
Palabras clave: fenilvinilideno, reacción de Heck, rendimiento cuántico, fluorescencia, electrónica de polímeros.
ABSTRACT
In this paper, we report the synthesis and optoelectronic characterization of three phenylene vinylene systems with electron-donor substituents (alcoxide type, -OR). The systems were obtained by Heck cross-coupling reaction, with yields over 95%, pure trans configuration conjugation, and high fluorescent quantum yields of blue-green color. The high stereoselectivity of the synthesis used is shown by obtaining fluorescence quantum yields higher than similar phenylene vinylene systems reported in literature, which makes these systems very attractive materials for the emerging polymer electronic technology.
Key words: phenylene vinylene, Heck reaction, quantum yield, fluorescence, polymers electronics.
RESUMO
Neste trabalho, reporta-se a síntese e a ca-raterizaçâo optoeletrônica de très sistemas fenil vinilideno com substituintes eletrodoadores do tipo alcoxil (-OR). Os sistemas foram obtidos pela reacào de acoplamento de Heck, com rendimentos acima de 95%, com uma conjugacào de configuracào totalmente trans e com altos rendimentos quànticos de fluorescencia de cor verde-azul. A grande esteroseletividade da síntese utilizada se ve refletida na obtencào de rendimentos quànticos superiores aos reportados para os sistemas fenil vinilideno de estruturas químicas similares, o qual faz de estes sistemas fenil vinilideno materiais atraentes comercial-mente dentro das nascentes tecnologias da eletrònica de polímeros.
Palavras-chave: fenil vinilideno, reacào de Heck, rendimento quàntico, fluorescencia, eletrònica de polímeros.
INTRODUCCIÓN
El descubrimiento de la electroluminiscencia usando polifenilvinilidenos (PFV, Figura 1) por Burroughes etal (1) dio inicio a lo que se conoce actualmente como electrónica de polímeros. Área de la ciencia de materiales con aplicaciones altamente atractivas tecnológicamente, tales como diodos orgánicos emisores de luz (2) (OLED, Organic Light Emitting Diodes, por sus siglas en inglés), celdas solares (3) y quimiosensores (4). Las posibilidades comerciales de la electrónica de polímeros son ilimitadas, teniendo en cuenta que pueden reemplazar a los materiales inorgánicos hoy día usados en un sinnúmero de tecnologías, pero con la ventaja de tener las propiedades mecánicas y fisicoquímicas de los polímeros. Infortunadamente, el comportamiento estadístico normal de los polímeros dificulta enormemente los estudios propiedad-estructura necesarios para desarrollar hasta un nivel comercial cada una de las tecnologías antes mencionadas de la electrónica de polímeros. Teniendo en cuenta lo anterior, y adicionalmente algunos problemas de procesabilidad encontrados en polímeros totalmente conjugados, los grupos de investigación de Karasz y Lahti (5-7), entre otros, han desarrollado una línea alterna de investigación en la electrónica de polímeros basada en sistemas poliméricos segmentados conjugados tipo fenilvinilideno. Estos copolímeros están compuestos por una zona alifática que da movilidad y aumenta la solubilidad, y una zona electrónicamente conjugada, confinada y homogénea, responsable de las propiedades de interés. La mayor diferencia entre los polímeros segmentados y los totalmente conjugados, radica en que los primeros, al tener conjugaciones confinadas, presentan propiedades optoelectrónicas homogéneas. Esta homogeneidad da posibilidad al desarrollo de estudios estructura-propiedad, con una ventaja adicional: permite la extrapolación de los resultados teóricos encontrados, usando moléculas fenilvinilideno (FV) análogas al polímero segmentado conjugado, lo que disminuye la demanda computacional requerida. Estas moléculas análogas, además de tener protocolos de síntesis sencillos y con mayores rendimientos que su contraparte en polimerización, se presentan como modelos inmejorables para una total caracterización estructural y optoelectrónica de su polímero análogo.
Algunas propiedades optoelectrónicas de los FV se pueden evaluar experimentalmente por medio del estudio de los espectros de absorción y emisión, generalmente con el fluoróforo en solución, en el cual, entre otras variables, es posible calcular el rendimiento cuántico de fotoluminiscencia (8), que proporciona una excelente aproximación de la eficiencia del fluoróforo como material electroluminiscente, base para la seleccionar la aplicación final del material en la electrónica de polímeros.
En este trabajo se reporta la síntesis y caracterización espectroscópica de tres sistemas fenilvinilideno, mediante la reacción modificada de Heck y la forma de calcular el rendimiento cuántico de estos sistemas orgánicos altamente conjugados (pero en principio aplicable a cualquier tipo de cromóforo) a partir del método de "mediciones ópticas en soluciones diluidas" (9), usando sulfato de quinina como patrón de referencia y los espectros de absorción y fluorescencia de las sustancias por estudiar.
MATERIALES Y MÉTODOS
Los solventes empleados en la síntesis, tales como CHCl3, CH3OH y CH3COOH, H2SO4, son de origen comercial y no se sometieron a ningún tratamiento previo. Por otro lado, la N,N-dimetilformamida (DMF) se secó dejándola en reflujo sobre óxido de bario por dos días bajo atmósfera de nitrógeno. El óxido de bario previamente se activó por calentamiento a 100 °C en mufla durante una semana. Una vez transcurrido este tiempo, la DMF se destiló y se recogió directamente en el balón de reacción usado para la síntesis.
Los puntos de fusión fueron medidos en un fusiómetro Stuart SMP10 y son reportados sin corrección. Los espectros FT-IR fueron tomados en un espectrofotómetro Shimadzu IR prestige-21 . Los espectros de resonancia magnética nuclear fueron tomados en un espectrómetro Bruker Advance 400 usando cloroformo deuterado (CDCl3) como solvente y tetrametil silano (TMS) como estándar interno.
Reacción de Heck
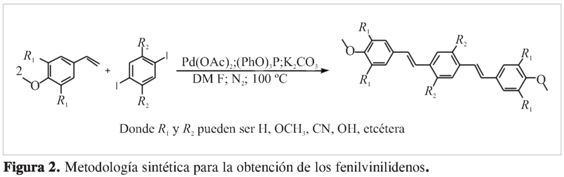
La síntesis de los sistemas FV se realizó usando la reacción de acoplamiento de Heck (10) modificada y desarrollada por nuestro grupo de investigación (11) entre un sistema aromático diyodado y un estireno sustituido, usando acetato de paladio (Pd(OAc)2) en cantidades catalíticas como fuente de paladio, trifenilfosfito ((PhO)3P) como ligante, K2CO3 como base en cantidades equimolares con respecto al estiren-derivado y como disolvente DMF seco. La reacción se hizo en un montaje tipo Schlenk bajo atmosfera de N2 a 100 °C y fue seguida por cromatografía de capa delgada usando solventes apropiados (Figura 2).
Espectros de absorción y emisión
Una vez caracterizados los sistemas FV, se prepararon soluciones en DMF con concentraciones entre 2x10-6 y 1x10-5 M, como también del sulfato de quinina en ácido sulfúrico 0,1 M (patrón para las mediciones del rendimiento cuántico). Los espectros de absorción fueron obtenidos en un equipo Thermo Scientific Evolution 300. Los espectros de emisión fueron obtenidos entre 380 y 600 nm con una longitud de onda de excitación de 350 nm en un equipo Photonics PTI 710.
Rendimiento cuántico
Los rendimientos cuánticos para los sistemas FV sintetizados fueron estimados por el método descrito por Williams et al. (12) usando la ecuación 1.
Donde Φ es el rendimiento cuántico, m es la pendiente de la curva construida al graficar el área bajo la curva del espectro de emisión en función de la absorbancia a la longitud de onda de excitación. Los valores para construir la curva se obtienen a partir de soluciones del FV en un rango de concentración entre 1x10-6 y 1x10-5 M. η es el índice de refracción del disolvente en el que se hace la medida. FV hace referencia al fenilvinilideno de estudio y R al patrón usado para la medida.
RESULTADOS Y DISCUSIÓN
Reacción de Heck
Usando la reacción de acoplamiento de Heck modificada y desarrollada por nuestro grupo de investigación (11), se obtuvieron con excelentes rendimientos los sistemas FV descritos a continuación:
(E,E)-2,5-Bis(metoxi)-1,4-bis(4-meto-xiestiril)benceno (FV-OCH3). Rendimiento de 97%, sólido amarillo con p.f. 212214° (lit. (25) 211-214 °C). RMN- 1H (400 MHz, CDCh) δ (ppm): 3,83 (s, 6H), 3,91 (s, 6H), 6,88 (m, 4H), 7,04 (d, 2H), 7,11 (s, 2H), 7,32 (d, 2H), 7,48 (d, 4H).
(E,E)-2,5-Bis(metoxi)-1,4-bis(3,4,5-trimetoxiestiril)benceno (FV-TriOCH3). Rendimiento de 98%. Sólido amarillo con p.f. 257-259 °C (lit. (25) 255-258 °C). RMN-1H (400 MHz, CDCl3) δ (ppm): 3,90 (s, 6H), 3,96 (s, 12H), 3,98 (s, 6H), 6,80 (s, 4H), 7,08 (d, 2H), 7,15 (s, 2H), 7,39 (d, 2H).
(E,E)-2,5-Bis(2-etanoil)-1,4-bis (3, 4, 5-trimetoxiestiril)benceno. (FV-CH2 CH2 OH). Rendimiento de 95%. Sólido amarillo con p.f. 246-248 °C (lit. (7) 245-247 °C). RMN-1H (400 MHz, DMSO-d6) δ (ppm): 3,67 (s, 6 H), 3.82 (m, 16 H), 4,08 (t, 4H), 6,89 (s, 4H), 7,3 (d, 2H), 7,45 (d, 2H), 7,34 (s, 2H).
La reacción de acoplamiento de Heck bajo las condiciones propuestas mostró excelentes rendimientos (superiores en todos los casos a 95%) para los sistemas FV sintetizados (Figura 3), con una alta estereoselectividad hacia el producto trans-trans, según el análisis por FT-IR y RMN-1H. El espectro de FT-IR muestra la presencia de una señal en 970 cm-1,ca-racterística para la flexión C-H fuera del plano en alquenos (980-965 cm-1) en configuración trans (13). Por su parte, el es-pectroRMN-1H complementa positivamente el resultado anterior, al presentar una constante de acoplamiento (J) de 16,4 Hz para los hidrógenos vinílicos, valor para J en alquenos con configuración trans. (14) Cabe anotar que en ninguna de las síntesis realizadas se presentaron señales que indicaran la presencia de isómeros configuracionales de los productos (ausencia de señales a 690 cm-1 y valores de acoplamiento cercanos a 12 Hz).
Para la electrónica de polímeros, estructuras conjugadas configuracionalmente trans puras son condición necesaria si se desean altas eficiencias en las propiedades optoelectrónicas (por ejemplo, fluorescencia, electroluminiscencia). Ya que para mantener una conjugación efectiva y un apropiado transporte de electrones es necesario que todos los orbitales p que conforman los enlaces i sean paralelos. El empleo de otras técnicas de síntesis como la reacción de Wittig proporcionan mezclas de isómeros debido a su pobre estereoselectividad, lo cual se ve reflejado en una disminución significativa de los rendimientos cuánticos (15) en comparación con los obtenidos por la metodología de Heck.
Espectros de absorción y emisión
Los espectros de UV-VisenDMF para los sistemas FV sintetizados muestran una intensa absorción con un máximo a aproximadamente 397 nm (Figura 4) asignada a la transición 1π →π Transición normalmente reportada para sistemas oligoméricos fenilvinilideno (16). La presencia de una segunda transición en forma de hombro ha sido anteriormente discutida al comparar los espectros de absorción de sistemas FV con y sin sustituyentes en las posiciones 2 y 5 del anillo central del sistema conjugado (17). Esta discusión plantea la presencia de una fuerte interacción mesomérica de los grupos sustituyentes -OR con el sistema FV, permitiendo el acercamiento del estado S2 hasta los estados S1 y S0, tras lo cual, se forma una nueva transición, visible y en forma de hombro, transición adicional a la normalmente encontrada entre estados π.
En cuanto a fluorescencia, los tres sistemas FV estudiados mostraron fotoluminiscencia en la región azul del espectro visible con máximos de emisión aproximadamente sobre 445 nm. Un análisis más riguroso del color de emisión (aquel detectado por el ojo humano), usando el diagrama de cromaticidad de la Commission Internationale de L'Eclairage (CÍE) arroja unos valores para las coordenadas X, Y de 0,125; 0,361 (FV-CH2CH2OH), 0,131; 0,323 (FV-TriOCH3 ) y 0,134; 0,370 (FV-OCH3), lo cual significa una emisión de color azul-verde, según el diagrama de cromaticidad (18). La Figura 4 muestra los espectros de emisión con perfiles similares al encontrado para los espectros de absorción pero invertidos; con una relajación de alta intensidad y energía desde el nivel vibracional más bajo dentro del nivel excitado S1 hasta el nivel basal S0, y una relajación adicional mostrada como un hombro en el espectro, posiblemente debido a la transición, sugerida por otros autores, de relajación desde el estado S1 hasta un nivel vibracional de mayor energía dentro del S0. Otra característica muy notoria en los espectros es la poca resolución vibracional, característica generalmente encontrada en los espectros para los sistemas fenilvinilideno poliméricos u oligoméricos (7).
Rendimiento cuántico
Las técnicas para estimar el rendimiento cuántico en estructuras altamente conjugadas pueden agruparse en dos: métodos absolutos (19) y relativos (20). Los primeros carecen de popularidad debido principalmente al uso de metodologías e instrumentos con requerimientos tecnológicos altos, lo cual implica grandes inversiones económicas. Por su parte, los métodos relativos son más accesibles, ya que requieren inversiones instrumentales bajas y se basan en el empleo de sustancias patrón con rendimientos cuánticos ampliamente estudiados y conocidos, usadas como referencia, sustancias de fácil adquisición y uso.
Los resultados encontrados para los sistemas FV estudiados bajo el método relativo a partir de la ecuación 1 y los espectros de absorción y emisión se muestran en la Tabla 1. En esta se puede observar que de todos los sistemas estudiados el rendimiento cuántico del sistema FV-Tri-OCH3 es el mayor. En comparación con el sistema FV-CH2CH2OH los resultados sugieren que los grupos metoxilos tienen una influencia positiva sobre este valor en comparación con los grupos hidroxietilos. Por otro lado, si se compara el FV-OCH3 con el FV-Tri-OCH3, la Tabla muestra que el efecto no es aditivo al número de grupos metoxilos presentes, pero que sí hay una tendencia creciente.
Al realizar una comparación de los rendimientos cuánticos obtenidos con los reportados para algunas moléculas similares usadas actualmente para la construcción de dispositivos en la electrónica de polímeros (Tabla 2), se puede asegurar que los sistemas sintetizados y, por consiguiente, sus correspondientes polímeros análogos, tienen un gran potencial en aplicaciones como los OLED, donde se busca altas eficiencias en los procesos radiativos como la fluorescencia. Por el contrario, los sistemas FV estudiados aquí tendrían bajos desempeños en aplicaciones como celdas solares, donde se busca favorecer procesos de relajación electrónica en los cuales el paso desde el estado excitado al estado basal se hace sin emisión de luz, lo que se conoce como procesos no radiativos, por ejemplo, el transporte de cargas. Es de resaltar que los sistemas FV estudiados en este trabajo presentan rendimientos cuánticos inclusive mayores a los reportados para estructuras químicas idénticas. Al comparar el rendimiento cuántico de PPV-oligomer (Tabla 2) y FV-Tri-OCH (Tabla 1) se puede concluir que el sistema FV en este trabajo obtenido presenta un valor dos veces mayor al reportado en la literatura. Lo anterior debido esencialmente a que la metodología de síntesis empleada en este trabajo (reacción de Heck) es diferente a las reportadas anteriormente y garantiza la pureza configuracional trans de las moléculas, por lo tanto, los rendimiento cuánticos aumentan significativamente.
No obstante, los sistemas FV podrían ser considerados solo como oligomeros y la Tabla 2 los compara con algunos polímeros. Resultados previos reportados por nuestro grupo (7) y otros (22, 24) muestran que los valores obtenidos para las propiedades optoelectrónicas de una molécula análoga FV se pueden extrapolar consistentemente solo a polímeros segmentados, prediciendo con bastante exactitud su comportamiento optoelectrónico, ya que la parte conjugada de la molécula análoga y la del polímero segmentado conservan características estructurales idénticas, y adicionalmente y no menos importante, la misma longitud de conjugación, que en este caso es de 2% unidades de conjugacion.
Los resultados aquí encontrados presentan una primera aproximación al efecto de grupos electrodonores en el sistema conjugado sobre el rendimiento cuántico y describen la importancia del método de síntesis para obtener altas eficiencias cuánticas.
REFERENCIAS BIBLIOGRÁFICAS
1. Burroughes, J.; Bradley, D.; Brown, A.; Marks, R.; Mackay, K.; Friend, R.; Burns, P.; Holmes, A. Light emitting diodes base on conjugated polymers. Nature. 1990. 347: 539-541. [ Links ]
2. Grinsdale, A.; Chan, K.; Martin, R.; Jokiz, P.; Holmes, A. Synthesis of light-emitting conjugated polymers for applications in electroluminescent devices. Chem. Rev. 2009. 109 (3): 897-1091. [ Links ]
3. Cheng, Y.; Yang, S.; Hsu, C. Synthesis of conjugated polymers for organic solar cell applications. Chem. Rev. 2009. 109 (11): 5868-5923. [ Links ]
4. Prodi, L.; Bolletta, F.; Montalti, M.; Zaccheroni, N. Luminescent chemosensors for transition metal ions. Coordination Chemistry Reviews. 2000. 205: 59-83. [ Links ]
5. Rathnayake, H.; Cirpan, A.; Karasz, F.; Odoi, M.; Hammer, N.; Barnes, M.; Lahti, P. Luminescence of Molecular and Block Copolymeric 2,7-Bis(phenylethenyl)-fluorenones; Identifying Green-Band Emitter Sites in a Fluorene-Based Luminophore. Chem. Mater. 2007. 19 (13): 3265-3270. [ Links ]
6. Rathnayake, H.; Cirpan, A.; Lahti, P.; Karasz, F. Optimizing LED properties of 2,7-Bis(phenylethenyl) fluorenes. Chem. Mater. 2006. 18 (2): 560-566. [ Links ]
7. Sierra, C.; Lahti, P. A photoluminescent, segmented oligo-polyphenylenevinylene copolymer with hydrogen-bonding pendant chains. Chem. Mater. 2004. 16 (1): 55-61. [ Links ]
8. Lakowicz, J. Principles of fluorescence spectroscopy. USA, Springer. 2006, p. 54. [ Links ]
9. Demas, J.; Crosby, G. The measurement of photoluminescence quantum yields. J. Phys. Chem. 1971. 75 (8): 991-1024. [ Links ]
10. Heck, R.; Nolley, J. palladium-catalyzed vinylic hydrogen substitution reaction with aryl, benzyl, and styryl halides. J. Org. Chem. 1972. 37 (14): 2320-2322. [ Links ]
11. Cárdenas, J.; Sierra, C.; Fadini, L. Triphenylphosphite and ionic liquids: positive effects in the heck cross-coupling reaction. 2010. Tetrahedron Lett. D.O.I: 10.1016/j. tetlet.2010.10.104. [ Links ]
12. Williams, A.; Winfield, S.; Miller, J. Relative fluorescence quantum yields using a computer-controlled luminescence spectrometer. Analyst. 1983. 108: 1067-1071. [ Links ]
13. Conley, F. Infrared spectroscopy. USA, Allyn and Bacon Inc., 1972, p. 100. [ Links ]
14. Nathan, J. Resonancia magnética nuclear de hidrógeno. USA, Eva V. Chesneau, 1973, p. 58. [ Links ]
15. Zyung, T.; Hwang, T.; Kang, I.; Shim, H.; Hwang, W.; Kim, J. Novel blue electroluminescent polymers with well-defined conjugation lenght. Chem. Mater.1995. 7 (8): 1499-1503. [ Links ]
16. Sarker, A.; Kaneko, Y.; Lahti, P.; Karasz, F. Excited states of bromine-substituted distyrylbenzenes: Models for conjugated polymer emission. J. Phys. Chem. A. 2003, 107: 6533-6537. [ Links ]
17. Ndayikengurukiye, H.; Jacobs, S.; Tachelet, W.; Van Der Looy, J.; Pollaris, A.; Geise, H.; Claeys, M.; Kauffmann, J.; Janietz, S. Alkoxylated p-phenylenevinylene oligomers: synthesis and spectroscopic and electrochemical properties. Tetrahedron 1997, 53: 13811-13828. [ Links ]
18. Trezona, P. Derivation of the 1964 CIE 10° XYZ colour-matching functions and their applicability in photometry. Color Res. Appl. 2001. 26 (1): 67-75. [ Links ]
19. Hamai, S.; Hirayama, F. Actinometric determination of absolute fluorescence quantum yields. J. Phys. Chem. 1983. 87(1): 83-89. [ Links ]
20. Demas, J.; Crosby, G. Measurement of photoluminescence quantum yields review. J. Phys. Chem. 1971. 75 (8): 991-1024. [ Links ]
21. Arnautov, S.;Nechvolodova, E.; Bakulin, A.; Elizarov, S.; Khodarev, A.; Martyanov, D.; Paraschuk, D. Properties of MEH-PPV films prepared by slow solvent evaporation. Synthetic Metals. 2004. 147: 287-291. [ Links ]
22. Ali, B.; Jabar, S.; Salih, W.; Al Tamimi, R.; Al Attar, H.; Monkman, A. Synthesis and spectroscopic characterization studies of low molecular weight light emitting PPV segmented copolymers. Optical Materials. 2009. 32: 350-357. [ Links ]
23. Akcelrud L. Electroluminicent polymers. Prog. Polym. Sci. 2003. 28: 875-962. [ Links ]
24. Sun, R.; Wang, Y.; Wang, D.; Zheng, Q.; Kyllo, E.; Gustafson, T.; Wang, F.; Epstein, A. high PL quantum efficient of poly(phenylene vinylene) systems through exciton confinement. Synthetic Metals. 2000. 111-112: 595-602. [ Links ]
25. Lin, H.C. Synthesis and characterization of light-emitting oligo (p-phenylene-vinylene)s and polymeric derivatives containing three-and five-conjugated phenylene rings. II. Electro-optical properties and optimization of PLED performance J. Polymer Sc. Part A: Polym. Chem. 2005. 44: 783-800. [ Links ]