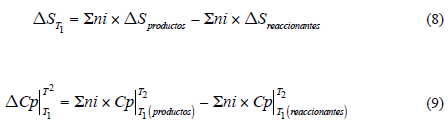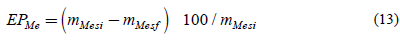Introducción
La demanda de hidróxido de níquel (II) como precursor del óxido para baterías recargables es cada vez mayor, esto por el incremento del uso de vehículos eléctricos e híbridos que reducen el consumo de combustible fósil y la emisión de gases perjudiciales al medio ambiente [1].
El hidróxido de níquel (II) se caracteriza por tener contenidos de níquel superiores a 55% y bajos porcentajes de impurezas aniónicas. Sus polimorfos fundamentales son: la fase α-Ni(OH)2, caracterizada por su alto grado de hidratación y la fase β-Ni(OH)2 que es la más estable. Por tal razón, esta última se utiliza en mayor medida para la producción de baterías recargables comerciales [2-4].
Generalmente este hidróxido se obtiene por precipitación química cuando reacciona una sal de níquel en disolución acuosa con una base. Se prefieren hidróxidos de sodio y amonio para lograr un producto que cumpla los requerimientos necesarios en las baterías [5]. El empleo de una disolución del ion amonio es importante para favorecer el proceso de precipitación, ya que reduce la velocidad de formación del hidróxido de níquel (II) y garantiza un mejor control de la distribución de tamaños y la forma de las partículas. No obstante, un contenido excesivo de amonio en la disolución puede disminuir el rendimiento del proceso de precipitación debido al incremento de la concentración de iones complejos solubles del tipo [Ni(NHn]2+ [6].
El mecanismo general de reacción para la síntesis del hidróxido de níquel (II) con hidróxidos de amonio y sodio se basa en dos etapas: la formación del catión complejo amoniacal y la precipitación del hidróxido de níquel [7].
La capacidad y la vida útil del hidróxido de níquel (II) como material activo de las baterías recargables alcalinas puede incrementarse mediante procesos de coprecipitación química, en los cuales se emplean disoluciones acuosas que contienen, fundamentalmente, especies de níquel, cobalto y manganeso procedentes de cátodos, polvos, óxidos y sales de alta pureza [6,8].
Con un propósito similar, varios autores reportan la obtención de hidróxido de níquel (II), empleando disoluciones acuosas multicomponentes generadas a partir de baterías gastadas, catalizadores saturados, residuales de los procesos de electrólisis y minerales de sulfuro de cobre y níquel. Estas disoluciones contienen sulfatos de níquel, cobalto, hierro, cobre, manganeso, zinc, sodio, calcio y magnesio, entre otras especies metálicas.
En la mayoría de los procesos antes mencionados se separan previamente las impurezas, tales como: calcio, magnesio y sodio hasta niveles inferiores al 3% de la concentración total de iones metálicos disueltos. Solo se dejan en disolución las especies químicas de interés cuya presencia en el hidróxido posteriormente precipitado puede beneficiar el rendimiento electroquímico de las baterías [9-12].
Uno de los retos del empleo de las disoluciones multicomponentes en la coprecipitación con hidróxidos de amonio y sodio es mantener el control estricto de las condiciones de reacción, ello para garantizar que la composición química y física de la mezcla de hidróxidos metálicos sea la adecuada. Los referidos hidróxidos precipitan a distintos valores de pH debido a las diferencias de solubilidad de los iones metálicos en disolución, lo que complejiza el proceso. Por tal motivo, es usual establecer las condiciones de síntesis directamente a partir de resultados experimentales, conseguidos con la ejecución de un considerable número de pruebas, [9-12].
Alternativamente, las mejores condiciones para obtener el hidróxido de níquel (II) pueden definirse de forma preliminar mediante cálculo termodinámico de las variaciones de entalpía, entropía y energía libre de Gibbs, en interrelación con las constantes de solubilidad (Ks) de cada una de las especies metálicas involucradas. También pueden emplearse diagramas de estabilidad o de zonas de predominancia de las especies químicas que son muy útiles para interpretar resultados y predecir condiciones de operación de los procesos, [13-15].
El uso de modelos de predicción de las condiciones de síntesis, basados en la combinación de ecuaciones de balance de masas y de equilibrio termodinámico para optimizar variables como pH de precipitación y concentraciones iniciales de reactivos, conduce a la resolución de sistemas de ecuaciones no lineales. Estos modelos son más complejos cuando se incrementa el número de especies químicas involucradas en las reacciones que caracterizan el estado de equilibrio. Con frecuencia los mismos se emplean para el análisis de sistemas acuosos en los que intervienen especies químicas de no más de tres elementos metálicos, con disoluciones de baja fuerza iónica (I ≤ 0,3 mol.L-1), para las cuales se asume un comportamiento ideal [13, 16, 17].
A partir de los concentrados de sulfuros del proceso de producción de níquel de la tecnología Caron en Cuba se pueden obtener disoluciones acuosas con concentración de iones metálicos inferior o igual a 1,5 molL-1 y fuerza iónica entre 4 y 5 molL-1. Las mismas contienen sulfatos de níquel, cobalto, hierro, cobre, zinc, manganeso, calcio y magnesio y, a pesar de su composición química heterogénea, podrían ser utilizadas para obtener hidróxido de níquel (II), con propiedades físicas y químicas que posibiliten su uso en las baterías recargables y en otras aplicaciones para diversificar la producción.
La definición de las condiciones apropiadas para la síntesis del hidróxido de níquel (II) a partir de estas disoluciones puede requerir un arduo trabajo experimental.
Teniendo en cuenta lo anterior, el propósito de este trabajo fue precisar, a través de análisis termodinámico y validación experimental, las condiciones más favorables para la síntesis de hidróxido de níquel (II) por precipitación química, empleando la disolución acuosa multicomponente generada durante la lixiviación del sulfuro de níquel de la tecnología Caron.
Materiales y métodos
Materiales y reactivos
Se empleó hidróxido de amonio (25% p/p, Merck, Alemania), hidróxido de sodio (98% de pureza, Merck, Alemania) y una disolución de sulfato de níquel (II) generada en pruebas a escala de banco de lixiviación oxidante del sulfuro obtenido en la Empresa Productora de Níquel y Cobalto Ernesto Che Guevara (Punta Gorda, Cuba) (Tabla 1).
Tabla 1 Composición química promedio de la disolución de sulfato de níquel, molL-1, (Densidad: 1,15 kgL-1; Fuerza iónica: 4,6 M; pH: 1,2).
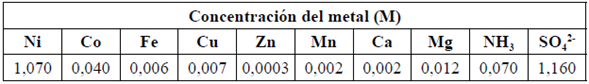
Se utilizó agua destilada para preparar las disoluciones de hidróxido de amonio y sodio con las concentraciones previstas en los experimentos iguales a 12,4 y 5,5 molL-1, respectivamente.
Equipos
La síntesis del hidróxido de níquel (II) se realizó en un reactor cilíndrico encamisado de siete litros de capacidad, provisto de un agitador de paletas y conectado a un termostato para garantizar la temperatura de trabajo. Las disoluciones se alimentaron al reactor con bombas peristálticas y para el control del pH se utilizó un medidor marca Hanna con electrodo de vidrio.
Para determinar la composición química de las disoluciones estudiadas y los productos obtenidos, se empleó un espectrofotómetro de absorción atómica, con llama y generador de hidruros, modelo SOLAR 929, UNYCAM.
Las fases mineralógicas presentes en el producto precipitado se analizaron por difracción de rayos X en polvo en un Difractómetro X'PERT3 de PANalytical. Se emplearon las siguientes condiciones: Barrido tipo Gonio en [°2θ] registro angular desde 4,004 hasta 79,996 con distancia de paso en °2θ de 0,008, radiación de cobre y filtro de níquel. La diferencia de potencial fue de 40 kV y corriente de 30 mA. La calibración del equipo se chequeó con patrón externo de silicio. Para identificar las fases se utilizó el programa HighScore de Panalytical.
Estudio termodinámico de las reacciones objeto de interés
El análisis termodinámico se realizó en un sistema del tipo Me(II) - SO4 2- -NH3 - OH-, donde Me(II) corresponde a los cationes metálicos: Ni2+, Co2+, Fe2+, Cu2+, Mn2+, Zn2+, Mg2+ y Ca2+. Las reacciones principales consideradas en este sistema incluyen la formación del catión complejo amoniacal, precipitación de hidróxidos metálicos y regeneración del hidróxido de amonio, Ec. (1), (2) y (3), [7, 13, 18].
A partir de la suma de las Ecs. (1), (2) y (3) se obtiene la reacción global del proceso Ec. (4):
La Ec. (4) se tomó como base para predecir la espontaneidad termodinámica y extensión de la reacción de los hidróxidos metálicos con la variación de la temperatura.
Las propiedades termodinámicas variación de entalpía (∆H), de entropía (∆S), de energía libre (∆G) y la constante de equilibrio (Ke) se determinaron mediante las Ecs. (5), (6), (7), (8), (9) y (10) [19, 20]:
Donde:
∆HT1, ∆GT1, ∆ST1: Variaciones de entalpía, energía libre y entropía a 298 K, respectivamente [19, 21-23].
∆HT2, ∆GT2, ∆ST2: Variaciones de entalpía, energía libre y entropía respectivamente, a las temperaturas de trabajo (303, 323 y 343 K).
Cp : Capacidad calorífica, kJ (mol-K)-1. (Datos de Cp, tomados de Criss y Cobble [19] para iones en solución y de Naumov [22] y Chase [23] para compuestos sólidos).
ni : Número de moles de cada sustancia que participa en la reacción.
R: Constante universal de los gases ideales (8 314 kJ/(molK).
Ke: Constante de equilibrio.
Se analizó el comportamiento de la constante de solubilidad (Ks) de la precipitación de hidróxidos metálicos a 298 K y a la temperatura seleccionada, tomando como referencia los datos reportados en la literatura [24] y la reacción inversa de la Ec. (4), respectivamente. Los valores de log (Ks) a la temperatura seleccionada se calcularon mediante la Ec. (11):
Estudio de la estabilidad en disolución de las especies químicas
Con la finalidad de aportar criterios para la selección de los intervalos de concentración de amoníaco y los valores de pH más favorables a emplear en la obtención del hidróxido de níquel (II), se utilizó el programa Medusa para sistemas en equilibrio químico. El mismo usa un algoritmo basado en el cálculo de la mínima energía libre del sistema de reacción [15, 25].
El programa crea gráficos bidimensionales de zonas de predominancia de las especies químicas, a partir de los datos suministrados por el investigador sobre los componentes del sistema, sus concentraciones iniciales y el valor de la fuerza iónica (I) que constituyen variables de entrada.
El valor de la fuerza iónica se calculó mediante la Ec. (12) [26]:
Donde:
zi: carga del ion
ci: concentración molar del ion, mol.L-1
La disolución de sulfatos metálicos empleada en este estudio presentó una fuerza iónica moderada (I = 4,6 mol L-1), lo cual indica que su comportamiento no es ideal y se requiere una mayor concentración de iones OH- para lograr la precipitación de las especies metálicas. En medios de fuerza iónica moderada o alta es difícil calcular teóricamente el consumo del agente neutralizante, ya que no siempre están disponibles los datos de actividad o coeficientes de actividad de las sustancias. Por tal razón, se pueden aprovechar los datos aportados por las curvas de valoración [27].
Considerando lo antes explicado, se simuló con el programa Medusa la curva de valoración potenciométrica de la disolución objeto de estudio. A partir de esta curva se seleccionaron las concentraciones molares de los iones hidróxido para construir los diagramas de predominancia de las especies químicas de níquel. Los diagramas construidos mostraron el valor de la fracción molar de cada una de las especies con respecto a la concentración total de amoníaco. Posteriormente se analizó la influencia de cada una de las variables de entrada sobre la reacción entre especies disueltas.
Para complementar los criterios de selección del pH y la concentración de amoníaco, se analizó el comportamiento de la solubilidad (S) de los iones metálicos presentes en la disolución de sulfato de níquel (II) a diferentes concentraciones de iones hidróxido y amoníaco en el sistema Me(II) - SO4 2-- NH3 - OH- a 298 K y 101325 Pa, tomando como base datos de constantes de solubilidad, log (Ks), y gráficos generados por el programa.
Síntesis y caracterización del hidróxido de níquel (II) eficiencia de precipitación
La síntesis de hidróxido de níquel (II) se realizó después de preseleccionar las condiciones termodinámicas más favorables, según lo explicado en los apartados anteriores. Se ejecutaron las pruebas a 303 K, con valores de pH iguales a 9, 11 y 13 y concentraciones de amoníaco iguales a 0,5 y 1,0 molL-1.
La formación del complejo amoniacal y precipitación de hidróxido de níquel (II) se logró mediante la reacción de la disolución de sulfato de níquel, (Tabla 1), con hidróxidos de amonio y sodio, según la siguiente metodología [28]:
Se tomaron las cantidades específicas de las disoluciones de sulfato de níquel e hidróxido de amonio y se añadieron al reactor de manera simultánea y continua para propiciar la formación del complejo amoniacal de níquel. Posteriormente se adicionó la disolución de hidróxido de sodio. Se utilizaron bombas peristálticas para regular el flujo y controlar el pH. Una vez alcanzado el pH de trabajo, se continuó agitando la mezcla durante 100 min. La pulpa de hidróxido de níquel se filtró, se lavó con agua destilada y se secó en estufa a 85 oC durante 24 h. Luego, se homogeneizó el tamaño de partícula del hidróxido de níquel (II) en un molino de bolas. Posteriormente se realizó la caracterización fisicoquímica y la identificación de las fases mineralógicas.
Se comprobó experimentalmente y se analizó la efectividad de las condiciones de síntesis precisadas en el análisis termodinámico mediante el cálculo de la eficiencia de precipitación de los iones metálicos de la disolución, según la Ec. (13).
Donde:
EPMe: Eficiencia de precipitación de especie metálica, en %
mMesi: Masa de especie metálica en disolución inicial, en g
mMesf: Masa de especie metálica en disolución final, en g
Resultados y discusión
Estudio termodinámico de las reacciones de interés
La variación de entalpía (∆H), entropía (∆S) y energía libre (∆G) en el intervalo de temperatura estudiado se presentan en la Tabla 2.
Tabla 2 Valores calculados1 de entalpía: HT, entropía: ST y energía libre: GT.
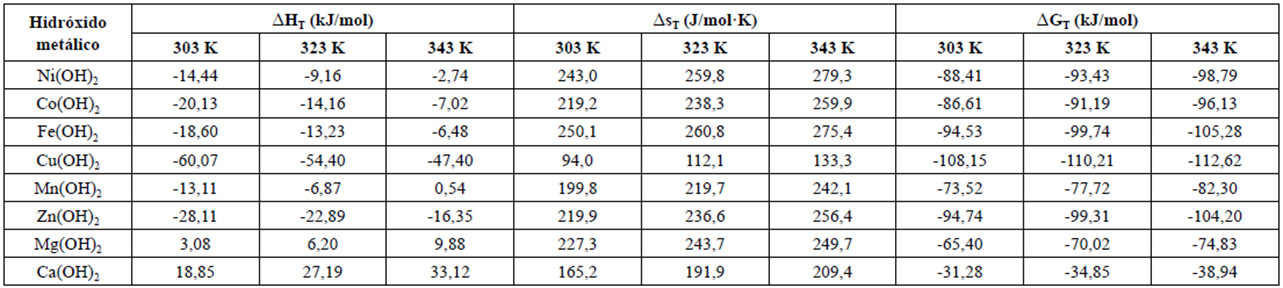
1∆HT ± 2,5 kJ∙mol-1, ∆ST ± 2,0 J∙(mol∙K)-1 y ∆GT ± 2,0 kJ∙mol-1, según los datos reportados por Naumov y Criss y Cobble a 298 K [19, 22, 29].
Los datos reportados en la Tabla 2 demuestran que las reacciones de precipitación de hidróxidos metálicos estudiados son exotérmicas (∆H < 0), excepto las que corresponden a la formación de los hidróxidos de magnesio y calcio en todo el intervalo de temperatura estudiado y el manganeso a 343 K.
Los valores de variación de entropía son positivos, lo que favorece la espontaneidad de todas las reacciones analizadas. A pesar del carácter endotérmico del proceso de formación de hidróxidos de calcio, magnesio y manganeso (T = 343 K), sus reacciones son espontáneas (∆G < 0) porque el efecto asociado a la variación de entalpía es inferior a los efectos entrópicos.
Por otro lado, a partir de la Ec. (4), donde se forma un sólido, debería esperarse una disminución en la entropía; pero el sistema objeto de estudio y los procedimientos aplicados no son simples. La referida ecuación representa la reacción global de un sistema en el cual la formación de aminocomplejos tiene un efecto no despreciable.
La variación de energía libre indica que los procesos de formación de hidróxido son espontáneos (∆G < 0). Este hecho evidencia la posibilidad de coprecipitación de los iones Cu2+, Fe2+, Zn2+, Co2+, Mn2+, Mg2+ y Ca2+, que sería muy favorable para aprovechar la riqueza catiónica de la disolución de partida en función de mejorar las propiedades del producto sólido obtenido [11].
Los valores de la constante de equilibrio para las temperaturas seleccionadas se muestran en la Figura 1. Se observa que el aumento de la temperatura desde 298 a 343 K no provoca cambios sustanciales en la extensión de las reacciones estudiadas, siendo ligeramente favorecidas a menor temperatura. Se exceptúan de este comportamiento las reacciones de formación de Mg(OH)2, Ca(OH)2 y Mn(OH)2 (solo a T > 343 K) por ser endotérmicas, a partir del principio de Le Chatelier.
Los aspectos descritos anteriormente sugieren la conveniencia de realizar el proceso a 303 K, que es la temperatura ambiental promedio de la región de Moa [30]. De esta forma no sería necesario calentar la disolución de partida, posibilitando el consiguiente ahorro de portadores energéticos durante el escalado industrial.

Figura 1 Comportamiento de la constante de equilibrio de precipitación de hidróxidos metálicos, (Ke).
Los valores de log (Ks) de los hidróxidos metálicos a 303 K se comparan con los reportados a 298 K en la literatura especializada [24], (Tabla 3):
Los compuestos más insolubles poseen constantes de solubilidad menores y precipitan más fácilmente. Según los valores calculados del log (Ks) a 303 K, el orden de precipitación de los hidróxidos metálicos es el siguiente: cobre, zinc, hierro, níquel, cobalto, manganeso, magnesio y calcio.
La solubilidad de los hidróxidos metálicos precipitados a 298 y 303 K es muy similar, lo que permite utilizar la información obtenida con el programa Medusa como referencia en la evaluación experimental del comportamiento del proceso de precipitación a 303 K.
Estudio de estabilidad de las especies químicas en disolución
En la curva de valoración potenciométrica de la disolución objeto de estudio se distinguen claramente dos saltos identificados con los números 1 y 2, que corresponden con las dos reacciones de neutralización (1) y (2) involucradas en la obtención del hidróxido de níquel. El salto 1 comprende un intervalo de pH entre 6,8 y 10,8 con un punto medio igual 8,8; mientras el salto 2 abarca desde 10,8 hasta 12,3 y un valor medio de 11,5. Por encima del valor máximo del salto 2, el pH se incrementa más lentamente a partir de pH de 13,1; indicando fin de la reacción (Figura 2).

Figura 2 Curva de valoración de la solución de sulfato de níquel generada con programa Medusa. T = 298 K; I = 4,6 molL-1.
El estudio anterior constituye la base para elegir los valores de pH y concentración molar de iones hidróxido, [OH-], que se suministran como datos de entrada al programa Medusa para la construcción de los diagramas de predominancia. Se seleccionan los valores de pH 9, 11 y 13 que corresponden a [OH-] iguales a 1,9; 2,2 y 2,5 molL-1, respectivamente.
La figura 3 muestra los diagramas de predominancia de las diferentes especies de níquel cuya estabilidad varía en dependencia de la concentración de amoníaco y del pH o de la concentración de iones OH-.

Figura 3 Fracción de las especies químicas de níquel. Aplicación del software Medusa-Hydra. T = 298 K; I = 4,6 molL-1; (a)- pH = 9,0 y [OH-]= 1,9 molL-1; (b)- pH = 11,0 y [OH-]= 2,2 molL-1; (c)- pH = 13,0 y [OH-]= 2,5 molL-1.
Se observa el predominio del hidróxido de níquel (II) y una mayor estabilidad de los complejos amoniacales de níquel con cinco y seis ligandos, para concentraciones menores de hidróxido (pH iguales a 9 y 11) y de amoníaco superiores a 0,4 molL-1 (Figuras 3 a y b).
Bajo las condiciones anteriormente mencionadas, podrían beneficiarse las características estructurales y morfológicas del hidróxido de níquel (II), porque se lograría la formación previa de los aminocomplejos de níquel(II), los cuales propician una menor velocidad de precipitación del hidróxido [6]. Sin embargo, a pH = 9 y [NH3] > 1,0 molL-1, la fracción molar de hidróxido de níquel (II) desciende hasta valores inferiores a 0,94; es decir que menos del 94% de los iones de Ni2+ de la disolución de partida son estables como hidróxido. Tal comportamiento indica el efecto perjudicial que puede tener el incremento de la concentración de amoníaco sobre el rendimiento del proceso (Figura 3 a).
A pH = 11, el efecto de la concentración de amoníaco es menor. La estabilidad del ion hexaminníquel(II) comienza a ser perceptible por encima de [NH3] = 1,1 molL-1, con fracciones de hidróxido de níquel(II) superiores a 0,98 (Figura b).
Para [OH-] igual a 2,5 molL-1 (pH= 13), la fracción de hidróxido de níquel (II) es igual a uno, en un amplio intervalo de concentraciones de amoníaco, con la disminución de la estabilidad de los aminocomplejos de níquel (II). Solo el complejo hexaminníquel (II) es estable para altas concentraciones de amoníaco (iguales o mayores que 3,3 molL-1) (Figura 3 c). Este aspecto podría constituir un comportamiento no deseado para el proceso, porque se necesitarían altas concentraciones de amoníaco para lograr la formación del complejo amoniacal con el consiguiente encarecimiento del proceso en el escalado industrial
Lo antes explicado indica que la síntesis de hidróxido de níquel (II) en el intervalo de pH entre 9 y 11, con concentraciones de amoníaco entre 0,4 y 1,1 molL-1 es recomendable para garantizar la formación del complejo [Ni(NH3)6]2+ y una precipitación como hidróxido de los iones de níquel de la disolución de partida superior al 94%.
No obstante, no se descarta totalmente la posibilidad de trabajar a pH 13, teniendo en cuenta que la recuperación de níquel en forma de hidróxido puede ser mayor.
La solubilidad (S) de los diferentes iones metálicos de la disolución en el valor promedio de concentración de amoníaco del intervalo referido anteriormente (0,75 molL-1) se muestra en la figura 4. Se observa un marcado descenso para los iones de níquel desde 0,038 molL-1 (log S = -1,42) a pH = 11, hasta 1,585 • 10-6 mol L-1 (log S= -5,8) a pH = 11,6. Para este último valor de pH, la solubilidad de los iones Ni2+, Co2+, Fe2+ muestra un comportamiento similar.
Solo los iones Mg2+ experimentan un cambio de solubilidad mayor con el pH, debido al exceso de álcali del medio de reacción a partir de pH = 11,3 y la baja estabilidad de los complejos que forma con el amoníaco [31, 32].
Los iones Cu2+, Zn2+, Ca2+ y Mn2+ no presentaron cambios importantes en la solubilidad para diferentes pH y, en general, fueron los más solubles. Los resultados antes descritos sugieren que podría lograrse la coprecipitación mayoritaria de los iones Ni2+, Co2+, Fe2+ y Mg2+ y en menor cuantía de los restantes, a partir del intervalo de pH comprendido entre 11,3 y 11,6 que corresponde a concentraciones de iones OH- iguales a 2,2 y 2,3 molL-1, respectivamente. Las concentraciones de iones OH-y pH por debajo de estos valores no garantizan suficiente disminución de solubilidad para lograr altos niveles de precipitación de los cationes analizados (Figura 4)
Comprobación experimental de la precipitación de hidróxido de níquel (II)
La composición química del hidróxido obtenido a diferentes valores de pH fue similar. Los mayores contenidos de níquel y cobalto en el hidróxido se obtuvieron para las muestras precipitadas a pH iguales a 11 y 13 (Tabla 4).
En correspondencia con la composición química mostrada en la Tabla 4, la masa de níquel precipitado representa el 95% de la masa total de cationes incluidos en el hidróxido, mientras que el contenido de cobalto constituye del 2,5 al 3,5%, el hierro del 0,85 al 1,0% y los restantes cationes reportan menos de 0,5%. La composición multicatiónica del producto propiciaría mejoras en las propiedades eléctricas y la vida útil del material activo de las baterías recargables, esto debido al efecto sinérgico de las diferentes especies metálicas [11, 33].
Por difracción de rayos X se observa que el producto principal obtenido coincide con el reportado por Hall y colaboradores [34] y corresponde al compuesto beta-hidróxido de níquel (II), con código 00-14-117 identificado como Theophrastite syn en la base de datos ICDD (International Center for Diffraction Data) Esta fue la única fase identificada a pH 11 y 13 (Figura 5 b). En el difractograma obtenido a pH igual 9 (Figura 5 a) se detectó además la presencia de sulfatos de níquel (II), hexa y heptahidratados, con códigos: 01-079-0189 y 00-001-0403 (Base de datos ICDD), identificados como níquelhexahidrato y morenosita, respectivamente, indicando insuficiente precipitación como hidróxido de los iones Ni2+.
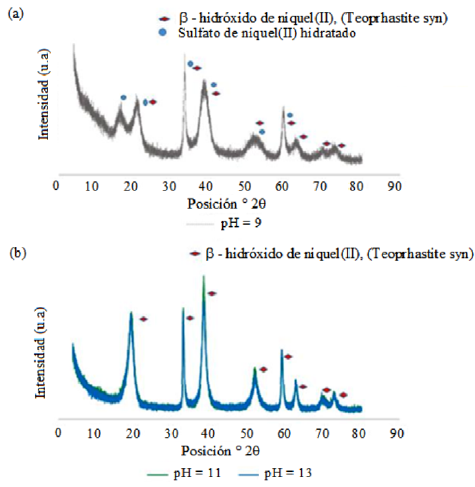
Figura 5 Difractogramas del hidróxido de níquel (II). T= 303 K; [NH3] = 0,5 molL-1. a) pH=9, b) pH=11 y pH=13.
Estos resultados concuerdan con el análisis de la estabilidad de las distintas especies de níquel realizado en secciones anteriores, reafirmando que el hidróxido de níquel (II) es más estable a pH entre 11 y 13) (Figura 5 b).
La figura 6 muestra el comportamiento de la eficiencia de precipitación de los cationes con respecto a la concentración de amoníaco. Se observa que la concentración de amoníaco igual a 1,0 molL-1 influye negativamente en la eficiencia de precipitación de los iones Cu2+, Zn2+ y Ni2+, lo que se corresponde con los valores de constantes de estabilidad de los compuestos complejos amoniacales formados por estos cationes [31]
En el caso del catión Ni2+, el resultado obtenido corrobora lo planteado por otros investigadores. Se observa una mayor estabilidad de los iones complejos amoniacales de níquel formados a medida que aumenta la concentración de amoníaco, lo que conlleva al incremento de la solubilidad de estos iones y una precipitación incompleta de Ni2+ [6, 10]. Este aspecto debe tomarse en cuenta ya que podría afectar el rendimiento general del proceso si se realiza la precipitación a pH= 9 (Figura 6).
Como se muestra en la Figura 6, se obtuvieron altas eficiencias de precipitación de los cationes metálicos, exhibiendo los mejores resultados con valores de pH iguales a 11 y 13 (alrededor del 99%), mientras que a pH igual a 9 precipitó el 96% de los iones de níquel presentes en la disolución de partida, (Tabla 5).
Tabla 5 Valores promedio de eficiencia de precipitación de hidróxidos, (%) (T= 303 K, [NH3] = 0,5 mol-L-1) (0,11 < s < 0,2)

La eficiencia de precipitación a pH = 9 también presentó una alta eficiencia, pero la presencia de sales hidratadas de níquel en el producto final obtenido, identificadas por difracción de rayos X, figura 5 a, exigiría un lavado más intenso del producto, con el incremento del consumo de agua en el proceso.
La eficiencia de precipitación de los iones Ni2+, Zn2+ y Mn2+ se incrementa ligeramente con el aumento del pH. En el caso de los iones Fe2+ y Co2+, la eficiencia de precipitación no muestra cambios importantes.
En el caso del cobalto, este metal posee estados de oxidación +2 y +3 en los complejos que forma con el amoniaco, lo que puede tener implicación en sus procesos de precipitación y la composición del hidróxido de níquel obtenido. En la tabla 5 se observan altas eficiencias de precipitación de iones Co2+. Esto sugiere que, bajo las condiciones empleadas en los experimentos, [NH3] = 0,5 mol-L-1, y a pesar de las particularidades asociadas a la formación y oxidación y reducción de los aminocomplejos de cobalto, se ha favorecido la formación del hidróxido de este metal.
Para los iones Cu2+ hay una marcada reducción de la concentración a pH = 13, sugiriendo la posible redisolución de parte del Cu(OH)2 precipitado debido a la reacción con el hidróxido de amonio regenerado, según la Ec. (3) [35].
Los iones Mg2+ presentan un comportamiento aparentemente contradictorio. Para valores de pH menores, la eficiencia de precipitación es la más baja. Su Ks en ausencia de amoniaco es una de las más altas con respecto a los demás iones metálicos (5,61-10-12; log Ks= -11,1) (Tabla 3). Sin embargo, a pH= 13 se logra una precipitación superior al 99%, probablemente porque su comportamiento está menos influenciado por la presencia del amoniaco en el medio de reacción. Este ion forma complejos muy débiles con el amoniaco [32].
La eficiencia de precipitación de cada uno de los iones metálicos se comporta conforme a los resultados del estudio de solubilidad teórico expuesto en la figura 4. Se exceptúan de este comportamiento los iones Mn2+ que muestran una eficiencia de precipitación mayor que la obtenida para los iones Ni2+, Co2+, Fe2+ y Mg2+ que son menos solubles. Este hecho podría explicarse por la menor estabilidad de los iones Mn2+ para formar complejos con ligandos que contienen nitrógeno como átomo donador de electrones, con lo que se confirma el orden de estabilidad conocido como Serie de Irving-Williams, donde las constantes de equilibrio para la formación de los complejos muestran la siguiente secuencia: Mn2+< Fe2+< Co2+<Ni2+<Cu2+> Zn2+ [35, 36].
Los resultados de la caracterización química y mineralógica del producto, así como la eficiencia de precipitación presentados en esta sección, indican la conveniencia de ejecutar el proceso en condiciones de 11 < pH < 13 y demuestran que se obtiene el β-Ni(OH)2 enriquecido con otros cationes metálicos por el alto rendimiento de la disolución multicomponente de partida en el proceso de precipitación. La investigación posterior de la cinética de reacción proporcionará una mayor comprensión del mecanismo de síntesis del proceso evaluado.
Conclusiones
Se realizó el análisis termodinámico y la validación experimental que permitieron establecer las condiciones más favorables para la síntesis de hidróxido de níquel (II) por precipitación química, con la utilización de la disolución acuosa multicomponente generada durante la lixiviación del sulfuro de níquel de la tecnología Caron.
Se estableció el comportamiento de la estabilidad y solubilidad de las especies químicas en un sistema Me(II) - SO4 2- - NH3-OH- para obtener b-Ni(OH)2, enriquecido este fundamentalmente con níquel, hierro y cobalto, y cuya composición química fue la siguiente: 58,5 β Ni ≤ 59,1%, 1,7 ≤ Co ≤ 2,1%, 0,5 < Fe ≤ 0,6%, Cu, Zn, Mn y Mg ≤ 0,2%.
Se lograron eficiencias de precipitación de los cationes Ni2+, Co2+, Fe2+ y Mn2+ superiores al 98%, a temperatura de 303 K, pH entre 11 y 13, concentraciones de amoniaco e hidróxido de sodio entre 0,5 y 1,0 mol-L-1 y de 2,2 a 2,5 mol-L-1, respectivamente.
Las condiciones establecidas en el proceso son muy favorables ya que brindan la posibilidad de incrementar la eficiencia de recuperación de las especies metálicas, abaratar el costo del proceso en el escalado industrial y disponer de un producto que podría ser potencialmente utilizado como material precursor de las baterías recargables.