Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.24 no.2 Medellín Apr./June 2011
ARTÍCULO DE REVISIÓN
Fisiopatología celular de la osteoartritis: el condrocito articular como protagonista
Osteoarthritis cellular pathophysiology: The articular chondrocyte as a central player
Julio César Sánchez Naranjo1; Diego Fernando López Zapata2
1 Médico fisiólogo, MSc, PhD. Profesor titular e investigador. Director del Grupo de Investigación de Fisiología Celular y Aplicada, Departamento de Ciencias Básicas, Facultad de Ciencias de la Salud, Universidad Tecnológica de Pereira, Colombia. jcsanchez@utp.edu.co.
2 Médico. Asistente de investigación. Estudiante del Doctorado en Ciencias Biomédicas. Universidad Tecnológica de Pereira, Colombia.
RESUMEN
La osteoartritis es una de las enfermedades más prevalentes y que más discapacidad produce en todo el mundo, lo que ocasiona costos altos para el paciente y la sociedad. En años recientes se ha venido obteniendo información importante sobre el funcionamiento normal del condrocito, la única célula presente en el cartílago articular y responsable de la síntesis de matriz extracelular. El condrocito responde a las condiciones fluctuantes del medio, generadas por los cambios de presión, modificando su composición iónica y alterando el transporte de solutos y agua en su membrana. Esta capacidad de respuesta es clave para el mantenimiento de la matriz extracelular y, por ende, de un cartílago funcional. Diversos factores relacionados con enfermedades crónicas metabólicas inician una cascada de eventos que termina con una respuesta inadecuada del condrocito ante la carga mecánica, lo cual lleva a un predominio del catabolismo de la matriz y a un cartílago defectuoso que es la base del desarrollo de la osteoartritis. En este proceso están implicadas diversas citocinas y hormonas que afectan la homeostasis del cartílago y que pueden constituirse en blancos terapéuticos prometedores.
Palabras clave
Condrocitos, Osteoartritis, Adipocinas, Cartílago Articular, Concentración Osmolar
SUMMARY
Worldwide, osteoarthritis is one of the most prevalent diseases. It causes high disability rates and represents a heavy burden to patients and society. In recent years, important findings about the normal function of the chondrocyte, the only cell in articular cartilage and responsible for matrix metabolism, have been made. Chondrocytes respond to the fluctuant conditions of their environment, generated by mechanical pressure changes, by modifying their ionic composition and altering solute and water membrane transport. This characteristic is a key factor to extracellular matrix maintenance, necessary for a functional cartilage. A number of factors related to chronic metabolic diseases initiate a cascade of events that lead to an inadequate response of chondrocytes to mechanical load; this ends in a preponderance of matrix catabolism and impairement of the cartilage, which is the basis for the development of osteoarthritis. Several cytokines and hormones are involved in this process and they may become promising therapeutic targets.
Key words
Chondrocytes, Osteoarthritis, Adipokines, Cartilage Articular, Osmolar Concentration
INTRODUCCIÓN
La osteoartritis (OA) es una enfermedad crónica y discapacitante muy frecuente en todos los países del mundo (1); se espera que su frecuencia seguirá elevándose debido al aumento de la esperanza de vida (2) y a los hábitos poco saludables. La enfermedad es multicausal y suele ser concomitante con otros trastornos de índole metabólica como la obesidad y la diabetes mellitus tipo II; puede progresar hasta impedir las labores cotidianas y así poner en riesgo la autosuficiencia, lo que acarrea elevados costos económicos y sociales (1,3).
A pesar de su importancia, solo en los últimos años se han hecho avances considerables en la comprensión de esta enfermedad, por lo que las estrategias de prevención y las medidas terapéuticas empleadas hasta el momento son insuficientes, si bien existen tratamientos paliativos que reducen el dolor pero que solo limitan hasta cierto punto el avance de la enfermedad (4). Estas limitaciones terapéuticas obedecen a las dificultades para el estudio de un problema multifactorial como es la OA y al distanciamiento básico-clínico por el que los avances son fragmentarios y poco aplicables. Los adelantos importantes en la comprensión de la OA se deben a la exploración de la fisiología celular del condrocito, especialmente de su homeostasis iónica y eléctrica. Dicha exploración es necesaria para entender los mecanismos responsables de su respuesta a las condiciones cambiantes del cartílago articular. Asimismo, el estudio de la fisiopatología de la obesidad y del síndrome metabólico ha permitido involucrar elementos nuevos e importantes que relacionan estas enfermedades con el desarrollo y progresión de la OA.
FISIOLOGÍA DEL CARTÍLAGO ARTICULAR
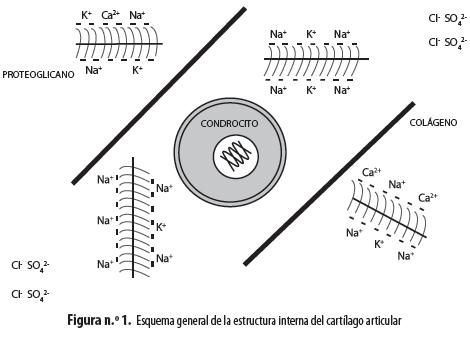
El cartílago articular es un tejido muy especializado que impide el daño articular secundario a la carga mecánica generada por el movimiento, gracias a que disminuye la fricción, es resistente a la tensión y a la compresión y se adapta a condiciones cambiantes (5). Estas propiedades se deben a que está compuesto básicamente por agua (60% de su peso) y por una matriz extracelular formada por proteoglicanos (PG) y fibras de colágeno (FC) tipo II, sintetizados por la única célula residente del cartílago, el condrocito (figura n.° 1). Este tejido está aislado de otros circundantes por la membrana sinovial, que es impermeable al paso de macromoléculas pero permite la difusión de nutrientes y oxígeno (6).
Los PG están formados por un esqueleto de ácido hialurónico, al cual se unen monómeros de glucosaminoglicanos (GAG), formando ramificaciones que se estabilizan por medio de proteínas de unión; los más comunes son el condroitín-sulfato, el queratánsulfato y el ácido hialurónico (7). Las FC de la matriz extracelular están formadas por colágeno (C) tipo II, aunque alrededor de un 10% está representado por los tipos IX y XI, que sirven como puente de unión entre fibras. También se encuentran en el cartílago articular, en muy pequeñas cantidades, el C tipo V, unido a proteínas de la matriz, y el C tipo X, que se expresa solo en las regiones donde hay calcificación. Las FC forman una red en la que se encuentran inmersos tanto los PG como los condrocitos (6,8,9).
Los condrocitos del cartílago articular no son homogéneos, sino que se diferencian en sus características morfológicas y funcionales según la zona del cartílago donde se ubiquen (figura n.° 2). Los de la zona superficial, que están en contacto con el líquido sinovial, presentan una apariencia alargada en contraste con los de las zonas intermedia y profunda que son redondeados. Sin embargo, en la zona más profunda la densidad celular es notablemente menor (6). Por otra parte, las características de las FC también difieren según la zona, puesto que la superficial contiene colágeno dispuesto de forma tangencial y baja concentración de PG, lo que confiere al cartílago resistencia a la tensión y a la fricción. Las zonas intermedia y profunda tienen FC más gruesas organizadas de forma radial y un contenido más alto de PG, que pueden atrapar agua, aumentando la resistencia del cartílago a la compresión (6). Los sulfatos adheridos a los GAG son responsables de capturar citocinas y factores de crecimiento y de contribuir al reconocimiento de algunos de estos mensajeros (10).
La gran cantidad de agua presente en el cartílago tiene funciones diversas e importantes; una de ellas es servir como medio de difusión de los nutrientes hacia el condrocito, célula cuya demanda energética es muy alta por ser muy activa metabólicamente (11). Debido a que el cartílago articular es avascular, los nutrientes y el oxígeno deben alcanzar el condrocito de distintas maneras. En el hueso subcondral existen canales para el transporte de nutrientes, pero estos canales son importantes solamente para la nutrición del cartílago epifisiario y para las zonas de osificación activas durante el crecimiento (12). Entonces, la difusión a través de la membrana sinovial es la principal forma de llevar nutrientes al condrocito (13), lo cual genera el problema de que los nutrientes se deben difundir a distancias de hasta un centímetro para poder alcanzar las células (14), lo que limita la eficacia de esta vía. No obstante, esta dificultad se soluciona porque los movimientos de la articulación hacen que el agua se desplace a las zonas de menor presión, arrastrando consigo los nutrientes (11). Además, muchas de las sustancias nutritivas pueden quedar almacenadas en la matriz extracelular generando un gradiente favorable para su paso hacia el condrocito (15).
Por otro lado, las cargas negativas de los proteoglicanos generan retención de cationes y repulsión de aniones, lo que juega un papel fundamental en la composición iónica del medio intracelular y extracelular del condrocito (figura n.° 1). Esta propiedad genera un conjunto de iones fijos, que no se mueven junto con el agua desplazada mecánicamente por la presión ejercida sobre el cartílago durante el movimiento de la articulación, lo que produce cambios locales de la osmolaridad que someten a los condrocitos a desafíos osmóticos constantes (11), que afectan su homeostasis (16) (figura n.° 3). La hiperosmolaridad externa produce hiperpolarización mientras que la hiposmolaridad provoca despolarización, como ha demostrado nuestro grupo en condrocitos articulares bovinos (17,18). Es muy llamativo que ambos fenómenos están mediados por incrementos de calcio intracelular que se alcanzan por diversas vías; en el caso de la hiperosmolaridad el calcio activa canales de potasio de alta conductancia (BKCa), activables por este ion, que provocan la salida de potasio del condrocito, hiperpolarizándolo. En el caso de la hiposmolaridad se activan canales que responden a la distensión (SAC, por la sigla en inglés de stretch-activated channels) permeables a cationes, principalmente a sodio cuya entrada a la célula provoca la despolarización observada (17,18).
Los cambios de osmolaridad externa ocasionan movimientos de agua a través de la membrana del condrocito, que es libremente permeable a ella gracias a la expresión de acuaporina 1 (6). Estos flujos de agua pueden alterar el volumen celular, que es crítico para las funciones del condrocito, por lo que se activan mecanismos para mantenerlo constante, conocidos como incremento y disminución reguladores de volumen (IRV y DRV respectivamente). Cuando el líquido extracelular es hipotónico, la tendencia es a que aumente el volumen celular por la entrada osmótica de agua, pero la célula lo contrarresta mediante la salida de solutos osmóticamente activos, como taurina y potasio, activando vías de transporte específicas y arrastrando agua al exterior (DRV) (6,19,20). Por otra parte, cuando el líquido extracelular es hipertónico, es de esperar que el agua salga de la célula debido a las fuerzas osmóticas pero el condrocito impide esto importando solutos como el potasio que arrastran agua de nuevo al interior, causando entonces un IRV (6,19,20).
El transporte de glucosa al interior del condrocito no requiere insulina, pues depende de acarreadores independientes de esta hormona como GLUT (por la sigla en inglés de glucose transporters) 1, 3 y 10, de los cuales el GLUT 1 es el más utilizado (21); GLUT 4 solo parece ser importante durante el desarrollo de la articulación (22). Sustancias como la vitamina C y la glucosamina, necesarias también para la síntesis correcta de la matriz extracelular, se transportan también por los GLUT (21).
Las condiciones de oxigenación del cartílago articular también son especiales: la hipoxia relativa es el estado normal y es aún mayor en las capas más profundas del tejido; las bajas concentraciones de oxígeno son necesarias para la condrogénesis, la síntesis de matriz extracelular y la homeostasis del condrocito. La normoxia aumenta la formación de especies reactivas de oxígeno y altera el potencial de membrana mitocondrial, lo que se traduce en menor síntesis de matriz y en condroapoptosis (23).
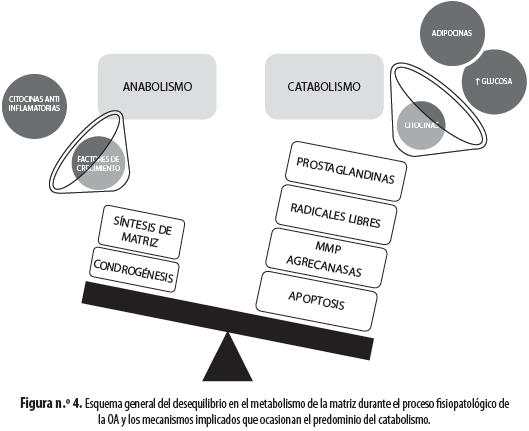
Para mantener todas las propiedades funcionales del cartílago, es necesaria no solo una síntesis apropiada de la matriz extracelular, sino además un catabolismo ordenado y programado de la misma, es decir, se debe alcanzar un equilibrio entre la síntesis y la destrucción de dicha matriz (24). Si hay disminución en el proceso de síntesis, el cartílago se tornará más delgado y débil; si, por el contrario, hay un aumento en la síntesis de matriz el cartílago será hipertrófico y desordenado y se favorecerá la formación de osteofitos. El catabolismo se debe principalmente a la degradación del colágeno gracias a la existencia de metaloproteinasas de matriz (MMP, por la sigla en inglés de matrix metalloproteinases); de ellas, las principales son MMP-1, MMP-8 y MMP-13 (6); estas enzimas convierten las FC en fragmentos que son sustrato de gelatinasas, que se encargan de degradarlos (25). Aparentemente, el catabolismo de los PG y de las proteínas de unión se hace por medio de agrecanasas y de las mismas MMP (6). También se ha visto que la eliminación de los grupos sulfato de los GAG hace parte de los procesos catabólicos normales, pero su destrucción excesiva por sulfatasas como SULF-1 y SULF-2 hace al cartílago vulnerable a la acción de citocinas inflamatorias (10), aunque también se ha encontrado que la ausencia de sulfatasas disminuye la respuesta a factores anabólicos y aumenta la respuesta a factores catabólicos (7).Debido a que la síntesis y destrucción de la matriz son procesos que deben ser controlados cuidadosamente, las MMP están reguladas por muchos factores endocrinos e inflamatorios así como por la disponibilidad de oxígeno y nutrientes (25-27).
También el sistema endocrino regula la actividad de los condrocitos; por eso muchos factores de crecimiento son responsables de la regulación de la condrogénesis (28). El factor de crecimiento similar a la insulina I (IGF-I, por la sigla en inglés de insulin growth factor) desempeña una función importante en la maduración y supervivencia de los condrocitos y en la inducción de síntesis de matriz; limita el catabolismo al antagonizar sustancias proinflamatorias como la interleucina-1 (IL-1β) (6,29). El factor transformante del crecimiento β (TGF-β, por la sigla en inglés de transforming growth factor-β) es una sustancia que se encuentra normalmente en concentraciones bajas; se la requiere para la síntesis de matriz y protege el catabolismo de esta al contrarrestar los efectos dañinos de sustancias proinflamatorias que activan la MMP-1 y la MMP-9; paradójicamente, también posee efectos proinflamatorios y puede activar la MMP-13 y agrecanasas como catepsina B y ADAMTS (por la sigla en inglés de a disintegrin and a metallproteinase with thrombospondin motifs) (6,30). Las proteínas morfogenéticas para el hueso (BMP, por la sigla en inglés de bone morphogenic proteins) son condroprotectoras, condrogénicas e inducen la síntesis de matriz (31); sus acciones son antagonizadas por algunas proteínas de la matriz como la folistatina y la noguina que se fijan a las BMP e impiden su unión a receptores (32).
Aunque la inflamación desencadena el catabolismo del cartílago por distintas vías (33), la prostaglandina E2, a dosis bajas, tiene efectos estimulantes de la síntesis de cartílago. El mecanismo no está claro, pero se especula que este efecto lo median receptores EP3 y EP4, de alta afinidad por prostaglandinas, y que, por lo tanto, requieren bajas concentraciones de su ligando, en contraste con los receptores clásicos EP1 y EP2 , activados solo con altas concentraciones, y que median la mayor parte de los efectos proinflamatorios de estos agentes (34). El óxido nítrico (ON) tiene el mismo comportamiento: a bajas concentraciones es inhibidor de las MMP y estimulante de la síntesis de PG; pero a altas concentraciones, como las inducidas por citocinas proinflamatorias, activa las MMP, aumenta la producción de radicales libres, induce apoptosis por alteración del potencial transmitocondrial y altera la homeostasis iónica (35,36).
FISIOPATOLOGÍA DE LA OA
La etiología y génesis de la OA son múltiples, es decir, existen diversos causantes de la enfermedad que generan diferentes alteraciones en la fisiología normal del cartílago. Pero cuando la enfermedad ya se encuentra avanzada suele haber homogenización de los daños y mecanismos comunes de perpetuación del cuadro. El cartílago articular, gracias a sus características, está diseñado para soportar los cambios articulares debidos al movimiento y a la carga mecánica, pero la aplicación de fuerzas estáticas prolongadas a las articulaciones, o de fuerzas cíclicas constantes, genera alteraciones en la producción de matriz y aumento del catabolismo, hallazgos característicos de la OA (5,37). La respuesta normal del cartílago es hipertrofiarse en las zonas de mayor presión y tornarse hipotrófico en las de menor presión (38,39), todo ello gracias a la reorganización de las fibras constituyentes del citoesqueleto, desencadenada por la mecano-transducción iniciada por los cambios de osmolaridad ya descritos, que son detectados por integrinas y canales activables por distensión (40). Es por la falta de este estímulo por lo que las personas sedentarias presentan articulaciones débiles y susceptibles al daño causado por enfermedades metabólicas, mientras que los ejercicios mal diseñados y repetitivos causan deformaciones en la articulación.
En las primeras fases de la enfermedad se suele observar el depósito de fibras de colágeno y proteoglicanos en cúmulos desordenados, lo que refleja una mayor producción de estas sustancias como respuesta a la destrucción aumentada. Cuando se ha iniciado el proceso de alteración de la matriz extracelular y de mal funcionamiento de los condrocitos, tienen lugar, como respuestas compensadoras, una mayor síntesis de matriz, un aumento del número de células sobre todo en las capas profundas del tejido y una mayor liberación local de factores de crecimiento (28). No obstante, esa respuesta es ineficaz porque se producen condrocitos característicos de cartílagos inmaduros, que son inapropiados para soportar las funciones de una articulación adulta; los condrocitos generados tienen también características propias de células inmaduras (6). Esa respuesta compensadora por sí misma, además de ser insuficiente para contrarrestar los daños articulares, es la causa de la generación de osteofitos y la invasión de zonas de cartílago calcificado dentro del cartílago normal; además estos mecanismos alcanzan un límite, después del cual dejan de funcionar y finalmente predomina el catabolismo articular (6,39). En la OA existe una resistencia al IGF-I, aparentemente por la expresión de inhibidores de la cascada de señalización proteína-quinasa B/Akt (PKB/Akt, por la sigla en inglés de proteinkinase B/Akt) como el homólogo 3 de Tribbles (TRB3, por la sigla en inglés de tribbles homologue 3), expresada por el condrocito en situaciones de estrés (41); a la vez la mayor producción de proteínas fijadoras de IGF-1 (IGFBP, por la sigla en inglés de insulin-like growth factor binding protein) en la matriz pericelular del cartílago osteoartrítico evita la unión de IGF-1 a sus receptores (42). Otros factores de crecimiento como TGF-β, HGF (hepatocyte growth factor), CTGF (connective tissue growth factor) y FGF (fibroblast growth factor) aumentan su producción, pero sus efectos son menos claros o, como en el caso del TGF-β, al aumentar su concentración empiezan a presentarse efectos catabólicos, debido a la activación de MMP (28,30). En resumen, en la OA hay una alteración del equilibrio entre la síntesis y el catabolismo de la matriz extracelular, que favorece la destrucción del cartílago ya sea por falta de sustrato o por activación de las MMP (figura n.° 4).
La activación de MMP y de agrecanasas por diferentes sustancias inflamatorias induce destrucción de las FC y de los PG, y los fragmentos de fibronectina resultantes de su digestión enzimática tienen efectos potenciadores del catabolismo de la matriz (8). La destrucción de los PG implica que desaparecen sus cargas negativas, por lo que se alteran la distribución iónica propia del cartílago y así como el potencial de membrana del condrocito, lo que afecta aún más sus funciones y empeora la situación del tejido (28,30). Las respuestas electrofisiológicas y de regulación del volumen intracelular a los cambios de osmolaridad también están alteradas, al parecer por causa de la IL-1β (20); este hecho es inductor de cascadas apoptóticas en el condrocito y además entorpece la respuesta celular a los cambios dinámicos de la articulación, lo que provoca un círculo vicioso que empeora el proceso fisiopatológico (43). Nuestro grupo ha encontrado que el condrocito del cartílago osteoartrítico está más despolarizado que el normal y no responde igual ante los cambios de osmolaridad externa, al parecer por una regulación inadecuada de los canales iónicos responsables de esa respuesta fisiológica (datos por publicar).
Aunque todavía no se sabe si la alteración del cartílago precede al daño de la membrana sinovial, sí hay certeza de que su mal funcionamiento potencia y perpetúa los daños en el cartílago articular puesto que los sinoviocitos tienen entre sus funciones el paso de nutrientes al líquido sinovial, la liberación de agentes inflamatorios y la remoción de sustancias nocivas (44). Cuando hay pérdida de la permeabilidad selectiva de la membrana sinovial o soluciones de continuidad en ella, se altera la regulación del transporte de solutos críticos para el condrocito, como el oxígeno y la glucosa. Por ejemplo, el nivel de oxígeno en el cartílago puede aumentar y la transición de condiciones hipóxicas a normóxicas lleva a un aumento en la producción de radicales libres, como se explicó anteriormente (23); dichos radicales activan MMP e inducen la liberación de TNF-α, IL-1β y TGF-α, que a su vez activan también MMP y otras sustancias proinflamatorias, ampliando el problema (45). Los radicales libres causan alteración del potencial transmembrana mitocondrial, reflejo de disfunción mitocondrial y de daño de la maquinaria energética del condrocito, lo que finalmente desencadena los mecanismos apoptóticos celulares (23, 26); del mismo modo los radicales de oxígeno lesionan los telómeros de los cromosomas, lo que acelera la senescencia del cartílago (46,47).
Como ya se mencionó, en el cartílago articular el ON tiene efectos ambiguos y dependientes de las dosis (35). A dosis bajas, por activación de la guanililciclasa, el ON aumenta la formación de GMPc, el cual activa la cascada de señalización iniciada por la proteínaquinasa G (PKG, por la sigla en inglés de proteinkinase G), promotora de la formación de matriz extracelular y de citoprotección; además, disminuye la liberación de sustancias proinflamatorias (35). Las dosis bajas funcionales de ON se deben a la existencia de una sintasa (cNOS) constitutiva; pero el estímulo de una sintasa inducible por la inflamación (iNOS) es el responsable de las dosis altas de ON presentes en el cartílago osteoartrítico, generadoras de concentraciones altas de radicales libres que son lesivos (48). Gracias al antagonismo en los efectos de estos radicales libres de oxígeno y nitrógeno, los antioxidantes han tenido efectos terapéuticos alentadores en la OA (49).
La cantidad de glucosa en el líquido sinovial es reflejo de su nivel en la sangre (13); su exceso en el líquido sinovial secundario a hiperglicemia también es causante de disfunción del condrocito mediante la producción de radicales libres de oxígeno y de citocinas proinflamatorias locales. Además los productos finales de la glucosilación avanzada refuerzan las uniones entre FC, lo que aumenta la rigidez del cartílago y así disminuye su funcionalidad (50). El condrocito de articulaciones sanas puede protegerse de este exceso de glucosa al disminuir la cantidad de receptores GLUT-1 expresados, pero los condrocitos de las articulaciones osteoartríticas no son capaces de hacerlo y transportan cantidades altas de glucosa con las consecuencias ya descritas, posiblemente debido a que citocinas proinflamatorias, como la IL-1β, causan mayor síntesis y expresión del transportador (21,50). El déficit de glucosa, vitamina C (necesaria para la síntesis adecuada de colágeno) y aminoácidos, asociado a restricciones nutricionales, es causa igualmente de alteraciones en la síntesis de matriz y facilitador de procesos osteoartríticos (21).
Aparte de la hiperglicemia, la diabetes mellitus tipo II y la obesidad afectan la homeostasis del cartílago normal mediante la liberación de agentes inflamatorios y de hormonas reguladoras del metabolismo. Es así como citocinas inflamatorias, entre ellas TNF-α, IL-1β, IL-6, IL-7 e IFN-γ (27,50,51), características del estado de inflamación crónica de estas enfermedades, alcanzan niveles elevados en el cartílago, tal vez por la permeabilidad alterada de la membrana sinovial y una mayor facilidad para llegar a las células (52).
La asociación entre estas citocinas proinflamatorias y la OA es relativamente clara, como ya se ha mencionado, ya que activan las MMP, inducen la liberación de radicales libres, aumentan la producción de prostaglandinas y disminuyen la expresión de genes de colágeno tipo II y de agrecanos (27,33). Los sinoviocitos producen péptidos que contrarrestan la actividad inflamatoria de estas citocinas, especialmente la IL-4 y el antagonista del receptor de la IL-1 (IL-1RA) (6,27). Es importante destacar que la activación de factores de transcripción antinflamatorios como el receptor activado proliferador de peroxisoma gamma (PPAR-γ, por la sigla en inglés de peroxisome proliferator activated receptor γ) son blanco para el desarrollo de terapias contra la OA, porque poseen efectos antinflamatorios y estimulantes de la supervivencia del condrocito y de la síntesis de matriz, pero nuevamente la IL-1β actúa sobre él inhibiéndolo (53).
Mediadores liberados principalmente por el tejido adiposo (llamados adipocinas) tienen acciones mal caracterizadas y contradictorias sobre el cartílago. La leptina, por ejemplo, puede ser producida por los condrocitos y sinoviocitos, en donde también tiene receptores. En concentraciones bajas posee efectos estimulantes del crecimiento y la proliferación de condrocitos y de la producción de matriz (3,31,54), pero en concentraciones más altas, como las que se presentan en la obesidad, se comporta como un factor proinflamatorio, que destruye la matriz extracelular, mediante la activación de MMP, la inducción de radicales libres y la alteración del metabolismo del condrocito (31,54,55). La adiponectina es una adipocina que típicamente presenta efectos antinflamatorios y sensibilizadores a la insulina en muchos tejidos, pero en el condrocito y el cartílago tiene efectos dañinos para la matriz al activar MMP e inducir la liberación de radicales libres (56). Sin embargo, otros estudios sugieren que puede activar inhibidores de MMP e inhibir la liberación de citocinas proinflamatorias (57).
Este enfoque fisiopatológico celular tendrá que traducirse en estrategias terapéuticas más efectivas en OA. Por ejemplo, en los últimos años se ha investigado la utilidad de la glucosamina en esta enfermedad, la cual estimula la producción de PG (58,59) y disminuye la síntesis de prostaglandinas (60) y el catabolismo de la matriz (61) y afecta el patrón de síntesis de proteínas, aumentando la producción de aquellas relacionadas con un efecto protector del cartílago (62). A pesar de estos avances, es necesario profundizar la investigación acerca de los efectos de este y otros agentes en la homeostasis del condrocito, factor clave para comprender mejor la regulación del metabolismo de la matriz y entender más cabalmente su utilidad terapeútica.
CONCLUSIONES
El condrocito es una célula compleja sometida a condiciones siempre cambiantes, por lo que su capacidad de adaptación es una característica fundamental para su supervivencia y para el mantenimiento de la homeostasis del cartílago mediante un balance adecuado entre la síntesis y el catabolismo de la matriz extracelular. Para poder cumplir con estas funciones el condrocito debe ser capaz de detectar los cambios de las condiciones fisicoquímicas del medio externo por la interacción de los componentes de la matriz y de proteínas de membrana que logran acoplarse funcionalmente, para permitirle a la célula responder en forma adecuada a las demandas que impone una carga mecánica que fluctúa permanentemente. El conocimiento de la homeostasis iónica y osmolar del condrocito es entonces fundamental para dilucidar los mecanismos íntimos del funcionamiento del tejido y para entender las alteraciones que ocurren en la OA. Solo en los últimos años se han empezado a revelar algunos de esos mecanismos, los cuales pueden generar conocimiento importante para el desarrollo de nuevas estrategias preventivas y terapéuticas que apunten a los mecanismos celulares implicados en el proceso fisiopatológico. El condrocito no es ajeno a las perturbaciones del organismo en general y responde a una variedad de mensajeros químicos, que son reflejo del funcionamiento de otros tejidos; una prueba de lo anterior es el papel de las adipocinas y citocinas en la fisiopatología de la OA, ya que estos agentes están relacionados con enfermedades metabólicas crónicas y actúan directa o indirectamente sobre el condrocito. El futuro de la investigación en OA debe entonces seguir enfocándose en indagar acerca de los mecanismos celulares implicados en el proceso y su relación con el funcionamiento general del organismo en un contexto fisiopatológico integral que permita comprender la enfermedad como parte de un proceso global y no como un fenómeno aislado y particular.
REFERENCIAS BIBLIOGRÁFICAS
1. Oliviero F, Ramonda R, Punzi L. New horizons in osteoarthritis. Swiss Med Wkly. 2010 Jan;140(140):w13098. [ Links ]
2. Kraan PM van der, Berg WB van den. Osteoarthritis in the context of ageing and evolution. Loss of chondrocyte differentiation block during ageing. Ageing Res Rev. 2008 Apr;7(2):106-13. [ Links ]
3. Heep H, Hilken G, Hofmeister S, Wedemeyer C. Osteoarthitis of leptin-deficient ob/ob mice in response to biomechanical loading in micro-CT. Int J Biol Sci. 2009 Jan;5(3):265-75. [ Links ]
4. Alcaraz MJ, Megías J, García-Arnandis I, Clérigues V, Guillén MI. New molecular targets for the treatment of osteoarthritis. Biochem Pharmacol. 2010 Jul;80(1):13-21. [ Links ]
5. Kim E, Guilak F, Haider MA. The dynamic mechanical environment of the chondrocyte: a biphasic finite element model of cell-matrix interactions under cyclic compressive loading. J Biomech Eng. 2008 Dec;130(6):061009. [ Links ]
6. Martel-Pelletier J, Boileau C, Pelletier J-P, Roughley PJ. Cartilage in normal and osteoarthritis conditions. Best Pract Res Clin Rheumatol. 2008 Apr;22(2):351- 84. [ Links ]
7. Otsuki S, Hanson SR, Miyaki S, Grogan SP, Kinoshita M, Asahara H, et al. Extracellular sulfatases support cartilage homeostasis by regulating BMP and FGF signaling pathways. Proc Natl Acad Sci U S A. 2010 Jun;107(22):10202-7. [ Links ]
8. Yasuda T. Comparison of hyaluronan effects among normal, osteoarthritis, and rheumatoid arthritis cartilages stimulated with fibronectin fragment. Biomed Res. 2010 Jan;31(1):63-9. [ Links ]
9. Sánchez Naranjo JC. Fisiología del condrocito articular. Rev Colomb Reumatol. 2008;15(1):21-33. [ Links ]
10. Otsuki S, Taniguchi N, Grogan SP, D'Lima D, Kinoshita M, Lotz M. Expression of novel extracellular sulfatases Sulf-1 and Sulf-2 in normal and osteoarthritic articular cartilage. Arthritis Res Ther. 2008 Jan;10(3):R61. [ Links ]
11. Oswald ES, Chao P-HG, Bulinski JC, Ateshian GA, Hung CT. Dependence of zonal chondrocyte water transport properties on osmotic environment. Cell Mol Bioeng. 2008 Dec;1(4):339-348. [ Links ]
12. Burkus JK, Ganey TM, Ogden JA. Development of the cartilage canals and the secondary center of ossification in the distal chondroepiphysis of the prenatal human femur. Yale J Biol Med. 66(3):193-202. [ Links ]
13. Simkin PA. Synovial perfusion and synovial fluid solutes. Ann Rheum Dis. 1995 May;54(5):424-8. [ Links ]
14. Levick JR, McDonald JN. Fluid movement across synovium in healthy joints: role of synovial fluid macromolecules. Ann Rheum Dis. 1995 May;54(5):417-23. [ Links ]
15. Buckwalter JA, Mankin HJ. Articular cartilage: tissue design and chondrocyte-matrix interactions. Instr Course Lect. 1998 Jan;47477-86. [ Links ]
16. Hopewell B, Urban JPG. Adaptation of articular chondrocytes to changes in osmolality. Biorheology. 2003 Jan;40(1-3):73-7. [ Links ]
17. Sánchez JC, Wilkins RJ. Changes in intracellular calcium concentration in response to hypertonicity in bovine articular chondrocytes. Comp Biochem Physiol A Mol Integr Physiol. 2004 Jan;137(1):173-82. [ Links ]
18. Sánchez JC. Efectos de la osmolaridad extracelular sobre el potencial de membrana en condrocitos articulares. Actual Biol. 2004;26(81):99-104. [ Links ]
19. Kerrigan MJP, Hall AC. Control of chondrocyte regulatory volume decrease (RVD) by [Ca2+]i and cell shape. Osteoarthritis Cartilage. 2008 Mar;16(3):312- 22. [ Links ]
20. Pritchard S, Votta BJ, Kumar S, Guilak F. Interleukin-1 inhibits osmotically induced calcium signaling and volume regulation in articular chondrocytes. Osteoarthritis Cartilage. 2008 Dec;16(12):1466-73. [ Links ]
21. Mobasheri A, Vannucci SJ, Bondy CA, Carter SD, Innes JF, Arteaga MF, et al. Glucose transport and metabolism in chondrocytes: a key to understanding chondrogenesis, skeletal development and cartilage degradation in osteoarthritis. Histol Histopathol. 2002 Oct;17(4):1239-67. [ Links ]
22. Vannucci SJ, Rutherford T, Wilkie MB, Simpson IA, Lauder JM. Prenatal expression of the GLUT4 glucose transporter in the mouse. Dev Neurosci. 2000 Jan;22(4):274-82. [ Links ]
23. Gibson JS, Milner PI, White R, Fairfax TPA, Wilkins RJ. Oxygen and reactive oxygen species in articular cartilage: modulators of ionic homeostasis. Pflugers Arch. 2008 Jan;455(4):563-73. [ Links ]
24. Swingler TE, Waters JG, Davidson RK, Pennington CJ, Puente XS, Darrah C, et al. Degradome expression profiling in human articular cartilage. Arthritis Res Ther. 2009 Jan;11(3):R96. [ Links ]
25. Amalinei C, Caruntu ID, Giusca SE, Balan RA. Matrix metalloproteinases involvement in pathologic conditions. Rom J Morphol Embryol. 2010 Jan;51(2):215- 28. [ Links ]
26. Jackson MT, Smith MM, Smith SM, Jackson CJ, Xue M, Little CB. Activation of cartilage matrix metalloproteinases by activated protein C. Arthritis Rheum. 2009 Mar;60(3):780-91. [ Links ]
27. Schuerwegh AJ, Dombrecht EJ, Stevens WJ, Van Offel JF, Bridts CH, De Clerck LS. Influence of proinflammatory (IL-1 alpha, IL-6, TNF-alpha, IFNgamma) and anti-inflammatory (IL-4) cytokines on chondrocyte function. Osteoarthritis Cartilage. 2003 Sep;11(9):681-7. [ Links ]
28. Shi S, Mercer S, Eckert GJ, Trippel SB. Growth factor regulation of growth factors in articular chondrocytes. J Biol Chem. 2009 Mar;284(11):6697- 704. [ Links ]
29. Ekenstedt KJ, Sonntag WE, Loeser RF, Lindgren BR, Carlson CS. Effects of chronic growth hormone and insulin-like growth factor 1 deficiency on osteoarthritis severity in rat knee joints. Arthritis Rheum. 2006 Dec;54(12):3850-8. [ Links ]
30. Roman-Blas JA, Stokes DG, Jimenez SA. Modulation of TGF-beta signaling by proinflammatory cytokines in articular chondrocytes. Osteoarthritis Cartilage. 2007 Dec;15(12):1367-77. [ Links ]
31. Simopoulou T, Malizos KN, Iliopoulos D, Stefanou N, Papatheodorou L, Ioannou M, et al. Differential expression of leptin and leptin's receptor isoform (Ob-Rb) mRNA between advanced and minimally affected osteoarthritic cartilage; effect on cartilage metabolism. Osteoarthritis Cartilage. 2007 Aug;15(8):872-83. [ Links ]
32. Tardif G, Hum D, Pelletier J-P, Boileau C, Ranger P, Martel-Pelletier J. Differential gene expression and regulation of the bone morphogenetic protein antagonists follistatin and gremlin in normal and osteoarthritic human chondrocytes and synovial fibroblasts. Arthritis Rheum. 2004 Aug;50(8):2521-30. [ Links ]
33. Kojima F, Naraba H, Miyamoto S, Beppu M, Aoki H, Kawai S. Membrane-associated prostaglandin E synthase-1 is upregulated by proinflammatory cytokines in chondrocytes from patients with osteoarthritis. Arthritis Res Ther. 2004 Jan;6(4):R355-65. [ Links ]
34. Tchetina EV, Di Battista JA, Zukor DJ, Antoniou J, Poole AR. Prostaglandin PGE2 at very low concentrations suppresses collagen cleavage in cultured human osteoarthritic articular cartilage: this involves a decrease in expression of proinflammatory genes, collagenases and COL10A1, a gene linked to chondrocyte hypert. Arthritis Res Ther. 2007 Jan;9(4):R75. [ Links ]
35. Abramson SB. Osteoarthritis and nitric oxide. Osteoarthritis Cartilage. 2008 Jan;16 Suppl 2S15-20. [ Links ]
36. Chaudhari AA, Seol J-W, Lee Y-J, Seol D-W, Park S-Y. Hypoxia protects articular chondrocytes from thapsigargin-induced apoptosis. Biochem Biophys Res Commun. 2009 Apr;381(4):513-7. [ Links ]
37. Hardmeier R, Redl H, Marlovits S. Effects of mechanical loading on collagen propeptides processing in cartilage repair. J Tissue Eng Regen Med. 2010 Jan;4(1):1-11. [ Links ]
38. Zuscik MJ, Hilton MJ, Zhang X, Chen D, O'Keefe RJ. Regulation of chondrogenesis and chondrocyte differentiation by stress. J Clin Invest. 2008 Feb;118(2):429-38. [ Links ]
39. Aigner T, Sachse A, Gebhard PM, Roach HI. Osteoarthritis: pathobiology-targets and ways for therapeutic intervention. Adv Drug Deliv Rev. 2006 May;58(2):128-49. [ Links ]
40. Iscru DF, Anghelina M, Agarwal S, Agarwal G. Changes in surface topologies of chondrocytes subjected to mechanical forces: an AFM analysis. J Struct Biol. 2008 Jun;162(3):397-403. [ Links ]
41. Cravero JD, Carlson CS, Im H-J, Yammani RR, Long D, Loeser RF. Increased expression of the Akt/PKB inhibitor TRB3 in osteoarthritic chondrocytes inhibits insulin-like growth factor 1-mediated cell survival and proteoglycan synthesis. Arthritis Rheum. 2009 Feb;60(2):492-500. [ Links ]
42. De Ceuninck F, Caliez A, Dassencourt L, Anract P, Renard P. Pharmacological disruption of insulinlike growth factor 1 binding to IGF-binding proteins restores anabolic responses in human osteoarthritic chondrocytes. Arthritis Res Ther. 2004 Jan;6(5):R393- 403. [ Links ]
43. Racz B, Reglodi D, Fodor B, Gasz B, Lubics A, Gallyas F, et al. Hyperosmotic stress-induced apoptotic signaling pathways in chondrocytes. Bone. 2007 Jun;40(6):1536-43. [ Links ]
44. Krasnokutsky S, Attur M, Palmer G, Samuels J, Abramson SB. Current concepts in the pathogenesis of osteoarthritis. Osteoarthritis Cartilage. 2008 Jan;16 Suppl 3S1-3. [ Links ]
45. Appleton CTG, Usmani SE, Bernier SM, Aigner T, Beier F. Transforming growth factor alpha suppression of articular chondrocyte phenotype and Sox9 expression in a rat model of osteoarthritis. Arthritis Rheum. 2007 Nov;56(11):3693-705. [ Links ]
46. Dai S-M, Shan Z-Z, Nakamura H, Masuko-Hongo K, Kato T, Nishioka K, et al. Catabolic stress induces features of chondrocyte senescence through overexpression of caveolin 1: possible involvement of caveolin 1-induced down-regulation of articular chondrocytes in the pathogenesis of osteoarthritis. Arthritis Rheum. 2006 Mar;54(3):818-31. [ Links ]
47. Yudoh K, Nguyen van T, Nakamura H, Hongo- Masuko K, Kato T, Nishioka K. Potential involvement of oxidative stress in cartilage senescence and development of osteoarthritis: oxidative stress induces chondrocyte telomere instability and downregulation of chondrocyte function. Arthritis Res Ther. 2005 Jan;7(2):R380-91. [ Links ]
48. Otero M, Lago R, Lago F, Reino JJG, Gualillo O. Signalling pathway involved in nitric oxide synthase type II activation in chondrocytes: synergistic effect of leptin with interleukin-1. Arthritis Res Ther. 2005 Jan;7(3):R581-91. [ Links ]
49. Beecher BR, Martin JA, Pedersen DR, Heiner AD, Buckwalter JA. Antioxidants block cyclic loading induced chondrocyte death. Iowa Orthop J. 2007 Jan;271-8. [ Links ]
50. Rosa SC, Gonçalves J, Judas F, Mobasheri A, Lopes C, Mendes AF. Impaired glucose transporter-1 degradation and increased glucose transport and oxidative stress in response to high glucose in chondrocytes from osteoarthritic versus normal human cartilage. Arthritis Res Ther. 2009 Jan;11(3):R80. [ Links ]
51. Long D, Blake S, Song X-Y, Lark M, Loeser RF. Human articular chondrocytes produce IL-7 and respond to IL-7 with increased production of matrix metalloproteinase-13. Arthritis Res Ther. 2008 Jan;10(1):R23. [ Links ]
52. Hwang J, Bae WC, Shieu W, Lewis CW, Bugbee WD, Sah RL. Increased hydraulic conductance of human articular cartilage and subchondral bone plate with progression of osteoarthritis. Arthritis Rheum. 2008 Dec;58(12):3831-42. [ Links ]
53. Afif H, Benderdour M, Mfuna-Endam L, Martel- Pelletier J, Pelletier J-P, Duval N, et al. Peroxisome proliferator-activated receptor gamma1 expression is diminished in human osteoarthritic cartilage and is downregulated by interleukin-1beta in articular chondrocytes. Arthritis Res Ther. 2007 Jan;9(2):R31. [ Links ]
54. Dumond H, Presle N, Terlain B, Mainard D, Loeuille D, Netter P, et al. Evidence for a key role of leptin in osteoarthritis. Arthritis Rheum. 2003 Nov;48(11):3118-29. [ Links ]
55. Otero M, Lago R, Gómez R, Lago F, Gomez-Reino JJ, Gualillo O. Phosphatidylinositol 3-kinase, MEK-1 and p38 mediate leptin/interferon-gamma synergistic NOS type II induction in chondrocytes. Life Sci. 2007 Oct;81(19-20):1452-60. [ Links ]
56. Lago R, Gomez R, Otero M, Lago F, Gallego R, Dieguez C, et al. A new player in cartilage homeostasis: adiponectin induces nitric oxide synthase type II and pro-inflammatory cytokines in chondrocytes. Osteoarthritis Cartilage. 2008 Sep;16(9):1101-9. [ Links ]
57. Chen T-H, Chen L, Hsieh M-S, Chang C-P, Chou D-T, Tsai S-H. Evidence for a protective role for adiponectin in osteoarthritis. Biochim Biophys Acta. 2006 Aug;1762(8):711-8. [ Links ]
58. Bassleer C, Rovati L, Franchimont P. Stimulation of proteoglycan production by glucosamine sulfate in chondrocytes isolated from human osteoarthritic articular cartilage in vitro. Osteoarthritis Cartilage. 1998 Nov;6(6):427-34. [ Links ]
59. Dodge GR, Jimenez SA. Glucosamine sulfate modulates the levels of aggrecan and matrix metalloproteinase-3 synthesized by cultured human osteoarthritis articular chondrocytes. Osteoarthritis Cartilage. 2003 Jun;11(6):424-32. [ Links ]
60. Gouze J-N, Gouze E, Popp MP, Bush ML, Dacanay EA, Kay JD, et al. Exogenous glucosamine globally protects chondrocytes from the arthritogenic effects of IL-1beta. Arthritis Res Ther. 2006 Jan;8(6):R173. [ Links ]
61. Piperno M, Reboul P, Hellio Le Graverand MP, Peschard MJ, Annefeld M, Richard M, et al. Glucosamine sulfate modulates dysregulated activities of human osteoarthritic chondrocytes in vitro. Osteoarthritis and cartilage / OARS, Osteoarthritis Research Society. 2000 May;8(3):207-12. [ Links ]
62. Calamia V, Ruiz-Romero C, Rocha B, Fernández-Puente P, Mateos J, Montell E, et al. Pharmacoproteomic study of the effects of chondroitin and glucosamine sulfate on human articular chondrocytes. Arthritis research & therapy. 2010 Jan;12(4):R138. [ Links ]
Recibido: julio 16 de 2010
Aceptado: noviembre 24 de 2010