Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista U.D.C.A Actualidad & Divulgación Científica
Print version ISSN 0123-4226
rev.udcaactual.divulg.cient. vol.17 no.1 Bogotá Jan./June 2014
CIENCIAS AGRARIAS-Artículo Científico
PROPIEDADES FUNCIONALES DE LA HARINA Y DE LOS AISLADOS PROTEICOS DE LA SEMILLA DE GUANÁBANA (Annona muricata)
FUNCTIONAL PROPERTIES OF FLOUR AND PROTEIN ISOLATES FROM Annona muricata SEEDS
Sandra P. Chaparro1, Mónica L. Tavera2, José J. Martínez3, Jesús H. Gil4
1 Magister en Ciencia y Tecnología de Alimentos. Profesora Facultad de Ciencias, Universidad Pedagógica y Tecnológica de Colombia UPTC, Avenida Central del Norte, Vía Paipa, Tunja, Boyacá - Colombia. Autor para correspondencia, e-mail: patricia.chaparro@uptc.edu.co
2 Química de Alimentos. Egresada Universidad Pedagógica y Tecnológica de Colombia, e-mail: monik8617@hotmail.com
3 Doctor en Química. Profesor Facultad de Ciencias, Grupo de Investigación Catálisis, Universidad Pedagógica y Tecnológica de Colombia, e-mail: jose.martinez@uptc.edu.co
4 Doctor en Química. Profesor Departamento de Ingeniería Agrícola y Alimentos, Universidad Nacional de Colombia, Sede Medellín, A.A.1779, Medellín, Colombia, e-mail: jhgilg@unal.edu.co
Rev. U.D.CA Act. & Div. Cient. 17(1): 151-159, Enero-Junio, 2014
RESUMEN
Se realizó el análisis proximal de la almendra de semillas de guanábana (Annona muricata), obtenidas como desecho agroindustrial y la caracterización funcional de la harina desengrasada y los aislados proteicos de las semillas. El porcentaje de proteína cruda en la almendra es del 15%, lo que hizo factible la extracción de aislados proteicos. El punto isoeléctrico (PI) de los aislados obtenidos con ausencia (A0) y presencia de NaCl (A1) fue, en ambos casos, de 4,0. El rendimiento para A0 fue de 46% y para A1, de 46,3%. El contenido de proteína para A0 fue de 39,9% y para A1, de 63,3%, en este último favoreciendo la capacidad de absorción de agua (CAA), la absorción de lípidos (CAL) y la capacidad espumante (CE). Las mejores propiedades emulsificantes fueron observadas en la harina desengrasada. Los aislados proteicos de la almendra de la semilla de guanábana podrían ser empleados en la industria de alimentos, como ingredientes funcionales.
Palabras clave: Capacidad espumante, absorción de lípidos, extracción de proteínas, fruto tropical.
SUMMARY
Proximate analysis of soursop (Annona muricata) seed kernel and functional characterization of defatted flour and protein isolates were studied. Kernel crude protein was 15%, which made it feasible to extract protein isolates. The isoelectric point (PI) of the isolates obtained in absence (A0) and in presence of NaCl (A1) was, in both cases, 4.0. The yield was 46% for A0 and 46.3% for A1. Protein content was 39.9% in A0 and 63.3% in A1. A higher yield in the extraction of proteins in A1 favors the water absorption capacity (FAC), the lipid absorption (CAL) and the foaming capacity (CE). The best emulsifying properties were observed in the defatted flour. The kernel protein isolates of the soursop seeds could be used in the food industry as functional ingredients.
Key words: Foaming capacity, oil absorption capacity, protein extraction, tropical fruit.
INTRODUCCIÓN
La Annona muricata es un árbol perteneciente a la familia Annonaceae, del cual, se obtiene el fruto conocido como ''guanábana''. Es originaria de las Antillas y de las regiones tropicales de América del Sur (Lock & Rojas, 2003). Las procesadoras de alimentos emplean esta fruta, debido a su alto contenido de azúcar y delicado sabor. De la transformación del fruto, se obtienen productos, tales como pulpa, jugo, concentrados, helados, néctares, mermeladas, jaleas, conservas, yogures, entre otros (Badrie & Schauss, 2009) y, además, se generan residuos del procesamiento, como la cáscara y las semillas, que se desechan al medio ambiente.
Los residuos de semillas generados de las procesadoras de frutas pueden poseer valor nutricional y características funcionales que no han sido estudiadas en detalle, por lo que se desconoce su posible utilización, como ingredientes en diversos productos alimenticios. Los aislados proteicos son una opción viable para el aprovechamiento de semillas, con contenidos significativos de proteína (21,43%) (Awan et al. 1980), ya que los aislados pueden ser usados en la industria, gracias a las propiedades funcionales que exhiben, tales como emulsificante, formación de espuma, gelación, incremento de la viscosidad, sabor, textura y absorción de grasa y agua; varias formas de aditivos proteicos son adicionados a los alimentos para incrementar sus características funcionales, nutricionales y económicas (Rakosky, 1989).
Las proteínas vegetales aisladas podrían tener un alto valor como ingredientes funcionales (Liadakis et al. 1995); sin embargo, sólo las de soja son ampliamente utilizadas; Pszczola (2004), señala que la industria alimentaria se encuentra en la búsqueda de proteínas alternativas que puedan competir con las que, actualmente, dominan el mercado. Los aislados proteicos vegetales pueden ser obtenidos por solubilización alcalina, seguido de precipitación en el punto isoeléctrico (PI) (Tzeng et al. 1990, Liadakis et al. 1995, Bernandino-Nicanor et al. 2001). Esta metodología es la más empleada, en parte, por la facilidad de su implementación y los altos rendimientos obtenidos de proteína; además, permite la adecuada separación de sustancias no-proteicas, tales como azúcares, fibra, lípidos y otros componentes no deseables en el producto final, principalmente, factores antinutricionales (FAN).
El objetivo de este trabajo fue obtener aislados proteicos de semillas de guanábana provenientes de la industria procesadora de frutas y determinar, parcialmente, las características fisicoquímicas y funcionales de interés, con el fin de estudiar la posibilidad para su uso en la industria de los alimentos.
MATERIALES Y MÉTODOS
Se utilizaron semillas de guanábana (A. muricata L.) obtenidas de la empresa procesadora de pulpas ''Pura Fruta'', ubicada en la ciudad de Tunja. Se tomó una muestra representativa de 20kg. Los reactivos fueron grado analítico (Marcas Merck y Panreac).
Análisis proximal de las semillas: Las semillas, se lavaron con agua, para eliminar los residuos de pulpa adheridos; se extrajo la almendra y se secó a 40°C durante 24 horas. Posteriormente, se hizo una reducción de tamaño en un molino analítico (IKA A11 Basic) y la muestra fue tamizada, a través de malla 0,5mm. La harina obtenida se almacenó en un recipiente hermético, a temperatura ambiente (20°C), hasta la posterior determinación cuantitativa de la humedad (método oficial 945.09 B (AOAC, 2000), extracto etéreo, (920.39 C), proteína cruda, (979.09 B), fibra cruda, (962.09 E) y cenizas (923.03) (AOAC, 2000).
Obtención de los aislados proteicos: La extracción, se llevó a cabo a partir de la harina desengrasada (extracción soxhlet con cloroformo) de la almendra de las semillas de guanábana, para lo cual, fue necesario conocer el punto isoeléctrico (PI) de las proteínas presentes en la harina. Se realizó la curva de solubilidad, de acuerdo con la metodología de Adebowale & Lawal (2004), con algunas modificaciones. Se prepararon seis muestras mezclando 0,5g de semilla (molida y desengrasada), con 10mL de agua destilada, en 6 tubos diferentes. Las muestras fueron sometidas a agitación durante media hora, para su homogenización; seguidamente, se midió el pH de la solución y se ajustó a valores de 2,0; 4,0; 6,0; 8,0; 10,0 y 12,0, mediante la adición de HCl 0,1M o NaOH 0,2M. Estas soluciones se mantuvieron durante una hora en agitación, para una adecuada homogenización; luego, se sometieron a centrifugación a 4000 rpm (centrífuga Eppendorf 5804), durante 20 minutos a 5°C, con el fin de separar las proteínas solubles de los demás componentes de la mezcla. El sobrenadante, se filtró y de éste se utilizó 1mL para la determinación de proteína soluble, que se realizó espectrofotométricamente mediante el método de Biuret (Gornall et al. 1949), utilizando como patrón proteico un estándar de albúmina bovina sérica (BSA), en un rango de concentraciones de 0,2 a 1,0mg/mL. Con los resultados obtenidos, se construyó la curva de solubilidad de las proteínas y se determinó el punto isoeléctrico, siendo éste el pH donde se presentó la menor solubilidad de proteína.
Posteriormente, se realizó la extracción de los aislados proteicos en ausencia (A0) y presencia (A1) de una solución salina de NaCl al 1%. Se mezclaron 20g de la harina con 400mL de agua destilada y 400mL de NaCl. Seguidamente, se ajustó el pH de las soluciones, a 12 con NaOH 0,2M y se dejaron en agitación durante 30 minutos. Las muestras, se sometieron a centrifugación (4000rpm) durante 20 minutos. Al sobrenadante obtenido, se le ajustó el pH hasta el punto isoeléctrico de la proteína, se centrifugó a 4000 rpm por 20 minutos y, el precipitado obtenido, se secó a 40°C por 24 horas. La cuantificación espectrofotométrica de la proteína, se llevó a cabo por el método de Biuret. El rendimiento, se determinó teniendo en cuenta el peso del aislado seco obtenido y el peso de harina desengrasada utilizada para la extracción (ecuación 1).

Propiedades Funcionales de la harina desengrasada y los aislados proteicos
Capacidad de absorción de agua y aceite: Se empleó el método de Beuchat (1977), para la determinación de la capacidad de absorción de agua (CAA) y aceite (CAL). Se tomó un gramo de la muestra y se mezcló con 10mL de agua destilada (y aceite, en otro tratamiento), durante 30 s. Luego, la muestra permaneció en reposo a temperatura ambiente (25 ± 2°C) por 30 min; seguidamente, se centrifugó a 3000 rpm por 30 min. Se reportó el volumen por gramo de muestra del sobrenadante medido en una probeta de 10mL. Adicionalmente, se llevó a cabo un estudio para determinar la influencia de la fuerza iónica, sobre la capacidad de absorción de agua y aceite, variando la concentración de NaCl (0; 0,2; 0,4; 0,6; 0,8 y 1,0M), en el medio de extracción.
Propiedades emulsificantes: La actividad y estabilidad emulsificante, se determinó usando el método de Neto et al. (2001). Se tomaron 5mL de una dispersión de la muestra en agua destilada (10mg/mL) y se homogenizaron con 5mL de aceite durante 1 min. Las emulsiones fueron centrifugadas a 1100 rpm por 5 min. Se midió la altura de la capa emulsificada y el contenido total del tubo (diámetro: 1cm, altura: 11cm). La actividad emulsificante (AE) fue calculada con la ecuación 2.

La estabilidad de la emulsión (EE) fue determinada por el calentamiento de ésta, a 80°C por 30 min, antes de centrifugar a 1100rpm por 5 min y se calculó, de acuerdo con la ecuación 3.

Propiedades espumantes: Se utilizó el método de Coffman & García (1977), para la determinación de la capacidad (CE) y estabilidad espumante (EE) de las muestras analizadas. Una cantidad de muestra fue dispersa en 100mL de agua destilada; luego, esta suspensión fue batida vigorosamente por 2 min usando una licuadora (Black & Decker), a velocidad 2. Se anotaron los volúmenes antes y después del mezclado. El porcentaje de incremento fue calculado, de acuerdo con la ecuación 4.
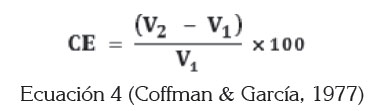
Donde, V2 es el volumen de la solución de proteína después de licuar y V1 es el volumen original de la solución. La EE fue determinada como el volumen de la espuma que permanece luego de 5 h, expresado como un porcentaje del volumen inicial de espuma.
Diseño Experimental: Se utilizó un diseño completamente al azar con dos tratamientos (aislados proteicos obtenidos A0 y A1). La unidad experimental fue el aislado obtenido por triplicado. Las variables de respuesta fueron las propiedades funcionales.
Análisis estadístico de datos: Los resultados fueron expresados como la media de tres determinaciones independientes. Las diferencias significativas entre las medias, se calcularon mediante el análisis de varianza de una vía y una prueba de comparación múltiple (diferencia mínima significativa de Fisher), con un nivel de significancia del 5%. Se utilizó el programa estadístico Statgraphics Plus 5.1.
RESULTADOS Y DISCUSIÓN
Análisis proximal de la almendra de la semilla: La tabla 1 resume los resultados obtenidos en el análisis proximal de la harina de almendra de la semilla de guanábana. Al comparar los valores con otros obtenidos de la literatura de semillas de frutos tropicales, se evidencia que el contenido proteico en la semilla de guanábana (15,28%) es superior a los registrados para otras semillas, tales como mango (6,36%) (Nzikou et al. 2010), guanábana (8,5%, 2,4%) (Kimbonguila et al. 2010; Onimawo, 2002), guayaba (9,9%) (Bernandino-Nicanor et al. 2001), pero inferior en otras, como maracuyá (28,5%), guanábana (27,3%, 15,4%) (Fasakin et al. 2008; Marroquín- Andrade et al. 2011), melón (35,7%), calabaza (36,5%) y paprika (24,4%) (El-Adawy & Taha, 2001).
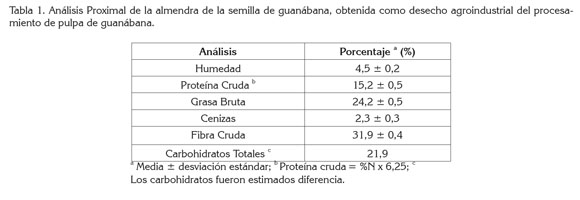
El contenido de humedad (4,5%) fue superior a semillas de maracuyá (2,3%), pero inferior a lo hallado por Kimbonguila et al. (2010) en guanábana (7,7%). Cabe resaltar que la muestra analizada, al presentar un contenido relativamente alto de humedad, puede tener una vida útil más corta que las otras semillas, ya que está más propensa al deterioro químico, enzimático y microbiológico.
El contenido de grasa (24,26%) es similar a lo obtenido por Fasakin et al. (2008) (22,6%), pero menor que lo hallado por Kimbonguila et al. (2010) (40%), en esta misma semilla, en melón (50,1%), calabaza (50,0%) y paprika (25,6%) (El- Adawy & Taha, 2001). Aunque no presenta un valor tan alto para ser fuente de lípidos, se resalta en la literatura la calidad de los aceites esenciales y los ácidos grasos, que pueden ser usados como aditivos aromáticos naturales, principalmente, en alimentos (Jirovetz et al. 1988) o como insecticidas (Manica, 1997). Aun así, los valores fueron altos comparados en semillas de mango (13%) (Nzikou et al. 2010) y en guayaba (2,4%) (Bernandino-Nicanor et al. 2001).
Las cenizas (2,3%) están en porcentaje similar a lo reportado para esta misma semilla (2,29%) (Fasakin et al. 2008) y mango (2,3%) (Nzikou et al. 2010), pero inferior a lo hallado en melón (3,6%), calabaza (3,21%) y paprika (4,32%) (El-Adawy &Taha, 2001).
La fibra cruda (31,90%) es inferior a la registrada para las semillas de maracuyá (37,7%), guanábana (43,4%) (Fasakin et al. 2008), paprika (34,9%) (El-Adawy & Taha, 2001) y guayaba (69,3%) (Bernandino-Nicanor et al. 2001), pero superior a lo reportado en semillas de mango (2,02%) (Nzikou et al. 2010), Annona muricata (5,2%) (Kimbonguila et al. 2010), melón (4,83%) y calabaza (4,43%) (El-Adawy & Taha, 2001).
Las variaciones encontradas en el análisis proximal pueden ser causadas por la diferencia de la variedad de la planta, el clima, el estado de maduración del fruto y las semillas. En todo caso, es evidente que el alto contenido en grasa y en proteínas encontrado en la harina de semillas de guanábana muestra la posibilidad de su uso, como materia valiosa en concentrado para animales (Fasakin et al. 2008). Marroquin- Andrade et al. (2011) ya habían señalado que el alto contenido de proteína en esta especie, mayor a la harina de otros cereales, hace que sea un buen suplemento en dietas basadas en cereales.
Obtención de los Aislados proteicos: La figura 1 muestra la variación de la solubilidad de la harina desengrasada a diferentes pH. Se puede observar que el punto isoeléctrico (PI) de las proteínas está cercano a un pH=4, lo que está dentro del rango encontrado en otras semillas, como la guayaba (pH 5) (Bernandino-Nicanor et al. 2001). A valores de pH inferiores o superiores al PI, las proteínas tienen cargas netas positivas o negativas, respectivamente, que confieren mayor capacidad de interacción con el solvente. La mayor solubilidad se debe a la máxima carga neta que logran las proteínas; este comportamiento es característico de proteínas vegetales. En contraste con la menor solubilidad, lo cual, podría ser una limitante para ser empleada como aditivo en alimentos con pH medio, la solubilidad proteica es útil en productos alimenticios, donde se requieren propiedades, como gelificación, emulsificación y formación de espuma o donde la proteína estará en solución (Mizubuti et al. 2000).

Una vez solubilizada la harina, en medio alcalino, se procedió a precipitar las fracciones proteicas a pH 4 (PI); el precipitado obtenido fue el aislado proteico. El rendimiento para A0 fue de 46% y para A1, de 46,3%. El contenido de proteína para A0 fue de 39,9% y para A1, de 63,3%. Los aislados proteicos presentaron mejores características químicas que la harina; por ejemplo, mayor riqueza proteica. Lo anterior indica que estas semillas pueden ser usadas para la extracción de aislados proteicos con una cantidad media de proteína en presencia de una solución salina de NaCl al 1%.
Propiedades Funcionales de la harina desengrasada y los aislados proteicos
Capacidad de absorción de agua: La figura 2 muestra la variación de la CAA de la harina y los aislados proteicos (A0 y A1), obtenidos en medios con diferente fuerza iónica (NaCl 0 y 1,0%, respectivamente); el aislado proteico A0 tuvo un mejor desempeño que A1 y la harina a valores de fuerza iónica por encima de 0,4M de NaCl. Un incremento de la fuerza iónica disminuyó la CCA, lo cual, se puede atribuir al efecto de blindaje que ejerce el NaCl, debido a que satura las cargas electrostáticas presentes en la proteína. La capacidad de absorción de agua depende, principalmente, de la proteína y de algunos parámetros de ésta, como tamaño, forma, factores estéricos, balance hidrofílico-hidrofóbico de los aminoácidos en las moléculas, como también de los lípidos y carbohidratos. Según Hodge & Hosman (1976), las harinas con alta CAA tienen compuestos más hidrofílicos y es considerada una propiedad funcional de las proteínas, fundamental en alimentos viscosos, tales como sopas, salsas, masas y alimentos horneados, productos donde se requiere una buena interacción proteína-agua (Granito et al. 2004).

Capacidad de absorción de lípidos (CAL): La figura 3 muestra la variación de la CAL en la harina y los aislados proteicos (A0 y A1), obtenidos en medios con diferente fuerza iónica (NaCl 0 y 1%, respectivamente). A1 tuvo un mejor desempeño que A0 y la harina desengrasada, en todo el rango de fuerza iónica evaluado. A medida que la concentración salina aumenta, se mejora notablemente la CAL; posiblemente, la habilidad para absorber grasa esté estrechamente ligada a los cambios conformacionales que provoca el NaCl en las proteínas extraídas. Este mecanismo se ha explicado como un entrapamiento físico de aceite (Kinsella, 1979). La absorción de aceite es importante en la tecnología de alimentos, en productos congelados precocidos listos para freír, en galletas y en algunos platos a base de cereal, por lo cual, se puede sugerir el uso de las harinas vegetales, en este tipo de productos (Ramírez & Pacheco, 2009). Las harinas de semillas son útiles potencialmente en la interacción estructural en los alimentos, en especial, en la retención del flavor, mejoramiento de la palatibilidad y aumento de la vida útil en productos de panadería o en derivados cárnicos, donde la absorción de grasa es deseable (Fennema, 2000).

Actividad y estabilidad emulsificante (AE y EE): Se observó que la harina tiene una mayor actividad emulsificante que los aislados proteicos A0 y A1 (Tabla 2). Las propiedades emulsificantes están relacionadas con la cantidad de proteína soluble e insoluble y de otros componentes, como los polisacáridos (McWatters & Cherry, 1977). La capacidad de formar emulsiones depende del balance de los grupos hidrofílicos y lipofílicos presentes en los componentes de la harina (Khalid et al. 2003). La acción de las proteínas en las harinas, como emulsificantes, es influenciada por la concentración de proteína, la velocidad de mezcla, el tipo de aceite y el tipo de sistema de emulsificación. Esta propiedad es de gran importancia para el uso del producto en aderezos para ensaladas y para productos cárnicos (Bushway et al. 1984). El desplegamiento de las proteínas en la interfase agua/aceite juega un papel importante en la capacidad y en la estabilidad emulsificante, debido al aumento de la hidrofobicidad (Jayaprakasha & Brueckner, 1999).

La EE de la harina desengrasada fue mayor que la obtenida para los aislados proteicos. La estabilidad emulsificante de las proteínas está relacionada con su habilidad para reducir la tensión interfacial entre el aceite y el agua en la emulsión. La actividad superficial es una función de la habilidad de la proteína de migrar, de absorber, de desplegarse y de rearreglarse en una interfase (Oshodi & Ojokan, 1997).
Las propiedades emulsificantes de las proteínas dependen, principalmente, de dos efectos: (1) a una disminución significativa en la energía interfacial, debido a la absorción de la proteína en la interfase aceite/agua y, (2) a la barrera energética, estructural, mecánica y electrostática causada por la capa interfacial, que se opone a los procesos de desestabilización (Wagner & Guegen, 1995).
La sal puede afectar las propiedades emulsificantes por dos mecanismos: (1) el NaCl puede reducir la repulsión electrostática entre las gotas de la emulsión y, (2) la concentración de electrolitos en altas concentraciones pueden alterar la organización estructural de las moléculas de agua, lo que perturba la resistencia de las interacciones hidrofóbicas entre los grupos no polares (McClements, 1999).
Capacidad y estabilidad espumante (CE y EES): La harina desengrasada no desarrolló espuma, posiblemente, debido al bajo contenido de proteína que tiene; sin embargo, en los aislados se evidenció un porcentaje de volumen incrementado de 2,9%. La EES de A0 y A1 duró solamente 30 min. La capacidad para formar espuma depende de la cantidad de proteínas presentes, de su estructura y de la habilidad relativa de esas proteínas para desnaturalizarse, precipitar y disminuir la tensión superficial en la interface aire-líquido de la espuma, esto indica que se necesita buena cantidad de proteína, para que haya capacidad espumante.
Algunos autores (Akintayo et al. 1998) han relacionado una buena capacidad espumante con la flexibilidad de las moléculas de proteína, con la reducción de la tensión superficial y con una cantidad alta de proteína globular ordenada, lo cual, dificulta relativamente la desnaturalización superficial, que es la que lleva a una baja formación de espuma. La razón por la que las harinas son capaces de producir espuma es que las proteínas en las harinas tienen una superficie activa. Las proteínas solubles pueden reducir la tensión superficial en la interfase entre las burbujas de aire y el líquido que las rodea, de esta forma, se obstruye la coalescencia. Además, las moléculas de las proteínas pueden desplegarse e interactuar unas con otras para formar una película o multicapa de proteína, con un incremento de la flexibilidad de la interfase aire-líquido. Como resultado, es más difícil para las burbujas romperse y la espuma es más estable (Adebowale & Lawal, 2004).
Los aislados proteicos obtenidos de la almendra de la semilla de guanábana exhibieron propiedades funcionales de interés en la industria de los alimentos, tales como capacidad de absorción de agua y lípidos y capacidad y estabilidad emulsificante. Adicionalmente, la almendra puede ser una fuente de fibra y grasa cruda, lo que se puede constituir en una disminución de disposición de residuos agroindustriales y en un ingreso extra, para los procesadores de pulpa de guanábana.
Conflicto de intereses: El manuscrito fue preparado y revisado con la participación de todos los autores, quienes declaramos que no existe ningún conflicto de intereses que ponga en riesgo la validez de los resultados presentados. Financiación: Este estudio fue financiado por la Escuela de Ciencias Químicas de la Facultad de Ciencias de la Universidad Pedagógica y Tecnológica de Colombia.
BIBLIOGRAFÍA
1. ADEBOWALE, K.; LAWAL, O. 2004. Comparative study of the functional properties of bambarra groundnut (Voandzeia subterranean) jack bean (Canavalia ensiformis) and Mucuna bean (Mucuna pruriens) flours. Food Res Int. 37:355-365. [ Links ]
2. AKINTAYO, E.; OSHODI, A.; ESUOSO, K. 1998. Effects of NaCl, ionic strength and pH on the foaming and gelation of pigeon pea (Cajanus cajan) protein concentrates. Food Chem. 64:1-6. [ Links ]
3. AOAC. 2000. Official Methods of Analysis (16th Ed.). Washington, DC: Association of Official Analytical Chemists. p.777-787. [ Links ]
4. AWAN, J.A.; KAR, A.; UDOUDOH, P.J. 1980. Preliminary studies on the seeds of Annona muricata. Plant Foods Hum. Nutr. 30:163-168. [ Links ]
5. BADRIE, N.; SCHAUSS, A. 2009. Soursop (Annona muricata L.): Composition, Nutritional Value, Medicinal Uses and Toxicology. En: Bioactive Foods in Promoting Health. Publisher: Academic Press: Oxford. p.621-643. [ Links ]
6. BERNANDINO-NICANOR, A.; ORTIZ, M.A.; MARTÍNEZ A., A.L.; DÁVILA, O.G. 2001. Guava seed protein isolate: functional and nutritional characterization. J. Food Biochem. 25(1):77-90 [ Links ]
7. BEUCHAT, L.R. 1977. Functional and electrophoretic characteristics of succinylated peanut flour protein. J. Agr. Food Chem. 25:258-261. [ Links ]
8. BUSHWAY, A.; WILSON, A.; HOUSTON, L.; BUSHWAY, R. 1984. Selected properties of the lipid and protein fractions from Chia seed. J. Food Sci. 49(2):555- 567. [ Links ]
9. COFFMAN, C.W.; GARCÍA, V.V. 1977. Functional properties and amino acid content of protein isolate from Mung bean flour. J. Food Technol. 12:473-484. [ Links ]
10. EL-ADAWY, T.; TAHA, K. 2001. Characteristics and composition of different seed oils and flours. Food Chem. 74: 47-54. [ Links ]
11. FASAKIN, A.O.; FEHINTOLA, E.O.; OBIJOLE, O.A.; OSENI, O.A. 2008. Compositional analyses of the seed of soursop, Annona muricata L., as a potential animal feed Supplement. Sci. Res. Essays. 3(10):521-523. [ Links ]
12. FENNEMA, O. 2000. Química de los Alimentos. Editorial Acribia. España. p.434-444. [ Links ]
13. GORNALL, A.G., BARDAWILL, C.J.; DAVID, M.M. 1949. Determination of serum protein by means of the biuret reaction. J. Biol. Chem. 177:751-756. [ Links ]
14. GRANITO, M.; GUERRA, M.; TORRES, A.; GUINAND, J. 2004. Efecto del procesamiento sobre las propiedades funcionales de Vigna sinensis. Interciencia/Caracas. 29:521-526. [ Links ]
15. HODGE, J.C.; HOSMAN, E.M. 1976. Carbohydrates. In: Fennema, R.O. (ed.) Principles of Food Science. Part 1. Food Chemistry. Dekker, New York. p.97-200. [ Links ]
16. JAYAPRAKASHA, H.; BRUECKNER, H. 1999. Whey protein concentrate: A potential functional ingredient for food industry. J. Food Sci Tech. 36:189-204. [ Links ]
17. JIROVETZ, L.; BUCHBAVER, G.; NGASSOUM, M.B. 1988. Essential oil compounds of the Annona muricata fresh fruit pulp from Cameroon. J Agr Chem. 46: 3719-3720. [ Links ]
18. KHALID, E.; BABIKER, E.; EL TINAY, A. 2003. Solubility and functional properties of sesame seed proteins as influenced by pH and/or salt concentration. Food Chem. 82:360-369. [ Links ]
19. KIMBONGUILA, A.; NZIKOU, J.M.; MATOS, L.; LOUMOUAMOU, B.; NDANGUI, C.B..; PAMBOU-TOBI, N.P.G.; ABENA, A.A.; SILOU, Th.; SCHER, J.; DESOBRY, S. 2010. Proximate composition and physico- chemical properties of the seeds and oil of Annona muricata grown in Congo-Brazzaville. Res. J. Environ. Earth Sci. 2(1):13-18. [ Links ]
20. KINSELLA, J.E. 1979. Functional properties of soy proteins. J. Am. Chem. Soc. 56:242-258. [ Links ]
21. LIADAKIS, G.N.; TZIA, C.; OREOPOULI, V.; THOMOPOULUS, C.D. 1995. Protein isolation of tomatoe seed meal, extraction optimization. J. Food Sci. 60:477-482. [ Links ]
22. LOCK, O.; ROJAS, R. 2003. Química y farmacología de Annona muricata Linn. Rev. Quím. 8(2):23-28. [ Links ]
23. MANICA, I. 1997. Taxonomic, Morphology and Anatomiaprocedinngs of I Brazilian Symposium on Annonaceous. Brasil: Universidade Estadual do Suroeste da Bahia. Depto e Fitotecnia e Zootecnia. Vitória da conavista Bahia. p.20-35. [ Links ]
24. MARROQUÍN-ANDRADE, L.; CUEVAS-SÁNCHEZ, J.; GUERRA, D.; REYES, L.; REYES-CHUMACERO, A.; REYES-TREJO, B. 2011. Proximate composition, mineral nutrient and fatty acids of the seed of Ilama, Annona diversifolia Saff. Sci Res. Essays. 6(14):3089-3093. [ Links ]
25. McCLEMENTS, D.J. 1999. Emulsion stability. In: Hasenhuettl, G.; Hartel, R. (eds). Food emulsions: Principles, practice, and techniques. Boca Raton, London, New York, Washington, DC, USA: CRC Press. p.185-233. [ Links ]
26. McWATTERS, K.H.; CHERRY, J.P. 1977. Emulsification, foaming and protein solubility properties of defatted soybean, peanut, fieldpea and pecan flours. J. Food Sci. 42:1444-1450. [ Links ]
27. MIZUBUTI, I.; JÚNIOR, O.; OLIVEIRA, L.; DA SILVA, R.; LOUKO, E. 2000. Propriedades funcionais da farinha e concentrado proteico de Feijão guandu (Cajanus cajan (L.) Millsp). Arch. Lat. Nutr. 50:274-280. [ Links ]
28. NETO, V.Q.; NARAIN, N.; SILVIA, J.B.; BORA, P.S. 2001. Functional properties of raw and heat-processed cashew nut (Anarcardium occidentale L.) kernel protein isolate. Nah. 45:258-262. [ Links ]
29. NZIKOU, J.M.; KIMBONGUILA, A.; MATOS, L.; LOU- MOUAMOU, B.; PAMBOU-TOBI, N.P.G.; NDANGUI, C.B.; ABENA, A.A.; SILOU, TH.; SCHER, J.; DESOBRY, S. 2010. Extraction and characteristics of seed kernel oil from mango (Mangifera indica). Res. J. Environ Earth Sci. 2(1):31-35. [ Links ]
30. ONIMAWO, I.A. 2002. Proximate composition and selected physicochemical properties of the seed, pulp and oil of soursop (Annona muricata). Plant Foods Hum. Nutr. 57:165-171. [ Links ]
31. OSHODI, A.; OJOKAN, E. 1997. Effect of salts on some of the functional properties of bovine plasma protein concentrate. Food Chem. 59:333-338. [ Links ]
32. PSZCZOLA, D. 2004. Ingredients of food technology. J. Food Sci. 58:56-69. [ Links ]
33. RAMÍREZ, A.; PACHECO DE DELAHAYE, E. 2009. Propiedades funcionales de harinas altas en fibra dietética obtenidas de piña, guayaba y guanábana. INCI. 34(4):293-298. [ Links ]
34. RAKOSKY, J. 1989. Protein Additives in Foodservice Preparations; AVI Book, Van Nostrand Reinhold: New York. 258p. [ Links ]
35. TZENG, Y.M.; DIOSADY, L.L.; RUBIN, L.J. 1990. Production of canola protein materials by alkaline extraction, precipitation, and membrane processing. J. Food Sci. 55:1147-1151. [ Links ]
36. WAGNER, J.; GUEGUEN, J. 1995. Effect of dissociation, deamination and reducing treatment on structural and surface active properties of soy glycinin. J. Agric. Food Chem. 43:1993-2000. [ Links ]
Recibido: Julio 24 de 2013 Aceptado: Abril 29 de 2014













