INTRODUCCIÓN
Las culturas prehispánicas han confeccionado complejos y edificios monumentales durante siglos, así como material cerámico y textil. La región de la costa norte de Perú, se ha caracterizado por sus impresionantes cerámicas y orfebrería (Shimada et al. 2003). En 1987-1990, se recuperó un espectacular tesoro de artefactos ornamentales y ceremoniales de oro y plata de las tumbas reales no saqueadas de Sipán, Perú (que data de 50-300 d.c.). Estos objetos dan evidencia de la artesanía sobresaliente de los orfebres Moche y reflejan las diversas técnicas elaboradas de metalurgia disponibles, en ese momento (Hörz & Kallfass, 2000). Hoy en día, estos artefactos están almacenados en condiciones ambientales no óptimas para climas tropicales, que muestran una colonización y deterioro visibles por comunidades microbianas. Las actividades de las comunidades microbianas en patrimonio cultural son causas importantes de daños, a través de procesos químicos o mecánicos (Ciferri, 2002; Warscheid & Braams, 2000). Este tipo de daño por microbiota, se conoce como biodeterioro, que se refiere a cualquier actividad biológica que afecta la apariencia e integridad de los materiales (Sterflinger & Piñar, 2013). El término "biodeterioro", también se puede definir como la alteración no deseada de varios materiales, causada por pequeños organismos vivos, como insectos (Kakakhel et al. 2019).
La presencia y actividad de arqueas, bacterias, algas, líquenes, hongos, a veces animales y plantas superiores, a menudo, causan biodeterioro de reliquias de cerámica, resto óseos y metales, por lo tanto, son amenazas importantes para la preservación a largo plazo, de este valioso patrimonio cultural (Kakakhel et al. 2019). Los hongos juegan roles positivos y negativos en nuestra vida diaria. Son patógenos que sintetizan sustancias corrosivas y micotoxinas, que tienen el potencial de causar biodeterioro materiales, como piedra y hormigón (Meng et al. 2016; 2017) y también en materiales poliméricos (Gu et al. 1998; Gu, 2003). El daño de los objetos del patrimonio cultural es un proceso causado por los procesos químicos y físicos, propios del metabolismo de los organismos involucrados (Kakakhel et al. 2019). El crecimiento microbiano en la superficie de los materiales puede causar el agrietamiento y el desplazamiento de los materiales de construcción, lo que resulta en el debilitamiento y la destrucción completa de los monumentos (Farooq et al. 2015; Liu et al. 2018). El biodeterioro, se ha discutido ampliamente, pero sus impactos negativos se han subestimado, debido a las pocas investigaciones sobre los mecanismos involucrados en el pasado (Kakakhel et al. 2019). Alguna vez, se creyó que los procesos químicos son los principales factores responsables de la descomposición, pero ahora las percepciones han cambiado y se ha aceptado, en general, que las bacterias, las arqueas y los hongos causan una seria destrucción al patrimonio cultural, como las momias, los libros y las pinturas, a través de su actividad enzimática, procesos metabólicos y corrosión/daño (Sterflinger & Piñar, 2013). El objetivo general fue identificar los microrganismos ambientales aislados de los almacenes del museo Tumbas Reales de Sipán, en Lambayeque, Perú.
MATERIALES Y MÉTODOS
El trabajo de investigación fue descriptivo de corte transversal, se analizaron 54 unidades de muestreo de los almacenes del museo Tumbas Reales Señor de Sipán, durante agosto-octubre de 2015. El muestreo, se realizó en los almacenes del museo Tumbas Reales Señor de Sipán, en la provincia de Lambayeque, ubicada en la región Lambayeque, a 5°28’36’’ y 7°14’37’’ latitud Sur, 79°41’30’’ y 80°37’23’’ de longitud Oeste y 18 m s.n.m. Los almacenes donde se colectaron las muestras fueron Ventarrón, El Triunfo, Santa Rosa y Sipán. En los tres primeros, se guardaban restos orgánicos y cerámicas y, en el cuarto, se almacén cerámicas y objetos metálicos. En cada almacén, las muestras se obtuvieron en la superficie del piso, superficie de pared, aire del ambiente y aire de cajas conteniendo material arqueológico, tomando en cuenta una zona expuesta, cerca de la puerta o ventana y una zona protegida (Figura 1, 2 y 3).
En la superficie de pisos y de paredes, se delimitaron dos áreas de 1m2, en las zonas expuesta y protegida, donde se colocaron seis “marcos” de cuadrados de cartulina, que delimitaron áreas de 5x5 cm y una superficie de 25 cm2 (Figura 1a y 1b).
Estos marcos fueron esterilizados en horno (180 °C x 20’), se ubicaron en el área delimitada: cuatro en las esquinas y dos en el centro y en el interior, se tomaron las muestras con hisopos estériles (180 °C x 2 h) y humedecidos con una solución de cloruro de sodio (NaCl 0,85 % p/v), más Tween 80. La superficie muestreada, se frotó con el hisopo en sentido horizontal, vertical y diagonal; luego, los hisopos se depositaron en tubos con la misma solución, para el posterior aislamiento en Agar nutritivo, con antibiótico Cicloheximida y Agar Papa Dextrosa con Cloranfenicol.
El muestreo de aire en los almacenes, se realizó en seis áreas delimitadas por un tablero de 50x50 cm, sostenido por un soporte de cartón prensado, a una altura de 1,20 cm. Los lugares seleccionados correspondieron a tres zonas protegidas (no hubo corrientes de aire) y tres expuestas (cerca de ventanas y puertas con corrientes de aire), de los almacenes. Según la técnica de sedimentación por gravedad sobre el tablero, se colocaron en las esquinas (4) y en el centro (2) placas de Petri, con Agar Nutritivo-fluconazol (tres placas), Agar Sangre-antimicótico (dos placas) y Agar Papa dextrosa (tres placas) y se mantuvieron abiertas durante 15 minutos (López-Aranda et al. 2020) (Figura 2).
En los estantes de los ambientes muestreados, se seleccionaron dos cajas de almacenamiento: en las zonas “protegida” y “expuesta”, se retiraron las tapas y, en su interior, se colocaron las placas de Petri abiertas, con Agar Nutritivo (tres placas) y Agar Papa Dextrosa (tres placas). Las cajas se taparon, cada 5 minutos, las paredes y la tapa de las cajas, se golpearon durante medio minutos y después de 15 minutos, se retiraron las placas de Petri. Los tubos con las muestras de superficie y las placas de Petri con las muestras de aire, se depositaron en la caja térmica (10 ± 1 °C) y se llevaron al laboratorio de Microbiología y Parasitología, para el aislamiento de bacterias y hongos (Figura 3).
Las muestras de superficies de pisos y de paredes colectadas con hisopos fueron sembradas en placas de Petri con Agar Nutritivo-fluconazol, para cuantificar bacterias y Agar Papa Dextrosa-antibiótico, para cuantificar hongos. La incubación, se realizó a 30 °C, en aerobiosis, hasta por 7 días, para bacterias y 10 días, para hongos. El número de unidades formadoras de colonias por metro cúbico de aire (UFCm-3) o metro cuadrado de superficie (UFCm-2), se calculó según la fórmula.
Donde: N = UFCm-3 o UFCm-2; a = número de colonias por placa de Petri; b (para m-2) = área (lado2) del muestreador (cm2); b (para m-3) = área (πR2) de la placa de Petri (cm2); t = tiempo de exposición.
Las colonias de bacterias y los hongos fueron agrupados, según su morfología y cada morfotipo, se aisló por duplicado, en viales con Agar Nutritivo y Agar Papa Dextrosa.
En la identificación de las bacterias, se determinaron las características macroscópicas de las colonias desarrolladas en agar nutritivo a 37 °C, durante 3 días. Para la identificación, a nivel de género, se realizaron tinciones de Gram y de Ziehl-Neelsen y las pruebas de catalasa, motilidad, acidez a partir de carbohidratos, hidrólisis del almidón y gelatina, tolerancia a NaCl, hidrólisis de arginina, reducción de nitratos, prueba de Vogues Proskauer.
Para la identificación de hongos, se usaron las características macroscópicas de las colonias desarrolladas en agar papa dextrosa a 30 °C, hasta por 10 días, para llegar a género. A continuación, con la técnica de “impresión con cinta adhesiva transparente” (Labarca et al. 2006), sobre cada colonia de hongo, se depositó un fragmento de cinta adhesiva de 6 cm de longitud y luego se llevó a una lámina portaobjetos, conteniendo una gota de azul de lactofenol; se presionó de manera sucesiva y se observó con objetivo de 40x, identificándose las características microscópicas del micelio vegetativo y las estructuras reproductivas (Barnett & Hunter, 1998).
Los datos obtenidos fueron ordenados y expresados en tablas y figuras, que permitieron visualizar y analizar las bacterias y los hongos de riesgo potencial, para el material arqueológico y trabajadores del museo. Los datos fueron procesados utilizando los programas Microsoft Office Word 2013 y Microsoft Office Excel 2013.
RESULTADOS Y DISCUSIÓN
Los hongos y las bacterias y el número de unidades formadoras de colonias de los microorganismos aislados en los almacenes del museo Tumbas Reales Señor de Sipán, se muestran en las tablas 1 y 2.
Tabla 1 Nombre de almacén y procedencia de muestras colectadas en museo Tumbas Reales Señor de Sipán, Lambayeque, 2015.
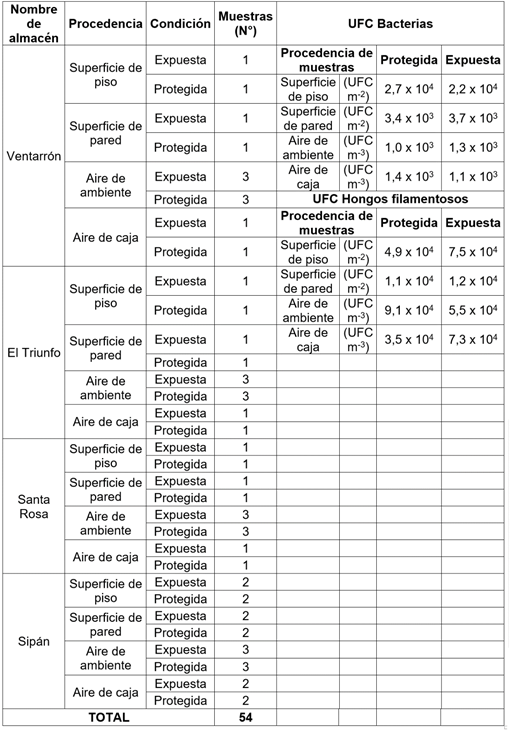
Tabla 2 Frecuencia de géneros de bacterias identificadas en los almacenes del museo Tumbas Reales Señor de Sipán, Lambayeque, 2015.

En las superficies y ambiente de los almacenes del museo Tumbas Reales Señor de Sipán, en Lambayeque, se cuantificaron bacterias y hongos filamentosos; en otros estudios sobre biodeterioro, también se aislaron géneros de bacterias y hongos, que colonizaban material histórico, en almacenes de museos (Grbić et al. 2013; Konsa et al. 2014). En el aire de los almacenes, se cuantificaron hasta 1,3x103 UFCm-3, superando 2,6x102 UFCm-3, reportados por Guiamet et al. (2011). Esto quizás se deba a la manera de almacenamiento y a los materiales arqueológicos almacenados.
La variedad de partículas de diferente origen forma y tamaño suspendidas en el aire del interior y exterior de los ambientes constituye el aerosol atmosférico. Las instalaciones históricas, como iglesias, criptas, bibliotecas y museos, son cruciales para preservar el patrimonio cultural, pero, al mismo tiempo, se visitan con frecuencia objetos turísticos y entornos de trabajo (Chmiel et al. 2019).
Se considera que la mayoría de las esporas de hongos se encuentran al aire libre, por lo que podrían ingresar a la mayoría de los locales examinados con el aire exterior o en la ropa de las personas. Por otro lado, los principales depósitos interiores de aerosoles bacterianos son la piel de humanos y animales, por lo tanto, los microorganismos predominantes en el aire atmosférico serían hongos, mientras que las bacterias prevalecerían en interiores (Cox & Wathes, 1995; Karbowska-Berent et al. 2011). Cuando se excluye la infiltración del aire exterior, el aumento del número de partículas fúngicas en el aire de bibliotecas, archivos y museos puede resultar de la dispersión de algunas fuentes internas, por ejemplo, colecciones contaminadas, papel tapiz o pintura (Karbowska-Berent et al. 2011).
En la superficie de pisos y paredes, se cuantificaron hasta 2,7x104 UFCcm-2, de bacterias, valor inferior a 7,1x105 UFCcm-2, reportado por Guiamet et al. (2011), en la superficie de mapas y fotografías de un museo. Al respecto, una diversidad de bacterias se ha cuantificado y aislado en diferentes materiales arqueológicos, en fibras textiles (Eyzaguirre, 2002), momias de sarcófagos (Cavka et al. 2010), cuerpos preservados en catacumbas (Piñar et al. 2013), aire, libros y documentos de museos y archivos (Sequeira et al. 2012). Fusarium no se conoce típicamente como un género fúngico importante que degrada la madera, sino que es un hongo asociado con la basura y el suelo, que es importante para degradar los detritos de las plantas y como patógenos de plantas; sin embargo, el género, a menudo, se aísla de los materiales de madera y se sabe que posee una alta actividad lignocelulolítica (Daâssi et al. 2016; Obruca et al. 2012). El número de hongos filamentosos fue mayor en el aire que en las superficies y la superioridad numérica, se debe a la rápida dispersión de las esporas, por el movimiento de las corrientes de aire. De igual manera, Rojas et al. (2012) identificaron una mayor diversidad de géneros de hongos filamentosos en el aire, en comparación con otros objetos muestreados (18 géneros).
El número de bacterias superó al de hongos filamentosos, coincidiendo con Guiamet et al. (2011). En los almacenes investigados, se identificaron siete géneros de bacterias, entre los que Bacillus, Streptococcus, Staphylococcus, Micrococcus y Streptomyces fueron reportados por Guiamet et al. (2011), así como Acinetobacter y Nocardia. Las bacterias Gram positivas predominaron frente a las Gram negativas, similar con Guiamet et al. (2011). Los cocos Gram positivos están asociados a la actividad humana; son acarreados en la piel y membranas mucosas (Zhu et al. 2003). El género Bacillus, se identificó en todas las muestras investigadas, evidenciándose un requerimiento de mantenimiento adecuado en los ambientes de procedencia (Guiamet et al. 2011).
En cuanto a las zonas investigadas, el número promedio de hongos filamentosos fue superior en las muestras de superficie de pisos, paredes y aire de las cajas de zonas expuestas, así como también en el aire del ambiente de zonas protegidas (Tabla 1). El número promedio de bacterias fue menor que el de hongos filamentosos en las superficies de pisos y paredes y en el aire de ambientes y cajas de los almacenes, en el museo Tumbas Reales Señor de Sipán (Tabla 1).
En los almacenes investigados, se identificaron 15 géneros de hongos filamentosos, entre los que Aspergillus, Cladosporium y Penicillium fueron reportados en ambientes y material arqueológico, por Guiamet et al. (2011) y Rojas et al. (2012).
El género Syncephalastrum fue reportado por Guiamet et al. (2011) y Rojas et al. (2012); los géneros Rhizopus y Stachybotrys, por Rojas et al. (2012); Alternaria y Nigrospora, por Rojas et al. (2012); Chrysosporium, por Cavka et al. (2010).
Los géneros Verticillium, por Piñar et al. (2013); Gliocladium también, se identificaron Cunninghamella, Circinella, Staphylotrichum y Cercospora, hongos encontrados sobre materia orgánica vegetal.
El género Aspergillus fue el más frecuente, similar con Guiamet et al. (2011) y Rojas et al. (2012). Este género de hongo filamentoso ha sido reportado en el aire en superficies de mapas y fotografías (Guiamet et al. 2011), en momias (López-Aranda et al. 2020; Cavka et al. 2010) y en ambientes interiores y exteriores de bibliotecas (Montanari et al. 2012). Asimismo, Rojas et al. (2012), en el aire y soportes de siete edificios históricos, identificaron Aspergillus, como uno de los géneros de hongos filamentosos más comunes, correspondiéndole el 34,2 %, de 38 especies identificadas.
En los almacenes, se aislaron e identificaron siete géneros de bacterias (Tabla 2), predominando Bacillus (94,4 %) y Micrococcus (64,8 %), seguido de Acinetobacter (63,3 %), Nocardia (31,4 %), Streptococcus (16,6 %), Staphylococcus (11,1 %) y Streptomyces (11,1 %). Los géneros Bacillus, Micrococcus, Nocardia y Streptococcus, se identificaron en las superficies de pisos, paredes y aire de ambientes y cajas, destacando Bacillus, que se registró en todas las muestras. A su vez, Staphylococcus, se identificó en las superficies de pisos, paredes y aire de los ambientes, así como Streptomyces, en las superficies de pisos y aire de los ambientes (Tabla 2).
En la presente investigación no se identificaron levaduras; sin embargo, López-Aranda et al. (2020) reportaron los géneros Candida y Rhodotorula, junto a hongos filamentosos, en momias, con visible deterioro. En su mayoría, los microorganismos identificados en la presente investigación han sido reportados como agentes de biodeterioro, por su actividad enzimática, con hidrólisis de la celulosa, lignina y proteína, producción de ácidos orgánicos y pigmentos (López-Aranda et al. 2020), destacando Bacillus, Streptomyces (Guiamet et al. 2011), Aspergillus, Penicillium, Cladosporium, Nigrospora, Rhizopus, Syncephalastrum (Rojas et al. 2012) y Penicillium. El biodeterioro implica alteraciones de las propiedades fisicoquímicas y mecánicas del material o soporte histórico, por acción de los organismos vivos. En este aspecto, bacterias y hongos causan un daño significativo en el material histórico, como resultado de su actividad metabólica (Farooq et al. 2015).
El género Aspergillus, seguido de Cladosporium, fueron los más frecuentes y se identificaron en las superficies de pisos, paredes y aire de ambientes y cajas de todos los almacenes. Los géneros Circinella, Syncephalastrum y Penicillium, se identificaron en las superficies y aire de algunos ambientes; Staphylotrichum, Gliocladium, Verticillium y Rhizopus, en las superficies, así como Chrysosporium, Stachybotrys, Cunninghamella, Alternaria, Cercospora y Nigrospora, en el aire (Tabla 3).
Tabla 3 Frecuencia de géneros de hongos filamentosos identificados en los almacenes del museo Tumbas Reales Señor de Sipán, Lambayeque, 2015.

Las bacterias y los hongos identificados en los almacenes del museo Tumbas Reales Señor de Sipán, también han sido reportados como patógenos para el hombre, mencionándose Nocardia, como causante de endocarditis infecciosa y micetoma; Acinetobacter, responsable de infecciones nosocomiales multirresistentes; Bacillus y Streptococcus, causantes de trastornos diversos en niños; Aspergillus, Penicillium, Alternaria y los mucorales, como causantes de procesos alérgicos y Rhizopus, Aspergillus y Penicillium, asociados a infecciones oportunistas en personas inmunodeprimidas. La presencia de bacterias y de hongos filamentosos en los ambientes de almacenamiento del material histórico representa un riesgo potencial de biodeterioro y enfermedades para los curadores, requiriéndose implementar adecuadas medidas de control y de mantenimiento. Se aislaron Bacillus, Micrococcus, Acinetobacter, Nocardia, Streptococcus, Staphylococcus y Streptomyces y los géneros de hongos filamentosos: Aspergillus, Cladosporium, Circinella, Syncephalastrum, Penicillium, Alternaria, Staphylotrichum, Cercospora, Rhizopus, Cunninghamella, Chrysosporium, Nigrospora, Stachybotrys, Gliocladium y Verticillium, en los almacenes del museo Tumbas Reales de Sipán.



















