INTRODUCCIÓN
El Bosque Seco Tropical (bs-T) se considera una formación vegetal con cobertura boscosa continua, distribuida entre los 0 y los 1000 m de altitud, en áreas con condiciones marcadamente estacionales con uno o dos periodos de sequía al año, con temperaturas superiores a los 24 °C y precipitaciones entre los 700 y 2000 mm anuales (IAvH 1997, Pizano et al. 2014). El bs-T corresponde a cerca del 22 % de las áreas de bosque de Sur América, siendo considerado uno de los ecosistemas más amenazados del planeta (Murphy y Lugo 1986, IAvH 1998, Miles et al. 2006). En Colombia se estima que la extensión original correspondía a cerca de 80 000 km2 y en la actualidad queda menos del 3 % (Etter 1993, IAvH 1998, Díaz 2006). Esta transformación ha generado zonas urbanas y paisajes dominados por sistemas agropastoriles, donde las prácticas agrícolas y ganaderas son las causantes de su simplificación (Arellano et al. 2008, Giraldo et al. 2011, Neita y Escobar 2012, Sánchez et al. 2016, de Farias y Hernández 2017).
Una de las estrategias más utilizadas para evaluar de manera rápida y eficiente el efecto de las perturbaciones de carácter antrópico es el uso de bioindicadores (McGeoch et al. 2002, Spector 2006, Otavo et al. 2013). Los escarabajos coprófagos (Coleoptera: Scarabaeidae: Scarabaeinae) se consideran un eficiente grupo indicador para evaluar estos efectos debido a su alta sensibilidad a los cambios ambientales (Halffter y Favila 1993). Adicionalmente, son esenciales para el funcionamiento de los ecosistemas al participar activamente en la descomposición del excremento, remoción y aireación del suelo, la dispersión secundaria de semillas y el control de parásitos (Nichols et al. 2008). A nivel mundial se conocen más de 7000 especies de Scarabaeinae agrupadas en 250 géneros (Schoolmeesters c2018). Para Colombia, Noriega et al. (2015) reconocen 305 especies agrupadas en 40 géneros, registradas en 386 localidades, de las cuales 16 corresponden a áreas de bs-T y de las cuales doce se ubican en la Costa Caribe (González-Alvarado y Medina 2015). Noriega et al. (2015) señalan que el departamento de Bolívar presenta un nivel de muestreo intermedio-bajo, con solo ocho localidades muestreadas y con extensas áreas sin ningún registro. En otras regiones del Caribe colombiano con bs-T se han encontrado entre 14 y 30 especies (IAvH 1998, Jiménez-Ferbans et al. 2008, Martínez et al. 2010, Solís et al. 2011, Rangel-Acosta et al. 2012), mientras que para Bolívar Noriega et al. (2013) señalan registros para 38 especies de Scarabaeinae.
En ambientes tropicales con regímenes pluviométricos marcados de lluvias y sequías se han registrado fluctuaciones de la riqueza y abundancia de escarabajos coprófagos entre una temporada y otra, donde el mayor pico se presenta al final de la temporada de lluvias (Andresen 2005, Andrade et al. 2011, Noriega et al. 2016). Se ha postulado que dichas fluctuaciones están influenciadas por la precipitación ya que genera una mayor oferta de recursos a nivel cualitativo y cuantitativo (Navarro et al. 2011), y también por la textura del suelo, la humedad y la estructura del hábitat que generan condiciones más apropiadas (Andresen 2005, Liberal et al. 2011). Adicionalmente, es importante mencionar que en este sentido no se han realizado trabajos en zonas semi-rurales del departamento de Bolívar evaluando el efecto de la estacionalidad en la estructura de los ensamblajes.
El poco conocimiento de la diversidad y estacionalidad de los escarabajos coprófagos en el departamento de Bolívar, sobre todo en los remanentes de bs-T, limita su uso como bioindicadores en estudios ecológicos y de impacto ambiental en la región. Por esta razón es importante realizar estudios con el fin de conocer a fondo su diversidad, estacionalidad y ampliar el inventario de los Scarabaeinae en los bs-T de este departamento. Uno de los remanentes de bs-T en mejor estado de conservación del departamento de Bolívar, y que a su vez está ubicado en área de influencia urbana, es el que se encuentra en el jardín botánico "Guillermo Piñeres" de Cartagena. En este trabajo se presenta el estudio de la diversidad y estacionalidad del ensamblaje de Scarabaeinae en un remanente de bs-T, buscando responder la siguiente pregunta de investigación: ¿Cuál es el patrón estacional del ensamblaje de escarabajos coprófagos en el Jardín Botánico de Cartagena? Nuestra hipótesis de estudio es que el ensamblaje de escarabajos coprófagos evidencia un patrón estacional marcado asociado al pico de lluvias afectando la abundancia, riqueza y estructura del mismo. Adicionalmente, exploramos las preferencias tróficas de cada una de las especies del ensamblaje.
MATERIALES Y MÉTODOS
Área de estudio
El jardín botánico "Guillermo Piñeres" está ubicado en área rural de Turbaco, en el sector Matute, departamento de Bolívar - Colombia (10°21' Norte, 75°25' Oeste) a 134 m de altitud (Fig. 1). Hace parte del zonobioma Cinturón Árido Pericaribeño, el cual presenta un régimen pluviométrico cuasi-bimodal, con un período seco definido entre diciembre y marzo, un período lluvioso entre agosto y noviembre con las mayores precipitaciones en el mes de octubre, y un periodo de transición entre abril y julio; la temporada de baja precipitación en los meses de junio y julio es llamada comúnmente Veranillo de San Juan (Jaramillo-Robledo y Chaves-Córdoba 2000, Pabón et al. 2001). El jardín fue creado en 1978 para el estudio y conservación de la flora y fauna de la región Caribe Colombiana, abarcando nueve hectáreas, cinco de ellas con colecciones de plantas y cuatro con bs-T nativo protegido. El área de bosque presenta la mayor parte de su cobertura original y otra parte como formación secundaria, con algunos elementos de Bosque Húmedo Tropical, Bosque Tropical Semicaducifolio, Bosque de Galería y Bosque Ripario, debido a la presencia de cuerpos de agua permanentes. Entre las especies vegetales dominantes se encuentran: Cavanillesia platanifolia (Humb. & Bonpl.) Kunth (macondo), Bursera simaruba (L.) Sarg. 1890 (indio en cuero), Astrocaryum malybo H.Karst. (palma espinosa), Swietenia macrophylla King (caoba), Cedrela odorata L. (cedro), Anacardium excelsum L. (caracolí), Ficus maxima Mill. (higuerón), Aspidosperma desmanthum Benth. ex Müll. Arg. (carreto), Cecropia peltata Linnaeus, 1759 (yarumo) y Nectandra turbacensis Nees (laurel amarillo) y a nivel faunístico los componentes más comunes son: Alouatta seniculus (Linnaeus, 1766) (monos aulladores), Bradypus variegatus Schinz, 1825 (perezoso), Dasyprocta punctata (Gray, 1842) (agouti americano), Tayassu tajacu (Linnaeus, 1758) (pecari), Sciurus granatensis Humboldt, 1811 (ardilla roja), además de varias especies de aves, reptiles y anfibios.
Diseño de muestreo y trabajo de laboratorio
Se hicieron muestreos en noviembre de 2015 y enero, mayo y septiembre de 2016. En cada uno de ellos se realizó un transecto lineal con catorce trampas de caída cebadas con excremento humano (Noriega y Fagua 2009). Adicionalmente, en noviembre se colocaron cuatro trampas cebadas con carne descompuesta, dos de res y dos de pollo, y en mayo y septiembre diez adicionales, cinco de res y cinco de pollo. Las trampas estuvieron separadas 50 m entre sí (Larsen y Forsyth 2005) y permanecieron activas por 48 horas. También se tomaron datos de precipitación en campo, los cuales fueron complementados con los datos de temperatura (2015-2016) de la estación del IDEAM (29035170 SINCERÍN), ubicada en Arjona, Bolívar. Los ejemplares capturados se preservaron en etanol al 90 % y se montó una colección de referencia. Se extrajo el genital de los machos para facilitar la identificación infragenérica, la cual se llevó a cabo utilizando claves taxonómicas a nivel de especie (Solis y Kohlmann 2004, González et al. 2009, Camero 2010, Vaz-de-Mello et al. 2011, Edmonds y Zidek 2012, Delgado y Curoe 2014, González-Alvarado y Vaz-de-Mello 2014), comparación con material de colecciones y la ayuda de expertos. Para la ordenación taxonómica supragenérica se siguió a Tarasov y Dimitrov (2016). Los ejemplares recolectados fueron depositados en la colección de referencia de la Universidad de Cartagena (CUDC) y en la colección de referencia del último autor (CJAN).
Análisis de datos
La eficiencia de cada muestreo se evaluó mediante curvas de acumulación de especies y con los estimadores de ACE, Chao 1, Jack-Knife 1, singletons (especies representadas por un individuo en todo el muestreo) y doubletons (especies que aparecen representadas por dos individuos) utilizando el programa EstimateS v. 9.1 (Colwell c2013). Se determinó la riqueza y la abundancia total y específica por muestreo, y se estimaron y compararon los índices de Shannon-Wiener, Simpson y Margalef, como medidas de la diversidad. Se determinó el grupo funcional (tipo de relocalización + tamaño + preferencia trófica) de cada especie según las siguientes categorías: i) tipo de relocalización del excremento (P = paracópridos - cavadores, T = telecópridos -rodadores y E = endocópridos - residentes), ii) el tamaño promedio de los individuos de cada especie (largo total desde el clípeo hasta el pigidio) (p = pequeño ≤ 10 mm, m = mediano > 10 a < 15 mm y g = grande ≥ 15 mm; siguiendo la propuesta de Doube (1990)) y iii) su preferencia trófica (C = coprófago, N = necrófago o G = generalista) cuando más del 75 % de los individuos aparecen en ese tipo de cebo. Las especies se agruparon en tres categorías según su registro en el tiempo: i) especies siempre presentes, aquellas presentes en los cuatro muestreos, ii) especies discontinuas aquellas presentes en dos o tres muestreos no consecutivos, y iii) especies exclusivas o presentes en solo un muestreo. Para comparar los ensamblajes de cada muestreo se realizó un análisis de similitud entre los muestreos, calculado mediante el índice de Bray-Curtis.
Se realizó un análisis de varianza (ANOVA) de una vía para determinar la existencia de diferencias entre la abundancia y la riqueza entre los muestreos, previa comprobación de la normalidad de los datos y de la homogeneidad de las varianzas con pruebas de Shapiro-Wilk y Levene respectivamente. A estos resultados, se les realizó una prueba de contraste "post-hoc" usando la corrección de Bonferroni de comparaciones múltiples entre las estaciones para evidenciar diferencias significativas. Para determinar la relación entre las variables climáticas como temperatura y precipitación promedio mensual, con la riqueza y la abundancia se realizó una regresión. El análisis de los datos se realizó mediante el programa PAST v. 1.37 (Hammer et al. 2001) con un valor de significancia de P ≤ 0,05.
RESULTADOS
Se capturaron 3550 individuos agrupados en 18 especies, diez géneros y seis tribus (Tabla 1). El género con el mayor número de especies fue Canthon (N = 7), seguido de Onthophagus y Eurysternus con dos especies cada uno, en los demás géneros solo se registró una especie. La especie más abundante fue Canthon aequinoctialis (Harold, 1868) con 1245 individuos (35,07%), seguida de Canthon subhyalinus (Harold, 1867) (N = 913, 25,72 %) y Canthon juvencus (Harold, 1868) (N = 317, 8,93 %).
Tabla 1 Diversidad de las especies de escarabajos coprófagos (Coleoptera: Scarabaeidae) en los cuatro muestreos (noviembre 2015, enero, mayo y septiembre 2016) realizados en el jardín botánico de Cartagena, Bolívar, Colombia.

Gremio (G): Paracópridos (P), Telecópridos (T) y Endocópridos (E); tamaño (T): pequeño ≤ 10 mm (p), mediano > 10 a ≤ 15 mm (m) y grande > 15 mm (g); y preferencia trófica (F): coprófago (C), necrófago (N) o generalista (G).
Los estimadores de ACE, Chao 1 y Jack-Knife 1 mostraron que en los muestreos se recolectó entre el 84,9 % y el 100 % del número estimado de especies (noviembre = 84,9-100 %, enero = 90,6-100 %, mayo = 87,9-96,5 %, septiembre = 94,3-100 %), y que el número de trampas en cada muestreo fue suficiente, ya que las curvas de estos estimadores fueron asintóticas (Fig. 2). Las curvas de singletons y doubletons disminuyeron y se cruzaron, lo cual indica que difícilmente pueden hallarse nuevas especies en el área de estudio (Fig. 2).

Figura 2 Curvas de acumulación de especies de escarabajos coprófagos (Coleoptera: Scarabaeidae) para los cuatro muestreos: a. noviembre 2015; b. enero; c. mayo; d. septiembre de 2016 y e. para el total recolectados en el jardín botánico de Cartagena, Bolívar, Colombia. N = número de especies registradas para cada estación y total.
Por otra parte, las especies Coprophanaeus jassius (Olivier, 1789), Canthidium aurifex Arrow, 1931 y Diabroctis cadmus (Harold, 1868) presentaron abundancias muy bajas (Tabla 1). La mitad de las especies se agrupó como especies siempre presentes y solo tres (16,6 %) fueron exclusivas de un solo muestreo (C. aurifex en noviembre 2015, D. cadmus en enero 2016 y C. jassius en septiembre de 2016) (Tabla 1).
En relación con los gremios de relocalización, el mayor número de especies fue el de los pequeños telecópridos (Tp = 5), seguido de los pequeños paracópridos (Pp = 4), los grandes paracópridos (Pg = 3) y los medianos telecópridos (Tm = 2). Solo se encontró una especie por gremio para los medianos paracópridos (Pm), grandes telecópridos (Tg), pequeños endocópridos (Ep) y medianos endocópridos (Em). No se encontraron especies pertenecientes al gremio de los grandes endocópridos (Tabla 1). Con respecto a las preferencias tróficas la mayoría de las especies presentan hábitos coprófagos (N = 12, 66,7 %), seguidos de las especies generalistas (N = 4, 22,2 %) y por último las especies con hábitos necrófagos que solo fueron dos (C cyanellus y P. hermes; 11,1 %) (Tabla 1).
Con respecto a la estacionalidad, se registraron diferencias significativas para la abundancia (F38 82 = 4,904, P = 0,003, N = 83) y para la riqueza (F4154 = 6,11, P < 0,001, N = 83) (Fig. 3) entre los muestreos. En enero de 2016 (época seca) se obtuvo la mayor abundancia (N = 1129) y el menor número de especies (11 spp.), mientras que la menor abundancia se presentó en mayo de 2016 (N = 667), mes que corresponde a la época de transición (Fig. 4). El mayor número de especies fue hallado en noviembre de 2015 y septiembre de 2016 (N = 16), meses correspondientes a la época lluviosa (Tabla 1, Fig. 4). Los mayores valores de los índices de Margalef (2,239) y Shannon-Wiener (1,865) se hallaron en septiembre de 2016. Exceptuando el índice de Margalef, no se registran diferencias en la diversidad entre los cuatro meses. Por otra parte, la mayor dominancia, según el índice de Simpson, fue en noviembre de 2015 (0,733) (Tabla 1).

Figura 3 Diagrama de cajas para: a. riqueza y b. abundancia en los cuatro muestreos para los escarabajos coprófagos (Coleoptera: Scarabaeidae) colectados en el jardín botánico de Cartagena, Bolívar, Colombia. Letras diferentes frente a las cajas representan pruebas de contraste post-hoc entre las estaciones evidenciando diferencias significativas (P = 0,05).

Figura 4 Relación entre: a. la riqueza (círculos) y la abundancia (barras) para los escarabajos coprófagos (Coleoptera: Scarabaeidae) colectados en el jardín botánico de Cartagena y los valores de b. pluviosidad y c. temperatura promedio en el norte de Bolívar, Colombia.
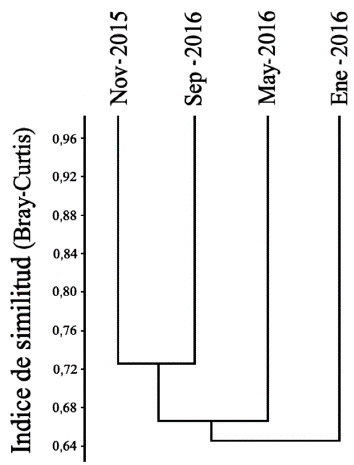
La precipitación y la abundancia presentaron una regresión lineal negativa (r = -0,381, P <0,01, n = 83), al igual que la riqueza y la precipitación (r = -0,370, P < 0,01, n = 83). El mes con la menor precipitación (0 mm) y la mayor temperatura promedio (35,5 °C) fue enero, y mayo el mes con mayor precipitación (144 mm) y menor temperatura (34,6 °C). En relación con la similitud se registraron diferencias entre los ensamblajes del segundo muestreo (enero 2016) y los demás muestreos, formando un grupo entre el primer (noviembre 2015) y el último muestreo (septiembre 2016, 72,74 %) (Fig. 5). La temperatura promedio no presentó variaciones superiores o inferiores a 1 °C durante el muestreo, y la prueba no mostró una relación significativa con la abundancia o la riqueza.
DISCUSIÓN
Dado que las curvas de acumulación indicaron que los cuatro muestreos fueron eficientes para el área de estudio, se pudo completar el inventario de los escarabajos coprófagos del bs-T del jardín botánico. A medida que el inventario se hace más completo, las probabilidades de registrar una especie no colectada anteriormente disminuyen, mientras que el esfuerzo necesario para un nuevo hallazgo se incrementa (Jiménez-Valverde y Hortal 2003). Sin embargo, es importante continuar muestreando en otras épocas, utilizar otras metodologías de muestreo (e.g., trampas elevadas, trampas de interceptación de vuelo, trampas de luz) y otros cebos (e.g., diplópodos, hongos, fruta, excremento de animales nativos) con el fin de buscar especies aun no registradas, y así poder completar el inventario de la diversidad regional que permita realizar monitoreos más precisos a mediano y largo plazo y entender la dinámica de estos ensamblajes.
Diversidad, estructura del ensamblaje y gremios
Las especies encontradas corresponden al 44 % de las registradas por Noriega et al. (2013) para Bolívar, y al 15 % de las registradas por los mismos autores para el Caribe. El número de especies estuvo dentro del intervalo propuesto por Escobar (1998), quien indica que hay entre catorce y 21 especies por localidad en la llanura del Caribe. Adicionalmente, en varias localidades del Cinturón Árido Pericaribeño con presencia de bosque seco tropical (bs-T) se han capturado entre quince y 30 especies (IAVH 1997, 1998, Barraza et al. 2010, Martínez et al. 2010, Navarro et al. 2011, Solís et al. 2011, Rangel-Acosta et al. 2012, Noriega et al. 2016, Rangel-Acosta et al. 2016a, b, Rangel-Acosta y Martínez-Hernández 2017). Pese a que no se encontraron tantas especies como en otras localidades de la región, el fragmento de bs-T del jardín botánico mantiene una diversidad importante de escarabajos coprófagos, lo cual puede ser un potencial indicador de su buen estado de conservación. Canthon fue el género más diverso y abundante, este género se reporta como el más abundante en el bosque seco, lo cual puede estar relacionado a su asociación con el excremento de monos aulladores (Alouatta spp.) (Medina y González 2014). La alta riqueza de este género en los bs-T del Caribe puede atribuirse a que la región norte de Sudamérica fue su centro de origen (Rivera-Cervantes y Halffter 1999, Padilla-Gil y Halffter 2007). Esto concuerda con varios estudios en la región Caribe, donde se reportan entre cinco y diez especies del género Canthon en diferentes localidades (Navarro et al. 2011, Solís et al. 2011, Rangel-Acosta et al. 2012, 2016a, b). Adicionalmente, Noriega et al. (2016) proponen que el género Canthon puede tener una condición generalista al presentarse tanto en lluvias como en sequía, concordando con los resultados encontrados.
Los pequeños telecópridos y paracópridos reportaron la mayor abundancia en todos los muestreos, representando más del 50 % del total. Rangel-Acosta et al. (2016b) y Martínez et al. (2010) encontraron que, independientemente de la época de muestreo, la estación o el hábitat, los pequeños paracópridos fueron dominantes en riqueza y abundancia. Estos autores también registran que los grandes paracópridos aparecen en bajo número de individuos durante la época seca, pero aumentan su abundancia durante la época de lluvias, concordando con los resultados encontrados. En los ecosistemas tropicales, las especies grandes son más abundantes en las épocas de mayor precipitación, debido a que las condiciones son más favorables al presentarse una mayor disponibilidad de recursos (Horgan 2006, Viegas et al. 2014, Iannuzzi et al. 2016), lo cual favorecería su permanencia, al poder consumir una mayor cantidad de alimento (Lobo 1993, Slade et al. 2007).
El grupo de los pequeños telecópridos, conformado en su totalidad por especies del género Canthon, fue el que presentó la mayor riqueza y abundancia, particularmente en enero, mes con la menor precipitación. Es posible que la severidad de la estación seca limite la actividad de estos escarabajos al estar más expuestos y al impedir el enterramiento del excremento debido a la compactación del suelo (Janzen 1983), condición que puede disminuir con las lluvias, facilitando la nidificación. Sin embargo, es probable que el suelo blando y arenoso que se encuentra en buena parte del jardín botánico favorezca su actividad, aumentando la rapidez con la que estas especies entierran el alimento y favoreciendo la construcción de las bolas-nido (Hanski y Cambefort 1991).
Preferencia de hábitat y tróficas
El jardín botánico no solo presenta áreas de bosque seco tropical (bs-T), sino también áreas adyacentes y colecciones de plantas, además está rodeado por áreas de uso ganadero y agrícola, lo cual genera una amplia oferta de hábitats. Rangel-Acosta y Martínez-Hernández (2017) encontraron que C. lituratus, C. septemmaculatus, C. jasius y D. cadmus, son típicas de hábitats adyacentes a fragmentos de bs-T. Navarro et al. (2011) reportan a D. cadmus en zonas de uso ganadero cercanas a bs-T. Mientras que Feer y Pincebourde (2005) encontraron que C. jassius es una especie típica de bosque. En localidades del Cinturón Árido Pericaribeño, el género Canthidium se ha reportado asociado a bs-T en bordes de bosques con una abundancia media-alta (Solís et al. 2011, Noriega et al. 2016, Rangel-Acosta et al. 2016a, b, Rangel-Acosta y Martínez-Hernández 2017). Igualmente, el uso de diferentes atrayentes permitió la captura de especies con preferencias coprófagas y necrófagas, recurso frecuentemente utilizado y con una alta capacidad de atracción como se reporta en otros trabajos (Ibarra-Polesel et al. 2015). En el área de estudio, C. cyanellus presentó claras preferencias por la carroña mientras que C. jassius se capturó exclusivamente con trampas cebadas con carne en descomposición, mientras que las demás especies pueden considerarse como coprófagos generalistas, puesto que su abundancia en las trampas con carroña fue muy baja. Mora-Aguilar y Montes de Oca (2009) consideran a C. cyanellus como necrófaga especialista, lo cual coincide con los resultados encontrados. Igualmente, las especies del género Coprophanaeus encontradas por Figueroa y Alvarado (2011) presentan preferencias necrófagas coincidiendo con nuestros resultados.
En este sentido, la baja abundancia de C. aurifex puede deberse a que Canthidium es un género que puede mostrar un comportamiento saprófago secundario, y puede alimentarse de frutos u otras partes de plantas en fermentación (Halffter y Matthews 1966) recursos no incluidos en el muestreo.
Estacionalidad del ensamblaje de escarabajos coprófagos
En diferentes localidades del Cinturón Árido Pericaribeño y del Neotrópico se ha obtenido una mayor riqueza y abundancia en muestreos realizados en época de lluvias que en época seca (Andresen 2005, Andrade et al. 2011, Liberal et al. 2011, Navarro et al. 2011, Medina y Lopes 2014, Iannuzzi et al. 2016, Noriega et al. 2016, Rangel-Acosta et al. 2016a, b), en oposición a nuestros resultados ya que la mayor abundancia se obtuvo cuando se registró una menor incidencia de lluvias y la menor abundancia se registró cuando la precipitación aumentaba. Este mismo resultado fue registrado por Ibarra-Polesel et al. (2015) quienes creen que es la temperatura y no la pluviosidad la variable que más influye en la estructura de los ensamblajes. Estas diferencias pueden también atribuirse a que las fuertes precipitaciones ocasionan la pérdida y disolución del recurso (Howden y Young 1981). No obstante, algunos estudios proponen que el cambio de la abundancia y estructura de la comunidad de escarabajos coprófagos en bosques secos están ligados a la precipitación (Andresen 2005, Navarro et al. 2011). Igualmente, esta variación estacional puede estar relacionada con una asincronía que permite la coexistencia de las especies al disminuir la competencia (Hanski y Cambefort 1991). A pesar de todo lo anterior, al tener una única repetición por estación es muy difícil aseverar que los resultados encontrados obedecen exclusivamente a un patrón estacional y no son variaciones asociadas a la dinámica poblacional.
Teniendo en cuenta todo lo anterior, podemos concluir que los escarabajos coprófagos del jardín botánico presentan un potencial patrón estacional viéndose la abundancia afectada por la precipitación, ya que la riqueza, diversidad y similitud cambiaron poco. En términos generales la estacionalidad de los insectos es usualmente afectada por disponibilidad de recurso, temperatura y precipitación (Wolda 1988). Durante la estación seca las condiciones son extremas, pues la combinación de altas temperaturas y poca humedad pueden limitar la actividad de las poblaciones (Batista et al. 2016), sin embargo, en nuestro caso la mayor abundancia se presentó en este periodo, aunque solo tenemos un solo evento de muestreo en la época seca. Finalmente, es importante proponer estrategias de conservación de los pequeños fragmentos de bosque seco tropical (bs-T) que se encuentran en zonas semi-rurales, como es el caso del jardín botánico, ya que no solo son capaces de albergar una alta diversidad de especies, sino probablemente sean los últimos relictos de la diversidad regional del bs-T, uno de los ecosistemas más drásticamente alterados en las últimas décadas.