Introducción
Desde el primer reporte de su síntesis presentado por Heinrich Limpricht (Limpricht, 1870), el furano ha sido un importante punto de partida para la síntesis de una gran cantidad de derivados industriales (Hoydonckx, et al., 2007; Fauque, 1954) y moléculas de interés en química orgánica (Katritzky, et al., 2010).
Los derivados de furano se conocen ampliamente como bloques de construcción para la preparación de polímeros (Gaitonde, et al., 2014; Gandini & Belgacem, 1997; Moore, et al., 1978; Moore & Kelly, 1978; Moore & Kelly, 1979; Moore & Kelly, 1984, Zeng, et al., 2013) y su impacto en el desarrollo tecnológico agrícola y farmacéutico, así como en procesos sintéticos, se reconoce desde hace décadas (Peters, 1939).
Dada su gran importancia sintética y aplicativa, se emprendió la síntesis de un derivado de furano, específicamente el 2,2-bis[5'-(2'-carbonilfuranil)]propano (BCFP), utilizando la reacción de Vilsmeier-Haack. Este compuesto se presenta como un prototipo de molécula que podría emplearse como monómero en reacciones de polimerización y, gracias a su simetría, también como bloque de construcción en las estructuras metal-orgánicas (metal-organic frameworks, MOFs).
En el presente estudio se reporta la síntesis y caracterización del compuesto BCFP, cuyas propiedades electrónicas se estudiaron por espectroscopia UV-Vis, en tanto que las electroquímicas se analizaron por voltamperometría cíclica. Los resultados obtenidos se contrastaron con cálculos teóricos hechos con el programa Gaussian 16 usando el funcional B3LYP y una base 6-31+G (d,p). El objetivo fue resaltar la importancia de este compuesto como punto de partida en química supramolecular y explorar por primera vez las propiedades electrónicas y electroquímicas que permitan potenciar su utilidad.
Materiales y métodos
El seguimiento de las reacciones y la verificación de la pureza de los productos se hizo por cromatografía de capa delgada (CCD) empleando placas de gel de sílice 60F 254 con un espesor de 0,2 mm (Merck); como revelador se utilizó una lámpara Spectroline serie E con dos longitudes de onda, 254 y 363 nm. Los reactivos y solventes se adquirieron de las casas comerciales Sigma-Aldrich® y Merck® y se utilizaron sin purificación adicional. Los solventes eran de grado analítico y algunos se secaron según los protocolos establecidos.
Los puntos de fusión se determinaron con un fusiómetro Stuart SMP3 o Barnstead Electrothermal modelo IA9300. Los espectros de infrarrojo (IR) se tomaron en un equipo FT-IR 8400 equipado con accesorio de ATR con punta de diamante. En un espectrómetro Bruker UltrashieldTM de 400 MHz, operado a 400 MHz para 1H y 100 MHz para 13C, se capturaron los espectros de RMN utilizando como solvente CDCl3-d. Además, se hicieron los experimentos bidimensionales HSQC, DEPT-135, HMBC, COSY y NOESY para verificar la naturaleza del producto.
La composición porcentual de los elementos de carbono e hidrógeno se determinó en un analizador elemental Thermo Flash EA 1112 Series y las mediciones de absorbancia se hicieron con un espectrofotómetro Pharma Spec Shimadzu JASCO V-730 UV-VIS. Los cálculos computacionales se hicieron con el programa Gaussian 16 usando el funcional B3LYP y una base 6-31+G (d,p). Las imágenes de orbitales moleculares de frontera se obtuvieron con la aplicación Gauss View 6.
Las pruebas de electroquímica se realizaron en un galvanostato potenciostato Metrohm Autolab PGSTAT302N utilizando como electrodo de trabajo carbón vítreo de 3 mm de diámetro, un alambre de platino como electrodo de conteo y un alambre de plata como electrodo de pseudorreferencia. Se agregó ferroceno sublimado como estándar interno para reportar los picos redox. Antes de iniciar las mediciones se dejó pasar un flujo de nitrógeno o argón (a través de la solución) para eliminar el oxígeno del medio. El comportamiento electroquímico se analizó mediante voltamperometría cíclica y de onda cuadrada (OSWV) empleando DMF previamente secada y hexafluorofosfato de tetrabutilamonio (n-Bu)4NPF6 como electrólito de soporte (0,1 M). Cada experimento se realizó a diferentes velocidades de barrido a partir de los 50 mV/s y hasta los 500 mV/s.
2,2-bis[5'-(2'-carbonilfuranil)]propano (BCFP)
Para la síntesis de este compuesto se siguió el protocolo reportado en la literatura (Chen & Wu, 2002). Se adicionó POCl3 (1,2 equivalentes) gota a gota a una solución que contenía un equivalente de 2,2-di(2-furil)propano (TCI Chemicals) en 5 mL de DMF bajo atmósfera de nitrógeno en constante agitación y sobre un baño de hielo. Después de mezclados, se agitó la solución por 5 horas en un baño de agua a 50 °C hasta que la solución se tornó color vino tinto, punto en el cual se dejó enfriar a temperatura ambiente. Posteriormente, se adicionaron gota a gota 10 mL de DMF y un (1) equivalente de POCl3 a la solución en un baño de hielo. La reacción continuó durante 10 horas en un baño de agua a 50 °C que luego se enfrió a temperatura ambiente y finalmente se vertió en agua-hielo. La mezcla resultante se neutralizó con hidróxido de sodio (NaOH) al 10 % y se dejó en reposo. Transcurridas 12 horas, se observó un sólido amarillo pálido que fue filtrado y recristalizado dos veces en etanol, resultando en un sólido blanco con un rendimiento del 55 %. RMN 1H (CDCl3, 400 MHz) δ (ppm): 9.63 (s, 2H, CHO), 7.22 (d, J=3.1 Hz, 2H, ArH), 6.37 (d, J=3.2 Hz, 2H, Ar), 1.79 (s, 6H, CH3). RMN 13C (CDCl3, 100 MHz) δ (ppm): 26, 38, 108, 123, 152, 164, 178. IR (KBr) v(cm-1): 1684, 1669 (C=O), 1374, 1361 (C-H), 1241, 968 (C-O-C). MS (EI) m/z 232, 217 (M-15). Punto de fusión: 91-93°C. Análisis elemental calculado para C13H12O4: C 67,23 %, H 5,21 %, O 27,56 %. Experimental C 67,22 %, H 5,21 %, O 27,57 %.
Resultados y discusión
La reacción de Vilsmeier-Haack es una reacción de una amida sustituida con tricloruro de fosforilo y un areno activado. La reacción fue publicada por primera vez en 1927 por Anton Vilsmeier y Albrecht Haack (Vilsmeier & Haack, 1927) y desde entonces se ha utilizado ampliamente en la síntesis de aldehídos.
El BCFP se preparó a partir del compuesto comercial 2,2-di(2-furil)propano, el cual actúa como arilo activado (Figura 1). En el presente caso, la DMF fue una amina sustituida que reaccionó con el tricloruro de fosforilo para formar el ion cloroiminio (reactivo de Vilsmeier), el cual reaccionó a su vez con el 2,2- di(2-furil)propano (arilo activado) a través de una reacción de sustitución aromática electrofílica generando un ion iminio intermedio que luego se hidrolizó para obtener el compuesto objetivo. La reacción requirió ajustar el pH con NaOH (al 10 %) dado el aumento de acidez ocasionado por la presencia del subproducto protonado de la dimetilamina. Para garantizar que ambos anillos fueran formilados fue necesario prolongar la reacción y realizar dos adiciones de DMF y cloruro de fosforilo. El rendimiento de la reacción resultó aceptable (55 %), aunque ligeramente menor al reportado previamente (Chen & Wu, 2002). Cabe destacar que, a pesar de que la reacción de Vilsmeier-Haack es ampliamente conocida, en el caso de la síntesis del BCFP se requirieron múltiples ensayos debido al poco rendimiento producto de la no formilación paralela de los anillos. Al final del protocolo empleado se introdujo una modificación al reportado en la literatura (Chen & Wu, 2002), con la cual se obtuvo el mejor rendimiento.
Los espectros de RMN (1H y 13C) (Figura 2) mostraron las señales esperadas para el compuesto. Debido a su simetría, se observaron cuatro señales en el RMN protónico: la primera, un singulete que integra para dos protones, se localizó en las 9,63 ppm, lo que es típico de los aldehídos. La segunda señal, un doblete que apareció en las 7,22 ppm, integra para dos protones con una constante de acoplamiento J de 3.1 Hz y correspondió al protón 4 del anillo furano (marcado con un punto verde). Una tercera señal se observó en 6,37 ppm, que integra para dos protones con una constante de acoplamiento J de 3.2 Hz, y correspondió al protón 3 del anillo furano (señalado en rojo en la figura). Por último, en el campo de arriba se observó un singulete que integra para seis protones, el cual se asignó a los protones metílicos. Asimismo, el RMN 13C (Figura 2) evidenció las 7 señales esperadas del compuesto BCFP. La asignación de dichas señales, así como las de RMN 1H, se basaron en los resultados bidimensionales (COSY, HMBC, DEPT 135) de la RMN.
El espectro UV-Vis se tomó en cloroformo (Figura 3). Se observó una absorción principal en los 293 nm, con un hombro en los 276 nm. Dichas absorciones se desplazaron hipsocrómicamente al aumentar la polaridad del solvente (metanol), efecto debido al incremento en la solvatación del par electrónico libre de los oxígenos de las unidades furano (el otro par hace parte de la resonancia del anillo), lo cual tiene como consecuencia la disminución de la energía del orbital n. La transición de un electrón al orbital π* produjo un estado excitado, cuyo nivel de energía no se vio afectado por el enlace de hidrógeno entre el metanol o los oxígenos. De esta forma, la energía asociada a la transición n→π* se incrementó (reducción en la energía del orbital n). Por su parte, el hombro observado a 276 nm se asoció con la absorción de los grupos formilo laterales y exhibió el mismo fenómeno.

Figura 3 Espectro de absorción UV-Vis del compuesto BCFP en cloroformo y gradientes del solvente cloroformo-metanol
Se optimizó, asimismo, la geometría de la molécula BCFP utilizando el programa Gaussian 16 (Frisch, et al., 2016) con el funcional B3LYP y la base 6-31+G (d,p). Como estructura de entrada se utilizaron los datos cristalográficos reportados por Gaitonde, et al. (2014) para una molécula similar. Los cálculos sirvieron para estimar las energías de los orbitales moleculares de frontera HOMO y LUMO (Figura 4), con el fin de correlacionar sus superficies con los resultados obtenidos por medidas electroquímicas y de UV-Vis.

Figura 4 Representación tridimensional del HOMO (arriba) y LUMO (abajo) calculados para la molécula BCFP. Paquete gráfico: Gaussian View. Cálculos llevados a cabo con Gaussian 16 usando el funcional B3LYP y la base 6-31+G (d,p)
La unidad básica del compuesto BCFP es el furfural, el cual tiene múltiples aplicaciones a nivel industrial y de química fina (Eseyinc & Steele, 2015). Sus propiedades electroquímicas ya se conocen y muchas de sus aplicaciones se centran en la oxidación a ácido furoico u otros ácidos derivados. Asimismo, la reducción del furfural permite la obtención del alcohol furfuril (Mariscal, et al., 2016; da Silva, et al., 2017). En este sentido, se esperaba un comportamiento similar en el compuesto analizado en el presente estudio, con orbitales moleculares de frontera de una densidad electrónica localizada principalmente sobre los anillos de furano y los aldehídos. Los grupos metílicos actuaron como donantes de densidad electrónica, de ahí su baja contribución al orbital LUMO. Los anillos furano en el compuesto BCFP poseen seis electrones n deslocalizados entre los cinco átomos que conforman el anillo, siendo un compuesto aromático n excedente, por lo que se esperaba que el comportamiento electroquímico del compuesto estuviera gobernado por estas características electrónicas. Tal comportamiento también se observó en la UV-Vis, en la que la principal transición electrónica se debe al anillo furano con un hombro producto de transiciones en los grupos carbonilo de los aldehídos. La voltamperometría cíclica ha sido una técnica electroquímica ampliamente utilizada para entender los mecanismos y propiedades oxidativas o reductivas frente a procesos de transferencia de carga tanto en compuestos orgánicos como inorgánicos. Los procesos catódicos y anódicos del compuesto BCFP se muestran en las Figuras 5-7.

Figura 5 Voltamperograma cíclico del compuesto BCFP. Solución de 0,1 M de (n-Bu)4NPF6 en DMF. Se usaron carbón vítreo como electrodo de trabajo, alambre de plata como pseudo-referencia y alambre de platino como electrodo de conteo. Velocidad de escaneo: 100 mV/s
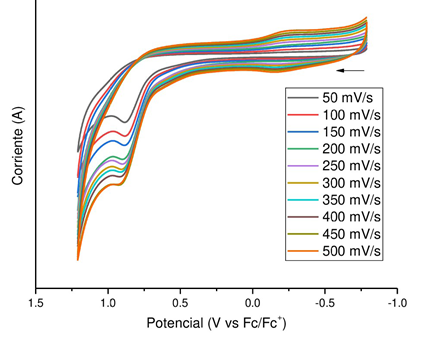
Figura 6 Voltamperograma cíclico (escaneo anódico a diferentes velocidades) del compuesto BCFP. Solución de 0,1 M de (n-Bu)4NPF6 en DMF. Se emplearon carbón vítreo como electrodo de trabajo, alambre de plata como pseudo-referencia y alambre de platino como electrodo de conteo

Figura 7 Voltamperograma cíclico (escaneo catódico a diferentes velocidades) del compuesto BCFP. Solución de 0,1 M de (n-Bu)4NPF6 en DMF. Se emplearon carbón vítreo como electrodo de trabajo, alambre de plata como pseudo-referencia y alambre de platino como electrodo de conteo
El compuesto BCFP exhibió un potencial de oxidación a 0,87 V, irreversible desde el punto de vista electroquímico, ya que no se observó una onda de reducción al escanear en la dirección catódica (Figura 5), lo que es indicativo de que el compuesto sufre un proceso químico que degrada o convierte la molécula en otra especie no activa dentro de la ventana de potencial de trabajo.
Cuando se aumentó la velocidad de escaneo de 50 mV/s a 500 mV/s, se observó un aumento en la intensidad de corriente para el proceso de oxidación (Figura 6) debido a que el aumento de la velocidad de escaneo disminuye el grosor de la capa de difusión en la interfase electrodo-solución. También se observó un evento reductivo, de baja intensidad, alrededor de los -0,15 V, más notorio al aumentar la velocidad de escaneo, lo cual es indicativo de que el comportamiento electroquímico de este compuesto en potenciales anódicos es una combinación de una transferencia electrónica lenta y una reacción química rápida. Por último, el análisis de la ecuación de Randles-Sevcik evidenció que la intensidad de corriente (ip) no comportaba una dependencia lineal con la raíz cuadrada de la velocidad de escaneo (v1/2) y tampoco se encontró relación lineal entre ip y v, por lo cual se presumió que el proceso de transferencia electrónica ocurrió a través de especies adsorbidas a la superficie del electrodo.
En el caso del escaneo en potenciales catódicos, el compuesto BCFP exhibió una reducción electroquímica y químicamente irreversible. El aumento en la velocidad de escaneo no reflejó una reversibilidad, por lo menos apreciable, en el rango de las velocidades de escaneo utilizadas (Figura 7), y en la oxidación tampoco se observó una dependencia lineal de la corriente de pico con la velocidad de escaneo o su raíz cuadrada ni la presencia de pre-picos que pudieran sugerir procesos de adsorción evidentes.
Al analizar la información electroquímica del compuesto BCFP, se observó que la intensidad de la onda de reducción fue mucho mayor que la del pico de oxidación, lo que lleva a pensar que el número de electrones involucrados en cada proceso es diferente y que, al comparar la intensidad de los picos y sus áreas, podrían representarse como dos procesos redox con diferente número de electrones involucrados: el primero, una oxidación en la que se abstrae un electrón para generar un catión radical, y la segunda, una reducción que involucra la transferencia de dos electrones (Figura 1S,https://www.raccefyn.co/index.php/raccefyn/article/view/1401/3133). En ambos casos las especies resultantes reaccionaron químicamente de manera rápida y de ahí la irreversibilidad observada.
Gracias a la correlación entre los cálculos DFT y los voltamperogramas, en los que se observó en el LUMO una mayor localización en los carbonilos, en tanto que en los HOMO la localización estuvo sobre los anillos (Figura 4), se propone que la reducción ocurre sobre los aldehídos, lo que posiblemente conlleva a que estos pasen a formar alcoholes si hay trazas de agua o acidez en el medio. En el caso de la oxidación, esta se llevaría a cabo principalmente sobre el anillo furano, generando un radical catión con subproductos no activos electroquímicamente en la ventana de potencial en que se trabajó.
Los resultados obtenidos muestran que la molécula BCFP es termodinámicamente estable (ΔE = 2,23 V), con transiciones electrónicas principalmente en la región ultravioleta y una química regida por los grupos aldehído y la n-excedencia de los anillos aromáticos. Estas características lo sitúan como un buen candidato a bloque de construcción de arquitecturas supramoleculares. Por ejemplo, la reacción del BCFP con dos equivalentes de la 2-hidracinopiridina resultaría en un ligando ditópico tridentado, asemejando en cada extremo el bolsillo de una terpiridina. Este tipo de ligandos pueden aprovecharse para formar rejillas moleculares al coordinar iones metálicos (de coordinación octaédrica o tetraédrica).
Conclusiones
Se preparó un compuesto dialdehído simétrico (BCFP) basado en dos anillos de furano interconectados por un grupo metileno. La metodología de síntesis se basó en la reacción de Vilsmeier-Haack. El compuesto se caracterizó mediante resonancia magnética nuclear (1H y 13C), FT-IR, espectrometría de masas, análisis elemental, espectroscopía UV-Vis, voltamperometría cíclica y cálculos computacionales a nivel de DFT. Los procesos electro-químicos que sufrió el compuesto fueron irreversibles al igual que las reacciones químicas que siguieron. Los datos de corriente de pico versus velocidad de escaneo sugieren que los procesos de transferencia de carga son mediados a través de especies adsorbidas.