Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Cardiología
Print version ISSN 0120-5633
Rev. Colomb. Cardiol. vol.23 no.4 Bogota July/Aug. 2016
https://doi.org/10.1016/j.rccar.2015.11.003
http://dx.doi.org/10.1016/j.rccar.2015.11.003
Fractura de los stents: una etiología diferente
Stent fractures: a different aetiology
Jerson Quitián Moreno a,b, Carlos Andrés Carvajal Tascón a,c, Jorge Dib Mor Dale a
a Fundación Santa Fe de Bogotá, Bogotá, Colombia
b Universidad El Bosque, Bogotá, Colombia
c Universidad de Los Andes, Bogotá, Colombia
Correo electrónico:jersonquitian@yahoo.com(Jerson Quitián Moreno)
Recibido el 3 de agosto de 2015; Aceptado el 2 de noviembre de 2015
Resumen
La fractura del stent es una complicación potencial de estos dispositivos. Su incidencia varía notablemente en los informes publicados (< 1% a 16%), pero la cifra exacta es desconocida debido a la dificultad en el diagnóstico y la falta de definiciones estandarizadas. Se describe un caso donde el mecanismo probable por el cual se genera la fractura se debe a la presencia de un gran quiste pericárdico.
Palabras clave: Stents liberadores de fármacos. Restenosis. Pericardio.
Abstract
A stent fracture (SF) is a potential complication of these devices. Their incidence varies considerably in published reports (<1% to 16%), but the exact figure remains unknown due to the difficulty of diagnosis and the lack of standardised definitions. A case is presented where the probable mechanism that originated the fracture was the presence of a large pericardial cyst.Keywords: Drug-eluting stent. Restenosis. Pericardium.
Introducción
La fractura de stent (FS) es una complicación potencial de estos dispositivos. Su incidencia varía notablemente en los informes publicados, encontrándose entre < 1 a 16%1,2.
Poco se sabe acerca de la incidencia exacta de la FS, debido a la dificultad en el diagnóstico y a la falta de definiciones estandarizadas. En la actualidad son una preocupación más que se suma a la restenosis y a la trombosis del stent3.
La primera descripción de este fenómeno se realizó en un stent implantado en un puente venoso en el año 2002. Poco después se publicaron 9 casos de fractura de los stents convencionales. El primer caso con un stent medicado apareció hasta el año 2004. Desde entonces, otros se han reportado pero la información obtenida de estas publicaciones es limitada.
Se ha descrito que la fractura es más común en los stents liberadores de sirolimus. Los factores facilitadores independientes del tipo del stent son la presencia de más puntos de flexión durante el ciclo cardiaco que generan: compresión, torsión, acodamiento y elongación, que al final pueden causar la fractura.
Los sitios de ruptura, en general, están situados en puntos sometidos a fuerzas de cizallamiento creadas por la propia anatomía de los vasos y la distorsión de la estructura del stent durante el implante que ocasiona una mala distribución de la fuerza durante la contracción cardiaca4.
El presente trabajo describe un caso de la fractura de un stent, asociado a la presencia de una masa mediastinal la cual es considerada como parte activa en el daño del dispositivo con fractura y restenosis del mismo.
Caso clínico
Se trata de un hombre de 76 años de edad, quien consulta por un cuadro de disnea en ejercicio acompañado ocasionalmente de opresión precordial sin otros síntomas asociados. Tiene antecedentes de enfermedad coronaria la cual fue intervenida quirúrgicamente 16 años atrás con: mamaria interna izquierda a descendente anterior y puente safeno a coronaria derecha; doce años después, por cuadro anginoso, se le implanta un stent medicado (Cypher 3.5 × 33 mm) en descendente anterior proximal y un stent convencional (Liberté 3.0 × 16 mm) en tercio medio. Un mes posterior a este implante por angina recurrente y restenosis del stent convencional en tercio medio de descendente anterior se le realiza implante de un stent medicado (Cypher 2.75 × 23 mm) intra-stent.
Otro antecedente importante para el caso es la presencia de una masa mediastinal diagnosticada 6 años antes. Una resonancia magnética la mostró como un quiste pericárdico en la región basal anterior del hemitórax izquierdo con un tamaño de 15 cm. que ocasionaba importante rechazo medial del ventrículo izquierdo con amplio contacto con el diafragma y la pleura costal. Un control con una resonancia un año después no mostró cambios.
El examen clínico era normal. Los hallazgos en perfusión miocárdica mostraron una isquemia del 18% en pared anterior con fracción de eyección del 42%.
En el cateterismo cardiaco se encontró: la arteria coronaria derecha ocluida con puente safeno permeable, la arteria circunfleja sin enfermedad significativa y la descendente anterior con un stent en tercio proximal permeable y los stents en tercio medio con restenosis difusa severa, mostrando dos fragmentos separados el primero de 5 mm y el segundo de 15 mm con un separación de 3 mm, característicamente el fragmento distal no sigue el movimiento cardiaco mientras que el proximal si lo hace siendo el punto de quiebre marcado por la fractura del stent.
Se le realizó una tomografía axial computarizada de tórax, la cual muestra una masa retrocardiaca que rechaza el corazón adelante y arriba comprimiendo el stent contra la reja costal lo cual inmoviliza el tercio distal del stent generando el estrés mecánico sobre el dispositivo que lleva a su fractura (figs. 1 y 2).
Discusión
La Intervención Coronaria Percutánea (ICP), en sus inicios, se limitaba a la dilatación con balón de las lesiones obstructivas significativas, en esta época la restenosis alcanzaba el 35 a 40% de los casos y la necesidad de cirugía urgente era alta. La utilización de los Stents Coronarios Convencionales o no Liberadores (BMS), mejoró el resultado angiográfico del procedimiento debido al control del retroceso elástico, redujo de manera significativa la presencia de complicaciones inmediatas como el cierre abrupto del vaso, disminuyó la necesidad de la cirugía de urgencia y bajó la tasa de restenosis a 20–25%. No obstante, las ratas de restenosis intra-stent alcanzaban aún un 20 a 30%. Los Stents Liberadores de Medicamentos (DES), mostraron ser superiores en la prevención de la restenosis intra-stent llegando al 8.6%5,6. Se calcula que se implantan alrededor de 2.5 millones de stents medicados al año en el mundo, siendo usados aproximadamente en el 70% o más de los casos.
Los principales problemas del uso de estos dispositivos son la presencia de: la trombosis tardía y la restenosis, que aun ronda aunque en menos del 5% de los casos7. La fractura de los stents principalmente, de los DES ha surgido como un factor predisponente para estas dos entidades y de aquí está ganando interés su diagnóstico8.
La fractura del stent se define como la presencia de una conexión interrumpida de celdas o de la estructura completa del stent vista por angiografía coronaria o ultrasonido intravascular que no estaba presente durante el caso índice. Adicionalmente, se describen tres patrones de fractura: la disrupción, la avulsión y el desplazamiento, dependiendo del sitio de interrupción y la presencia o ausencia de desplazamiento9.
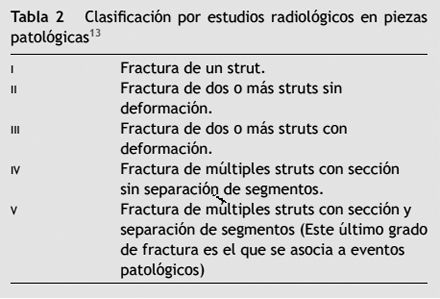
No existe aún un sistema unificado de clasificación. Se propone de la siguiente manera según la referencia de algunos autores, ver tablas 1 y 2.
Tabla 1 Fractura de stents. Clasificación
Las fracturas de los stents se han reportado con mayor frecuencia de manera tardía en los siguientes meses a la implantación aunque también se encuentran casos de fracturas tempranas, el mecanismo de estas últimas está posiblemente ligado al estrés del stent cuando se dilatan lesiones complejas9.
La importancia de la fractura del stent radica en que se asocia a la restenosis y a la necesidad de revascularización del vaso tratado10. En los seguimientos angiográficos a 9 meses de implante de DES se ha encontrado: el 33% de restenosis, el 28% de revascularización del vaso tratado en los pacientes con fractura del stent. En pacientes con seguimiento guiado por las historias clínicas, se encontró: restenosis en el 47.4%, oclusión total en el 7.9% y formación de aneurisma en el 13.2%, se requirió revascularización del vaso tratado en el 52.6%11.
El primer reporte de la fractura del stent coronario data del año 2002 en un paciente con un stent en el tercio medio de un puente safeno9, a partir de allí se han descrito múltiples casos de este fenómeno principalmente asociado a los stents medicados12, siendo más comunes con los liberadores de sirolimus de primera generación (Cypher, como en nuestro caso), posteriormente, se describieron algunos que incluyeron stents de nuevas generaciones.
La incidencia de la fractura en diversos estudios varía ampliamente entre 0.84 y 16%13. Debido a que el diagnóstico se realiza por: angiografía o Ultrasonido Intravascular (IVUS) y dadas sus limitaciones la verdadera incidencia aún es desconocida. En estudios anatomopatológicos se ha encontrado una incidencia del 29% en los stents medicados mucho mayores que los informados clínicamente14. La mayoría de las fracturas de los stent detectadas en este estudio no se asociaron a falla del dispositivo excepto las más severas (grado V) en la que se encontró la trombosis o la restenosis en un 71%.
La fractura del stent convencional tiene una incidencia menor11, usualmente asociados al implante en las arterias periféricas, las lesiones complejas en las arterias coronarias como: bifurcaciones o puentes coronarios. También, puede haber un subdiagnóstico debido a la presencia de una capa más gruesa de tejido hiperplásico.
Factores predisponentes
Más de una factor puede presentarse en un caso determinado, pero generalmente, todos llevan a los dispositivos a estar sometidos a fuerzas deformadoras repetitivas como: compresión, torsión, flexión y elongación que desencadenan fatiga del material y ruptura. De igual manera, los diferentes diseños y materiales de los stents tienen mayor o menor susceptibilidad a la fractura, por ejemplo: los stents fabricados en aleaciones metálicas (cromo-cobalto, platino-cobalto) son menos proclives a la fatiga y fractura que el acero inoxidable15.
Arteria coronaria derecha. La fractura es mucho más frecuente en este vaso en el que se han descrito hasta el 56.4% de los casos, explicado por su tortuosidad y amplio movimiento durante el ciclo cardiaco. Los vasos menos comprometidos son: el tronco principal, el descendente anterior y la circunfleja.
Puentes safenos. En los puentes venosos el estrés mecánico puede ser muy alto debido a la curvatura del injerto, el espacio intratorácico y la fibrosis que rodea al puente.
Vasos tortuosos. La distorsión por tortuosidad de un segmento del stent durante su implante puede crear un desbalance en la distribución del estrés durante la contracción cardiaca, también puede haber una disminución en la capacidad del stent de rotar sobre su eje llevando a alargamiento del vaso predisponiéndolo a la fractura. El cambio de angulación del vaso, impuesto por el stent, puede llevar a estrés a la estructura del stent.
Sobre expansión. Crea un aumento de la tensión en el stent que produce mayor tendencia a la fractura12.
Lesiones largas. La mayoría de las fracturas se presentan en la porción media del stent excepto en los stents más largos de 25 mm en donde se encuentran hacia el borde proximal.
Stents superpuestos. En los casos de los stents en tándem la mayoría de las fracturas fueron observadas entre los 5 mm de la zona sobrelapada tanto en el stent proximal como en el distal.
Stents medicados. Los stents que con más frecuencia se asocian a la fractura son los liberadores de sirolimus; en un metaanálisis de ocho estudios con 5.321 pacientes y 108 fracturas del stent, la incidencia de la fractura del stent fue de 4%, y todos menos uno eran de primera generación liberador de sirolimus (Cypher)10,15. Se cree que esta tendencia se debe al diseño del stent en celda cerrada que lleva al dispositivo a ser más rígido y a estirar más el vaso tratado13. Otras posibilidades técnicas que harían a estos stents más susceptibles a la ruptura son las técnicas usadas para preparar la superficie para recibir el polímero y la corrosión generada por este y el medicamento. Aunque los stents con nuevas aleaciones como el cromo-cobalto y el platino-cobalto, son menos susceptibles a la corrosión14, también, se han descrito casos de fracturas.
Diagnóstico
La cineangiografía con o sin medio de contraste sigue siendo el método diagnóstico más utilizado. El IVUS detecta una mayor cantidad de casos pero no se utiliza de rutina, se deja, en la práctica para confirmar casos dudosos en las imágenes radiográficas9.
Se han desarrollado nuevos métodos de substracción digital para realzar la imagen del stent en el momento de la implantación, en estos métodos se introduce un balón con marcadores con el fin de que sirvan para alinear y apilar varias imágenes mejorando la resolución. La tomografía multidetectores ha alcanzado un buen nivel de precisión para detectar la separación y en muchos casos la restenosis asociada13; La Tomografía por Coherencia Óptica (OCT), tiene una alta resolución y se ha descrito como un método para confirmar el diagnóstico o detectar casos nuevos.
Manejo
El manejo óptimo de los pacientes con la fractura de strut incidental o aislado es desconocido, pudiéndose considerar la observación clínica con la prolongación de la terapia dual más allá del año y considerar una terapia de revascularización, percutánea o quirúrgica, dependiendo de los síntomas y extensión de la isquemia9. Se ha descrito el uso del stent intra-stent aun en ausencia de la restenosis. En el futuro, si los stent reabsorbibles se vuelven ampliamente utilizados, es posible que el riesgo de la fractura quede en el pasado15.
Conclusión
El caso reportado aquí muestra que la fractura del stent, en este caso tipo V, lleva al desarrollo de la restenosis que ocasionó la isquemia sintomática.
Consideramos a este como un caso especial por que el paciente fue tratado inicialmente con un stent convencional que sufrió la restenosis (¿mismo mecanismo?) para lo cual recibió un stent medicado intra-stent (Cypher). Se presenta una noxa externa que ocasiona desplazamiento y compresión del stent entre el corazón y la caja torácica que inmoviliza la porción distal del dispositivo dejando libre la porción proximal y el punto de la fractura se encuentra exactamente en la unión de estos segmentos.
En este caso se recomendó la realización de descompresión del quiste pericárdico para posteriormente realizar la revascularización quirúrgica en descendente anterior que el paciente rechazó y continúa al momento en manejo médico.
Responsabilidades éticas
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
1. Kandzari DE, Rao SV, Moses JW. Clinical and angiographic outcomes with sirolimus-eluting stents in total coronary occlusions. The ACROSS/TOSCA-4 (Approaches to Chronic Occlusions With Sirolimus-Eluting Stents/Total Occlusion Study of Coronary Arteries-4) trial JACC: Cardiovascular Interventions. 2009; vol. 2, No. 2, 97-106. [ Links ]
2. Umeda H., Gochi T., Iwase M. Frequency, predictors and outcome of stent fracture after sirolimus-eluting stent implantation. International Journal of Cardiology. 2009;133:321-6. [ Links ]
3. Lee S.E., Jeong M.H., Kim I.S. Clinical outcomes and optimal treatment for stent fracture after drug-eluting stent implantation. Journal of Cardiology. 2009;53:422-8. [ Links ]
4. Sianos G., Hofma S., Ligthart J.M.R., Saia F., Hoye A., Lemos P.A., Serruys P.W. Stent fracture and restenosis in the drug-eluting stent era. Catheter. Cardiovasc Interv. 2004;61:111-6. [ Links ]
5. Moses J.W., Leon M.B., Popma J.J. Sirolimus eluting stents versus standard stents in patients with stenosis in a native coronary artery. N Engl J Med. 2003;349:1315-23. [ Links ]
6. Stone G.W., Ellis S.G., Cox D.A. A polymer-based, paclitaxel-eluting stent in patients with coronary artery disease. N Engl J Med. 2004;350:221-31. [ Links ]
7. Shite J., Matsumoto D., Yokohama M. Sirulimus stent fracture with thrombus, visualization by optical coherence tomgraphy. Eur Heart J. 2006;27:1389. [ Links ]
8. Alexopoulus D., Xanthopoulou I. Coronary stent fracture: how frequent it is? Does it Matter. J Cardiol. 2011;52:1-5. [ Links ]
9. Chakravarty T., White A.J., Buch M. Meta-Analysis of Incidence, Clinical Characteristics and Implications of Stent Fracture. Am J Cardiol. 2010;106:1075-80. [ Links ]
10. Chowdhury P.S., Ramos R.J. Coronary-Stent Fracture. N Engl J Med. 2002;347:581. [ Links ]
11. Ino Y., Toyoda Y., Tanaka A. Predictors and prognosis of stent fracture after sirolimus eluting stent implantation. Circ J. 2009;73:2036-41. [ Links ]
12. Lee M.S., Jurewitz D., Aragon J., Forrester J., Makkar R.R., Kar S. Stent fracture associated with drug-eluting stents: clinical characteristics and implications. Catheter Cardiovasc Interv. 2007;69:387-94. [ Links ]
13. Halkin A., Carlier S., Leon M.B. Late incomplete lesion coverage following Cypher stent deployment for diffuse right coronary artery stenosis. Heart. 2004;90. [ Links ]
14. Nakazawa G., Finn A.V., Virmani R. Incidence and predictors of drug eluting stent fracture in human coronary artery. A pathologic analysis. J Am Coll Cardiol. 2009;54:1924-31. [ Links ]
15. Ormiston J.A., Webber B., Ubod B., White J., Webster M.W. Coronary stent durability and fracture: an independent bench comparison of six contemporary designs using a repetitive bend test. Euro Intervention. 2015;10:1449-55. [ Links ]