INTRODUCCIÓN
Los trasplantes de órganos han venido en aumento en las últimas décadas y son en la mayoría de los casos el único tratamiento ante el estado final y la falla de un órgano. Los trasplantes son generalmente aceptados como el mejor y en ocasiones, el único tratamiento para prolongar y mejorar la calidad de vida 1.
La falla cardiaca es una enfermedad progresiva que afecta a más de cinco millones de personas solamente en los Estados Unidos; algunas estimaciones sugieren que entre un 5 % y 10 % de todos los pacientes con falla cardiaca se encuentran en estadios más severos de la enfermedad, con gran impacto sobre la calidad de vida y alta mortalidad 2. En estas fases avanzadas de la falla cardiaca, el trasplante de corazón es el único medio para proveer un impacto positivo de gran magnitud sobre la calidad de vida y la supervivencia, y se ha observado que las personas con trasplante cardiaco tienen una supervivencia a un año, cerca del 90 % y 50 % sobreviven más de 11 años 3.
El periodo de mayor riesgo tras el trasplante cardiaco es el primer año, con una mortalidad cercana al 20 %. Entre los pacientes que sobreviven al primer año, la supervivencia media es de 14 años 4. Estos pacientes presentan complicaciones entre las cuales se estiman: la falla precoz del injerto (16,5 %), seguida de la infección (15,9 %), la enfermedad vascular del injerto (13,7 %), tumores (11,9 %) el rechazo agudo (7,8 %), algunas asociadas al uso de los tratamientos inmunosupresores 5. Se estima que hasta el 20 % de las complicaciones asociadas a los inmunosupresores corresponden a complicaciones neurológicas 6.
El uso de medicamentos inmunosupresores se asocia a riesgo de infecciones y neoplasias 7. Estas últimas en pacientes trasplantados tienen un curso agresivo con una mortalidad de tres a cinco veces mayor que en la población general 8. Los linfomas primarios del sistema nervioso central (LPSNC) son generalmente linfomas de células B y se presentan con frecuencias del 0,5 % al 1,5 % de todos los linfomas del SNC 9. Este tipo de neoplasias se caracterizan por ser de crecimiento rápido y de alta malignidad, pueden ser diagnosticadas a través de imágenes, análisis del líquido cefalorraquídeo y exámenes anatomopatológicos, y en la mayoría son positivos para CD20 en la inmunohis-toquímica 10.
Se presenta el caso de una paciente a quién se le diagnosticó una masa cerebral, 4 años después de un trasplante cardiaco y se discuten los principales aspectos clínicos y de la patología.
Presentación del caso
Paciente femenina de 36 años, admitida con clínica de 11 días caracterizada por cefalea global tipo punzada, mareo, náuseas, vómito, alteración en la emisión del lenguaje, debilidad en el miembro superior izquierdo, e incapacidad sostenerse en bipedestación.
La paciente recibió un trasplante ortotópico de corazón 4 años antes por insuficiencia cardiaca estadio D, secundaria a miocardiopatía dilatada por Poliomavirus JC. Durante su evolución presentó dos episodios de rechazo e insuficiencia renal estadio V en tratamiento con hemodiálisis. Recibió tratamiento con micofenolato mofetil 360 mg, everolimus 0,5 mg, prednisolona 10 mg, furosemida 40 mg, espirinolactona 25 mg, carvedilol 6,25 mg, enalapril 25 mg, rosuvastatina 20 mg y levotiroxina 50 mg al día.
Al ingreso se valoró una paciente en regulares condiciones generales con presión arterial 90/63 mmHg, frecuencia de 93 latidos por minuto, frecuencia respiratoria 20 por minuto, temperatura de 36,5 °C e índice de masa corporal de 23,23. Se encontraba alerta, orientada en tiempo, lugar y persona, con lenguaje claro, fluente, coherente y juicio de realidad conservado. Fondo de ojo normal, sin papiledema, pupilas isocóricas y reactivas a la luz, movimientos oculares normales. No se encontró compromiso de pares craneales bajos. No había signos meníngeos y los pulsos carotideos eran simétricos y normales. Se encontró paresia del miembro superior izquierdo 4/5 e incoordinación motora del hemicuerpo izquierdo, Hoffman y Babinski bilateral. Los laboratorios del ingreso mostraron anemia con neutrofilia y linfopenia.
La resonancia magnética (RM) mostró una lesión difusa en el cuerpo calloso y región cerebelosa con edema perilesional con colapso incompleto del tercer ventrículo (figura 1). El estudio del LCR mostró abundantes hematíes e hiperproteinorraquia; se realizaron estudios para virus, hongos, todos ellos negativos.
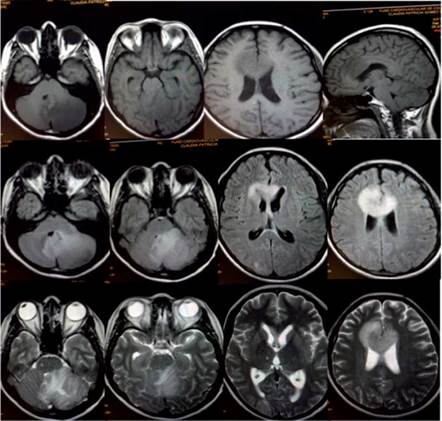
Figura 1 Estudio de resonancia magnética cerebral Las imágenes muestran una lesión focal intra-axial de aspecto edematoso que compromete corteza y región paramediana frontal bilateral que compromete el aspecto anterior del cuerpo calloso, cruza línea media y se asocia a edema perilesional, de 4,8 x 3,9 cm. Se observa extensión al lóbulo cerebeloso y pedúnculo cerebeloso izquierdo y al vermis con desplazamiento anterior de la protuberancia. Adicional a esto se observa hiperintensidad en corteza parieto-occipital izquierdo.
Al día cuarto se inició tratamiento con voriconazol 200 mg intravenoso ante la posibilidad de compromiso infeccioso del sistema nervioso central, trimetroprim/sulfame-toxazol, anfotericina B liposomal, meropenen, y se realizó biopsia cerebral por craneotomía abierta.
El día 6 de la hospitalización, la paciente presentó paro cardiorrespiratorio que requirió maniobras avanzadas de reanimación e ingreso a la unidad de cuidados intensivos bajo soporte ventilatorio.
El reporte anatomopatológico de la biopsia mostró a nivel perivascular presencia de células grandes con marcada atipia celular, reactivo intensamente en la población tumoral compatible con desorden proliferativo tipo linfoma B difuso de célula grande, fenotipo no centro germinal (figura 2a). Se realizaron estudios de inmunohistoquímica, mostrando expresión intensa, el CD10 débil y focal, CD3 con escasa reactividad linfoide acompañante T, MUM-1 fue reactivo intensamente en la población tumoral, el Ki-67 del 80 %, y el CD 30 mostró expresión completa de membrana en ocasionales células atípicas (figura 2b).
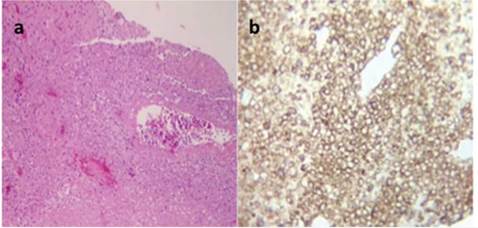
Figura 2 Estudio Anatomo-patológico biopsia lesión cerebral Se observa a nivel perivascular la presencia de células grandes con marcada atipia celular, linfoma B difuso de célula grande, fenotipo no centro germinal (2a). La inmunohistoquímica CD20, BCL2, BCL6, muestra expresión CD10 débil y focal, el CD3 con escasa reactividad linfoide acompañante T, el MUM-1 reactivo intensamente, el Ki-67 fue del 80 %, y el CD 30 mostró expresión completa de la membrana en ocasionales células atípicas (2b).
Los estudios de microbiología realizados en sangre y LCR fueron negativos para bacterias, virus y hongos. El día octavo se suspendió el tratamiento antibiótico y se inició esquema con metotrexate en ampollas de 500 mg en infusión de 24 horas, fonilato de calcio, ampollas de 50 miligramos en infusión cada 6 horas, citarabina ampollas de 500 miligramos en infusión cada 12 horas, y ondasetrón. La paciente falleció 11 días después.
DISCUSIÓN
El trasplante de corazón en pacientes con enfermedad cardiaca terminal ha significado no sólo la prolongación de la vida, sino también el cambio radical en la calidad de vida. Una de las limitantes de los trasplantes corresponde a la donación. A nivel mundial la tasa de trasplante cardiaco para el 2013 fue de 11 trasplantes por millón de habitantes 5. En Colombia la tasa de trasplante de órganos sólidos fue de 20,4 trasplantes por millón de habitantes para el 2013 y 22,2 para el 2014. Dentro de estos, la tasa de trasplante cardiaco fue de 1,7 por cada millón de habitantes, para el 2013 (74 trasplantes en total), y 1,6 para el año 2014 11. Esto implica que en el país hay una baja tasa de donación, lo cual se constituye en la principal limitante para el trasplante de órganos. A pesar de esto, es de esperarse que la frecuencia con la que se realizan estos procedimientos, tienda a aumentar.
Existen complicaciones propias del trasplante y otras relacionadas con la inmunosupresión a la cual se somete a estos pacientes. Este caso muestra la aparición de una neo-plasia cerebral en una paciente sometida a trasplante con un antecedente de infección viral que la llevó a falla cardiaca. La infección previa correspondió apoliomavirus, la cual se ha relacionado con neoplasias del sistema nervioso central cuando han sido inoculados directamente en modelos animales; pero, sin que se haya establecido relación directa con síndromes linfoproliferativos en humanos 12,13. Esto quiere decir que en este caso de manera interesante coexisten al menos dos factores que potencialmente pueden estar asociados a neoplasias. Sin embargo, hay una muy clara asociación de los medicamentos inmunosupresores y la aparición de tumores.
El origen de las neoplasias tras el trasplante puede ser de novo con una incidencia mayor en los pacientes trasplantados con respecto a la población general y en relación con la infección por HIV. El linfoma primario de SNC en general es considerado un tumor dependiente del estado inmuno-lógico del huésped 14. La infección por virus de Epstein Barr (EB) y virus linfotrófico de células T humana (HTLV-1, HTLV-8), también han sido relacionados con este tipo de tumores. Los síndromes mieloproliferativos son comunes en pacientes trasplantados, pero solo corresponden al 5 % de las neoplasias del SNC en este tipo de pacientes 15.
El tipo de inmunosupresión y la intensidad también han sido relacionados con la aparición de síndromes mieloproli-ferativos en SNC. En general, la combinación de ciclospo-rina y tacrolimus parece estar relacionado con una mayor aparición de estas neoplasias comparado con otro régimen de inmunosupresores. Una serie de casos identificó que 25 de 29 pacientes que desarrollaron este tipo de síndromes mieloproliferativos en SNC se encontraban recibiendo esta combinación. Sin embargo, no es posible establecer una causalidad debido al poco peso epidemiológico de este estudio 16.
Se ha encontrado una asociación directa con el virus de EB en pacientes con desórdenes autoinmunes y el uso de micofenolato mofetil en la aparición de síndromes mie-loproliferativos en el SNC, por lo que se recomienda una adecuada selección y estricta vigilancia en pacientes con desórdenes inmunes previos 17. En el caso descrito, la paciente se encontraba en tratamiento con micofenolato mofetil, pero no se había aislado el virus de EB.
El tiempo promedio de presentación postrasplante de los síndromes mieloproliferativos en SNC puede variar desde 18 meses hasta más de 3 años 18. Se ha encontrado una media de 4,4 años desde el trasplante hasta el diagnóstico de la neoplasia cerebral, similar al tiempo de trasplante de este caso. En estos estudios, las lesiones multifocales en hemisferios cerebrales fueron la presentación más frecuente en estos estudios (61 % y 72 %, respectivamente) 15. En el caso reportado, la paciente presentó una lesión única hemisférica. Esta presentación inusual llevó a considerar inicialmente la presencia de neuroinfección, las cuales pueden tener una presentación clínica y radiológica con algunas similitudes. Una serie de casos de linfomas cerebrales posterior a trasplante de riñón, recalca la dificultad en el diagnóstico radiológico de la neoplasia por la presentación radiológica tan variada 19.
En la evaluación diagnóstica como alternativa inicial se debe realizar una tomografía computarizada (TC) o una resonancia magnética (RM) como método complementario. En la TC los LPMSNC en un 50 % de los casos se observa una hipodensidad, en 33 % se observan lesiones hiperden-sas, y en 16 % son isodensas. En algunos casos la captación de contraste es intensa de modo periférico a la lesión o moderada dentro de la lesión. En la RM en secuencias T1, el 54 % de los casos mostraba una lesión hipointensa, 34 % isointensa, y 13 % una lesión hiperintensa moderada. En las secuencias de T2 se puede observar en el 87,5 %, una lesión hiperintensa 20.
Es indispensable que tras el estudio inicial se hagan estudios de extensión dado que los LPSNC en un 4 a 12 % tienen compromiso sistémico, por lo que se recomienda el estudio del neuroeje por RM o por PET. Este último puede tener mejor relación costo-efectividad frente a la TC abdominal, torácica y la biopsia de médula 21,22.
El tratamiento oncológico se basa en la combinación de esteroides, quimioterapia y radioterapia, puesto que se trata de tumores muy sensibles a estos tres tratamientos. Se ha comprobado mayor supervivencia con tratamiento combinado de radioterapia y quimioterapia en comparación a la radioterapia sola y mejor pronóstico. El metotrexato y la citarabina son los fármacos más activos y los regímenes de tratamiento que incluyen estos fármacos y radioterapia consiguen una tasa de respuesta del 80 % y una supervivencia media de 3 años. Estos tumores responden bien inicialmente, aunque la respuesta es de poca duración, no tiene efecto curativo ni predice una mejor evolución (hasta el 90 % recidivan durante el primer año) 23,24.
Se ha relacionado con peor pronóstico cinco variables que afectan negativamente la sobrevida; edad mayor a 60 años, escala de calidad de vida en paciente oncológico (Eastern Cooperative Oncology Group - ECOG) mayor a 1, niveles séricos de LDH elevados, hiperproteinorraquia y el compromiso de estructuras cerebrales profundas (regiones periven-triculares, ganglios basales, tronco del encéfalo y cerebelo). Cuando se tiene un factor como estos, la sobrevida es del 80 %, 2 a 3 del 48 % y de 4 a 5 del 15 %. Los LPSNC son una neoplasia muy dependiente del sistema inmunológico del paciente por lo que, a mayor inmunosupresión, menor respuesta al tratamiento 25.














