INTRODUCCIÓN
Los bosques ribereños presentan múltiples funciones dentro de las planicies inundables y no inundables (Wilcke et al., 2002; Roig et al., 2005). Estos albergan gran variedad de especies vegetales protectoras, proporcionan refugio para diversos organismos, retardan el escurrimiento (Depettris et al., 1992; Ceccon, 2003), modulan el balance entre erosión y sedimentación, participan en la acumulación y transferencia de nutrientes, constituyen la solución más eficiente para reducir la contaminación difusa (Naiman et al., 2005; Veneklaas et al., 2005), entre otras funciones (Klinge et al., 1983; Herrera, 1985).
En Colombia se han deforestado vastas extensiones de bosques (Etter et al., 2006) de alta diversidad y alto grado de endemismo (Gentry y Dodson, 1987; Henderson et al., 1991), afectando por ello el reciclaje de nutrientes y la regulación de caudales. No se cuenta con referentes publicados sobre estudios de caída de hojarasca para el Caribe Colombiano en el que se valoren los aportes individuales de hojarasca de especies, en bosques asociados a recursos hídricos, por lo que este estudio puede servir de base para futuras investigaciones aplicadas a la producción forestal, permitiendo así dimensionar el tipo de servicios que ofrecen y generar a su vez, estrategias integrales para el manejo y conservación de sus ecosistemas.
Los manantiales son ecosistemas de gran importancia (Zedler y Kercher, 2005). El manantial de Cañaverales se encuentra actualmente afectado por la creciente presión humana, se registra degradación de hábitat y grandes pérdidas de vegetación que lo acercan a un bosque primario intervenido por su estructura y composición florística (Corpoguajira, 2011). Por ello, es necesario ahondar en el conocimiento de sus ecosistemas, con especial atención a la dinámica de procesos funcionales de los bosques inundables, los bosques no inundables y al matorral espinoso que son estratégicos para el mantenimiento y suministro de bienes y servicios ambientales.
La hojarasca representa la mayor ruta de retorno de materia orgánica para la biota acuática y terrestre de estos bosques (Kumar y Agrawal, 2001; Zapata et al., 2007) como fuente de suministro y mantenimiento de la fertilidad del suelo (Vitousek et al., 1995; Parzych y Trojanowski, 2006; Wang et al., 2008), que satisface las necesidades nutricionales de las especies vegetales (García Oliva et al., 2003; Barreto y León, 2005). Por ello, la caída, descomposición y liberación de nutrientes de la hojarasca son procesos funcionales claves que pueden suministrar información esencial acerca del desarrollo fenológico, vitalidad y variación anual como reacción al clima y a otros cambios ambientales (Schessl et al., 2008). Las investigaciones en el trópico han comparado ecosistemas manejados y no intervenidos (Del Valle, 2003; Dale y Polasky, 2007) y han determinado la importancia de esta hojarasca en la creación de refugios para la conservación de la biodiversidad (Perfecto et al., 1996).
El presente trabajo pretendió probar la hipótesis orientada a valorar las diferencias entre la caída y descomposición de hojarasca de tres tipos de bosque y durante eventos de lluvia y de sequía. Este estudio de caída de hojarasca es pionero en Colombia en el que se valoran los aportes individuales de hojarasca de especies, en bosques asociados a recursos hídricos.
MATERIALES Y MÉTODOS
Área de estudio
El estudio se realizó durante seis meses en el manantial de Cañaverales, localizado en el municipio de San Juan del Cesar, La Guajira, Colombia (10°44'21 N, y 72°50'00 W) sobre las estribaciones de la Serranía de Perijá a una altura de 267 m s.n.m. dentro de la sub-cuenca del río Cañaverales (Fig. 1). La temperatura media anual es de 27,3 °C y el régimen de precipitaciones discontinuo (776,7 mm/año) sigue un patrón bimodal a través máximos durante mayo-septiembre y mínimos durante diciembre-marzo, meses en los que solamente se registra el 4,6 % del total anual (Hernández et al., 1992; IDEAM, 2005).
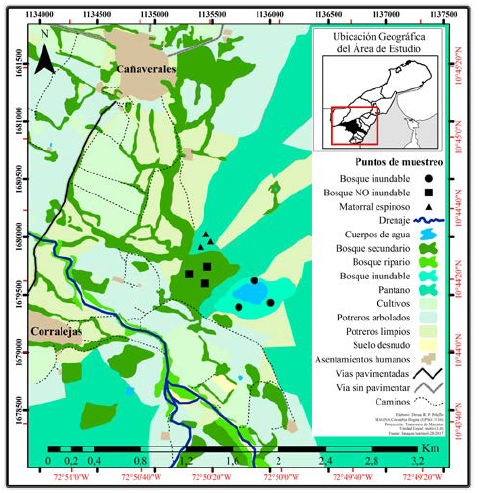
Figura 1 Manantial de Cañaverales, mapa general de usos y coberturas con la ubicación de los sitios de estudio. Sitio 1: bosque inundable, Sitio 2: bosque no inundable y Sitio 3: matorral espinoso. (Tomado de Corpoguajira, 2011).
La vegetación del área de estudio corresponde al bosque seco tropical, uno de los ecosistemas más degradados y fragmentados del país (Etter, 1993; IAvH, 1998). El área cuenta en promedio con 104 especies, agrupadas en 88 géneros y 45 familias; las familias que presentan mayor número de especies son Fabaceae, Capparaceae,
Bignoniaceae, Caesalpinaceae y Mimosaceae, (IAvH, 1998). Los géneros que son endémicos y restringidos a bosques secos tropicales en Colombia son Amyris, Bourreria, Bulnesia, Bursera, Caesalpinia, Crecentia, Gyrocarpus, Malpighia y Ximena y entre las especies amenazadas se encuentran el Carreto (Aspidosperma polyneuron), Guayacan (Bulnesia arbórea), Ébano (Libidibia ebano) y Palma Grata (Bactris guineensis) (IAvH, 1998). En función de la oferta hídrica se definen tres unidades de vegetación: bosque inundable, bosque no inundable y matorral espinoso, que se distinguen entre sí en cuanto a su fisonomía, estructura y composición florística (Corpoguajira, 2011).
Los bosques inundables (sitio 1) están localizados sobre la porción oriental del área y cubren 12,45 ha (28,1 % de la superficie evaluada), que permanece inundada durante varios meses del año. En la superficie del cuerpo de agua abundan S. apetala, A. excelsum Nymphaea cf. corardii, Sagittaria sp. y Eleocharis sp, mientras que en las orillas hay árboles con alturas entre 10-15 m, entre los que se destacan Triplaris sp. (Barriga de culebra), Eugenia sp. (Arrayán), Bactris guineensis (Palma grata), Hura crepitans (,Ceiba de leche) y Crateva tapia (Toco); seguidos por ceibas Hura crepitans y Ceiba pentandra que presentan alturas entre 18 y 25 m, en algunas zonas se observan Bauhiniaglabra y Bromelia chrysantha (Corpoguajira, 2011).
Los bosques no inundables (sitio 2) cubren cerca de 6,55 ha en la porción plana alrededor del espejo de agua del manantial de Cañaverales y en las colinas circundantes. Se trata de un bosque multiestratificado con elementos emergentes de B. alicastrum (Guaimaro), A. graveolen (Quebracho colorado) y Hura crepitans (Ceiba) que alcanzan los 35 m de altura (Corpoguajira, 2011).
El matorral espinoso (sitio 3) cubre 16,05 ha y está conformado por elementos arbustivos y sub-arbóreos de porte bajo y copas amplias y aparasoladas, que presentan alturas entre los 5-10 m. Está compuesto por especies como P. juliflora (trupillo), B. simaruba (resbala mono) Mimosa cf. arenosa (espinito rojo) y varias del género Machaerium. No se observan plantas epífitas, pero sí algunos bejucos (Buahinia glabra) así como algunas hierbas en el estrato herbáceo (Corpoguajira, 2011).
Métodos de campo y laboratorio
Caída de hojarasca
Para estimar la cantidad de hojarasca producida se ubicaron tres trampas de colecta por cada una de las dos especies más abundantes de cada sitio: (Sitio 1) bosque inundable. Especies utilizadas: Sterculia apetala (camajon) (SA), Anacardium excelsum (caracolí) (AE), (Sitio 2) bosque no inundable. Especies utilizadas: Brosimum alicastrum (guaimaro) (BA), Astronium graveolen (gusanero) (AG) y (Sitio 3) matorral espinoso. Especies utilizadas: Bursera simaruba (Resbala mono) (BS) y Prosopis juliflora (trupillo) (PJ). Las trampas tenían un área individual de 1 m2 (Proctor, 1983), y una altura de 1 m desde la superficie del suelo (Ramírez et al., 2007) y malla fina (Fuentes y Rodríguez, 2012), estando separados 50 m entre ellas (Quintero et al., 2014).
El material fue colectado mensualmente durante 6 meses (108 colectas en total) etiquetado y trasladado al laboratorio para ser secado en un horno a 60 °C (Aussenac et al., 1972) hasta peso constante en una balanza analítica modelo PW124 marca ADAM. Luego, el material fue separado en las siguientes fracciones hojas (fracción H), material reproductivo (flores, frutos y semillas) (fracción F), material leñoso (Solo fueron consideradas ramas menores a 5 cm, correspondientes a trozos de corteza, debido a que esta es la fracción que pudo ser colectada en las trampas utilizadas) (fracción L) y material misceláneo (órganos vegetales no identificables) (fracción M) (Cuevas y Lugo, 1998; Caldentey et al., 2001).
El material seco fue fragmentado en un molino Willey y tamizado en malla 20 (0,84 mm) y posteriormente calcinado a 550 °C (Luh Huang y Schulte, 1985), para determinar el peso seco libre de cenizas.
Descomposición de hojarasca foliar
Se colectaron hojas de las especies vegetales mencionadas anteriormente el primer mes de muestreo previo a la senescencia de cada especie. Se utilizaron alícuotas de masa inicial constante de 10 g de peso seco al aire, que fueron introducidas en grupos de 6 bolsas de 20 x 20 cm por especie (malla de 0,5 mm de tamaño de poro). Las bolsas se cerraron con hilo de nylon y se colocaron en el suelo, sujetados por grapas, para prevenir que se perdieran por escorrentías superficiales (Wieder y Lang, 1982).
En cada sitio evaluado se realizó un experimento por especie, con tres replicas que contenian seis mallas para las recolectas mensuales que abarcaron los periodos seco y lluvioso, de tal manera que el ensayo consto de 108 mallas en total, para las seis especies estudiadas. Tras cada retirada de bolsas en campo, se trasladaron al laboratorio, en donde el material fue extraído y limpiado con un pincel con ayuda de agua destilada hasta eliminar completamente partículas de suelo adherida, raíces, pequeños invertebrados que penetraban a menudo en las bolsas. Posteriormente se secaron y calcinaron bajo las condiciones antes descritas para determinar así el contenido de materia orgánica libre de cenizas.
Mensualmente se recolectaron seis bolsas por sitio de estudio para un total 18 bolsas por evento de muestreo, mediante seis colectas abarcando los periodos seco y lluvioso. El ensayo por tanto constó de 108 bolsas en total, para las seis especies estudiadas. Tras cada retirada de bolsas en campo, se trasladaron al laboratorio, en donde el material fue extraído y limpiado con un pincel con ayuda de agua destilada hasta eliminar completamente partículas de suelo adherida, raíces, pequeños invertebrados que penetraban a menudo en las bolsas. Posteriormente se secaron y calcinaron bajo las condiciones antes descritas para determinar así el contenido de materia orgánica.
Para determinar el coeficiente de descomposición de la hojarasca se utilizó el modelo exponencial negativo propuesto por Petersen y Cummins, (1974) Mt = Me-^ en donde Mt es la masa remanente en el tiempo t, Mi es la masa inicial de hojarasca, -k es el coeficiente exponencial de descomposición y t el lapso de tiempo durante el cual se lleva el proceso (Escalante et al., 2012). En este modelo el tiempo requerido para que se descomponga el 50 y 99 % de la hojasca se calcula como t05=ln0,5/k y t=ln(1-0,99)/k. Así mismo, se calculó también el tiempo medio de permanencia, estimado como la inversa de k (Olson, 1963).
Análisis estadístico
Se determinaron las diferencias entre la variable caída de hojarasca y los factores sitios, especie, fracción y periodos climáticos, por medio de análisis de varianza-Anova, probando inicialmente los supuestos de aleatoriedad de residuos (prueba Durbin Watson), homogeneidad de varianza (prueba de Bartlett) y normalidad de los residuos de cada Anova (prueba de Shapiro Wilk: S-W). Las variables mostraron un comportamiento aleatorio, pero no cumplieron los supuestos de normalidad, por lo que se realizó el análisis de varianza no paramétrico de Kruskal-Wallis (K-W).
El análisis de potencia y tamaño de muestra requerido para cada análisis de varianza realizado se determinó a través de la función de notaciones de Cohen (1988). Para todos los análisis se utilizó el programa estadístico R versión 2.3.2 (R Development Core Team, 2016).
RESULTADOS
Variables ambientales
La precipitación en la estación aeropuerto-Alfonso López cercana al área de muestreo fue inferior a los 6mm.día-1 entre los meses de diciembre a marzo (correspondiendo a los primeros cuatro muestreos) mientras que los dos meses finales del estudio alcanzaban los 27,7 mm.día-1 (Fig. 2A). El periodo inicial M1 al M4 mostraron un valor de precipitación significativamente menor en comparación con el periodo lluvioso, correspondiente a los muestreos M5 y M6 (F=2,536; p=0,001; n=182), aunque en términos generales la precipitación fue baja.
La temperatura media durante el periodo de estudio fue 30,7 °C, siendo el valor más alto el registrado en el mes de marzo con 41,6 °C, y los más bajos en el mes de enero con 22,3 °C. Las temperaturas promedio presentaron diferencias significativas para los meses de estudio (F=1,782; p=0,003; n=182) como se evidencia en la Fig. 2B.
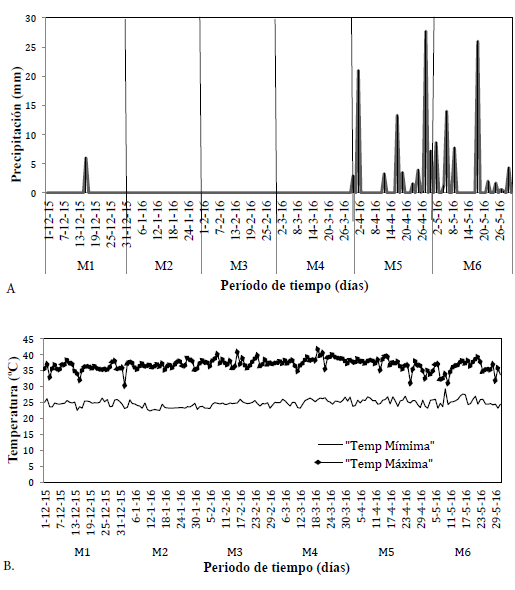
Figura 2 A. Precipitación diaria en los periodos de muestreo del bosque seco tropical del manantial de Cañaverales. En los muestreos (M1: muestreo 1, M2: muestreo 2, M3: muestreo 3, M4: muestreo 4, M5: muestreo 5 y M6: Muestre o 6). B. Temperatura diaria.
Los umbrales de precipitación presentados generaron efectos en los aportes de la biomasa, provenientes de la hojarasca estacional, por las diferencias significativas (F=1,748; p=0,029; n=182) que se presentaron en los meses de diciembre a mayo.
Variación de la caída de hojarasca entre los sitios y periodos climáticos
Los aportes promedio de MO para los periodos lluvioso y seco fueron de 0,440 y 0,647 g.m-2 día-1 respectivamente. A nivel generalse puede observar (Fig. 3) que los mayores aportes de hojarasca se presentaron durante eventos de sequía (KW=22.9, gl= 5,p=0.0003) y en el matorral espinoso (0,98±0,30 g.m-2 día-1), seguido de los bosques inundables (0,95±0,26 g.m-2.día-1),ybosquesnoinundables (0,85±0,19 g.m-2.d día aunque la dispersión de los valores fue mayor en el matorral espinoso, lo cual le resta importancia en la contribución de materiales orgánicos.
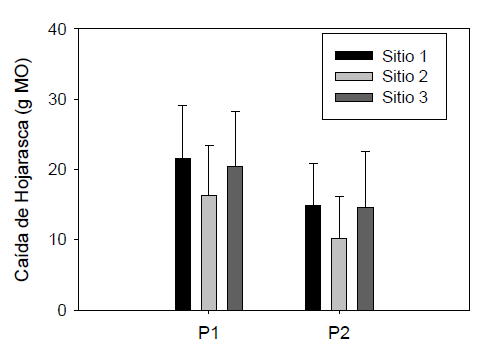
Figura 3 Variación de los niveles de MO aportada por la hojarasca en los tres sitios evaluados (Sitio 1. bosques inundables; Sitio 2. bosques no inundables y Sitio 3. matorral espinoso) y entre eventos de lluvia (P1) y sequía (P2). Las barras representan los valores promedio y las líneas acotadas ± 1 desviación estándar.
Variación de la caída de hojarasca entre especies y periodos
En el bosque inundable SA (0,68 g·m-2·día -1) y AE (1,18 g·m-2·día -1) presentaron el mayor registro en M3; similar al patrón presentado por BA (0,65 g·m-2·día -1) y AG (1,00 g·m-2·día -1) en el bosque no inundable, mientras que los aportes realizados por BS (0,72 g·m-2·día -1) y PJ (1,18 g.m-2.día -1) establecidas en el matorral espinoso, aumentaron en M2. A nivel general, los aportes máximos de hojarasca por las seis especies vegetales se presentaron en el periodo seco (KW= 64.4, gl= 11, p<0,01). En cuanto a aportes de hojarasca, las especies de mayor ingreso de este material fueron PJ y AE, pertenecientes a los bosques inundables y matorral espinoso respectivamente (Fig. 4).
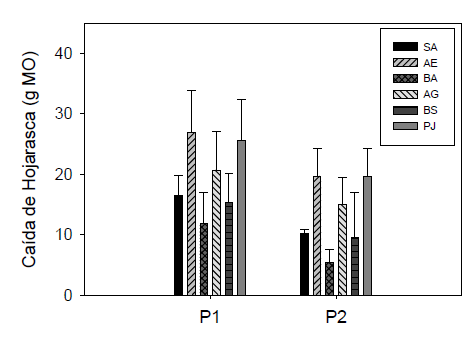
Figura 4 Variación de los niveles de MO aportada por la hojarasca de las seis especies vegetales evaluadas y entre eventos de lluvia (P1) y sequía (P2). Las barras representan los valores promedio y las líneas acotadas ± 1 desviación estándar.
Los aportes fueron del 66,61 % para el material foliar (H), 15,92 % para el material reproductivo (F) y 11,12 % para el material leñoso (L) del total de la hojarasca colectada. Los mayores aportes del material foliar (0,602; 0,498 y 0,797 g-m-2-día-1) y reproductivo (0,209; 0,167 y 0,163 g-m-2-día-1), se registraron durante las primeras colectas en el bosque inundable, bosque no inundable y matorral espinoso respectivamente, que corresponden al periodo seco. Las menores producciones de material foliar (0,310; 0,167 y 0,248 g-m-2 día -1) y reproductivo (0,016; 0,020 y 0,031 g-m-2-día-1) corresponden al periodo lluvioso.
El comportamiento de los aportes del material leñoso es similar al presentado por el material foliar y reproductivo, con aportes de 0,117, 0,145 y 0,078 g.m-2día-1 para el bosque inundable, bosque no inundable y matorral espinoso respectivamente. Destaca el aporte hojas (H) para los dos periodos climáticos comparado con el resto de fracciones que presentaron poca variación (KW= 211,4, gl= 7, p<0,01) (Fig. 5). Este patrón se presentó de forma similar al comparar las fracciones por los diferentes sitios evaluados, en donde la variación sigue siendo dominada por hojas, en todos los sitios (KW=218.23, gl= 1, p<0,01), así como al discriminar estas fracciones por cada una de las especies, dominando en todos los casos sus aportes de hojas (KW= 247,42, gl= 23, p<0,01).
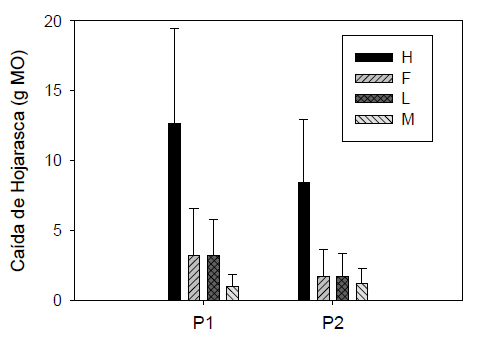
Figura 5 Variación de los niveles de MO aportada por cada fracción de la hojarasca, entre eventos de lluvia (P1) y sequía (P2). Las barras representan los valores promedio y las líneas acotadas ± 1 desviación estándar.
Descomposición de hojarasca
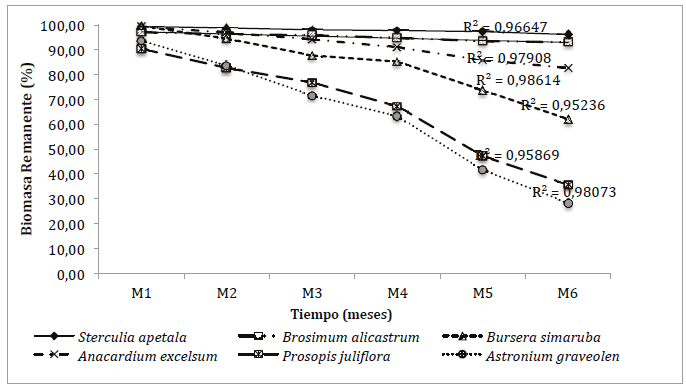
En el análisis exploratorio, se destaca que la relación entre el porcentaje de descomposición de la hojarasca foliar de las especies evaluadas y los muestreos, presentó un ajuste (R2) con el modelo exponencial oscilando entre 0.95 y 0.99 (Fig. 6). Las constantes de descomposición de S. apetala (SA), A. excelsum (AE), B. alicastrum (BA), A. graveolen (AG), B. simaruba (BS) y P. juliflora (PJ) fueron de 0,258, 0,270, 0,299, 1,055, 0,757 y 1,095 respectivamente, con diferencias significativas (KW=33.527, gl=5, p<0.01). SA fue la especie más persistente, con un tiempo medio de permanencia cuatro veces más alta que el de la especie PJ, que presentó los mayores aportes de hojarasca y las mayores tasas de descomposición al igual que la AG.
Las pendientes de los modelos exponenciales, presentaron un comportamiento diferencial, asociado al tipo de especie en los procesos de descomposición, observando que la especie AE (Fig. 6) perteneciente al sitio 1 fue la que generó el mejor ajuste (R2 0,99), indicando menor heterogeneidad entre los periodos de estudio.
En los procesos de descomposición se observó una mayor pérdida de peso en las dos primeras colectas (diciembre y enero) y los meses de mayor precipitación (abril y mayo) con un periodo intermedio de descomposición lenta como se evidencia en la Fig. 5, encontrando que al final del monitoreo (183 días) las especies SA (3,88 %), BA (6,98 %) y AE (17,26 %) habían perdido poco materia orgánica, contrario a las especies AG (71,57 %), PJ (64,34 %) y BS (37,99 %) que presentaron altos porcentajes de degradación de la materia orgánica, presentando diferencias significativas (KW=65,18, gl=5, p<0,01) en los meses de muestreo del periodo de estudio.
DISCUSIÓN
A pesar de que se evaluaron solo seis especies, los aportes de hojarasca son considerablemente bajos, si se comparan con los registros para la vegetación completa de bosques ribereños (Fuentes y Rodríguez, 2012; Collantes et al., 2014; López et al., 2015;). La correlación negativa entre la producción de hojarasca en las tres formaciones vegetales de bosque inundable, bosque no inundable y matorral espinoso con la precipitación, se corresponde con las afirmaciones de Sanches et al. (2003), quien indica que la producción de hojarasca en bosques tropicales aumenta en las épocas de menor precipitación por el déficit hídrico, ante lo cual las especies vegetales reaccionan perdiendo el follaje. Por su parte, Murovhi et al. (2012) encontraron correlación positiva entre la producción de hojarasca, la humedad atmosférica, la temperatura ambiente, el diámetro de tallo, la altura y copa de las especies vegetales.
La producción de hojarasca del presente estudio fue 0,47 t-ha1-año-1 para el periodo seco y 0,10 t-ha-1-año-1 para el periodo lluvioso. Estas fluctuaciones están asociadas al periodo del ciclo vegetativo con la sucesión de las etapas fenológicas propias de cada especie vegetal, y condiciones climáticas (Celentano et al., 2011; Quintero et al., 2014). El aporte de la fracción foliar total fue de 1,35 t-ha-1-año-1 siendo la de mayor peso en la hojarasca (64,73 %), reportes similares a los de González et al. (2013), Collantes et al. (2014) y López et al. (2015), registraron una participación de esta fracción en los sistemas tropicales que oscila entre 60 y 70 %. Lo anterior debido a que el material foliar según Piatek y Allen (2000) presenta una alta demanda de nutrientes con respecto al resto de los órganos vegetativos; ya que entre el 30 % y 70 % del total de los nutrientes almacenados anualmente se encuentran en las hojas.
La fracción superior a 5 cm no se pudo colectar en las trampas utilizadas, a pesar de que el ingreso de ramas y palizada de esta dimensión, se observó en el suelo, especialmente durante eventos de lluvia. Campbell et al. (1992) y Larned (2000) hacen especial énfasis en la dificultad para cuantificar este tipo de fracciones cuando son de gran tamaño, debido a las limitaciones que presentan los métodos tradicionales de muestreo. Al igual que en la investigación de Webster et al. (1999) quienes mencionan que la dificultad para evaluar la fracción leñosa se presenta por la distribución parchada en espacio y en tiempo. Siendo este un aporte importante que da cuenta de la estructura física de los bosques ribereños.
Las especies S. apetala y A. excelsum se descomponen más lento y BS y PJ más rápido, posiblemente por la composición química y estructural de las hojas. El nivel de descomposición de la hojarasca para cada especie puede estar asociado a su dependencia de las condiciones climáticas (precipitación, humedad y temperatura), las características edafológicas, la diversidad biótica entre otros, pero lo más importante se relaciona a la composición química de su material vegetal y la resistencia de este a los procesos de descomposición (Zhang et al., 2008).
La producción y descomposición de la hojarasca son procesos claves para la conservación y/o recuperación de las formaciones vegetales, debido a que promueven procesos de circulación de los nutrientes y mantenimiento de las comunidades, por lo que resulta necesario conocer los aportes de materia orgánica que realizan las especies vegetales para garantizar el retorno de los nutrientes (Gaspar et al., 2015). Los resultados obtenidos sugieren conveniente estudiar la posibilidad de realizar estudios de restauración ecológica de los nutrientes aportados por las especies A. excelsum y P. juliflora, por su aportación de materia orgánica y la rápida capacidad de aportar nutrientes de esta última por la alta tasa de descomposición de materia orgánica.
CONCLUSIONES
El análisis de la caída y descomposición de la materia orgánica vía hojarasca de las seis especies evaluadas en el bosque fluvial del manantial de Cañaverales se caracterizó por: (1) los aportes de la materia orgánica aumentaron en el periodo de sequía, en especial para las fracciones H y F y las especies evaluadas, salvo aquellas pertenecientes al matorral espinoso; (2) Los mayores aportes de materia orgánica los realizaron las especies P. juliflora y A. Excelsum; (3) la relación entre la descomposición de hojarasca foliar de las especies evaluadas y el periodo de monitoreo es descrito por un modelo exponencial negativo, y (4) las mayores tasas de descomposición las presentó la especie S. apetala.