INTRODUCCIÓN
Las actividades humanas han cambiado las características estructurales y biológicas de algunos bosques con el avance de los procesos de urbanización, generando un cambio en la cobertura vegetal que produce paisajes transformados que a la vez alteran la fauna en sus hábitats naturales (Clergeau et al., 1998). Existen investigaciones que apoyan la idea que la frontera urbana afecta la fauna, en especial a las aves (Bayne et al., 1997; Jokimaki y Huhta, 2000; Borgmann y Rodewald, 2004; Colombelli-Négrel y Kleindorfer, 2009; López-Flores et al., 2009; Michalski y Norris, 2014). La transformación del entorno mediado por la urbanización afecta a especies especialistas porque reduce la disponibilidad de comida y refugio, recursos indispensables para sobrevivir y reproducirse, y a su vez, reduce la riqueza de especies de las comunidades; y se hacen raras las especies con dietas y necesidades muy específicas como lo son algunas especies de la familia Thamnophilidae que son el grupo simulado en esta investigación. De esta forma, las zonas urbanas pueden considerarse como trampas ecológicas dado que atraen aves a reproducirse, no necesariamente brindando protección, dado que sus coberturas vegetales no son adecuadas para evitar depredadores (Cervantes, 2006). Conjuntamente, al incrementar las perturbaciones antrópicas se pierde la calidad del hábitat y se introducen depredadores domésticos (e.g., gatos y perros), o se atraen depredadores nativos oportunistas afectando negativamente las poblaciones de aves al ser expuestas a depredadores no habituales.
En su informe del estado del medio ambiente de Colombia (IDEAM et al., 2016), se indica que en las últimas décadas la tasa de deforestación ha aumentado. En términos regionales, la Amazonia colombiana presentó los mayores niveles de pérdida de bosque para los años 2015 y 2016 con 56 962 ha y 70 074 ha respectivamente (Miniambiente y IDEAM, 2016). Esta deforestación se debe a factores antrópicos tales como: minería, ganadería, construcción y cultivos. El reto para la conservación de la biodiversidad, por tanto, será alcanzar una interacción factible entre lo urbano y el bosque, porque lo urbano está incrementando en una tasa acelerada la extinción de especies nativas (Marzluff et al., 2001).
Entre los procesos ecológicos que son afectados por la urbanización está la depredación de nidos de aves. En zonas urbanas se incrementa la depredación de nidos por la presencia de mascotas (Remeí, 2005), que se convierten en depredadores. Varios estudios evidencian que el incremento en la cobertura vegetal reduce las tasas de depredación de nidos en las aves en zonas perturbadas por el hombre (Jokimaki y Huhta, 2000; Weidinger, 2002; Nalwanga et al., 2004; Michalski y Norris, 2014), apoyando la hipótesis de que nidos con cobertura vegetal más densa - como en bosques con poca intervención - son menos propensos a ser depredados (Martin, 1992; Filliater et al.,1994). Por lo tanto, se espera que en la medida que la cobertura vegetal disminuye, aumente la probabilidad de depredación de nidos.
También se ha documentado que, al cambiar las coberturas vegetales dominadas por especies nativas por coberturas con especies de plantas foráneas, aumenta la depredación en los nidos de las aves (Jokimaki y Huhta, 2000; Mezquida y Marone, 2003; Borgmann y Rodewald, 2004).
Si las fronteras urbanas están cambiando la cobertura natural de los bosques por coberturas menos densas y con menor diversidad vegetal comparadas con las originales, esto debe afectar la reproducción de las aves. Por tanto, se espera que áreas con mayor intervención antrópica (e.g., presencia de carreteras, casas, caminos), presenten depredación más alta de nidos que en aquellas áreas sin intervención antrópica. También se espera, a menor escala, que la densidad de cobertura vegetal alrededor del nido sea un factor que influya en la depredación de los nidos.
En este trabajo se compara el efecto de las actividades humanas sobre la depredación de nidos artificiales a través de un gradiente de intervención antrópica en la jurisdicción de Leticia, Amazonas, Colombia. Los experimentos con nidos artificiales han sido ampliamente usados para examinar los patrones de depredación en hábitats fragmentados (Burke et al., 2004; Spanhove et al., 2009; Chmel et al., 2018) en sitios con perturbaciones antrópicas (Clergeau et al., 1998; Blair, 2004) y en la variación entre y dentro de hábitats (Blair, 2004). Empleando una aproximación experimental, el uso de nidos artificiales proporciona a los investigadores un tamaño de muestra significativo para análisis estadísticos apropiados (Major y Kendall, 1996; Ortega et al., 1998), y permite controlar variables (Moore y Robinson, 2004). Su diseño experimental debe ser planteado cuidadosamente para poder comparar los resultados con nidos naturales, dado que la depredación de los nidos puede estar mediada por el tipo de depredador (Ortega et al.,1998), la forma del nido, el tipo de bosque (Colombelli-Négrel y Kleindorfer, 2009), la altura del nido (Ortega et al.,1998), entre las más significativas.
MATERIALES Y MÉTODOS
Áreas de estudio
Esta investigación se llevó a cabo en jurisdicción del municipio de Leticia en una zona cercana al casco urbano que presenta un paisaje en continuo cambio principalmente asociado a la rápida expansión de la frontera urbana, ganadera, agrícola y la extracción de recursos naturales (Malhi et al., 2008; CEPAL, 2013)Se seleccionaron tres sitios de estudio de acuerdo con sus niveles de perturbación (Fig. 1)
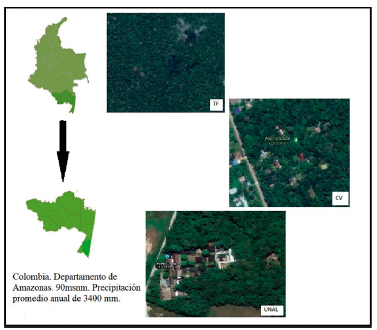
Fotos de Google Earth 2020.
Figura 1 Sitios de estudio con diferentes grados de intervención antrópica en la jurisdicción de Leticia, Amazonas. Julio 2017. TF: Bosque de Tierra Firme grado de intervención cero; CV: Reserva de la Sociedad Civil Cerca Viva grado de intervención dos, UNAL: Campus de la Universidad Nacional Sede Amazonas grado de intervención uno.
Bosque de Tierra Firme (TF) (04°00' S, 069°53' W,119 m.s.n.m): Sitio categorizado como grado cero de intervención. Está ubicado a 27 km al norte del casco urbano de Leticia, y hace parte de una reserva forestal de la Nación constituida por la Ley 2da de 1959. Es un bosque muy húmedo tropical en buen estado de conservación, con altura promedio de los árboles de 40 m y con un porcentaje promedio de abertura de dosel de 8,85 % (± 5,66). La presión antrópica es esporádica, caza y extracción de recursos vegetales por parte de las comunidades indígenas.
Campus de la Universidad Nacional de Colombia sede Amazonia (UNAL) (04°11'S y 069°56' W, 99 m.s.n.m): Sitio categorizado como grado uno de intervención antrópica, porque tiene una presión antrópica intermedia, debida a presencia continua de personas, principalmente en la zona edificada, pero no hay extracción de recursos. Tiene un área aproximada de 20 ha de las cuales 2,25 ha están construidas de una manera sectorizada y existen senderos entre el bosque. Este sitio está ubicado en la periferia del casco urbano a 2 km del centro de la ciudad de Leticia. Es un bosque en regeneración de aproximadamente 28 años de edad, posee algunos árboles grandes y maduros, y parches dominados por platanillo (Musaceae), especie típica de zonas en regeneración en la Amazonía. Los árboles tienen una altura promedio de 9,25 m (± 1,66 m), tiene un porcentaje promedio de abertura de dosel de 8,84 % (± 5,96).
Reserva Natural Cerca Viva (CV) (04°07' S, 069°56' W, 85 m.s.n.m): Este sitio se categorizó en grado dos de intervención por la alta presión antrópica que presenta. Está ubicado a 11 km de la cabecera municipal de Leticia, y cuenta con caminos usados para movilización esporádica, caza y extracción de material vegetal. Tiene un área de 29 ha de las cuales 3,95 ha están construidas. Tiene aproximadamente 18 construcciones tales como casas, corrales de gallinas y caminos con adecuaciones, las cuales son usadas por aproximadamente ocho familias. Es un bosque en regeneración de aproximadamente 19 años de edad, tiene una altura promedio de 11,13 m (±1,62) y posee un promedio de abertura de dosel de 8,64 % (± 4,56), dominado principalmente por platanillo (Musaceae) y árboles frutales. Los niveles de ruido son altos (i.e., música de parlantes), y está en el borde de la vía principal hacia la ciudad de Leticia y en los alrededores existen otros asentamientos humanos.
MATERIALES Y MÉTODOS
Entre junio y julio de 2017 realizamos experimentos de depredación de nidos artificiales en los tres sitios de estudio mencionados con diferentes niveles de intervención antrópica. Los nidos fueron construidos con la fibra de hojas en proceso de descomposición de la palma "mil pesos" (Oenocarpus bataua) debido a que se observó aves extrayendo este material y también con el fin de evitar olores o materiales nuevos que puedan influir la actividad de los depredadores. Los nidos fueron de color café oscuro, su longitud entre 7180 mm y su profundidad de tres a cuatro centímetros (Fig. 2). Los huevos fueron hechos con plastilina no tóxica, de color blanco con pintas café, de longitud entre 17-18 mm, y estos se dejaron 48 horas al aire libre para disminuir el olor de la plastilina. Los nidos y huevos se hicieron de esta forma según lo reportado para algunas especies de aves paseriformes (Gering y Blair, 1999) registradas en los sitios de estudio pertenecientes a la familia Thamnophilidae y de nido en copa como Thamnophilus murinus, Thamnophilus schistaceus, Thamnophilus doliatus y Thamnomanes ardesiacus. De este último taxón se encontraron dos nidos naturales activos los cuales tenían hojas secas y fibras muy parecidas a las usadas para construir los nidos artificiales.

Fotos de los autores
Figura 2 Ejemplos de nidos construidos con la fibra de hojas en proceso de descomposición de la palma mil pesos (Oenocarpus bataua) y ubicados en tres sitios en Leticia, Amazonas, Colombia. En la foto se muestra el complejo nido- huevos como fue puesto sobre los árboles. a. vista lateral del nido. b. vista superior del nido. c. ejemplo de la ubicación del nido.
En cada uno de los sitios de estudio se instalaron 36 nidos artificiales (108 nidos en total, Fig. 2). Cada nido, con dos huevos de plastilina, se ubicó a una distancia mínima de 20 m del otro nido más cercano. Los nidos se ubicaron a una altura desde el suelo entre 90 y 140 cm, según se ha reportado en metodologías similares (Martin, 1987; Mezquida y Marone, 2003; Colombelli-Négrel y Kleindorfer, 2009; López-Flores et al., 2009; Chmel et al., 2018). Los nidos fueron expuestos por 16 días para simular un período de incubación de un ave paseriforme, la cual puede durar de 15 a 20 días (Martin et al., 2007; Ocampo et al., 2012). Estos nidos fueron visitados cada dos o tres días para determinar el destino del nido (i.e., depredado o activo) y el tipo de depredador a partir de las marcas dejadas en los huevos.
Todos los nidos fueron marcados con una cinta reflectiva a una distancia no menor de dos metros, y georreferenciados con un GPS Garmin 64ss. Un nido fue considerado fallido (i.e., depredado) si uno de sus huevos presentaba marcas o no se encontraban los huevos en el periodo de observación. Los nidos depredados fueron clasificados de la siguiente manera: A: cuando los huevos no estaban presentes, G: cuando las marcas eran rasguños, P: cuando las marcas eran de picos, D: cuando las marcas eran de dientes. Finalmente, si el nido llegó a los 16 días de exposición sin evidencia de depredación se clasificó como N (i.e., exitoso).
Con el objetivo de caracterizar el sitio de anidación y evaluar su efecto sobre el destino de los huevos, se registraron las siguientes variables asociadas a la estructura vegetal: Distancia del nido al tronco principal de la planta (cm) variable micro-cobertura, abertura de dosel encima del nido variable macro-cobertura medida con un lente Japan Optics Vivitar HD 4 gran angular (%), altura del nido sobre el suelo (cm), cobertura vegetal visual alrededor del nido (%) variable micro-cobertura, esta se mide a un metro del nido haciendo un circunferencia de 50 cm y se estima el porcentaje de cobertura que cubre el nido en esa circunferencia. Para esto se siguió el manual de Martin et al. (1997), asimismo se midió la distancia del nido a la construcción más cercana en metros. Las construcciones definidas fueron: corrales de gallinas, carreteras, casas y viviendas indígenas o de colonos. Adicionalmente, fue establecida una parcela vegetal circular temporal de 11,3 m de radio (0,04 ha) variable macro-cobertura, donde se cuantificó la densidad de árboles (#ind/área) y el promedio de altura (m) de los árboles con diámetro a la altura del pecho > 10 cm. Este tipo de parcelas temporales han sido empleadas anteriormente para determinar la heterogeneidad del hábitat en estudios de ecología (Blair, 2004; López-Flores et al., 2009; Bakermans et al., 2012;
Colorado y Rodewald, 2015). Adicionalmente, se cuantificó la cobertura vegetal baja del bosque a partir del número de toques de las plantas en las piernas del investigador desde los 20 cm hasta 80 cm de altura, cada toque se cuenta como una posible barrera para un depredador detectar el nido, variable macro-cobertura.
Las imágenes de abertura del nido, que es un proxy de visibilidad del nido por parte de depredadores, fueron analizadas en el programa Gap Light Analyzer versión 2.0, que arroja un porcentaje de abertura de dosel para cada nido. La depredación de nidos se reporta en porcentaje (i.e., nidos depredados dividido entre el número de nidos totales por cada área de estudio), siguiendo la forma de presentarse con base en la literatura sobre el tema (e.g. Martin, 1995; Gering y Blair, 1999; Mezquida y Marone, 2003; Nalwanga et al., 2004; Colombelli-Négrel y Kleindorfer, 2009; López-Flores et al., 2009)Finalmente, se identificaron los diferentes depredadores en los sitios de estudio haciendo recorridos ad libitum por la zona cada cinco días.
Análisis estadísticos
Para determinar la relación entre el destino del nido (Éxito del nido) y las variables de estructura de la vegetación, se desarrollaron siete modelos lineales generalizados (MLG) con familia binomial (Regresión logística) y función enlace logarítmica, siendo destino del nido (D=depredado=1 y E=exitoso=0) la variable dependiente categórica. Las variables que se midieron en porcentaje (i.e., Abertura de dosel y cobertura vegetal alrededor del nido) se convirtieron con logaritmo en base 10 (log 10; Colombelli-Négrel y Kleindorfer, 2009). Para elegir el mejor modelo de los cuatro se usó el criterio de información de Akaike de segundo orden (AICc), empleado para muestras pequeñas (Burnham y Anderson, 2002). El paquete estadístico utilizado para analizar los datos fue Rcmdr del software R (RStudio et al.,2019).
RESULTADOS
La abertura de dosel no varió para los tres sitios de estudio con diferentes niveles de intervención antrópica (Tierra Firme = 8,85 % ± 5,66; Campus UNAL 8,84 % ± 5,96; Cerca Viva = 8,64 % ± 4,56). Para el sitio de estudio Campus UNAL, la densidad de árboles por parcela (2,86 individuos/0,04 ha) y la cobertura vegetal baja (78,80 toques ± 28,87) fue menor que en los otros dos sitios de estudio, mientras que la cobertura vegetal alrededor del nido fue más baja en el área de estudio Cerca Viva con 83 % ± 78,16.
De los 108 nidos artificiales instalados en campo, 38 fueron depredados, seis de 36 en el sitio "bosque de Tierra Firme" (16,66 %; grado cero de intervención), 15 depredados en el sitio de estudio Campus Universidad Nacional sede Amazonia (41,66 %; con grado uno de intervención), y 17 depredados en el sitio de estudio Cerca Viva (47,22 %; con grado dos de intervención). El porcentaje de depredación fue significativamente diferente entre los sitios de estudio (X 2 = 8,3639, df= 2; p > 0,015;), con menor depredación en el sitio de menor intervención antrópica (Tierra Firme). Se detectó depredación virtualmente en los 16 días que los nidos estuvieron expuestos (Fig. 3). Sin embargo, tomando en conjunto los tres sitios de estudio, hubo más depredación en algunos días, particularmente hacia el final del tiempo de exposición de los nidos, siendo más intensa en el día 13 de exposición de los huevos en el que se encontraron diez nidos depredados. En cuanto al tipo de depredador se tuvo que la marca más frecuente en los huevos de plastilina (Fig. 4) fue la de rasguños (G. rasguños; 16 nidos), seguida por la marca de dientes (D; 15 nidos). La marca con menor presencia fue de picos (P), con 3 nidos en total. Los depredadores en común para los tres sitios de estudio fueron: zarigüeya (Didelphis sp. y Marmosa sp), zarigüeya pequeña (Caluramys sp.), ardilla (Sciurus sp), mono tití (Saguinus sp), boa (Boa constrictor), caracará (Milvago chimachima), gavilán caminero (Rupornis magnirostris), y oropéndola (Psarocolius decumanus). Para la reserva Cerca Viva y para el sitio Campus UNAL se encontraron además de los depredadores citados, mascotas como gatos y perros.
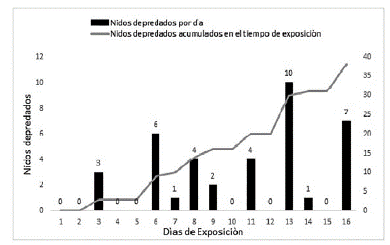
Figura 3 Número de nidos depredados durante los días de exposición de los huevos en los tres sitios de estudio en un gradiente de intervención antrópica en jurisdicción del municipio de Leticia, Amazonas, Colombia.
De los siete modelos realizados que utilizaron el nido como unidad básica de análisis (i.e. unidad experimental) y destino final del nido como variable dependiente binaria nido (exitoso - depredado), el modelo que recibió mejor peso empírico para explicar la depredación de nidos artificiales fue aquel que incluyó las variables cobertura vegetal baja, abertura de dosel y cobertura vegetal alrededor del nido (df= 5; weight = 0,0447). Se encontró una relación positiva entre el destino del nido y abertura de dosel (ß= 1,59; p < 0,045; EE=0,799), cobertura vegetal alrededor del nido (ß= 1,95; p < 0,000; EE=0,547) y cobertura vegetal baja (ß= 0,025; p < 0,001; SE=0,007), así como una asociación negativa entre el destino final del nido y las áreas de estudio (ß= -0,65; p < 0,054; SE=0,338). No se encontró relación significativa entre el destino del nido y las variables densidad de árboles, distancia del nido a tronco principal, altura del árbol donde está construido el nido (sustrato), distancia del nido a construcción y altura promedio de los árboles en la parcela.
DISCUSIÓN
La compleja interacción que puede tener un nido con su ambiente hace que los experimentos de manipulación sean frecuentemente usados para entender los mecanismos ecológicos asociados a la depredación y comprender los factores que pueden mediar en esta interacción ecológica (Moore y Robinson, 2004). Al usar nidos artificiales en experimentos de depredación el supuesto básico es: la depredación de nidos naturales y artificiales será igual o similar. Sin embargo, se requiere de otras consideraciones, para comparar los datos obtenidos entre nidos artificiales y naturales. Por ejemplo, se debe dividir el ciclo de reproducción en dos etapas incubación y pichones y con nidos artificiales solo se podría hacer la comparación con la etapa de incubación ya que este tipo de nidos no tienen un cuidado parental o pichones para simular la segunda etapa.
Dado que la actividad de los padres en el nido puede influir en las tasas de depredación, de hecho, es más probable que la depredación ocurra en pichones más que en huevo, varios estudios muestran que las diferencias entre nidos naturales y artificiales son notorias (Moore y Robinson, 2004; Thompson III y Burhans, 2004). En esta investigación los resultados solo serían comparables con la etapa de incubación. Thompson III y Burhans (2004) encontraron diferencias entre los tipos de depredadores entre nidos artificiales y naturales, esto puede ser porque los nidos naturales están mejor ocultos al depredador que los nidos artificiales (Wilcove, 1985), asimismo mencionan que a pesar de esto los estimadores de depredación diaria entre nidos artificiales y naturales no difiere significativamente.
Nuestra investigación muestra que la depredación de nidos aumentó a medida que se incrementaba la perturbación. Adicionalmente, se encontró que la depredación de nidos fue menor en aquellos sitios con mayor cobertura vegetal baja y cobertura vegetal alrededor del nido. Estas variables de estructura, junto con la abertura de dosel, están relacionadas con la protección del nido y el confinamiento de este. Estas variables aportan protección al nido en forma de camuflaje, distracción de olores, e inclusive como barrera física que impide el acceso a los nidos (Bayne et al., 1997). Similarmente, varios investigadores apoyan la idea de que nidos con más cobertura vegetal alrededor pueden evadir ciertos depredadores (Nalwanga et al., 2004; Remeí, 2005; Winter et al., 2005), y así disminuir su depredación (Filliater et al., 1994; Winter et al., 2005; Michalski y Norris, 2014). Uno de los mecanismos asociados a una mayor depredación en nidos con baja cobertura vegetal alrededor de éste estuvo relacionado con un incremento en su detectabilidad, especialmente por parte de ardillas y aves.
La intervención antrópica puede disminuir el número de refugios adecuados para que las aves eviten la depredación (Jokimaki y Huhta, 2000), lo que hace que estas áreas puedan convertirse en trampas ecológicas (Battin, 2004; Cervantes, 2006), es decir, lugares que parecen apropiados para anidar pero que no cumplen con las características para asegurar protección a las aves, lo que se traduce en depredación. Las tasas de depredación de nidos artificiales aumentan con la intervención antrópica, tanto en zonas templadas (Gering y Blair, 1999; Jokimaki y Huhta, 2000) como en zonas tropicales (López-Flores et al., 2009). Nidos en zonas templadas y con baja cobertura vegetal alcanzan mayor tasa de depredación, con un porcentaje aproximado de 68 % (López-Flores et al., 2009), mientras que en zonas tropicales la tasa de depredación puede llegar hasta un 80 % (Thorington y Bowman, 2003)de nidos depredados en zonas con alta intervención.
Nuestros resultados apoyan la idea que las áreas con intervenciones antrópicas presentan una mayor depredación. Sin embargo, otras investigaciones (Bocz et al., 2017) encontraron lo contrario en un experimento con nidos artificiales en el Mediterráneo. Similarmente, Blair (2004) evaluando nidos artificiales en un gradiente de urbanización en Ohio, Estados Unidos, encontró que la probabilidad de depredación decreció con el incremento de la urbanización. Estas diferencias con nuestra investigación podrían estar explicadas por las variaciones en las densidades poblaciones o de construcción y las categorías derivadas, así como a diferencias ecológicas entre los biomas en que se desarrollaron los estudios. Por ejemplo, la zona clasificada como urbana en la ciudad de Leticia para esta investigación no posee tanta población (Población en el departamento del Amazonas 46 950 personas, y para Leticia 32 450 personas; (Siatac-AC., 2015)) ni estructuras construidas como las que menciona Blair (2004). Otros factores importantes que pueden influir en la depredación podrían estar relacionadas con la estructura del paisaje, la disponibilidad de recursos y los depredadores presentes en el área (Remeí, 2005).
CONCLUSIONES
Los mecanismos detrás de la depredación de nidos aún son poco conocidos y no fueron objeto directo de evaluación de esta investigación. Por ejemplo, la evaluación de requerimientos que puedan influenciar la reproducción y establecimiento de nidos como disponibilidad de alimento y refugio podrían ser objeto de estudio futuro en esta misma área de la Amazonía. Los resultados de esta investigación pueden ser usados de forma indirecta en el plan de ordenamiento territorial de Leticia y así ayudar a la conservación de las especies de fauna y flora.
















