INTRODUCCIÓN
El hábitat desde un punto de vista espacial se define como el área que reúne las condiciones y características físicas y biológicas necesarias para la supervivencia y reproducción de una especie (Delfín-Alfonso et al., 2013). Este puede ser dividido en dos escalas: el macrohábitat y el microhábitat, el primero hace referencias a características a escala del paisaje, como zonas de asociaciones específicas de vegetación (Hall et al. 1997), mientras que el segundo se refiere a características del hábitat en escala fina, que en el caso particular de los anfibios pueden ser la cobertura vegetal, los sitios de percha y sustratos disponibles (Román-Palacios et al. 2016).
Los estudios del uso de microhábitats en anfibios brindan información importante acerca de los patrones de forrajeo y tipos de presas consumidas (Duré y Kehr, 2004; Cajade et al. 2010; Posso-Peláez et al. 2017). Se ha documentado que los anfibios adultos generalmente consumen invertebrados y en algunos casos pueden alimentarse de pequeños vertebrados, sin embargo, la composición taxonómica de las presas depende principalmente del patrón de uso de los microhábitats, dicha composición de las presas ha sido relacionada con el tamaño y sexo de los individuos (Fonseca-Pérez et al. 2017). De acuerdo con Luría-Manzano et al. (2018), la talla de las ranas es importante al momento de la captura de las presas, debido a que individuos de mayor tamaño consumen presas más grandes, en comparación con los más pequeños. Así mismo, se ha observado que ranas de tamaño corporal mayor consumen presas de tamaño mayor, mientras que las especies más pequeñas consumieron presas más pequeñas, evitando así el solapamiento de la dieta entre los diferentes tamaños de los individuos (Muñoz-Guerrero et al., 2007). En el caso particular de C. rhodopis se ha observado que el sexo y el tamaño de los individuos tienen un efecto sobre el número de presas consumidas, lo que sugiere que cada sexo podría estar regulando de manera diferente las poblaciones de invertebrados (Luría-Manzano et al., 2018).
Existen vacíos de información sobre la ecología e historia de vida de muchas de las especies de anfibios (Posso-Peláez et al., 2017), como es el caso de Craugastor berkenbuschii (Peters, 1870), una especie endémica de México considerada especialista de hábitats rocosos ribereños en bosques tropicales y mesófilos de montaña (Pough et al., 2003). Se distribuye entre los 80 y 1900 m.s.n.m. en los estados de San Luis Potosí, Puebla, Veracruz, Tabasco y Oaxaca (Güizadoriparian ecosystems, endemic. Rodríguez et al. 2010), y se encuentra protegida por la NOM 059 SEMARNAT-2010 bajo la categoría de "Protección especial" (Pr), y catalogada por la Unión Internacional para la Conservación de la Naturaleza (UICN) en "Preocupación menor" (Fernández-Badillo et al., 2020). A pesar de ello no existen estudios poblacionales que hagan referencia al uso de microhábitat y diversidad de presas consumidas por esta especie, por lo que el objetivo de la presente investigación fue determinar el uso de microhábitat para las diferentes clases etarias entre épocas climáticas y comparar la diversidad de presas consumidas por los machos y hembras adultas de C. berkenbuschii en un arroyo tropical en Tabasco, México. Nuestras predicciones fueron que: 1) los adultos de C. berkenbuschii utilizan un mayor número de microhábitats independientemente de la época climática, y 2) existen diferencias en la composición de las presas consumidas por las machos y hembras adultas de C. berkenbuschii.
MATERIALES Y MÉTODOS
Área de estudio
El área de estudio se localiza en la sierra del municipio de Huimanguillo, al sur del estado de Tabasco (17°19' N y 93°33' O), ubicada en la región fisiográfica conocida como Montañas del norte de Chiapas. La topografía es accidentada con pendientes de 25 a 75 % y un intervalo altitudinal de 200 a 1000 m.s.n.m. (Alejandro-Montiel et al., 2010). El clima predominante es cálido húmedo con lluvias todo el año (Af), con precipitación media anual de 3638 mm y temperatura media anual de 20,6 °C (Carvajal-Hernández et al., 2018). Las épocas climáticas presentes en el sitio de estudio son secas, lluvia o temporal y norte (West et al., 1985; Aceves-Navarro y Rivera-Hernández, 2019): la época de seca se caracteriza por presentar bajas precipitaciones (100 mm), altas temperaturas (27° C) y fuertes vientos conocidos como sures, esta época abarca los meses de marzo, abril y mayo; lluvia o temporal, se caracteriza por presentar fuertes precipitaciones (290 mm) y vientos alisios, esta época abarca los meses de junio, julio, agosto y parte de septiembre; y norte, se caracteriza por la disminución de temperatura (24° C), mayor número de días nublados y alta humedad relativa, debido a la presencia de frentes atmosféricos denominados nortes, esta época se extiende desde finales de septiembre al mes de febrero, aunque el periodo más lluvioso del año se presenta en los meses de septiembre a octubre.
En el área se encuentran dos tipos de vegetación: selva alta perennifolia y vegetación secundaria. La selva se caracteriza por presentar árboles de más de 45 m de altura como: caoba (Swietenia macrophylla King), ramón (Brosimum alicastrum Swartz), ceiba (Ceiba pentandra Gaertn), jobo (Spondias mombin L), zopo (Guatteria grandiflora Donn.Sm.) y palo mulato (Burserasimaruba L). En la vegetación secundaria predominan herbáceas, arbustos y árboles de entre 10 y 30 m de altura como: guarumo (Cecropia obtusifolia Bertol), guácimo (Guazuma ulmifolia Lam), jonote (Heliocarpus donellsmithii Rose), ciruelillo (Trichilia havanensis Jacq) y naranjillo (Bernardia dodecandra (Sessé ex Cav.) Govaerts). La superficie muestreada es atravesada por un arroyo rocoso conocido como "La Escalera", el cual tiene una anchura de 5-10 m y una profundidad promedio de 50 cm, aunque se pueden presentar pozas de formación natural de más de 1 m de profundidad y cascadas permanentes o temporales (Palma-López et al., 2011; Rodríguez y Banda, 2016).
Trabajo de campo
Se establecieron diez transectos sobre el arroyo de 100 m de largo por 15 m de ancho cada uno, dejando una separación de 25 m entre ellos con el fin de evitar la captura y lavado estomacal de los individuos previamente capturados. Los transectos fueron muestreados mensualmente durante un año, de septiembre 2017 a agosto 2018. Enero fue el único mes donde no se realizó trabajo de campo debido a condiciones meteorológicas desfavorables, lo cual impidió el acceso al sitio de estudio. Los recorridos se realizaron de 09:00 a 15:00 h y de 18:00 a 00:00 h, obteniendo un esfuerzo de muestreo de 1320 h/hombre (Rios-Rodas et al., 2020).
Para cada individuo observado de C. berkenbuschii se registró el sexo, clase etaria, microhábitat utilizado y época climáticas. El sexo se determinó mediante las excrecencias nupciales presentes en los machos adultos y el tamaño del tímpano, cuyo diámetro en el caso de los machos equivale al 80 % con relación al diámetro del ojo, mientras que en las hembras es del 40 % (Campbell y Savage, 2000; Lynch, 2000), para el caso de las crías, se utilizó una lupa y fotografías digitales para la observación del tamaño relativo del tímpano. Debido a que la especie de estudio presenta desarrollo directo, se determinó la categoría de edad de los individuos con base en la longitud hocico-cloaca (LHC) mencionada por Campbell y Savage, (2000) y Lynch (2000): crías (organismos recién eclosionados) < 20 mm, juveniles de 21 a 37 mm y adultos de 38 a 83 mm. Como microhábitat se registraron los sustratos en los cuales fueron encontrados los individuos durante el estudio.
Para identificar las presas consumidas por los machos y hembras adultas de C. berkenbuschii, se realizaron lavados estomacales in situ al momento de la captura mediante la técnica descrita por Solé (2005), modificando el tamaño de las jeringas utilizadas, para ello se utilizaron jeringas de 20 y 35 ml según el tamaño del individuo, con el objetivo de causar el menor daño posible. El agua para los lavados se tomó del arroyo donde se capturaron las ranas. Una vez terminados los lavados estomacales los individuos fueron liberados en el sitio de captura. Posteriormente, se desinfectó el material con una solución de hipoclorito con el fin de evitar la propagación de enfermedades infecciosas. Los contenidos estomacales obtenidos fueron etiquetados y almacenados en frascos con alcohol etílico al 70 % para su posterior determinación. Las presas fueron determinadas hasta el nivel de orden, con la ayuda de las claves taxonómicas de Triplehorn y Johnson (2005).
Análisis de datos
La proporción de sexos de C. berkenbuschii por clases etarias se determinó al dividir el número de machos entre el número de hembras (Morláns, 2004). Posteriormente se realizó una chi-cuadrada utilizando a las clases etarias y el sexo como variables independientes para determinar si la categoría de edad influye en la proporción de sexos. Las diferencias estadísticas en la frecuencia de uso de microhábitats por clases etarias y épocas climáticas se determinaron usando la prueba no paramétrica Kruskal-Wallis, donde se utilizó como variable de respuesta la abundancia y como variable independiente los microhábitats, seguida de una prueba post-hoc para identificar los microhábitats donde se presentaban las diferencias, esto con ayuda del programa estadístico Statgraphics Centurion 18 versión 18.1.13. La diversidad de presas consumidas por sexos se calculó a través del índice de diversidad verdadera o números de Hill de orden 1 (1D), en el cual todas las categorías de presas son consideradas en el valor de diversidad, ponderadas proporcionalmente según su abundancia. La distintividad taxonómica de las presas consumidas por machos y hembras se comparó a través de los siguientes niveles taxonómicos: reino, filo, subfilo, clase, subclase y orden; con los cuales se calculó el índice de distintividad taxonómica promedio (A+), el cual mide el grado de la relación taxonómica neta de una comunidad independientemente del número de muestras (Warwick y Clarke, 1995; Gerónimo-Torres et al., 2022). La frecuencia de ocurrencia de presas consumidas entre machos y hembras adultas se comparó con las curvas de rango-abundancia (Feinsinger y Ventosa-Rodríguez, 2014; Magurran, 1998), para ello se transformaron las frecuencias de presas con el logaritmo base 10. Finalmente se evaluó la similitud de la dieta consumida por los machos y las hembras a través del índice de Sorensen y la completitud de las presas consumidas se determinó a través del estimador no paramétrico Bootstrap (Moreno, 2001).
RESULTADOS
Durante el tiempo de muestreo se registraron un total de 437 individuos, de los cuales 165 fueron adultos, 162 juveniles y 110 crías, con una proporción de sexo sesgada a favor de las hembras para las tres clases de edades (Adultos: M [31]: H [134]= 0,23:1; juveniles: M [53]: H [109] = 0,49:1; crías: M [38]: H [72]= 0,53:1). De acuerdo con el análisis estadístico de chi cuadrada las categorías de edades sí presentan diferencias estadísticamente significativas con respecto al sexo (X 2 = 11,09; gl=2; p<0,05).
Uso de microhábitats
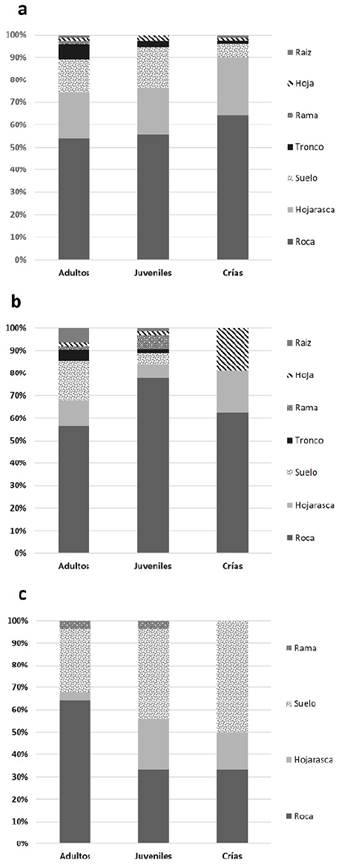
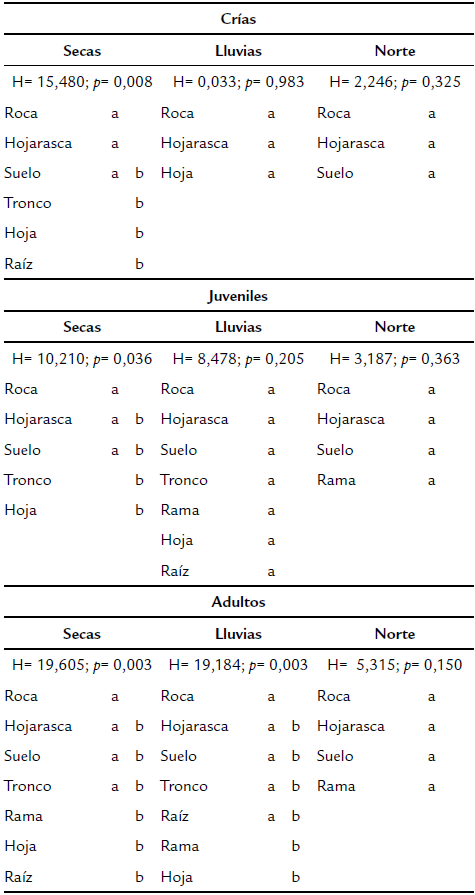
En la temporada de seca, se identificaron para las crías un total de seis microhábitats utilizados: roca, hojarasca, suelo, tronco, hoja y raíz, donde los sustratos roca y hojarasca presentaron diferencias estadísticamente significativas con los sustratos tronco, hoja y raíz (H = 15,480; p= 0,008); para los juveniles se identificaron un total de cinco microhábitats: roca, hojarasca, suelo, tronco y hoja, donde el sustrato roca presentó diferencias con los sustratos tronco y hoja (H= 10,210; p= 0,036); para los adultos se identificaron un total de siete microhábitats: roca, hojarasca, suelo, tronco, rama, hoja y raíz, donde el sustrato roca presentó diferencias con los sustratos rama, hoja y raíz (H= 19,605; p= 0,003) (Tabla 1; Fig. 1a).
En la temporada de lluvia, se identificaron para las crías un total de tres microhábitats: roca, hojarasca y hoja, entre los cuales no se presentaron diferencias (H= 0,033; p= 0,983); para los juveniles se identificaron un total de siete microhábitats: roca, hojarasca, suelo, tronco, rama, hoja y raíz, donde al igual que las crías no presentaron diferencias (H= 8,478; p= 0,205); para los adultos se registraron los mismos microhábitats utilizados por los juveniles, encontrando diferencias significativas entre el sustrato roca con respecto a los sustratos rama y hoja (H= 19,184; p= 0,003) (Tabla 1; Fig. 1b).
En la temporada de norte, se identificaron para las crías un total de tres microhábitats: roca, hojarasca y suelo, entre los cuales no se presentaron diferencias (H = 2,246; p= 0,325); en el caso de los juveniles y adultos se registraron cuatro microhábitats: roca, hojarasca, suelo y rama, donde al igual que en las crías no se presentan diferencias (juveniles: H= 3,187; p= 0,363; adultos: H = 5,315; p= 0,150) (Tabla 1; Fig. 1c).
Diversidad de presas
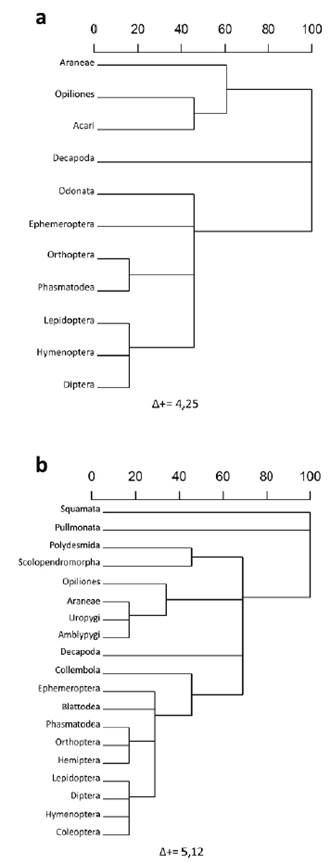
Se realizó el lavado estomacal a 79 individuos adultos, entre los cuales 67 (12 machos; 55 hembras) tenían al menos un tipo de presa. Se registró un total de 21 órdenes de presas consumidas, entre los cuales 19 órdenes fueron encontrados en las hembras y 11 en los machos (Tabla 2). Numéricamente, en los machos los órdenes Orthoptera y Opiliones fueron los taxones dominantes, seguidos de Araneae, Decapoda y Diptera. En las hembras, Hymenoptera fue el orden dominante numéricamente, seguido de Orthopera, Coleoptera, Opiliones y Araneae. Para ambos sexos se registraron órdenes con un solo registro, en el caso de los machos fueron cuatro y para hembras nueve (Fig. 2). De acuerdo con el índice de diversidad verdadera (1D), la diversidad de presas consumidas fue similar para machos y hembras, con valores de 9,67 y 9,08, respectivamente. Sin embargo, según el índice de distintividad taxonómica promedio (A+), la mayor diversidad taxonómica de presas la obtuvieron las hembras con 5,12 y la menor los machos con 4,25 (Fig. 3). El análisis de similitud de presas consumidas mostró un valor de 0,53, al compartir nueve órdenes de presas. Las curvas de rango-abundancia muestran que la composición y abundancia de las presas consumidas por C. berkenbuschii presentan patrones diferentes entre machos y hembras (Fig. 2). El estimador Bootstrap calculó para los machos una riqueza de órdenes consumidas de 13,10 y para las hembras 22,70 con una completitud de presas del 83,97 y 83,70 % respectivamente.
DISCUSIÓN
La proporción de sexos sesgada a favor de las hembras adultas de C. berkenbuschii pudo haber estado relacionada con la facilidad de localizar a un mayor número de hembras que de machos, debido a la diferencia en el tamaño corporal, ya que las hembras son aproximadamente 45 % más grandes que los machos (Campbell y Savage, 2000). Este resultado difiere para la mayoría de los estudios realizados en anuros, en los cuales hay un sesgo a favor de los machos atribuido a un efecto de muestreo, en el que las vocalizaciones emitidas sirven de guía para ubicarlos y capturarlos con mayor frecuencia (Martínez-Coronel y Pérez-Gutiérrez, 2011; Ortega-Andrade et al., 2011), lo que no ocurre con C. berkenbuschii, debido a que los machos no emiten vocalizaciones como la mayoría de los anuros. Sin embargo, el sesgo a favor de las hembras estuvo presente en todas las clases de edades, aunque en proporciones más equitativas que en el caso de los adultos, lo que sugiere que en la población estudiada son más abundantes las hembras que los machos con una proporción de sexos de 0,38=1 (M [122]: H [315]).
Las características del área evaluada permiten que nuestra especie de estudio sea abundante, ya que a menudo se encuentra asociada a la presencia de arroyos con afloramientos rocosos y pendientes pronunciadas (Savage, 1975; Fernández-Badillo et al., 2020). A pesar de ser esta una especie terrestre con desarrollo directo, depende de un gran número de microhábitats húmedos para sobrevivir (Savage, 1975) tal y como se registró en nuestros resultados. Sin embargo, el microhábitat con mayor número de registros en nuestro estudio fue roca, tal como ya lo habían reportado Savage (1975) y Campbell y Savage (2000) en otras poblaciones de C. berkenbuschii y lo descrito por diversos autores para otras especies del grupo rugulosus (Ryan et al., 2008; Pineda y Rodríguez-Mendoza, 2010; Zumbado-Ulate et al., 2011). El uso de microhábitat por parte de los anfibios está condicionado por sus requerimientos tróficos y ecofísiológicos (Green, 2003), los cuales podrían estar relacionados con la edad de los individuos, como lo observado en nuestros resultados durante las épocas del año y entre las diferentes clases etarias. Al igual que Savage (1975), registramos una alta abundancia de crías en la época de seca y se encuentran principalmente en roca y hojarasca, esta última podría ser utilizada como refugio contra sus depredadores, y al mismo tiempo suministrarles alimento, y permitir regular la temperatura y humedad, variables que influyen en la dinámica depredador-presa en la hojarasca y que evita la desecación de la piel en las ranas (Duellman y Trueb 1994; Oliveira et al., 2013; Vitt y Caldwell, 2013; Walton, 2013; Cruz-Elizalde et al., 2016).
Tabla 2 Tipo y cantidad de presas consumidas por hembras y machos adultos de C. berkenbuschii.
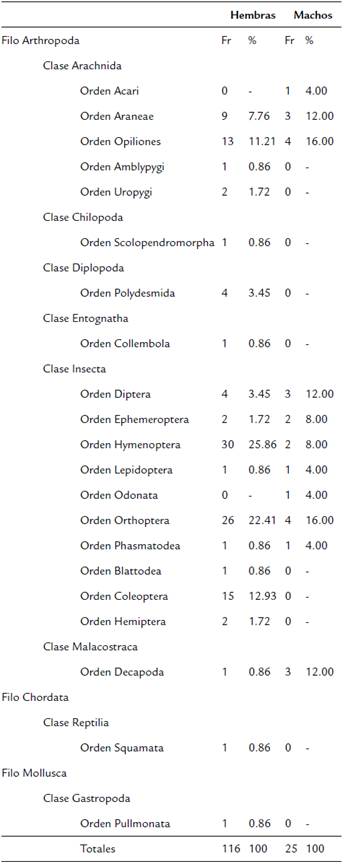
Fr= Frecuencia de ocurrencia
En nuestro estudio C. berkenbuschii mostró un bajo porcentaje de individuos sin contenidos estomacales (15,2 %), en comparación con los valores reportados para sus congéneres: C. raniformis Boulenger, 1896 con 47,6 % (Blanco-Torres et al., 2015), C. lineatus Brocchi, 1879 con 28,9 % (Martínez-Coronel y Pérez-Gutiérrez, 2011) y C. alfredi Boulenger, 1898 con 27,2 % (Luría-Manzano y Ramírez-Bautista, 2017), pero similar a lo registrado para C. rhodopis Cope, 1867, el cual fue de 14,3 % (Luría-Manzano et al., 2019). Es probable que esto se deba al hecho de realizar los lavados estomacales al momento de la captura, lo que aumenta la posibilidad de encontrar contenido. Aunado a que la mayor actividad de los insectos nocturnos que se encuentran en las cercanías de cuerpos de agua tiende a ser en las primeras horas de la noche (O'Donnell, 2000; Braun, 2011). En cuanto a las presas consumidas C. berkenbuschii registró un valor alto de diversidad (M: 9,67; H: 9,08), comparado con lo descrito por Martínez-Coronel y Pérez-Gutiérrez (2011) para C. lineatus y por Blanco-Torres et al. (2015) para C. raniformis con 2,3 y 6,8, respectivamente. Estos hallazgos en la dieta de C. berkenbuschii, sugieren que la especie utiliza una estrategia de forrajeo de acecho (sit-and-wait), la cual está basada en una dieta oportunista, que consiste en consumir un menor número de presas de mayor tamaño (Vidal y Labra, 2008).
La similitud de presas consumidas entre machos y hembras fue baja con respecto a otros estudios realizados para anfibios (Crnobrnja-Isailovic et al., 2012; Rodrigues y dos Santos-Costa, 2014; Luría-Manzano et al., 2019). Lo anterior puede ser atribuido a las diferencias entre el número de muestras. Sin embargo, dicha disimilitud entre las presas consumidas por machos y hembras fue corroborado por el índice de distintividad taxonómica promedio, el cual atribuye un mayor valor de diversidad a las hembras. La incorporación de nuevas métricas de diversidad, como lo es la distintividad taxonómica promedio puede ayudar a entender aún mejor la historia natural de estos organismos, sin depender de las restricciones del tamaño de muestra.
Las presas consumidas por C. berkenbuschii fueron en su mayoría himenópteros, ortópteros, coleópteros y arácnidos. Estos grupos de artrópodos son comunes dentro de la dieta del género Craugastor (Martínez-Coronel y Pérez-Gutiérrez, 2011; Blanco-Torres et al., 2015; Luría-Manzano y Ramírez-Bautista, 2017; Luría-Manzano et al., 2019) y en otras ranas de hojarasca como Ischnocnema henselii Peters, 1870 (Dietl et al., 2019), Haddadus binotatus Spix, 1824 (Coco et al., 2014) y Pristimantis labiosus Lynch, Ruíz-Carranza y Ardila-Robayo, 1994 (Gutiérrez-Cárdenas et al., 2016), además de ser reconocidas como presas con alto contenido proteico para ranas de talla grande (Anderson y Smith, 1998; Dietl et al., 2009; Klaion et al., 2011). Las presas consumidas con mayor frecuencia por las hembras fueron himenópteros, donde los más abundantes dentro de este grupo fueron los formícidos. De acuerdo con Lima (1998), los formícidos son insectos considerados presas de talla mediana, por lo que los adultos suelen consumir un alto volumen para compensar sus exigencias alimenticias (Almeida-Gomes et al., 2007). Así mismo, Lima y Moreira (1992) consideran que el tamaño de la rana presenta una correlación positiva con el tamaño de la presa, ya que se ha observado que el volumen de formícidos incrementa con el tamaño del individuo, lo que ocurre con las hembras de nuestro estudio. Si bien muchas de las presas consumidas por C. berkenbuschii han sido documentadas como alimento para otras especies de anfibios, los órdenes Pulmonata, Scolopendromorpha, Uropigy y Squamata son por primera vez reportadas como presas para el género Craugastor.
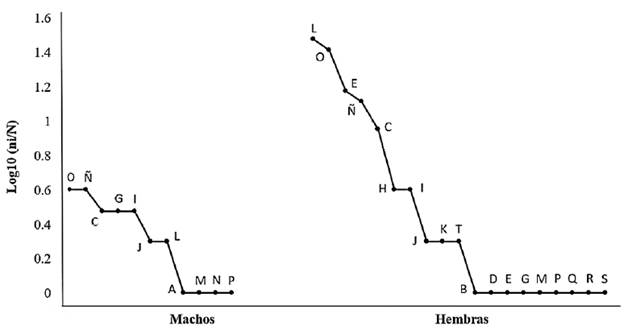
Figura 2 Curvas de rango-abundancia de las presas consumidas por machos y hembras de C. berkenbuschii. Acari (A), B (Amplipigy), Araneae (C), Blattodea (D), Coleoptera (E), Collembola (F), Decapoda (G), Polydesmida (H), Diptera (I), Ephemeroptera (J), Hemiptera (K), Hymenoptera (L), Lepidoptera (M), Odonata (N), Opiliones (Ñ), Orthoptera (O), Phasmatodea (P), Pullmonata (Q), Scolopendromorpha (R), Squamata (S), Uropygi (T).
CONCLUSIONES
Los resultados obtenidos muestran que no se cumplió la predicción de que los adultos de C. berkenbuschii utilizan un mayor número de microhábitats sin importar la época climática, ya que la especie utiliza una gran variedad de microhábitats asociados a los arroyos independientemente de la clase etaria; sin embargo, el sustrato roca fue el más utilizado durante todo el año de muestreo. La gran variedad de presas consumidas, el bajo número de individuos sin contenido estomacal y la alta abundancia de C. berkenbuschii, sugiere que esta especie desempeña un papel importante en la dinámica de las poblaciones de invertebrados asociados a los ecosistemas ribereños. Así mismo se confirmó la predicción de que existen diferencias en la composición de las presas consumidas por las machos y hembras adultas de C. berkenbuschii. Por lo anterior, se recomienda continuar con los estudios sobre la biología y ecología de C. berkenbuschii que aporten información sobre las relaciones intra e interespecíficas para conservar y mantener la dinámica de uno de los ecosistemas más importantes del planeta, como lo es el ribereño.