INTRODUCCIÓN
La lesión hepática inducida por medicamentos, conocida por sus siglas en inglés como DILI (Drug-Induced Liver Injury), es el término designado a cualquier tipo de daño hepático secundario a la administración de medicamentos1, y es la principal causa de falla hepática en el hemisferio occidental 2. Es difícil estimar la verdadera incidencia de DILI en Colombia debido a la falta de estadísticas actualizadas de esta entidad; se tiene un registro de 44 casos colombianos entre 1996 y 2012, reportados por la Red Hispano Latinoamericana de Hepatotoxicidad3.
El medicamento más frecuentemente implicado en DILI es el acetaminofén, pero otros medicamentos también pueden asociarse a este fenómeno, como por ejemplo, amoxicilina/clavulánico, los antituberculosos y el diclofenaco 2,4. En cuanto a los antituberculosos, los de primera línea son los que más se han asociado a hepatotoxicidad, y en su orden son pirazinamida, isoniazida y rifampicina5. La frecuencia reportada de DILI causada por isoniazida y rifampicina es del 0,6 y 1,1%, respectivamente6.
Aun así, la mayoría de los casos por DILI se explican por características del individuo y no por propiedades de los medicamentos 7. Existen algunos factores de riesgo descritos, entre los cuales están la edad avanzada, el sexo femenino, el alcoholismo, el tabaquismo, la desnutrición, la infección por virus hepatotropos y la hipoalbuminemia 1,5,7.
El tratamiento estándar ante la lesión hepática inducida por medicamentos suele basarse en suspender los agentes causantes y hacer seguimiento bioquímico 1,8. En el caso del acetaminofén, el tratamiento de elección es la N-acetilcisteína (NAC), medicamento con actividad antioxidante directa e indirecta y con efectos antiinflamatorios importantes. Este agente reduce el daño por estrés oxidativo a nivel celular, mitocondrial y de membrana, regula la apoptosis e inhibe la liberación de citoquinas 2,8.
Está descrito que la NAC es de utilidad en DILI no causada por acetaminofén tanto para prevención como para tratamiento 9, sin embargo, pocas veces ha sido valorada específicamente en el caso de antituberculosos y las principales guías clínicas no lo recomiendan. Por tal motivo, se planteó realizar una revisión sistemática de ensayos clínicos que evalúen el uso de este medicamento en pacientes adultos en tratamiento con antituberculosos que presenten DILI, en comparación con el tratamiento estándar o placebo.
METODOLOGÍA
Protocolo y registro
El protocolo de esta revisión sistemática no fue inscrito en el Registro Internacional de Revisiones sistemáticas (International prospective register of systematic reviews: PROSPERO), sin embargo, está incluido en el material suplementario. Esta revisión se realizó siguiendo las recomendaciones de la Colaboración Cochrane10 y la publicación en concordancia con la lista de chequeo del PRISMA 2020 (Referred Reporting Items for Systematic Reviews and Meta-Analyses)11.
Criterios de elegibilidad
Se incluyeron ensayos clínicos controlados aleatorizados en los que se estudiaran pacientes adultos con DILI por antituberculosos, que hubieran evaluado el uso terapéutico de NAC, por cualquier vía de administración, comparado con el no uso de esta, y en los que se hayan evaluado los siguientes desenlaces: tiempo a la mejoría bioquímica de la hepatitis, estancia hospitalaria y mortalidad. No hubo restricciones de idioma ni por el estado de publicación. Se tuvieron en cuenta estudios publicados hasta diciembre de 2022. Se excluyeron artículos en los que se evaluara el uso de NAC como profilaxis para DILI por antituberculosos.
Estrategia de búsqueda
Entre diciembre de 2021 y diciembre de 2022 se realizó una búsqueda sistemática por parte de tres autores (AMB, AMC, AHV) con algoritmos de búsqueda (ver tabla 1) construidos en inglés, idioma utilizado para esta. Dichos algoritmos se utilizaron en las bases de datos PubMed (MEDLINE), LILACS, CINAHL, EMBASE, Registro CENTRAL de ensayos clínicos de Cochrane, Scopus, Scielo y Web of Science. Adicionalmente, se hizo una búsqueda en fuentes diferentes a bases de datos bibliográficas electrónicas, como contacto con investigadores, registros de ensayos clínicos en Clinicaltrials.gov, ISRCTN.com (International Standardised Randomised Controlled Trial Number), Clinicaltrialsregister.eu, ICTRP (International Clinical Trials Registry Platform), revisión en las agencias regulatorias como FDA (Food & Drug Administration) y EMA (European Medicines Agency) y se revisaron las referencias bibliográficas de artículos de revisión12.
Selección de estudios
Tres autores (AMB, AMC, AHV) examinaron de manera independiente títulos y resúmenes que resultaron de la búsqueda en bases de datos, los cuales fueron evaluados según los criterios de inclusión. Se obtuvieron los reportes completos de los títulos que cumplieron los criterios de inclusión o en los que hubo incertidumbre. Los autores luego leyeron el texto completo y definieron si cumplían con los criterios establecidos. Se registraron las razones de exclusión de los estudios. Ninguno de los autores fue cegado frente a los títulos, autores o instituciones de los ensayos.
Recolección de la información
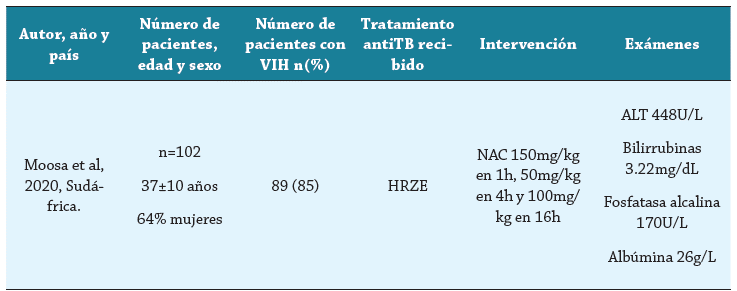
Se creó un formulario en Google Forms, en el cual tres autores (AMB, AMC, AHV) de manera independiente realizaron la extracción de la siguiente información: características sociodemográficas (edad, sexo), características clínicas (tiempo de estancia hospitalaria, mortalidad, infección por virus hepatotrópos, infección por VIH), características de laboratorio (albúmina en sangre, ALT, bilirrubinas, fosfatasa alcalina) y tipo de antituberculoso. Los resultados del formulario fueron puestos en común por parte de los tres autores, y si había discordancia, se llegaba a un consenso entre los mismos. Los resultados finales fueron diligenciados en una tabla en Microsoft Word.
Evaluación de riesgo de sesgos
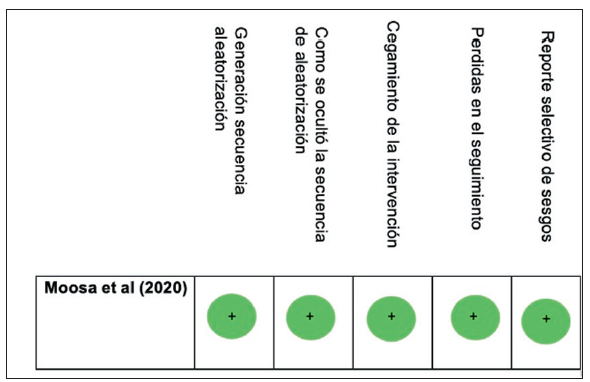
Para evaluar el riesgo de sesgos de los artículos cada investigador (AMB, AMC, AHV) evaluó individualmente los dominios de generación y cegamiento de la secuencia de aleatorización, cegamiento de las intervenciones, pérdidas en el seguimiento, y el reporte selectivo de desenlaces, por medio de la herramienta RoB 2.0 de Cochrane 13; en caso de haber algún desacuerdo, se resolvieron mediante un consenso entre los tres investigadores. El riesgo de sesgos se consideró bajo solo si todos los dominios fueron calificados como "bajo riesgo de sesgos".
Desenlaces
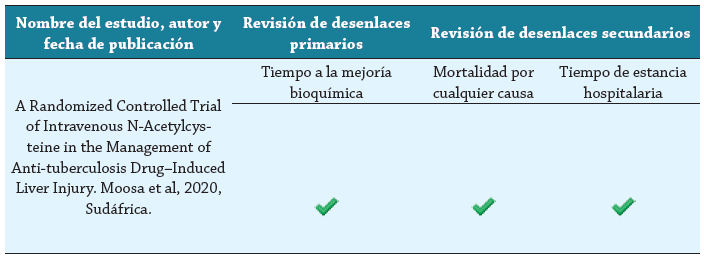
El desenlace primario fue tiempo a la mejoría bioquímica de la hepatitis; los desenlaces secundarios fueron tiempo de estancia hospitalaria y mortalidad por cualquier causa. Tres investigadores (AMB, AMC, AHV) evaluaron de manera independiente la presencia de los desenlaces en los estudios mediante la herramienta Outcome Reporting Bias Trials (ORBIT) 14; en caso de haber algún desacuerdo, se resolvió mediante un consenso por parte de los tres investigadores.
RESULTADOS
Selección de los estudios
La figura 1 muestra los resultados de la búsqueda y las razones de exclusión de los estudios. De 35 artículos encontrados, se excluyeron seis debido a que no eran ensayos clínicos 15-20, cinco en los que no se evaluaba la N-acetilcisteína como tratamiento para el DILI 5,15,21-23, dos en los que no se evaluaba el uso de N-acetilcisteína 24,25, y 21 resultados que correspondían a duplicados de otros artículos previamente revisados. La búsqueda a partir de fuentes diferentes a bases de datos bibliográficas electrónicas no arrojó ningún resultado. Solo uno cumplió con los criterios de inclusión 26. Las características del estudio incluido se muestran en la tabla 2.
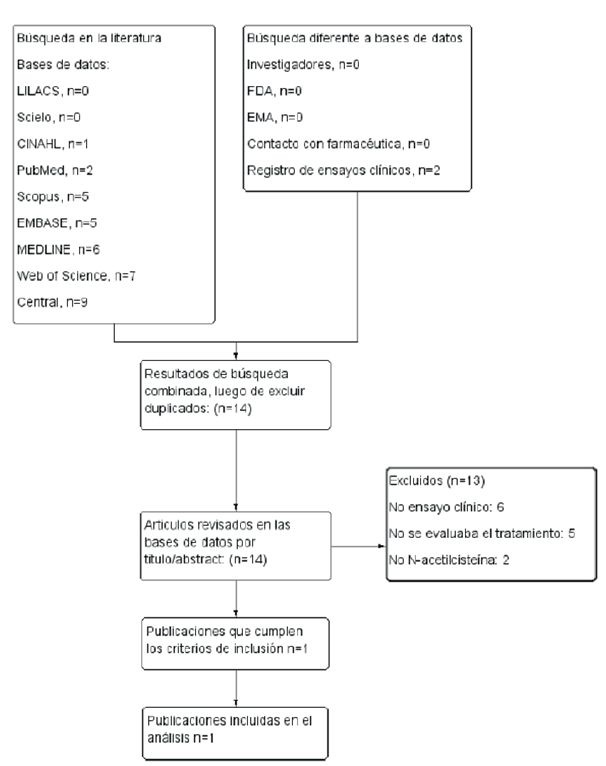
Fuente: elaboración propia de los autores.
Figura 1 Flujograma de selección de estudios y razones de exclusión
Características del estudio
El estudio seleccionado (Moosa et al.) fue un ensayo clínico controlado, aleatorizado, doble ciego, desarrollado en el contexto de la atención en tres hospitales públicos(New Somerset Hospital, Groote Schuur Hospital y Khayelitsha Hospital) de Ciudad del Cabo (Sudáfrica). Los participantes del estudio fueron aleatorizados en razón de 1:1 para recibir NAC intravenosa o placebo. Los desenlaces evaluados se muestran en la tabla 3.
Riesgo de sesgos en el estudio
El estudio se calificó como "bajo riesgo de sesgos" en todos los dominios de la herramienta RoB 2.013 (figura 2).
Resultados de estudios individuales
Todos los desenlaces estudiados en la revisión se evaluaron en el estudio incluido que reportó información de 102 pacientes. El tiempo a la mejoría bioquímica del grupo de la intervención tuvo una mediana de 7,5 días (RIQ 5,5-11) y en el grupo placebo tuvo una mediana de 8 días (RIQ 5-13), el HR fue de 1,03 (IC 95% 0,68-1,57).
El tiempo de estancia hospitalaria en el grupo de la intervención tuvo una mediana de 9 días (RIQ 6-15) y en el grupo placebo fue de 18 días (RIQ 10-25), con un HR de 1,73 (IC 95 % 1,13-2,65).
La mortalidad por cualquier causa no difirió entre los grupos y fue de 14%. No se reportó ninguna otra medida de resumen.
Los efectos adversos presentados fueron: náuseas (17 %), vómito, rash, prurito, dolor en el sitio de venoclisis y reacción anafilactoide, con un 2 % cada una.
DISCUSIÓN
La NAC es un compuesto que incrementa las concentraciones intracelulares de cisteína a través de mecanismos directos e indirectos, ya sea como profármaco que libera la cisteína por la acción de la enzima acilasa I, o a través de la modulación de los niveles de cisteína unida a proteínas plasmáticas y tisulares a través del intercambio de tiol. Se considera que NAC aumenta los niveles intracelulares de glutatión, que es un depurador no enzimático endógeno de radicales libres, al proporcionar el sustrato cisteína para su síntesis 27.
El desarrollo de DILI por antituberculosos está mediado por diferentes mecanismos, tanto dosis-dependientes como de hipersensibilidad o idiosincráticos. El mecanismo de hepatotoxicidad por pirazinamida no está dilucidado completamente; se ha considerado el efecto tóxico de su metabolito, el ácido 5 hidroxipirazinoico 28-30. La isoniazida es inicialmente metabolizada por la N-acetiltransferasa 2, que resulta en la formación de metabolitos no tóxicos (diacetilhidrazina) y tóxicos (hidrazina); este último, además de tener un efecto tóxico directo, participa en el desarrollo de estrés oxidativo, que también contribuye a la hepatotoxicidad 31. La rifampicina por sí sola tiene bajo potencial de hepatotoxicidad y su metabolismo no produce metabolitos tóxicos 32, sin embargo, puede tener un efecto sinérgico al ser administrada junto con isoniazida, debido a que puede activar ciertos procesos que desencadenan el aumento de metabolitos tóxicos de la isoniazida 31.
Resumen de los resultados
Esta revisión incluyó un artículo que evaluaba la eficacia de NAC en 102 adultos hospitalizados con DILI secundario al tratamiento con antituberculosos. La NAC, comparado con placebo, disminuyó el tiempo de estancia hospitalaria. No hubo diferencias significativas en el tiempo a la mejoría bioquímica ni en la mortalidad entre los grupos de intervención.
En general, se encontró que la N-acetilcisteína fue bien tolerada por los pacientes que la recibieron. Se consideró que los efectos adversos serios presentados durante el estudio no fueron relacionados a la administración del medicamento.
Calidad de la evidencia y aplicabilidad
En el único estudio encontrado, el riesgo de sesgos fue bajo de acuerdo con la herramienta Rob 2.0, sin embargo, debido al tamaño de la muestra, su estimado es impreciso.
No es posible evaluar la aplicabilidad de la intervención a partir de los resultados de nuestra revisión, sin embargo, se podría inferir que la NAC con sus propiedades antioxidantes y antiinflamatorias serviría para el tratamiento de DILI por agentes diferentes al acetaminofén, ya que su patogénesis incluye la formación de metabolitos reactivos, estrés oxidativo e inducción de vías de señalización proinflamatorias 1,33.
Además, se pueden extrapolar resultados de estudios de DILI no inducido por acetaminofén tratado con NAC. Se reporta que el uso terapéutico del medicamento en DILI causado por otros agentes con mecanismos de toxicidad similares a los del acetaminofén genera mejorías en la mortalidad y la condición clínica de los pacientes 34,35.
Adicionalmente, existen reportes de casos en que se usa la NAC en el tratamiento de DILI inducido por medicamentos con mecanismos de toxicidad diferentes a los del acetaminofén, entre estos la amiodarona y el norfloxacino, que han demostrado mejoría bioquímica y del cuadro clínico 33,36-38.
En un estudio prospectivo que evaluaba el rol de la NAC en pacientes adultos con DILI no inducida por acetaminofén, se incluyeron 3 pacientes en el grupo de intervención y 8 en el grupo de control cuya DILI era inducida por antituberculosos, y a pesar de que no se tienen los resultados específicos de estos pacientes, en general se encontró menor mortalidad y estancia hospitalaria con el uso terapéutico de NAC 34.
Otros estudios han estimado el efecto profiláctico de NAC en DILI inducido por antituberculosos tanto en humanos 5,39 como en modelos animales 40,41. Entre estos, un ensayo clínico abierto en el que se incluyeron 60 pacientes 5 y un ensayo clínico doble ciego en el que se incluyeron 88 pacientes 39, ambos encontraron una menor tasa de DILI, disminución en el tiempo de tratamiento y menores valores de transaminasas en el grupo intervención.
A partir de lo expuesto anteriormente se podría especular sobre la eficacia del uso terapéutico de este medicamento en cuadros de DILI inducido por antituberculosos.
CONCLUSIONES
No es posible concluir con confianza sobre el efecto terapéutico de la N-acetilcisteína en pacientes con DILI por antituberculosos, debido a que en esta revisión solo se analizó un estudio al respecto. Es pertinente incentivar el desarrollo de más ensayos clínicos que evalúen el beneficio de esta.