1. INTRODUCCIÓN
La producción de quinua en Colombia para el 2016 fue de 4350 Ha, de las cuales el 75% se cultiva en los departamentos del Cauca, Nariño y Cundinamarca, mientras que el 25% restante lo produce el departamento de Boyacá, con un rendimiento no mayor a 2 t.Ha-1. En países como Bolivia, Perú y Estados Unidos, el rendimiento supera las 4 t.Ha-1, con una participación en el marcado internacional del 42.5%, 41.5% y 6.7% respectivamente, mientras que Colombia, aporta un 0.02% [1]. Esta perspectiva permite reconocer entre otras cosas, las causas de la baja tecnificación del sistema agrícola que limitan la productividad, asociadas al desconocimiento de factores bióticos y abióticos que limitan el rendimiento en grano del cultivo.
Sin embargo, el desarrollo de este cultivo ha ido en aumento en diferentes partes del mundo, como respuesta a la necesidad constante de alimento abundante y de calidad; así, la búsqueda de especies que con facilidad se adapten a condiciones adversas de clima y suelo, ha sido la prioridad de centros de investigación, entidades públicas y privadas. Las plantas de quinua, tienen la capacidad de establecerse en climas que van desde los 0 hasta los 4000 msnm, con resistencia a heladas y bajas temperaturas.
Uno de los grandes problemas que aborda la agricultura en la actualidad es la salinización de los suelos, efecto del uso de fertilizantes altamente solubles aplicados a través del fertirriego, que para el caso de Colombia, se presenta en cultivos como la fresa (Fragaria spp), cebolla (Allium cepa) y tomate (Solanum lycopersicum L.) principalmente [2], dado a que altas dosis de fertilizantes en los cultivos, no logran ser absorbidos en su totalidad por las raíces de las plantas y por lo tanto, son acumulados en las zonas perimetrales del sistema radical, generando reducción en el potencial osmótico del suelo , dificultando la absorción de agua y en consecuencia de los nutrientes necesarios para el desarrollo de actividades fisiológicas, metabólicas y genéticas.
De acuerdo a lo anterior, la absorción de agua y nutrientes en las plantas se da activamente en su crecimiento, principalmente en el transcurso de las fases vegetativas, por lo que la condición de salinidad daría como resultado plantas con bajo porte, fases vegetativas prolongadas y en muchos casos la muerte por estrés hídrico, deficiencia de nutrientes y reducción de la biomasa [3]. Sin embargo, se ha reportado que varias especies de la familia Amaranthaceae son halófitas facultativas, es decir, pueden tolerar niveles moderados de salinidad (menores a 0,3 M). Tal es el caso de la quinua (Chenopodium quinoa Willd), que según Wu y colaboradores [4], muestra una excepcional adaptabilidad y desarrollo en suelos salinos, cuya extensión se ha venido incrementando y representan cerca de 390 millones de hectáreas en zonas áridas y semiáridas en todo el mundo [5]. Para Colombia particularmente, Casierra-Posada y colaboradores [6], afirman que cerca de 86592 Km2 de suelos aptos para la agricultura, son ahora susceptibles a tornarse salinos.
Por los motivos expuestos, el objetivo de este experimento fue evaluar el número de días hasta la formación de 6 y 8 hojas verdaderas, ramificación y aparición de panoja, así como el número de hojas y ramificaciones, longitud de tallo, contenido de clorofila, peso fresco y seco de raíz, tallo y hojas, conductividad eléctrica y pH del entorno de las raíces de Chenopodium quinoa expuestas a salinidad por cloruro de sodio.
2. MATERIALES Y MÉTODOS
El estudio fue desarrollado en el invernadero de Victoria Granja Agroecológica en el municipio de Ventaquemada - Boyacá (Colombia) a una altura de 2780 m y coordenadas 5°22'50.56" N, y 73°30'16.84" W. La temperatura promedio durante el ensayo fue de 17.2 °C, con humedad relativa de 73.2%, y una iluminación diaria media de 620±409 (imol m-2 s-1. Las semillas de Chenopodium quinoa accesión Soracá fueron obtenidas del banco de colección del grupo de investigación en Agricultura Organizaciones y Frutos (AOF) de la Fundación Universitaria Juan de Castellanos - Tunja (Colombia).
2.1 Sustrato
Las semillas fueron sembradas en macetas de 10 Kg en proporciones de suelo - Abono Orgánico Mineral Victoria 4:1 (Tabla 1). Cabe anotar que en el Municipio predominan suelos con características ándicas [8].
Tabla 1 Características químicas del sustrato utilizado para la siembra de las plantas de especie C. quinoa.

Métodos de análisis: MO: Walkey & Black; S y B: Fosfato monobásico de calcio; Micronutrientes: Olsen modificado; Bases de intercambio: acetato de amonio. MO: Materia orgánica; CIC: Capacidad de intercambio catiónico.
Fuente: Elaboración propia
2.2 Material vegetal
La semilla de quinua (C. quinoa Willd), accesión Soracá, es un cultivar predominante en el departamento de Boyacá, se caracteriza por tener tiempos a la germinación promedios de 24 horas; presencia de ramificaciones y panojas compactas o laxas dependiendo de las condiciones del clima y el suelo. Presenta ciclos productivos que van desde 140 hasta los 180 días, con contenidos de clorofila entre los 30 y 80 unidades SPAD, con semillas monospérmicas indehiscentes de color crema [1];[9].
2.3 Diseño experimental
Se aplicó un diseño completamente al azar con 6 repeticiones. Los resultados estadísticos se sometieron a prueba de normalidad por Shapiro-Wilk y homogeneidad por Batllett; la comparación de medias con prueba de Tukey (a=0.05), utilizando el programa R versión 3.3.1. Los tratamientos para inducir la salinidad con cloruro de sodio (NaCl) fueron soluciones T0: 0,0 M; T1: 0,1 M; T2: 0,2 M y T3: 0,3 M, siendo aplicadas gradualmente a partir de los 15 días después la siembra en un periodo de seis semanas.
2.4 Variables a evaluar
Durante el ensayo, la humedad del suelo de las macetas se mantuvo cercana a la capacidad de campo y se realizaron los siguientes registros:
- Número de días hasta la formación de 6 hojas verdaderas, 8 hojas verdaderas, ramificación y aparición de panoja: se contó el número de días a partir de la siembra para cada una de las fases a evaluar, teniendo como referencia la metodología propuesta por Sosa-Zuniga y colaboradores [10].
- Materia fresca y seca de tallos, raíz y hojas: se obtuvo en el momento de la aparición de panoja, separando la raíz, tallos y hojas para cada tratamiento, utilizando una balanza analítica (Eternity®). El secado se realizó con un horno (HSY-75) a 104°C por 24 horas.
- Número de hojas: se contó el número de hojas cada 15 días a partir de la primera aplicación de NaCl.
- Longitud de tallo: se midió tomando la distancia entre la base del tallo y el ápice apical de la planta, utilizando un flexómetro rígido.
- Número de ramificaciones: obtenido por conteo de los brotes laterales del tallo principal.
- Contenido de clorofila: registrado mediante el uso del equipo portátil SPAD 502 Plus, tomando hojas al azar de cada una de las plantas.
3. RESULTADOS Y DISCUSIÓN
3.1 Respuesta a fases fenológicas vegetativas
El desarrollo de las fases vegetativas de las plantas de C. quinoa mostró diferencias significativas entre las medias de cada uno de los tratamientos, a excepción del número de días hasta la formación de seis hojas verdaderas (Tabla 2), encontrando retraso en la manifestación de algunas fases vegetativas de las plantas que se sometieron a la aplicación de NaCl. Algo similar ocurrió en los días hasta la aparición de 8 hojas verdaderas, así como a la ramificación y a la aparición de la panoja. Además, se evidenció que las plantas sometidas al tratamiento T3 (0,3 M), no alcanzaron a llegar a la expresión de 8 hojas verdaderas, dado a que presentaron marchitez generalizada en los tejidos, seguida de necrosis y finalmente, la muerte.
Tabla 2 Respuesta de fases fenológicas vegetativas de plantas de Chenopodium quinoa Willd a salinidad por NaCl.

Todos los valores son medias con prueba de Tukey (p ≤ 0.05). ±: Error estándar. *: La variable no cumplió con supuestos y por tanto se realizó prueba de T3 de Dunnett. HV: hojas verdaderas; R: ramificación; AP: aparición de panoja.
De acuerdo con Torres y colaboradores [11], los días hasta la aparición a seis hojas verdaderas en plantas de C. quinoa, se da entre los 32 y 45 días después de la siembra, sin embargo reconocen que este rango puede variar, ya que la precocidad de las plantas depende de su expresión genética y de las condiciones de clima y suelo en que se desarrollen, lo que posibilita explicar la temprana aparición de esta fase fenológica en este ensayo y en este cultivar.
Por otro lado, la aparición de ocho hojas verdaderas y ramificación se encuentra dentro de los rangos propuestos por Melo [9], quien afirma que las condiciones del suelo y del clima determinan el comportamiento fenológico de esta especie, dado a que las condiciones de salinidad generadas durante el ensayo evidencian diferencias significativas al llegar a esta fase, coincidiendo con Casierra-Posada y colaboradores [3], quienes reportaron que la presencia de sales en el suelo de las plantas reduce el potencial osmótico, lo que efectúa limitaciones en la captura de agua y minerales, generando por consiguiente reducción en el crecimiento y desarrollo de las plantas. Lo anterior explica por qué los tratamientos T1 y T2 tardaron más tiempo al llegar a la aparición de la panoja, como consecuencia del alto gasto energético que requiere la planta para inducir esta fase y el impedimento de la planta para la toma de nutrientes como N, P y K, que a su vez facilitan la expresión de fitohormonas como las auxinas y giberelinas, indispensables en la división y elongación celular [12].
3.2 Número de hojas
En las plantas de C. quinoa, el número de hojas aumentó significativamente a través del tiempo, sin que se presentaran diferencias significativas entre los tratamientos, a diferencia de lo observado en la toma de datos del día 60 (Figura 1), donde el tratamiento testigo tuvo el mayor valor (124.8±5.73). Sin embargo, se observó que las plantas al llegar a formación de grano en el día 120, no mostraron diferencias significativas en el número de hojas, aunque, el tratamiento T1 (809±83,74) obtuvo mayor número de folios que el T0 (665±114,83), y el T2 (142±158,04); en tanto que en el tratamiento T3 la aplicación de NaCl generó posteriormente pérdida de hojas por necrosis y finalmente, la muerte de la planta.

Figura 1 Respuesta al número de hojas de C. quinoa bajo diferentes aplicaciones de NaCl, respecto a los días después de la siembra. *: Diferencias significativas entre tratamientos, ns: indica no diferencias significativas entre los tratamientos. Las barras representan el error estándar. Se muestra la ecuación del modelo cuadrático para cada uno de los tratamientos.
De acuerdo con Maliro y colaboradores [13], las elevadas concentraciones de salinidad en los suelos, afectan el comportamiento morfológico y fisiológico de plantas de C. quinoa, ya que reduce considerablemente la producción de biomasa y por consiguiente el rendimiento en grano, además de causar en algunos casos la muerte de las plantas; así, el tratamiento T3, muestra que los mecanismos de adaptabilidad a las condiciones salinas dadas, no fueron suficientes para sobrevivir. Sin embargo, en los demás tratamientos se observa que la producción de hojas fue exponencial, coincidiendo con Zurita-Silva y colaboradores [14], quienes muestran que en plantas de quinua sometidas a una moderada salinidad, la producción de prolina, prolamina y glicina-betaína propician ajustes osmóticos, así como también intervienen en la regulación y conductancia estomática así como en reducción del número de estomas. De esta manera, los resultados ponen en evidencia el potencial adaptativo y productivo de C. quinoa, en tanto que un alto número de hojas puede afectar positivamente la actividad fotosintética y en consecuencia varios aspectos productivos del cultivo.
3.3 Longitud de tallo
El análisis de varianza mostró que los tratamientos aplicados expresaron diferencias significativas en el crecimiento de los tallos (p ≤ 0.05), especialmente a partir de la ramificación (Figura 2). Se halló que la media del tratamiento T0, exhibió el mayor valor durante su crecimiento, manteniéndose así hasta la formación del grano (147.4±9.6 cm a los 120 días). Por el contrario, los tratamientos T1 y T2, los cuales tuvieron una altura a los 120 días después de la siembra de 121,83±2,27 cm y 99,16±5,07 cm respectivamente, fueron los de porte más bajo.

Figura 2 Comportamiento de la longitud del tallo de C. quinoa bajo diferentes aplicaciones de NaCl, respecto a los días después de la siembra *: Diferencias significativas entre tratamientos, ns: indica no diferencias significativas entre los tratamientos. Las barras representan el error estándar. Se muestra la ecuación del modelo cuadrático para cada uno de los tratamientos.
Por esta razón, el crecimiento de las plantas es un parámetro varietal que se encuentra íntimamente relacionado con aspectos genéticos y ambientales. Resaltando lo reportado por Chilo y colaboradores [15], condiciones como la salinidad, disminuyen la velocidad de crecimiento de C. quinoa, manifestando en los tallos estructuras muy delgadas y quebradizas, dado que el contacto físico de los pelos radicales con el cloruro de sodio induce plasmólisis de las células del tejido y necrosis localizada, lo que dificulta aún más el transporte de nutrientes hacia los diferentes órganos [16], además según lo observado en el tratamiento T3, se evidencia reducción en las características de longitud de tallo, lo que según Taiz y Zaiger [12], se debe a que las sales que ingresan a nivel intercelular en la planta, generan reducción en la turgencia celular por ósmosis y por ende pérdida de agua, que se refleja en el tamaño de los tejidos.
3.4 Número de ramificaciones
En los tratamientos estudiados, el número de ramificaciones emitidas a lo largo del crecimiento vegetativo mostró diferencias significativas a partir de los noventa días posteriores a la siembra, manteniéndose el tratamiento T0 como el de mayor número de éstas durante el desarrollo, superando al tratamiento T1 en un 8,81% y al tratamiento T2 en un 27,71% al final del ensayo. Además, como se observa en la Figura 3, el tratamiento T3 no logró desarrollar este tipo de estructuras, dado a que en días anteriores las plantas expresaron deshidratación seguida de necrosis general y muerte, atribuyéndose a que no soportaron la dosis de NaCl.

Figura 3 Respuesta al número de ramificaciones en C. quinoa bajo diferentes aplicaciones de NaCl, respecto a los días después de la siembra *: Diferencias significativas entre tratamientos, ns: indica no diferencias significativas entre los tratamientos. Las barras representan el error estándar. Se muestra la ecuación del modelo cuadrático para cada uno de los tratamientos.
Un factor de interés morfológico en las variedades de quinua, es que no todas desarrollan ramificaciones [16], y por ende determina la estructura de la panoja. Según García-Parra y colaboradores [1], la variedad de C. quinoa, manifiesta cambios en la arquitectura del panojamiento según las condiciones de clima y suelo, lo que indica que la variabilidad de esta especie se encuentra no solamente influenciada por factores genéticos, sino también por factores externos. De acuerdo a lo observado en la Figura 3, el número de ramificaciones aumentó durante el desarrollo.
Además, se encontró que en las fases finales del ensayo, hubo diferencias significativas entre los tratamientos, concordando con Núñez [17], quien afirma que la aparición de este tipo de estructuras incrementa el gasto y la demanda energética de las plantas, lo que evidenciaría un problema en condiciones salinas, con las consecuencias anteriormente discutidas.
3.5 Contenido de clorofila
La Figura 4 ilustra la respuesta del contenido de clorofila en los tratamientos aplicados a las plantas de C. quinoa, durante su desarrollo. Se halló que las medias no mostraron diferencias estadísticas significativas. Sin embargo, a partir de la ramificación, se encontró al tratamiento T2 como el de mayor incremento durante el desarrollo del ensayo.
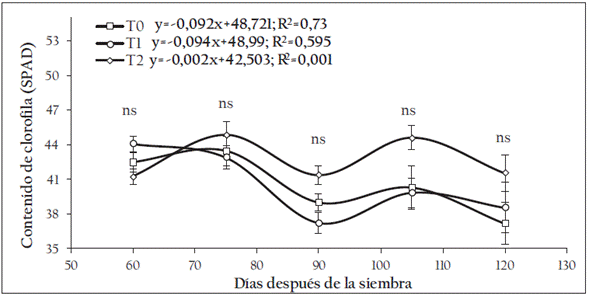
Figura 4 Comportamiento del contenido de clorofila en plantas de C. quinoa bajo diferentes aplicaciones de NaCl, respecto a los días después de la siembra *: Diferencias significativas entre tratamientos, ns: indica no diferencias significativas entre los tratamientos. Las barras representan el error estándar. Se muestra la ecuación del modelo lineal para cada uno de los tratamientos.
De acuerdo a lo evaluado por García-Parra y colaboradores [1], la accesión Soracá presenta contenidos de clorofila en rangos de 35 y 85 unidades SPAD, que pueden variar en función de las condiciones de clima y suelo. Sin embargo, según Riccardi y colaboradores [18], la adaptabilidad de las plantas de quinua es mayor en comparación con los cereales, en tanto que a altos contenidos de salinidad, la quinua expresa fuertes cambios en los contenidos de clorofila, influyente en el metabolismo y la producción de semillas.
3.6 Distribución de materia fresca y seca
Los valores de masa fresca y seca obtenidos en los diferentes tratamientos fueron variables (Figura 5).

Figura 5 Respuesta del peso fresco y seco de la raíz, tallo y hojas de plantas de C. quinoa bajo diferentes aplicaciones de NaCl, Las barras representan el error estándar.
El tratamiento T0 presentó masas superiores en materia fresca en comparación a los tratamientos T1 y T2; mientras que los valores obtenidos para materia seca, el tratamiento con mayor promedio fue el T2, mientras que el valor de la materia seca de tallo superó en 1,10% al del tratamiento T1 y en 8,03% al del tratamiento T0.
De acuerdo con los resultados de la materia fresca, se infiere que la acumulación de agua en los tejidos vegetales se debe a la constante división celular durante el crecimiento y desarrollo de las plantas, puesto que las vacuolas aumentan su potencial de reserva hídrica [19], lo que permite el aumento significativo con el transcurso del tiempo. Sin embargo según Casierra-Pasada y colaboradores [6], las plantas expuestas a salinidad presentan significativas lesiones necróticas que se dan a raíz de la exposición a esta particularidad, afectando la producción de biomasa, dado a que la incorporación de las sales a nivel intercelular es difícilmente incorporada en el metabolismo de las plantas. Sin embargo, especies como Tecticornia medusa ha desarrollado estrategias morfológicas que le permiten modificar el tamaño de las hojas y mantener los tallos suculentos para comportarse como planta halófita, gracias a la existencia de concentraciones de Na + y Cl - al interior de los tejidos, facilitando la absorción de agua y la producción de biomasa [20], mientras que para el caso de algunas especies de Amaranthaceae, la producción de prolina facilita la condición de halófita facultativa y la homeostasis interior, reduciendo el efecto de la salinidad y la variación en la producción de materia seca y fresca [21].
3.7 Conductividad eléctrica y pH
Factores como el potencial de hidrógeno y el contenido de sales en el suelo, son aspectos de importancia agrícola, principalmente por el efecto que tienen sobre la expresión de las plantas y los organismos edafícolas. De acuerdo con la Figura 6, el análisis de varianza mostró diferencias significativas para el pH de los sustratos de cada uno de los tratamientos. La media del pH fue menor para el tratamiento T3 que la del T2, T1 y T0. Además, se observó que la conductividad eléctrica, muestra diferencias entre los tratamientos a medida que aumenta la dosis de cloruro de sodio (NaCl).

Figura 6 Comportamiento de la conductividad eléctrica y el pH en los sustratos de las especies C. quinoa sometidos diferentes aplicaciones de NaCl. Las barras indican el error estándar. Letras iguales indican ausencia de diferencias significativas.
De acuerdo con Eisa y colaboradores [22], la presencia de sales en el suelo es la principal condición de aumento de la conductividad eléctrica, en tanto que el potencial osmótico se ve afectado, y por ende la toma de agua y nutrientes por parte de plantas de la especie Chenopodium album. A pesar de ello, es de resaltar la capacidad de tolerancia a condiciones difíciles de suelo que ha desarrollado el género de plantas entre las que se encuentra la quinua [23]. Según Bazile y colaboradores [24], la capacidad de tolerancia a esta condición del suelo, se ha obtenido a través de cruzamiento natural con parentales que son halófitos; razón por la cual existen grupos agroecológicos de quinua que son específicos para los salares y para el nivel del mar, donde las concentraciones de sal en el suelo son mayores. Además, de acuerdo con lo descrito por Eisa y colaboradores [25], se reconoce el nivel máximo de tolerancia de salinidad para algunas variedades de quinua, mientras no supere los 20 dS. m1, lo que es consistente con lo obtenido en el tratamiento T3 del ensayo, donde se registró la muerte de todos los individuos. De acuerdo con García [26], los cambios de pH pueden no ser afectados por las concentraciones de sal en el suelo, ya que intervienen otros factores. Sin embargo, también pueden manifestarse efectos de antagonismo y sinergismo de los elementos en el suelo afectando por ende la disponibilidad de los mismos para las plantas.
CONCLUSIONES
La salinidad en suelos agrícolas ha venido aumentando significativamente, por tanto el cultivo de la quinua es una de las principales especies con mayor adaptabilidad a esta condición edáfica, tolerando niveles máximos de 15,2 dS.m1.
La producción de materia seca y fresca no se vio afectada significativamente por la condición de salinidad en el suelo, lo que permite cultivar quinua bajo tales condiciones, útil en diferentes sistemas de producción agropecuaria.
Finalmente, aunque las aplicaciones de cloruro de sodio para los tratamientos T0, T1 y T2 fueron en incremento y se encontraron diferencias significativas, se puede afirmar que la salinidad sí afecta el crecimiento y desarrollo de la quinua, siendo más notorio en el tratamiento T3, confirmando que conductividades eléctricas superiores a 20 dS. m-1, generan la muerte de plantas de Chenopodium quinoa Willd.














