Introducción
Los bosques tropicales se consideran los ecosistemas terrestres más importantes del planeta, debido a su extensión geográfica, complejidad ecológica, alta biodiversidad y tasas de endemismo (Myers et al., 2000; Pan et al., 2013). Esto hace que desde hace mucho tiempo se vengan realizando investigaciones dirigidas a comprender los procesos que tienen lugar en los ecosistemas (Kraft et al., 2008; Quinto et al., 2022). En algunos de los estudios realizados en bosques tropicales se ha indicado que la variación en composición y diversidad sobre los gradientes ambientales puede ser una consecuencia de la adaptación diferencial al suelo, clima y otros factores (p. ej. ensamblaje de nicho; Loke y Chisholm, 2023), junto con los efectos de la distancia geográfica y la limitación de la dispersión de las especies la diversidad tiende a variar con la escala climática y de suelo (Quinto y Moreno, 2014; González-Caro et al., 2020).
Sin embargo, en los últimos años con el aumento del precio del oro la actividad minera se ha intensificado, a tal punto que se ha convertido en uno de los principales impulsores de deforestación en bosques tropicales (Alday et al., 2010; Asner et al., 2013; Mosquera-Andrade, 2014); debido a que, durante su implementación se eliminan los compartimentos que sustentan la vida de los ecosistemas vulnerados (Alday et al., 2010). Asimismo, se erosionan los agregados del suelo, la textura cambia, se reduce el contenido de humedad, los nutrientes se lixivian, el sustrato se contamina con desechos sustancias toxicas incluyendo el mercurio (Hg), la vegetación se reduce y los procesos ecológicos asociados se ven afectados (Álvarez-Berríos y Mitchell-Aide, 2015).
Algunas estimaciones han permitido dimensionar los impactos de la minería a los ecosistemas boscosos; por ejemplo, Mosquera-Andrade (2014) reportó una pérdida de 7200 ha/año de bosques en el departamento del Chocó, mientras que Espejo et al. (2018) informaron tasas de deforestación de 8000 ha/año para bosques de la Amazonía colombiana, lo cual es preocupante si se tiene en cuenta que gran parte de las cifras asociadas a la minería ilegal no reposan en bases de datos (Lara-Rodríguez et al., 2020), lo que hace que se subestimen las áreas deforestadas durante la actividad minera (Fuentes et al., 2021).
A pesar de los notables efectos impuestos por la minería sobre el suelo y la pérdida de la diversidad, a la fecha el estudio de ¿cómo se recupera la vegetación y la diversidad en áreas post-minería?, el problema ha recibido poca atención (Ramírez et al., 2019). Al respecto, la mayoría de las investigaciones en la materia se han ocupado de evaluar aspectos como el proceso de revegetación natural de las minas sin tener en cuenta factores ambientales (Ramírez et al., 2019; Valois-Cuesta et al., 2022), la respuesta de la vegetación a la adición de nutrientes (Oktavia et al., 2015; Kalamandeen et al., 2020; Viana-Cunha et al., 2022) y el estudio del contenido nutricional del suelo sin incluir la vegetación (Quinto et al., 2022). Sin embargo, para los bosques pluviales de tierras bajas de Colombia, es poco lo que se conoce acerca de cómo la composición y la diversidad florística y como esta se explica por los factores espaciales y ambientales.
El propósito de esta investigación fue analizar la diversidad de especies leñosas y su relación con variables ambientales en bosques post-minería del Chocó Biogeográfico, la cual estuvo guiada por las siguientes preguntas de investigación (i) ¿existen diferencias en los patrones estructurales y de diversidad entre los bosques post-minería de 15 y 30 años? y (ii) ¿Cuáles son los determinantes ambientales y espaciales de la similitud en composición florística de los dos bosques post-minería?
Materiales y métodos
Área de estudio
El estudio se realizó en la parte norte del Chocó Biogeográfico, ubicada en el extremo nor-occidental de Sudamérica que abarca desde la Serranía del Darién en los límites entre Panamá y Colombia, hasta el norte del Ecuador en la Provincia de Esmeraldas. Esta región está delimitada por la cordillera occidental de los Andes en Colombia y el Océano Pacífico. La región es conocida principalmente por ser una de las áreas con mayor pluviosidad del mundo (hasta 11,000 mm/año de precipitación promedio). Actualmente, gran parte de la región se encuentra cubierta principalmente por bosques primarios continuos en buen estado de conservación, que incluye un amplio rango de altitud (desde 0-4000 msnm) y paisajes especialmente en las tierras bajas (desde bosques de tierra firme bien drenados hasta bosques pantanosos). También incluye diferentes tipos de bosque en un gradiente de altitud que alcanza los 3000 msnm (Poveda et al., 2004).
Los datos para el análisis se levantaron en un área boscosa previamente degradadas por minería a cielo abierto de oro, en la localidad de Jigualito, municipio de Condoto (Coordenadas: 5°06’01” N y 76°32’44” W). Tiene una precipitación promedio de 8000 mm anuales, una altitud de 70 m y topografía plana (Poveda et al., 2004).
Los suelos son Ultisoles, pero debido a la minería han cambiado su estructura original, caracterizándose por presentar material rocoso y arenoso. Además, son ácidos con altos contenidos de materia orgánica - MO, nitrógeno - N total, fósforo - P disponible, aluminio - Al y arcilla; mientras que, las concentraciones de calcio - Ca, potasio - K, magnesio - Mg, capacidad de intercambio catiónico - CICE y limo, son muy bajas en áreas de reciente actividad minera, pero su contenido es mayor en áreas con más tiempo de recuperación (Quinto et al., 2022).
Establecimiento de parcelas
Se establecieron 10 parcelas permanentes de 50 x 50 m (2500 m2) en bosques post-minería de 15 y 35 años luego, dentro de cada unidad de muestreo se instalaron 25 cuadrantes de 10 x 10 m (100 m2), en los cuales se realizaron las mediciones de suelos, diversidad y estructura.
Medición de diámetros y altura de los árboles
En las parcelas establecidas se midió el diámetro a la altura del pecho (DAP) a todos los árboles con DAP ≥ 5 cm. Estas mediciones se realizaron en la parte cilíndrica del árbol, en áreas libres de nudos, ramas, bambas o raíces adventicias. El perímetro del tronco del árbol donde se midió el DAP se marcó con pintura asfáltica amarilla para garantizar que todas las mediciones se realizaran en la misma zona de la primera medición. La altura de los árboles se determinó con un clinómetro Sutton, a distancias fijas de 10 metros de los individuos. Los datos de diámetro y altura de los árboles se promediaron a nivel de unidades de cuadrante.
Identificación taxonómica y clasificación en grupos funcionales
Se identificaron todas las morfoespecies hasta el máximo nivel taxonómico posible (especie, género, familia botánica). Esta identificación se llevó a cabo utilizando claves especializadas y por confrontación con el material depositado en la colección del herbario Chocó de la Universidad Tecnológica del Chocó (Torres-Torres et al., 2016). Deberían indicar si hicieron depósito formal del material colectado. Con esta información se determinó la riqueza de especies, abundancia de individuos (Quinto y Mosquera, 2014). Los cálculos de diversidad se realizaron a nivel de unidades de muestreo, para comparar en la misma escala con las demás variables ambientales.
Muestreo de suelos
En cada cuadrante se tomaron muestras de suelos a 20 cm de profundidad, con un barreno cilíndrico. Las muestras se enviaron al Laboratorio de Biogeoquímica de la Universidad Nacional de Colombia sede Medellín, en donde se determinaron los parámetros fisicoquímicos del suelo, empleando las siguientes técnicas: textura con el método de Bouyoucos, pH con potenciómetro de suelo: agua 1:2; MO con el método de Walkley y Black y volumetría; nitrógeno con el método de Micro-Kjeldahl; fósforo con Acido L ascórbico y espectrofotómetro UV - VIS; y Ca, Mg, K con el método de acetato de amonio 1N, neutro y absorción atómica (Quinto y Moreno, 2017).
Diversidad y distribución de abundancia de especie
Se utilizaron curvas de especies individuos y especies áreas para describir los patrones generales de diversidad, basado en la riqueza de especie a escala de parcelas (Duque et al., 2016). Seguidamente, se analizó la distribución de abundancia de especies (SAD) a escala de parcela (Duque et al., 2016). Para esto último, se utilizó el método de máxima verosimilitud para ajustar el lognormal y logseries a cada distribución (Prado y Miranda, 2013). Los modelos se clasificaron utilizando el criterio de información de Akaike (AIC, por sus siglas en inglés), que permite comparar diferentes modelos estadísticos y seleccionar el mejor entre ellos (para este caso el mejor ajuste de distribución; Duque et al., 2016).
Determinantes ambientales y espaciales de la similitud florística
Se utilizó un procedimiento de ordenación de escala multidimensional no métrica (NMDS) en los tamaños de efecto observados y estandarizados de similitud para visualizar diferencias entre la composición florística en los ecosistemas muestreados. Para evaluar los efectos ambientales y espaciales sobre la diversidad se utilizó un análisis de redundancia basado en la distancia (RDA; Legendre y Legendre, 2012) para dividir la cantidad de variación de similitud explicada por cada conjunto de variables explicativas. El RDA es un método para llevar a cabo ordenaciones restringidas utilizando medidas de distancia no euclidianas. En el RDA, la matriz PhyloSor estandarizada se transformó internamente en coordenadas principales, que luego se utilizaron en un análisis de redundancia (RDA). Antes del análisis, los valores estandarizados de PhyloSor se convirtieron en distancias positivas escalando entre 0 y 1. Luego, se ejecutó RDA solo con las variables espaciales y se aplicó un procedimiento de selección directa para identificar un eje PCNM significativo. El mismo procedimiento se realizó para las variables de suelo. Finalmente, se realizó un RDA que incluía la distribución espacial de las parcelas (variable espacial) y el contenido de P y K como variables ambientales (Legendre y Legendre, 2012). Para todos los modelos, los resultados se informaron en términos de la R2 valores. Los análisis se realizaron utilizando el paquete vegan, en el entorno de R (Oksanen et al., 2019; González-Caro et al., 2020).
Partición de variación
Se realizaron particiones de variación (VARPART) para identificar la contribución de cada variable en la explicación de la composición florística de los dos ecosistemas (Peres-Neto, 2006; Legendre, 2008). VARPART permite identificar los efectos puros de las variables ambientales y espaciales y cuanto queda sin explicar (Legendre et al., 2005). Para esto, se realizó la transformación de Hellinger sobre la abundancia de especies para disminuir el peso de las más abundantes (Legendre y Gallagher, 2001).
Las variables espaciales se obtuvieron a partir de las coordenadas geográficas de las parcelas transformadas a una matriz de distancias geográficas entre parcelas y utilizando el análisis de coordenadas principales de matrices vecinas (PCNM) (Borcard y Legendre, 2002; Dray et al., 2006). El análisis se realizó en Qeco (Di Rienzo et al., 2010) en la interfaz R (R Development Core Team, 2022) con las bibliotecas Vegan; Función PCNM (Oksanen et al., 2013).
Resultados
Composición y estructura florística
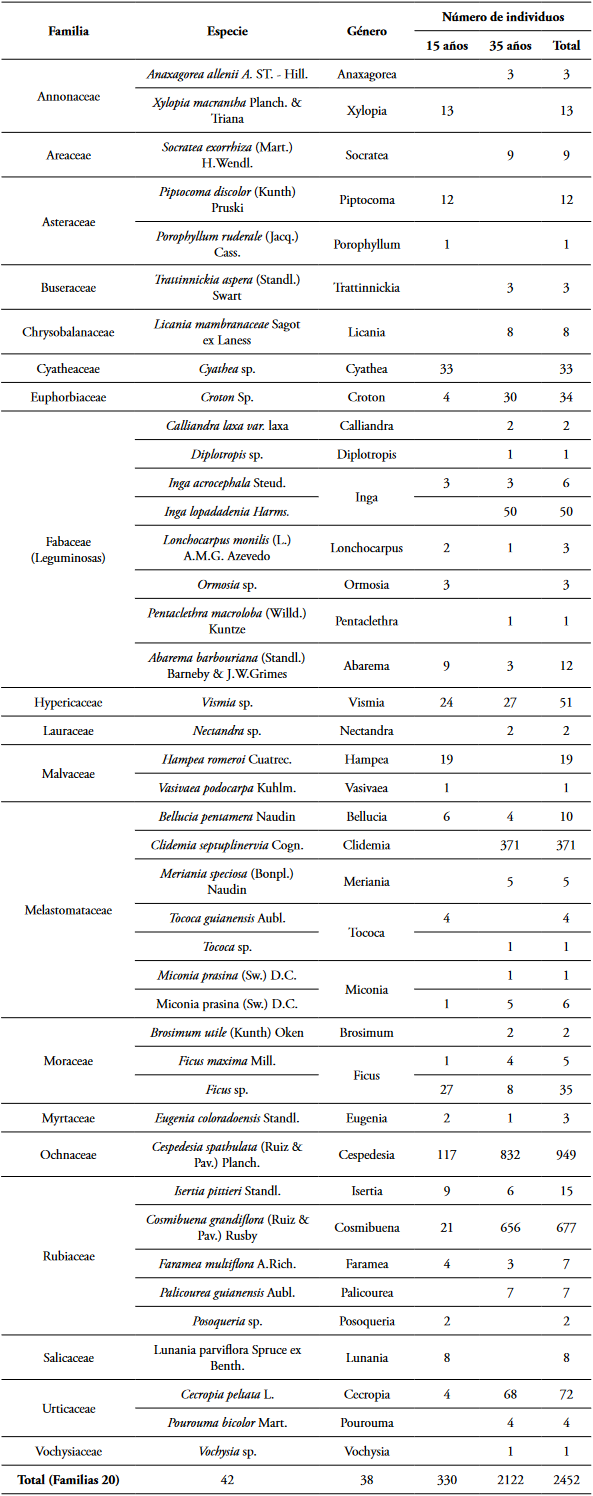
En total se registraron 2453 individuos (15 años = 330 ind. y 35 años = 2123 ind.), agrupados en 42 especies y 20 familias botánicas. En general, la composición florística arbórea está dominada por Cespedesia spathulata (Ruiz & Pav.) Planch., Cosmibuena grandiflora (Ruiz & Pav.) Rusby, Clidemia septuplinervia Cogn., Cecropia peltata L., Crotón sp., Vismia sp. y familias botánicas como Ochnaceae, Rubiaceae, Melastomataceae, Urticaceae, Hypericaceae y Fabaceae. En síntesis, en las Tablas 1 y 2, se resumen las características estructurales, ecológicas y edáficas de los ecosistemas estudiados.
Tabla 2 Características estructurales, ecológicas y edáficas de los bosques post-minería de 15 y 35 años de recuperación.
| Localidad | Jigualito | |
|---|---|---|
| Tipo de ecosistema | Bosques en recuperación | |
| Tiempo de sucesión (años) | 15 | 35 |
| Promedio DAP | 5,57 | 13,89 |
| Altura promedio | 7,46 | 13,44 |
| Riqueza | 5,56 | 8,68 |
| Abundancia | 11,12 | 17,36 |
| Dominancia | 0,31 | 0,31 |
| Shannon | 1,42 | 1,44 |
| Margalef | 1,75 | 1,73 |
| Berger-Parker | 0,44 | 0,43 |
| pH | 4,64 | 4,47 |
| Materia orgánica (%) | 5,07 | 10,26 |
| Fósforo (ppm) | 30,73 | 26,10 |
| Nitrógeno total (%) | 0,23 | 0,4 |
| Aluminio (cmol/kg) | 2,84 | 3,29 |
| Calcio (cmol/kg) | 1,28 | 2,85 |
| Magnesio (cmol/kg) | 1,35 | 1,6 |
| Potasio (cmol/kg) | 0,51 | 0,34 |
| CICE (cmol/kg) | 5,71 | 8,4 |
| Arena (%) | 66,08 | 73,41 |
| Limo (%) | 23,84 | 20,35 |
| Arcilla (%) | 10,08 | 6,06 |
Diversidad del bosque
Se encontró una mayor diversidad de especies en el bosque de 15 años de recuperación, en el que se pueden encontrar hasta 25 especies al muestrear 300 individuos; mientras que para el ecosistema de 35 años la misma cantidad de individuos se pueden encontrar agrupadas en 15 especies diferentes (Figura 1A). Asimismo, se denota que al aumentar el número de parcelas existe la posibilidad de encontrar nuevas especies, observándose los mejores valores en las minas en los que la vegetación lleva 35 años de recuperación (± 30 especies en 5 parcelas), frente a las ± 24 especies en 5 parcelas sugeridas para las minas de 15 años de recuperación (Figura 1B).
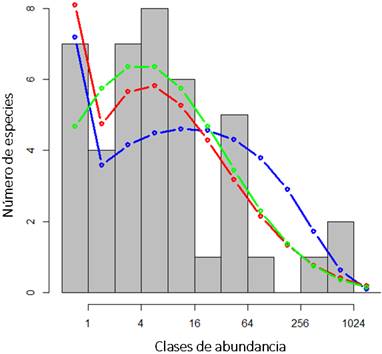
Distribución de abundancia de especie
Las distribuciones de abundancia de especies en los dos ecosistemas se ajustaron mejor por logaritmo normal que por serie logarítmica (Figura 2). Aunque el modelo logarítmico normal empleado tiende a subestimar sistemáticamente el número de especies más raras, funcionó mejor para ajustar el número de especies con las abundancias intermedias más comunes que la serie logarítmica (Figura 2).
Ordenación
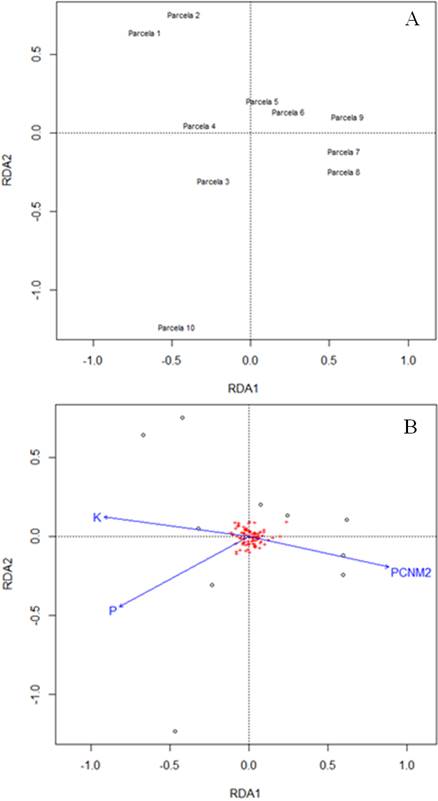
El procedimiento de ordenación de escala multidimensional no métrica (NMDS, Figura 2S; 3S) permitió observar que existen disimilitudes a nivel florístico entre los dos ecosistemas muestreados, permitiendo visualizar claramente dos grupos. El RDA realizado permitió la visualización de tres grupos organizados de acuerdo con su semejanza florística. Estos grupos son: el primero representado por las parcelas 1 y 2, el segundo conformado por las parcelas 3 y 4 y el tercero comprendido por las parcelas de la 5 a la 9, que se encuentran agrupadas y presentan características florísticas similares. Finalmente, se observa que la parcela 10 se encuentra separada de los dos grupos (Figura 3A).
Partición de la variación
Las variables seleccionadas fueron matriz de suelos (variables ambientales), específicamente contenido de P y K. Para la matriz espacial, se seleccionó el PCNM 2, que representa distribución espacial entre parcelas. El VARPART (Figura 4) mostró que el contenido de P y K explican el 40% de la variación en bosques post-minería de 15 y 35 años; mientras que las variables espaciales no explican para nada la variación y la fracción no explicada es de 66%. Asimismo, se denota que el suelo explica el 16% y los efectos compartidos entre las variables espaciales y ambientales es del 24% (Figura 4).
Discusiones
¿Existen diferencias en los patrones estructurales y de diversidad entre los bosques post-minería de 15 y 35 años?
A nivel florístico (composición, estructura y diversidad) se observó que hay una separación entre las parcelas de los bosques post-minería de 15 y 35 años. Esto pareciera estar relacionado con el tiempo de sucesión o recuperación de los sitios (Ramírez et al., 2019). Al respecto, Quinto et al. (2013) han indicado que estas diferencias son muy comunes en cronosecuencias y que se generan en suelos post-minería, en los que se presentan serios déficit nutricional producto del intercambio de los horizontes del suelo y la lixiviación de nutrientes que se da posterior a esta intervención (Valois-Cuesta y Martínez-Ruiz, 2016).
La pérdida de nutrientes pareciera ser un gran problema en los suelos post-minería del Chocó Biogeográfico (Tabla 2S; Quinto et al., 2022) y al parecer tiene fuerte influencia en la recuperación de la diversidad de los sitios (Ramírez et al., 2019). Esto se corrobora con los resultados obtenidos en la presente investigación, en el que la diversidad es inferior a la obtenida en investigaciones de bosques naturales de la misma zona de vida (Torres-Torres et al., 2017; Mena-Mosquera et al., 2020). De igual forma, se observó que, aunque la diferencia en riqueza de especie de los sitios muestreados no es muy grande la curva especie-individuo indica que a medida que se incremente el muestreo de individuos el ecosistema más joven presentará más diversidad, pero cuando se aumente el número de parcela la diversidad va a ser mayor en el bosque de 35 años. Este resultado difiere de lo obtenido por Valoyes y Ramírez (2020), quienes encontraron mayor diversidad para bosques post-minería de Condoto. Esto podría explicarse por diferencias en la topografía de los terrenos y tipo de minería practicado (p. ej. con draga, dragones o retroexcavadora).
¿Cuáles son los determinantes ambientales y espaciales de la similitud en composición florística de los dos bosques post-minería?
De acuerdo con los resultados obtenidos, el suelo, y en particular su contenido de nutrientes, juega un papel fundamental como determinante de la similitud y diferencia florística entre los sitios muestreados. Se ha observado una relación directa entre la composición de la vegetación y los nutrientes presentes en el suelo (Valois-Cuesta et al., 2022). Además, el tipo de vegetación desarrollada en el suelo tiene un impacto significativo en el tiempo de recuperación de los ecosistemas (Ramírez et al., 2019; Valoyes y Ramírez, 2020). En este sentido, los hallazgos de Oktavia et al. (2015) sugieren que en las áreas post-minería recién perturbadas se presentan pocos contenidos de cationes básicos (como Ca y Mg) en concentraciones de 0,0 y 0,5 me/100 g. Estos cationes son responsables del crecimiento radicular y el anclaje de las plantas. La presencia de estos bajos contenidos se asocia frecuentemente con la topografía resultante de la actividad minera, lo que facilita la lixiviación de nutrientes junto con la precipitación (Ramírez et al., 2019). No obstante, con el paso del tiempo en este tipo de sucesión, se observa un incremento gradual de minerales como Ca y Mg (Sansupa et al., 2021; Semy y Singh, 2021).
El análisis de ordenación (RDA) sugiere un patrón característico de este tipo de ecosistema en el que los sitios de mayor edad tienden a agruparse entre sí y los de menor edad tienden a quedar dispersos. Este hallazgo es similar a lo sugerido por Ramírez y Rangel-Ch. (2019) y Ramírez et al. (2019), quienes indicaron que la composición florística del sitio es un gran responsable de esta separación, ya que los suelos que quedan después de la minería tienden a promover el crecimiento de algunos grupos de vegetación homogéneo, los cuales son reemplazados conforme aumentan los años, permitiendo esto en parte que lleguen a colonizar especies como las leguminosas que aportan al restablecimiento de la fertilidad del suelo (Feldpausch et al., 2004; Paoli et al., 2005).
Por su parte, al relacionar las diferencias en composición de los sitios con las variables ambientales, hay una separación triple: por un lado, se observó un grupo explicado por las variables espaciales (parcelas 5, 6, 7, 8 y 9), lo que puede ser atribuido a la ubicación o la forma como se encuentran distribuidas las parcelas, ya que el trabajo de minería es realizado por cortes que por lo general se realizan de forma lineal (Valois-Cuesta y Martínez, 2016), ocasionando esto pocas variaciones latitudinales o longitudinales. Por otro lado, hay un grupo que se explica por variables ambientales y a la vez, este se subdivide en dos grupos más a saber: los explicados por la presencia de P en el suelo (parcelas 3 y 10) y los relacionados con la presencia de K en el suelo (parcelas 1, 2 y 4). Frente a la influencia del suelo se ha indicado en gran parte de las investigaciones que la fertilidad del suelo (especialmente la disponibilidad de N, P y K) es el principal limitante de la composición estructura, diversidad y productividad del bosque (Sayer et al., 2012, Álvarez-Clare et al., 2013, Quinto y Moreno, 2017); por ejemplo, Feldpausch et al. (2004) señalaron que el N resulta ser el principal limitante en los primeros estados sucesionales del bosque, mientras que el P lo es en ecosistemas maduros (Paoli et al., 2005). Esto en parte es explicado por Walker y Syers (1976), quienes señalaron que, durante el desarrollo del suelo, la meteorización de la roca madre o del material original proporciona la principal fuente de fósforo para el desarrollo inicial de la vegetación. Este material a lo largo de los años se agota gradualmente y por ende el P disponible (Viana-Cunha et al., 2022).
También durante este proceso, los cationes básicos derivados de la roca como el calcio, el magnesio y el potasio pueden perderse por lixiviación o quedan poco disponibles por la oclusión de los óxidos de hierro y aluminio (Quinto et al., 2022). Por su parte, el nitrógeno tiende a acumularse con el tiempo y los aportes de la fijación biológica superan las pérdidas de N (Hedin et al., 2009). Por esta razón, a lo largo de las tres últimas décadas se ha tratado de comprobar en qué medida el P limita la productividad de los bosques (Wright et al., 2011; Wright et al., 2018; Wright, 2019; Viana-Cunha et al., 2022).
En este sentido, Quinto y Moreno (2017), en bosques naturales del Chocó Biogeográfico han señalado que la productividad y sus componentes se encuentran limitados por múltiples nutrientes del suelo.
Conclusiones
Los bosques post-minería de 15 y 35 años estudiados presentan marcadas separaciones en su composición florística y estructura, atribuidas al tiempo de sucesión y recuperación de los sitios, donde la actividad minera ha generado déficits nutricionales en el suelo que afectan la diversidad y abundancia de especies presentes. Asimismo, se aprecia que el contenido de nutrientes en el suelo juega un papel clave en la similitud y diferencia florística entre los bosques post-mineros. Específicamente, el contenido de fósforo y potasio en el suelo parece influir en la composición de especies leñosas en los sitios muestreados. Además, el análisis de ordenación revela que los bosques más antiguos tienden a agruparse, lo que sugiere que la composición florística del suelo y la presencia de ciertos grupos de vegetación influyen en la recuperación del ecosistema con el tiempo.