Introducción
Hábitat es un término ampliamente utilizado para describir las relaciones entre los organismos y su ambiente. Se registran diferentes enfoques relacionados con su definición, considerándolo como: el espacio geográfico; el área ocupada por la especie; el conjunto de condiciones biofísicas necesarias para el sostenimiento de las especies; el rango histórico, potencial y actual de una especie (Alagona, 2011). De igual manera, se refiere al hábitat como el tipo de ambiente; características ambientales; conjunto de recursos y condiciones ambientales que determinan las poblaciones; zona (área) de disposición y uso de recursos y el conjunto de recursos y condiciones ambientales que promueven la ocupación de la especie (Stadtmann y Seddon, 2020).
Hábitat también se considera como el lugar donde vive la especie determinada por el recurso presente y la habilidad para capturar ese recurso, su capacidad para explorar nuevos recursos a medida que estén disponibles y los factores intervinientes que pueden impedirle utilizarlos (Alagona, 2011). De igual manera, se considera como el conjunto de recursos necesarios para sostener una población en el espacio y en el tiempo (McComb, 2016).
Diferentes autores definen hábitat como el área física real ocupada por la biota, la cual oferta diferentes nichos para su desarrollo (Hall et al., 1997; Ojasti y Dallmeier, 2000; Di Bitetti, 2012; Begon y Townsend, 2021). Comprendiendo nicho (ecológico) como las interacciones entre tolerancias y requisitos para definir las condiciones y recursos utilizados o experimentados por un individuo o especie para su desarrollo (Turture et al., 2019; Begon y Townsend, 2021).
La definición de hábitat (Hall et al., 1997) se encuentra estrechamente relacionada con la de nicho ecológico (Grinnell, 1917; Elton, 1927; Hutchinson, 1957; ver revisión de Pocheville, 2015) y es utilizada para explicar la distribución de las especies (Stadtmann y Seddon, 2020). Aunque se debe considerar que el hábitat por sí solo no presenta una visión completa de las interacciones ecológicas, al igual que la presencia de una especie tampoco define el hábitat (Stadtmann y Seddon, 2020).
Asimismo, la selección de hábitat por parte de la especie responde a diversos factores comportamentales, naturales y aprendidos, relacionados con sus ofertas ambientales para las relaciones intra e interespecíficas (Krausman, 1999; Ojasti y Dallmeier, 2000). En este sentido, el hábitat puede seleccionarse por su disponibilidad (accesibilidad a los componentes físicos y biológicos por parte del organismo). La especie selecciona el hábitat por su idoneidad en oferta de condiciones y por lo óptimo en el alcance de su objetivo (éxito reproductivo, supervivencia).
Por un lado, la persistencia en el hábitat es condicionada por la disponibilidad de condiciones para el forrajeo, el refugio, protección, etc., y su relación con la depredación y la competencia (Krausman, 1999). Mientras que la preferencia de hábitat es la consecuencia de la selección de hábitat (Krausman, 1999), surge cuando los organismos se encuentran la mayoría de tiempo en hábitats poco abundantes en el paisaje (Krausman, 1999).
Por otro lado, el uso de hábitat es la forma como el organismo aprovecha las ofertas ambientales, los recursos físicos y biológicos (Krausman, 1999). Las diferentes actividades de un organismo requieren componentes ambientales específicos, los cuales pueden variar en el transcurso del tiempo (estaciones y temporadas climáticas), condicionando e influyendo en su dinámica espacio temporal, ya que su presencia, ocupación y permanencia se relaciona con los recursos necesarios para su sustentabilidad (Krausman, 1999; Begon y Townsend, 2021). Al ser una de las principales problemáticas relacionada con la perdida de conectividad, debido a que las condiciones que permiten el uso del hábitat dependerán de la posibilidad de llegar, ocupar y permanecer en este (Begon y Townsend, 2021).
La transformación de las coberturas naturales causa cambios en sus características, generando cambios en la oferta de hábitats potenciales para la biota en general. Algunos grupos biológicos son más sensibles a este tipo de transformaciones de las coberturas, las cuales generan pérdida de hábitats, desconociendo la importancia de la representación de algunos hábitats estratégicos para la conservación y sustentabilidad de sus poblaciones.
Los anfibios son un grupo que debido a sus características fisiológicas y comportamentales son sensibles a los cambios del entorno (Vitt y Caldwell, 2013; Urbina-Cardona et al., 2014), suelen congregarse en hábitats húmedos, principalmente en sus periodos de reproducción. Al igual que en otros grupos biológicos, la clasificación y repartición de hábitats se encuentran estrechamente ligadas al nicho ecológico de cada especie, lo que permite la coexistencia y sustentabilidad de las comunidades, en relación con la disponibilidad de recursos necesarios.
La reducción de la complejidad de los hábitats por la intervención antrópica es un factor que amenazan las poblaciones y diversidad de anfibios (Almeida-Gomes y Rocha, 2014; Urbina-Cardona et al., 2014). La fragmentación de ecosistemas puede ocasionar desaparición y aislamiento de hábitats estratégicos, disminuyendo las condiciones para su desarrollo y aumentando la competencia interespecífica por la disponibilidad de recursos (Urbina-Cardona y Reynoso, 2005; Santos y Tellería, 2006). Las interacciones interespecíficas y la disponibilidad de recursos dan forma al nicho ecológico y contribuyen a identificar su hábitat.
Los estudios en poblaciones de anfibios dirigidos a conocer relaciones inter e intraespecíficas de estos con las coberturas naturales y antropogénicas son escasos en el Caribe de Colombia (Vargas-Salinas et al., 2019). Se desconocen los elementos del entorno que favorecen la conservación de anfibios, más allá de la importancia de ambientes húmedos para su desarrollo. Es evidente la necesidad de estudios sobre la biota y su relación con la dinámica de los usos del suelo y la transformación de coberturas, estudios que permitan reconocer las amenazas e implicaciones que se tienen al transformar el paisaje y perder unidades del paisaje, claves para la conservación de grupos como los anfibios.
El presente estudio tiene como objetivo analizar la relación entre diferentes hábitats y los anfibios asociados a cinco coberturas, en un área rural del municipio de Dibulla, La Guajira. Se pretende generar información sobre los anfibios y su relación con la dinámica de transformación del entorno, buscando reconocer la influencia de las coberturas y su oferta de hábitats ejercen sobre la estructura y composición de los anfibios.
Materiales y métodos
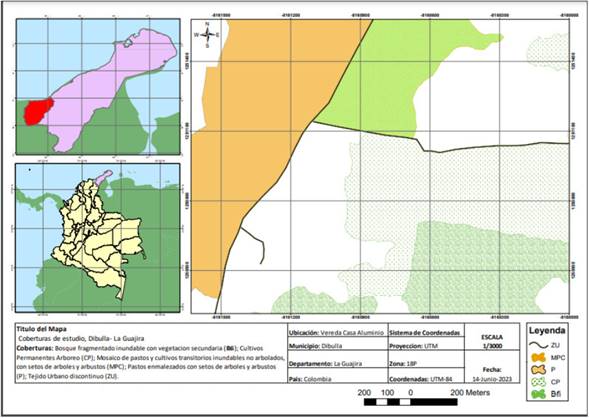
Área de estudio. Se localiza en el municipio de Dibulla, Vereda Casa Aluminio, departamento de La Guajira, Colombia (11° 14 ́16” y 11° 13 ́ 27” N; 73° 18 ́ 49” y 73° 18 ́ 25” O) (Figura 1).
Esta área presenta altitud entre los 3 y 17 msnm, clima cálido con temperatura promedio anual de 30°C y un régimen bimodal de lluvias con precipitaciones anuales aproximadamente 1700 mm. El estudio se realizó en un área que presenta diferentes coberturas con la presencia de terrenos artificializados, agrícolas, bosque y áreas seminaturales (IDEAM, 2010) (Figura 1; Tabla 1).
Fuente: elaboración propia.
Figura 1 Mapa área de estudio. Vereda Casa Aluminio, Dibulla, La Guajira, Colombia.
Tabla 1 Coberturas de la tierra identificadas, Dibulla, La Guajira. Adaptado de IDEAM, 2010.
| Niveles | ||||
|---|---|---|---|---|
| 1 | 2 | 3 | 4 | Código |
| Bosques y áreas seminaturales | Bosque fragmentado | Bosque fragmentado con vegetación secundaria | Bosque fragmentado inundable con vegetación secundaria | Bfi |
| Territorios agrícolas | Cultivos permanentes | Cultivos permanentes arbóreos | Palma de aceite | CP |
| Territorios agrícolas | Áreas agrícolas heterogéneas | Mosaico de pastos y cultivos | Mosaico de pastos y cultivos transitorios inundables no arbolado con setos de árboles y arbustos | MPC |
| Territorios agrícolas | Pastos | Pastos enmalezados | Pastos enmalezados con setos de árboles y arbustos | P |
| Territorios artificializados | Zonas urbanizadas | Tejido urbano discontinuo | ZU |
Fuente: elaboración propia.
Trabajo de campo. Durante ocho meses, se realizaron cinco visitas por mes para describir y registrar los hábitats de encuentro de anfibios asociados a cinco coberturas de la tierra. La selección y descripción de cada hábitat consideró el lugar preciso de encuentro de los individuos dentro de la cobertura (Heyer et al., 1994), además de las características físicas específicas que tipificaron un área particular, para lo cual se consideró la composición de la cobertura, presencia o ausencia de cuerpos de agua, altura de la flora acuática y terrestre, unidades paisajísticas naturales y artificiales, usos del suelo y ubicación.
Para el estudio y registro de los anfibios se utilizó la técnica estandarizada de relevamiento por encuentros visuales (Heyer et al., 1994), sobre caminatas aleatorias. Se describieron los lugares de encuentro de cada ejemplar y se georreferenciaron. Los muestreos se realizaron entre las 8:00 y 17:00 horas y las 18:00 y 3:00 horas. La determinación taxonómica se realizó siguiendo los criterios descritos en literatura especializada propuesta por diferentes autores.
Análisis de coberturas, hábitats y especies. Para identificar el uso de hábitat por las especies de anfibios, se consideró el número de ejemplares y especies encontradas o registradas (S) en cada hábitat (Moreno, 2001).
Se analizó la riqueza y abundancia de anfibios, además de la composición de hábitats y coberturas, por medio del análisis de escalamiento multidimensional no métrico (NMDS). Este análisis midió las proximidades y distancias por medio del índice de Bray Curtis, considerando las diferencias medidas de la bondad del modelo (Stress) según lo establecido por Kruskal (1964).
De igual manera, para medir las diferencias entre coberturas, hábitats, riqueza y abundancias de anfibios se utilizó una prueba no paramétrica para k muestras, debido a que la distribución de los registros no cumplió con los principios de normalidad y homocedasticidad de varianzas, considerándose por su naturaleza la prueba de Kruskal-Wallis, determinándose si existen diferencias entre los hábitats, coberturas y la representación de este grupo.
Para analizar la diversidad entre hábitats se utilizó el análisis de similitud - disimilitud por el coeficiente de Jaccard (Moreno, 2001), a través de un análisis clúster. Este análisis permite observar agrupamientos entre coberturas, teniendo en cuenta hábitats compartidos y exclusivos. Estos análisis se realizaron con el software Past 4 (Hammer et al., 2001).
Análisis hábitats y especies. Para la medida del grado de sobreposición en la dimensión espacio del nicho, se utilizó el análisis de sobreposición de nicho de Pianka (Oij), el cual considera la proporción del uso del recurso entre dos especies, para lo cual se registra la abundancia por especie presente en cada hábitat. Para la medida de amplitud de nicho se consideraron las condiciones de nicho retenido (preservando el grado de especialización de la especie) y reasignado (tendiendo a mayor amplitud de uso y por tanto mayor solapamiento de la comunidad simulada en relación con la observada), razón por la cual en el presente estudio se analizó la amplitud de nicho por medio de los algoritmos RA2, RA3, RA4, índice de Pianka, siguiendo las consideraciones de Gotelli y Ellison (2013).
Los análisis de amplitud y solapamiento de nicho espacial para las especies de anfibios en cada cobertura se realizaron a partir de 1000 interacciones aleatorizadas a través de los software EcoSim professional (Entsminger, 2019) y R-project 4.3.0.
Resultados
Riqueza y rasgos funcionales
Se registraron 9978 anfibios, distribuidos en un orden, cinco familias, trece géneros y 21 especies. La familia Hylidae fue la más representativa por su número de géneros (6) y de especies (9). Todas las especies registradas durante el estudio son de actividad nocturna y representadas principalmente por los hábitos terrestre y fosoriales (Figura 2, Tabla 2).

Fuente: elaboración propia.
Figura 2 Anfibios frecuentes en cinco coberturas, en un área rural de Dibulla, La Guajira. Abreviaturas de las especies Tabla 2.
Tabla 2 Rasgos funcionales de los anfibios registrados en cinco coberturas de la tierra en Dibulla, La Guajira.
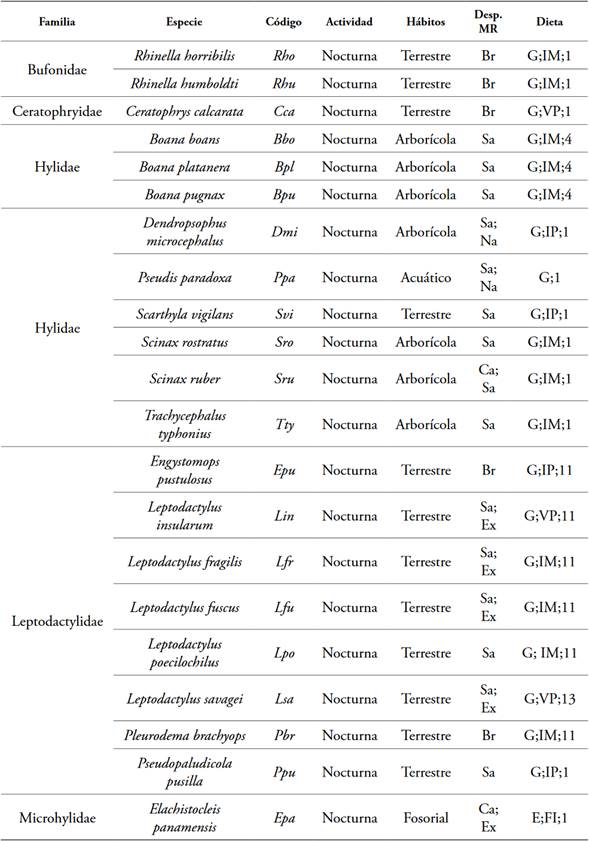
*Abreviaturas: Desplazamiento (Desp.); Brincador (Br); Saltador (Sa); Excavador (Ex); Caminador (Ca); Modo reproductivo (MR); Huevos y renacuajos exotróficos en agua léntica (1); Huevos y renacuajos exotróficos en agua lótica (2); Huevos y etapas iniciales de larvas en concavidades naturales o construidos; después de la inundación, renacuajos exotróficos en charcos o arroyos (4); Nido de espuma que flota en charcos; renacuajos exotróficos en charcos (11); Nido de espuma flotando en el agua acumulada en las concavidades construidas; renacuajos exotróficos en charcos (13); Generalista (G); Especialista (E); Invertebrados pequeños (IP); Invertebrados medianos (IM); Vertebrados pequeños (VP); Formicidae, Isoptera (FI). Adaptado de Blanco-Torres (2019).
Fuente: elaboración propia.
Hábitats de uso y encuentro para anfibios en diferentes coberturas
Se definieron 38 hábitat de uso y encuentro, distribuidos en las cinco coberturas en estudio. Estos describen las características de cada cobertura estudiada, resaltando que los hábitats identificados no se presentaron en todas las localidades (Tabla 3).
La cobertura mosaico de pastos y cultivos transitorios inundables no arbolado con setos de árboles y arbustos (MPC), fue la cobertura con mayor número de hábitat de encuentro para anfibios (29). Mientras que la cobertura bosque fragmentado inundable con vegetación secundaria (Bfi) fue la cobertura con menor registro de hábitat de encuentro para los anfibios (16) (Tabla 3).
La cobertura que presentó mayor riqueza de especies de anfibios (19 sp.) fue la cobertura de tejido urbano discontinuo (ZU), mientras que las coberturas Bfi y MPC fueron las coberturas con menor riqueza (13 sp.).
Las coberturas cultivo de palma de aceite (CP) con 3068 registros de anfibios, seguida de las coberturas MPC con 2802 registros y ZU con 1907 fueron las coberturas con mayor registro de abundancias. Mientras que la cobertura de P con 1289 registros y Bfi con 912 fueron las coberturas con los menores registros de anfibios durante el estudio (Tabla 3).
Tabla 3 Distribución de especies de anfibios y sus abundancias en hábitat de encuentro en cinco coberturas, Dibulla, La Guajira, Colombia.

* Riqueza de especies (Sp); Abundancia (A); Abreviaturas de coberturas Tabla 1.
Fuente: elaboración propia.
Se observaron diferencias significativas entre las coberturas de la tierra, hábitat de encuentro y la riqueza de anfibios (H: 48,77; p-valor: 0,04682).
Se presentaron diferencias significativas entre las coberturas de la tierra, los hábitats de encuentro y las abundancias de anfibios (H: 49,74; p-valor: 0,03741).
Cada cobertura presentó una composición diferente de hábitat de encuentros y de sus comunidades de anfibios. La heterogeneidad del paisaje de cada cobertura de la tierra, representada en los hábitats identificados con presencia de anfibios, no guardó relación aparente con la diversidad de estos grupos y la oferta de hábitats por coberturas.
Relaciones de similitud de las comunidades de anfibios en diferentes coberturas
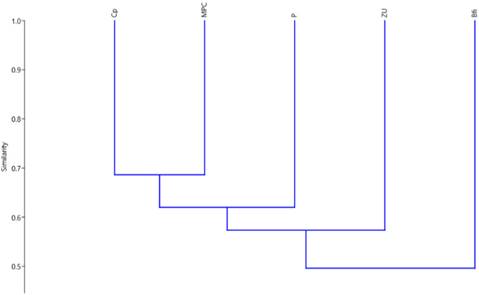
La riqueza y representación de anfibios para cada cobertura registró una relación proporcional media <50% entre las comunidades de estas. Se observó que las comunidades asociadas a coberturas de uso agropecuario (MP; MPC; CP) fueron las más similares registrando similitud media alta >60% en la riqueza y representación de este grupo, siendo las comunidades más similares las registradas en las coberturas MPC y CP (>65%). Asimismo, se observó que las comunidades de anfibios relacionadas con la cobertura de uso forestal (Bfi) fueron las de menor similitud en relación con las comunidades registradas en otras coberturas (Figura 3).
Fuente: elaboración propia.
Figura 3 Análisis de similitud de las comunidades de anfibios por coberturas, Dibulla, La Guajira. Índice de Jaccard, coeficiente de correlación 0,7975. Ver código de coberturas en Tabla 1.
Hábitats, coberturas y la distribución de anfibios
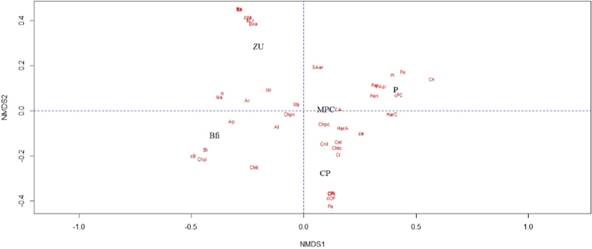
El uso de hábitat determinado por el registro de anfibios en ellos, muestran una aparente relación en cuanto a los hábitats de encuentro, riqueza y abundancia de anfibios presentes en las coberturas con los usos del suelo agrícola; las coberturas Bfi y ZU se encuentran separadas entre sí y de otras coberturas, aunque se compartan hábitat entre estas coberturas (Figura 4).
Fuente: elaboración propia.
Figura 4 Representación de la riqueza y abundancia de anfibios por hábitat de encuentro en diferentes coberturas, Dibulla, La Guajira. Escalamiento multidimensional no métrico por distancia de Bray Curtis, Stress tipo 1 = 0. Ver referencia de coberturas y hábitat en Tabla 2.
El análisis NMDS realizado a la riqueza y abundancia de anfibios presentes en los hábitats de cada cobertura, presenta un Stress tipo 1 = 0, lo que corresponde a un modelo con interpretación excelente (Kruskal, 1964). Se observó que los agrupamientos de hábitats parecen relacionarse al tipo de uso, es así como coberturas de usos agrícolas (P, MPC y CP) se encontraron cercanas en este análisis, no así, las coberturas de uso forestal (Bfi) y uso urbano (ZU) (Figura 4).
La riqueza de anfibios es independiente de la abundancia de estos en cada cobertura. Aunque se observan hábitats con representación similar entre coberturas, la riqueza y abundancia de anfibios responde a condiciones más complejas que la representación de estos hábitats naturales o artificiales ofertados en las coberturas.
Uso de hábitat
La abundancia y riqueza de anfibios en cada hábitat y cobertura fue diferente; la cobertura MPC registra la mayor composición de hábitat utilizados por anfibios, aunque no es la cobertura que registra la mayor abundancia en este grupo (Tabla 2).
En la cobertura Bfi los hábitats que registraron mayor riqueza y abundancia de anfibios fueron los relacionados con el sotobosque en el interior de la cobertura, hábitats cubiertos por vegetación, hábitats asociados a caminos, charcos permanentes y hojarasca. La cobertura CP presentó los hábitats asociados a caminos, charcos, zonas inundables y cobertura vegetal de mediana altura, como los de mayor preferencia por los anfibios (Tabla 2).
En la cobertura MPC los hábitats relacionados con el interior de la cobertura, matorrales y charcos se observan como los de mayor riqueza para anfibios, mientras que los hábitats relacionados con caminos en cultivos y pastos, vegetación de mediana altura terrestre o acuática fueron en los que se registró su mayor abundancia (Tabla 2).
Los hábitats que definen la cobertura P y hábitat relacionados a charcos fueron los de mayor riqueza y abundancia, mientras que en la cobertura ZU se registró la mayor riqueza y abundancia relacionada con los hábitats que presentan mayor cobertura vegetal: matorrales, árboles y hojarasca (Tabla 2).
Solapamiento espacial en anfibios
En la mayoría del análisis se observó que las medias y varianzas muestran solapamiento de nicho observado mayor al simulado, con altos niveles de significancia en la mayoría de las coberturas (Tablas 4, 5, 6, 7 y 8).
Tabla 4 Solapamiento de nicho por pares de 13 especies de anfibios presentes en la cobertura Bfi, Dibulla, La Guajira.
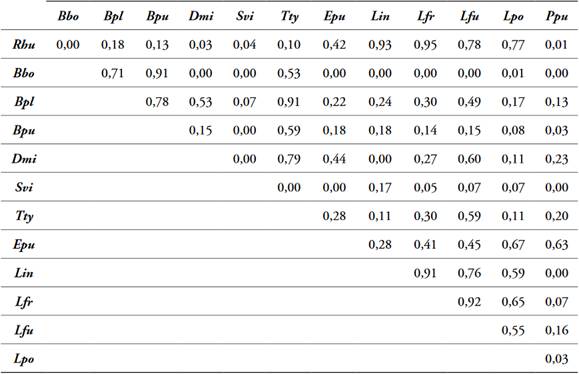
Abreviaturas de las especies tabla 2.
Fuente: elaboración propia.
Tabla 5 Solapamiento de nicho por pares de 14 especies de anfibios presentes en la cobertura CP, Dibulla, La Guajira.
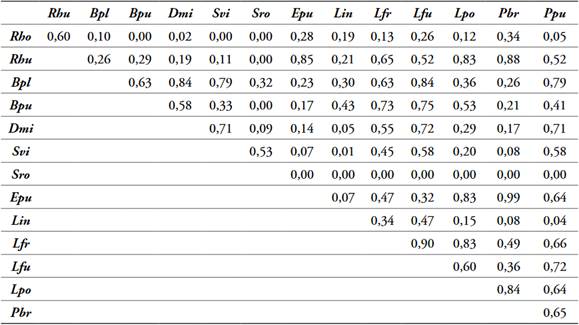
Abreviaturas de las especies tabla 2.
Fuente: elaboración propia.
Tabla 6 Solapamiento de nicho por pares de 13 especies de anfibios presentes en la cobertura MPC, Dibulla, La Guajira.
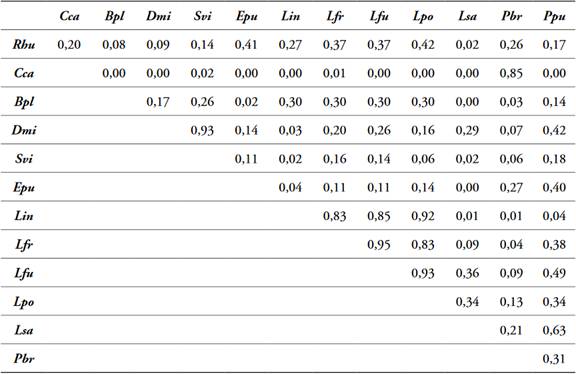
Abreviaturas de las especies tabla 2.
Fuente: elaboración propia.
Tabla 7 Solapamiento de nicho por pares de 16 especies de anfibios presentes en la cobertura P, Dibulla, La Guajira.
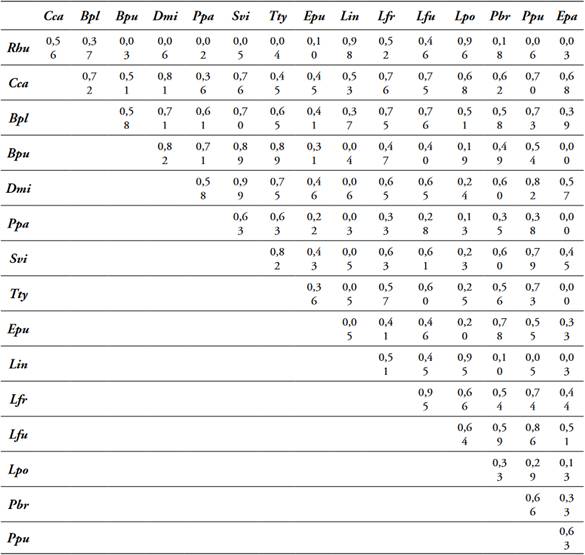
Abreviaturas de las especies tabla 2.
Fuente: elaboración propia.
El análisis de solapamiento por pares de especies de anfibios registró diferencias en el número de especies con valores de solapamiento >75% por cada cobertura, se observaron altos solapamientos entre especies que comparten hábitos (terrestres, semiarborícolas, arborícolas) y entre especies de la misma familia. Cobertura Bfi, 10 de las 13 especies observadas (Tabla 4); cobertura CP, 11 de las 14 especies observadas (Tabla 5); cobertura MPC, 8 de las 13 especies observadas (Tabla 6); cobertura P, 13 de las 16 especies observadas (Tabla 7); cobertura ZU, 14 de las 19 especies observadas (Tabla 8).
Tabla 8 Solapamiento de nicho por pares de 19 especies de anfibios presentes en la cobertura ZU, Dibulla, La Guajira.
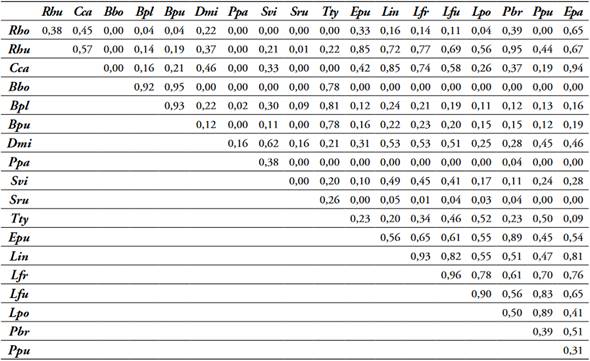
Abreviaturas de las especies tabla 2.
Fuente: elaboración propia.
Se observaron resultados significativos para las medias y varianzas de solapamiento en los algoritmos R3 y R4 en todas las coberturas. Asimismo, en estos algoritmos, la media del solapamiento de nicho observado fue mayor a la media del nicho simulado para anfibios (Tabla 9).
Tabla 9 Medias y varianzas observadas y esperadas del solapamiento de nicho espacial de anfibios en cinco coberturas, Dibulla, La Guajira. Los valores se obtuvieron a partir de 1000 interacciones aleatorizadas de las comunidades de anfibios registradas.

Fuente: elaboración propia.
El algoritmo R2 registró resultados no significativos para las medidas y varianzas de solapamiento en las coberturas Bfi y CP, mientras que las demás presentaron resultados significativos para este. Asimismo, el algoritmo R2 registró que la media del solapamiento de nicho observado fue menor a la media del nicho simulado para las coberturas Bfi, MPC y P (Tabla 9).
Los algoritmos muestran solapamiento espacial de las especies en la mayoría de las coberturas, presentando la mayor diferencia de medias frecuentemente en el algoritmo RA3 (Tabla 9).
Discusión
Solapamiento espacial y repartición de hábitat
Los anfibios listados son especies generalistas, de amplia distribución, tolerantes al disturbio (Acuña-Vargas 2016). La mayoría de especies registradas presentan distribución en las diferentes coberturas estudiadas, condicionando su presencia no solamente a la oferta de hábitat, sino a los hábitos de las especies, los cuales hacen que prefieran determinadas condiciones espaciales ofertadas por el entorno (Gardner et al., 2007a, 2007b).
Los anfibios agrupan especies abundantes en hábitats propicios, compartidos entre coberturas, lo cual se relaciona con lo manifestado por Urbina-Cardona et al. (2014), los anfibios terrestres se relacionan con microhábitats aptos para su desarrollo. Estos responden a las características particulares ofertadas por cada hábitat, debido a que son más sensibles a los cambios en la cobertura vegetal (Carvajal-Cogollo y Urbina-Cardona, 2008).
Al parecer los anfibios no responden al número de hábitats ofertados por las coberturas o con oferta de un recurso en particular (temporal o permanente), respondiendo a condiciones más complejas, que contemplan entre otras: el tipo de cobertura y la vegetación, zonas inundables, charcos y arroyos (temporal o permanente), suponiendo que son las especies las que definen el hábitat a ocupar según sus necesidades.
Son los hábitos de las especies y los hábitats ofertados los que condicionan el uso y ocupación, ya que estos aparentemente se relacionan, como sugieren otros estudios (Hartel et al., 2010; Guerra y Aráoz, 2015). Se evidencia que los registros de riqueza y abundancia de anfibios no obedecen a un patrón o tendencia preestablecido y definido, comparten hábitat en cada cobertura, aunque su uso y distribución temporal es diferente. Estas condiciones entre otras permiten la coexistencia de los grupos en los hábitats (MacArthur y Wilson, 1967; Lesbarrères et al., 2014).
De igual manera, los anfibios parecen agruparse por relaciones filogenéticas cercanas, aparentemente influyen en la distribución de las especies, como relaciones adaptativas (Lesbarrères et al., 2014). Asimismo, los hábitos de las especies las agrupan en cada hábitat, según la respuesta de estas a los cambios en el ambiente (actual e histórico) y pueden explicar el solapamiento de las especies en relación con la estructura, ofertas del hábitat y las relaciones inter e intraespecíficas (Blanco y Bonilla, 2010).
En los anfibios es más evidente la relación entre el uso - repartición del hábitat y el hábito - categoría taxonómica (familia), presentando alto solapamiento espacial en cada familia (Bufonidae, Leptodactylidae de hábitos terrestres y fosoriales, y la familia Hylidae, de hábitos arborícolas y semiarborícolas). En todos los casos el valor de las medias del solapamiento observado fue mayor al simulado, aunque puede que el solapamiento real sea menor al evidenciado.
El alto solapamiento espacial encontrado para algunas especies es difícilmente explicado solo con registros de presencia en un hábitat determinado, se hace necesario considerar variables como el tiempo y oferta de recursos en el hábitat, lo cual permitiría no sobredimensionar el solapamiento espacial de las especies y explicar la coexistencia de las especies en los hábitats.
Las especies utilizan los recursos espaciales de forma diferente, aunque se presenten en hábitats similares o equivalentes en cada cobertura. Aunque se presente mayor oferta de un hábitat en particular por una cobertura, esto no disminuye la posibilidad de coocurrencia de especies y que estas se encuentren al parecer más relacionadas con otro tipo de condiciones (oferta trófica, refugio, zonas de reproducción, etc.).
El registro de solapamiento espacial entre especies no explica competencia entre estas, el uso de los recursos puede ser en tiempo diferente. Esto se logró observar en la sucesión de la actividad vocal de especies de anfibios, no todas las especies tienen actividad vocal en el mismo momento, ni en el mismo lugar, incluso se pueden distinguir periodos de cantos por especies durante la noche y entre noches. Asimismo, en los periodos de actividad, desplazamiento, percha y forrajeo de las diferentes especies de estudio no se desarrollan en el mismo tiempo y espacio.
Las características de las coberturas y la oferta de hábitat aparentemente no condicionan la diversidad, esta responde al parecer a los hábitos de las especies, es así como se puede suponer que coberturas que ofertan menos hábitats de distribución vertical influyen en la presencia y permanencia de especies con hábitos arborícolas y semiarborícolas.
La complejidad espacial no es garantía para la diversidad de anfibios, lo que se evidencia en el hecho que coberturas más homogéneas como monocultivos o pastizales no reducen la riqueza, esta se mantiene, asociada a las adaptaciones de las especies o incluso a las actividades antropogénicas del uso del suelo (por ejemplo: los sistemas de riego artificial garantizan condiciones de humedad que favorecen la presencia de algunas especies, mientras que coberturas de mayor complejidad espacial, como un fragmento de bosque, presentan una dinámica natural, la cual puede ser influenciada por las matrices circundantes y afectar la riqueza y estructura de sus comunidades).
Coberturas de la tierra y repartición de hábitats
Se evidenció que la riqueza y abundancia de anfibios responden a condiciones más complejas que el tipo de perturbación antropogénica y se condiciona más al grado de perturbación, dependiente del tipo, tiempo e intensidad del uso del suelo y su influencia sobre la estructura de la cobertura, ofertas y transformación de hábitats y en estos a las diferentes dimensiones que lo definen o describen, comprendidos como ofertas ambientales.
Los hábitats relacionados con bordes de coberturas, recurso agua y mayor cobertura vegetal (matorrales, hojarasca, setos de árboles y arbustos), se presentaron como los hábitats con mayor riqueza de especies y número de individuos. En las coberturas de poca vegetación y zonas abiertas como pastos enmalezados con setos de árboles y arbustos, se registra la mayor riqueza y abundancia de especies relacionada con los setos con vegetación y la presencia de diferentes cuerpos de agua. Asimismo, coberturas con mayor vegetación como bosque y zonas urbanizada registraron la mayor riqueza de especies y abundancias relacionadas a arbustos, hojarasca y cuerpos de agua. Todo lo anterior hace suponer que la cobertura vegetal (estructura y composición) y la oferta hídrica (temporal o permanente) son recursos clave para la riqueza y abundancia de anfibios.
Los resultados del presente estudio indican un elevado solapamiento en las preferencias de hábitat de anfibios, lo que sugiere una elevada superposición de nicho en la dimensión espacial. Aunque la actividad de las especies en las comunidades es asincrónica, se observa una sucesión en los periodos de actividad de las especies y la frecuencia de encuentro. Estas diferencias en la actividad temporal de las especies sugieren además de la repartición espacial, una repartición temporal que aparentemente favorecería la coexistencia de especies competidoras, especies predadoras y especies presas.
La estrecha relación de las especies con los recursos ofertados en cada hábitat o cobertura son difíciles de detectar, se evidencia alto solapamiento espacial entre pares de especies en una misma familia y que comparten los mismos hábitos. El registro de solapamiento espacial entre especies, no necesariamente explica competencia entre estas, ya que el uso de los recursos puede ser en tiempo diferente. La tendencia de ocurrencia de especies responde a la disponibilidad de hábitats relacionados con sus hábitos.
Se resalta que, aunque existió disponibilidad de agua en charcas y arroyos durante el tiempo de estudio, producto de los sistemas de riego de cultivos y cuerpos de agua asociados a las diferentes coberturas, no se observaron todas las especies de anfibios concentradas en estos hábitats, lo que evidencia especies de anfibios que no se encuentran exclusivamente condicionadas por el recurso agua, sino por su disponibilidad o representación.
Asimismo, los modos reproductivos pueden influir en la selección del hábitat y condicionar la presencia y agrupamiento en relación con las necesidades de la especie y características del hábitat para el evento reproductivo.
La alta sensibilidad de los anfibios a los cambios del entorno, los hacen considerar un grupo indicador de calidad de hábitat, en relación con sus exigencias fisiológicas y comportamentales, principalmente aquellas relacionadas con aspectos fisicoquímicos del agua y del aire.
Conclusiones
Los trabajos dirigidos al estudio de relaciones ecológicas de anfibios en relación con coberturas y usos del suelo en el Caribe de Colombia son escasos, el presente estudio aporta información sobre relaciones intra e interespecífica en anfibios de las tierras bajas. Se logró reconocer que, aunque algunas de las especies presentan alto solapamiento espacial, su coexistencia puede soportarse en el uso asincrónico del recurso espacial.
Las especies de anfibios utilizan los hábitats debido a condiciones más complejas que su oferta, aunque exista preferencia de algunas especies por las características que ofertan algunos tipos de hábitats, independientemente del tipo de cobertura o uso del suelo. Los hábitos de las especies se relacionan con la selección y ocupación de hábitats, e incluso algunos de los agrupamientos.
Existe la necesidad de estudios que permitan interpretar la salud de un hábitat particular por la presencia de las especies, además de estudios dirigidos a comprender las relaciones intraespecíficas e interespecíficas para la comprensión de los efectos de los cambios en el hábitat. Esto como insumo para la planeación del uso y manejo de los recursos naturales en el tiempo, en la medida que acercándose a la interpretación de la dinámica espacio temporal de las especies se pueden ajustar el aprovechamiento sustentable de los recursos naturales y la biodiversidad.















