Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Cancerología
Print version ISSN 0123-9015
rev.colomb.cancerol. vol.19 no.4 Bogotá Oct./Dec. 2015
https://doi.org/10.1016/j.rccan.2015.09.001
http://dx.doi.org/10.1016/j.rccan.2015.09.001
REPORTE DE CASO
Síndrome de teratoma creciente: reporte de caso y revisión de la literatura
Growing teratoma syndrome: a case report and review of the literature
Mónica Medinaa, Diana Santanaa, María Islena Beltránb y Oscar Serranoa,c,*
a Departamento de Ginecología Oncológica, Instituto Nacional de Cancerología, Bogotá D. C., Colombia
b Departamento de Patología Oncológica, Instituto Nacional de Cancerología, Bogotá D. C., Colombia
c Posgrado en Ginecología y Obstetricia, Universidad Militar Nueva Granada, Bogotá D. C., Colombia
* Autor para correspondencia. Correo electrónico: oscarfernandoserranoortiz@gmail.com (O. Serrano).
Recibido el 19 de junio de 2015; aceptado el 1 de septiembre de 2015 Disponible en Internet el 14 de noviembre de 2015
Resumen
El síndrome de teratoma creciente (STC) es una condición poco común que se presenta en pacientes con tumores de células germinales no seminomatosos (TCGNS) de tipo teratoma inmaduro. Se caracteriza por la aparición de masas metastásicas que pueden alcanzar grandes volúmenes durante o después de la administración de la quimioterapia, asociado a la negativización de los marcadores tumorales. Histopatológicamente estas masas corresponden a un teratoma maduro. A continuación se presenta el caso de una paciente de 24 años, con diagnóstico de síndrome de teratoma creciente, incluyendo su evaluación, manejo quirúrgico y seguimiento a corto plazo.
Palabras clave: Teratoma inmaduro; Síndrome de teratoma creciente; Retroconversión.
Abstract
The growing teratoma syndrome is a rare condition that occurs in patients with non-seminomatous germ cell immature teratoma. It is characterised by the appearance of metastatic masses that can reach large volumes during or after administration of chemotherapy, associated with the negative result for tumour markers. Histopathologically these masses correspond to a mature teratoma which is explained by a retroconversion phenomenon. The case is presented of a 24 year-old patient, diagnosed with growing teratoma syndrome, including her evaluation, surgical management, and short-term follow-up.
Keywords: Immature teratoma; Growing teratoma sindrome; Retroconversion.
Introducción
El síndrome de teratoma creciente fue descrito por primera vez por Logothetis et al. en 1982. Consiste en una condición poco frecuente que se presenta en pacientes con TCGNS de tipo teratoma inmaduro. Se caracteriza por la aparición de masas metastásicas que pueden alcanzar grandes volúmenes durante o después de la administración de la quimioterapia, asociado a la negativización de los marcadores tumorales1. Histopatológicamente estas masas corresponden a un teratoma maduro, lo cual es explicado por un fenómeno de retroconversión a la quimioterapia2.
Hasta la fecha, hemos encontrado alrededor de 44 casos reportados en la literatura mundial. Dada la baja incidencia, el reto en la sospecha diagnóstica, la rápida progresión de la enfermedad y la dificultad que en algunas ocasiones conlleva su abordaje quirúrgico, comentamos el caso de una paciente manejada en el Instituto Nacional de Cancerología en el año 2014 y revisamos la literatura referente al caso.
Descripción del caso clínico
Se trata de una paciente femenina de 24 años, que cursaba con dolor y distensión abdominal desde noviembre del 2012. Como antecedentes ginecológicos, la paciente presentó menarquia a los 12 años, ciclos irregulares (oli-gomenorreas), una gestación y la fecha del último parto fue hace 2 años.
Solicitó ecografía transvaginal que reportó una masa sólida en anexo izquierdo de 18 x 10 cm y una masa predominantemente quística de 16 x 10 cm, con vegetaciones en su interior, dependiente de anexo derecho, asociado a líquido libre en moderada cantidad; marcadores tumorales Ca 125: 90,4 UI/ml, AFP: 193 UI/ml, B-HCG: menor a 1 mUI/ml, por lo cual en mayo de 2013 se realizaron una ooforectomía izquierda, resección de masas ováricas bilaterales, apendicectomía y omentectomía, extrainstitucional. El reporte de patología evidenció un teratoma inmaduro de ovario izquierdo grado 3 (fig. 1) y un teratoma quís-tico maduro de ovario derecho; el epiplón, el apéndice y el líquido peritoneal fueron negativos para malignidad.
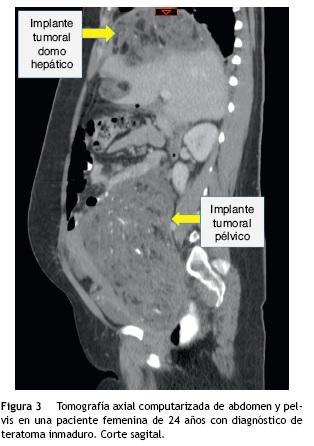
Recibió tres ciclos de quimioterapia (bleomicina, etopo-sido y cisplatino) presentando neumonía, anemia severa y neutropenia febril. Presentó negativización de marcadores tumorales; sin embargo, las imágenes de control realizadas en julio de 2013 evidenciaban una masa heterogénea de 7 x 6 cm en el espacio recto-uterino, que desplazaba anteriormente el útero y la vejiga, y generaba compresión parcial del recto. El cuarto ciclo de quimioterapia lo terminó en octubre de 2013, por lo cual realizaron una nueva tomografía abdominopélvica que reportó hacia la pelvis, gran formación heterogénea de componente mixto, con calcificaciones en su interior, dado por una lesión neoplásica probablemente de origen ginecológico; hígado con imágenes hipodensas periféricas, con pequeñas calcificaciones en su interior, localizadas en el domo hepático y lóbulo derecho, de bordes definidos, al parecer no infiltrantes, que correspondían probablemente a lesiones secundarias y adicionalmente una formación hipodensa lobulada, sólida, con calcificaciones, localizada hacia el flanco izquierdo en la cavidad peritoneal (figs. 2-4 ).
Por cambio en su entidad promotora de salud, acudió al Instituto Nacional de Cancerología en donde se consideró tumor de ovario germinal (teratoma inmaduro, no se des carta tumor del seno endodérmico por elevación de AFP), estadio IA; con progresión intraperitoneal extensa luego de tercer ciclo de quimioterapia; se discutió en la junta mul tidisciplinaria y se decidió llevar a laparotomía exploratoria con intención de citorreducción, en conjunto con el servicio de cirugía gastrointestinal y hepatobiliar.
El procedimiento quirúrgico fue programado para diciembre del 2013, pero se canceló por cuadro de farin goamigdalitis bacteriana. Finalmente, en enero de 2014 se realizó una citorreducción óptima, con resección de múl tiples implantes tumorales retroperitoneales, en la raíz del mesenterio y suprahepático, histerectomía abdominal total y salpingooforectomía derecha, sin complicaciones (fig. 5).
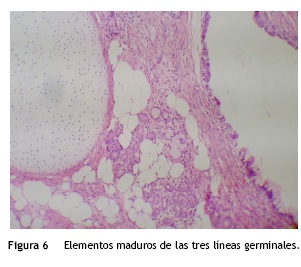
La paciente presentó una evolución satisfactoria en su postoperatorio y acudió con reporte definitivo de patología que evidenció teratoma qu stico maduro en la totalidad de los implantes resecados (fig. 6).
Los marcadores tumorales se encontraban negativos. Fue valorada en conjunto con servicios de ginecología oncológica y oncología clínica quienes consideraron cuadro de retro-conversión de teratoma inmaduro; la paciente no requirió manejo adicional con quimioterapia, se inició terapia de reemplazo hormonal y se programaron controles periódicos cada 3 meses. Un año posterior al procedimiento quirúrgico, la paciente se encontraba libre de enfermedad.
Discusión
El STC consiste en la aparición de masas metastásicas voluminosas durante o después de la quimioterapia, administrada como tratamiento para TCGNS, asociado a la negativización de los marcadores tumorales. Estas masas histopatológicamente corresponden a teratomas maduros1.
El STC ha sido descrito en TCGNS originados en el testículo, en los ovarios y con mucha menor frecuencia en el mediastino y en la glándula pineal3,4.
Dada la baja frecuencia en su presentación, no existen datos reportados en cuanto a su prevalencia. André et al., presenta el mayor número de casos reportados en la literatura y describe una ocurrencia de STC en 2-7% de los TCGNS, aunque solo 3 de los 33 casos reportados en su trabajo corresponden a tumores de origen ovárico5. Se presenta comúnmente en la segunda y tercera década de la vida; no obstante, existen casos publicados tan temprano como a la edad de 5 años6,7 y tan tardíos como a los 51 años8.
Existe la tendencia a diferenciar el término de «síndrome de teratoma creciente» de «fenómeno de retroconversión», afirmando que en el primero las masas metastásicas conservan la capacidad para aumentar de tamaño mientras que en el fenómeno de retroconversión, las masas permanecen estables; sin embargo, Ansalem et al. concluye en su revisión que el STC y el fenómeno de retroconversión corresponden probablemente al mismo fenómeno9.
Se han planteado diferentes hipótesis en cuanto a su etiología: la primera afirma que la quimioterapia destruye las células malignas inmaduras, dejando únicamente los elementos de teratoma benignos (elementos maduros); la segunda plantea que la quimioterapia altera la cinética de una célula germinal maligna totipotencial, llevándola hacia la diferenciación en un teratoma maduro benigno; la tercera habla de una diferenciación inherente y espontánea de las células malignas en tejidos benignos, y la cuarta que propone que el STC corresponde a metástasis benignas provenientes de un componente de teratoma maduro no reconocido en un tumor primario maligno5,10.
El diagnóstico inicia por sospecha clínica tras la aparición de masas metastásicas voluminosas durante o después de la quimioterapia, administrada como tratamiento para TCGNS, asociado a la negativización de los marcadores tumorales1.
Vale la pena mencionar la elevación inicial de los niveles de alfa-fetoproteína (AFP) presentados por la paciente. Esta elevación puede darse en algunos teratomas inmaduros puros o puede ser explicada por un posible componente mixto, en este caso, teratoma inmaduro con tumor del seno endodérmico; sin embargo, la revisión histopatológica no evidenció tal componente, lo que no descarta también un posible error de laboratorio. La inmunohistoquímica no fue considerada necesaria por ninguno de los patólogos (extra o intrainstitucional).
Todos los tumores de células germinales malignos pueden presentar un componente mixto. La combinación más comúnmente reportada en la literatura es disgerminoma con tumor del seno endodérmico; no obstante, cualquier combinación puede ser presentada, lo que explica la elevación simultánea de diferentes marcadores como la LDH, AFP y/o HCG, en este tipo de tumores. La elevación de estos marcadores no solo contribuye al diagnóstico, sino también al seguimiento y al pronóstico. En especial, la elevación de AFP se ha relacionado con un comportamiento más agresivo de la enfermedad y un peor pronóstico11-14. Pendlebury et al. describe un caso de elevación de la AFP aun posterior a la quimioterapia y resección quirúrgica completa, sin evidencia de recaída tumoral15.
Se han descrito características imagenológicas sugestivas de retroconversión tales como: incremento en la densidad de las masas, márgenes mejor circunscritos en relación con el tejido adyacente, aparición de calcificaciones internas con áreas grasas y cambios quísticos, en comparación con estudios previos. Finalmente, el diagnóstico se confirma con el estudio histopatológico del espécimen quirúrgico16.
La resección quirúrgica es considerada el tratamiento de elección, sin requerir quimioterapia adyuvante. La intervención quirúrgica debe realizarse con prontitud para evitar que la resección se haga más difícil por el rápido crecimiento de las masas y/o aparición de nuevas lesiones. Según la experiencia quirúrgica reportada por el MD Anderson, la disección de ganglios linfáticos retroperitoneales proporciona un excelente control local y un bajo riesgo de progresión17.
En nuestro caso, se logró una citorreducción óptima sin complicaciones intra o post-operatorias y la paciente se encuentra libre de enfermedad un año después de la intervención quirúrgica. La resección completa de la enfermedad ha sido reportada en una alta proporción de las pacientes (80-100%)5,12. La tasa de recaída estimada en las pacientes sometidas a una resección completa es del 4% vs. 83% en caso de resección incompleta. La supervivencia global y el periodo libre de enfermedad a 5 años es del 90% y 73% respectivamente5. Bentivegna et al., en un análisis retrospectivo de 38 casos, describe tasas de citorreducción completa de hasta un 65,7% de los casos, dentro de los cuales se realizaron intervenciones como peritonectomías (n: 22), resecciones intestinales (n: 8) y esplenectomías (n: 5). En 52,6% (n: 20) de las pacientes, pudo llevarse a cabo cirugía conservadora de fertilidad, de las cuales 25% (n: 5) lograron un embarazo. En un tiempo de seguimiento promedio de 73 meses, 23,6% de los pacientes (n: 10) recayeron en forma de teratoma maduro, de los cuales 80% (n: 8) habían tenido una citorreducción completa inicial. Una paciente falleció a causa de su enfermedad, secundario a una obstrucción intestinal y tromboembolismo pulmonar18.
Existen hasta la fecha dos casos reportados por Shigeta y De Cuypere et al., en cuanto a experiencia en resección quirúrgica por vía laparoscópica19,20.
Se han descrito otras opciones terapéuticas como el manejo médico con interferón alfa e inhibidores de cdk4/6. Sin embargo, esto no ha sido confirmado en una cohorte de pacientes y por lo tanto es necesaria más experiencia para validar este tipo de tratamiento5,21,22.
Responsabilidades éticas
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de intereses
Los autores declaran que no existe ningún conflicto de intereses.
Agradecimientos
Dr. Pedro Hernando Calderón y Lina María Trujillo, revisores institucionales del artículo.
Bibliografía
1. Logothetis CJ, Samuels ML, Trindade A, Johnson DE. The growing teratoma syndrome. Cancer. 1982;50(8):1629-35. [ Links ]
2. DiSaia PJ, Saltz A, Kagan AR, Morrow CP. Chemotherapeutic retroconversion of immature teratoma of the ovary. Obstet Gynecol. 1977;49(3):346-50. [ Links ]
3. Afifi HY, Bosl GJ, Burt ME. Mediastinal growing teratoma syndrome. Ann Thorac Surg. 1997;64(2):359-62. [ Links ]
4. O'Callaghan AM, Katapodis O, Ellison DW, Theaker JM, Mead GM. The growing teratoma syndrome in a nongerminomatous germ cell tumor of the pineal gland: a case report and review. Cancer. 1997;80(5):942-7. [ Links ]
5. André F, Fizazi K, Culine S, Droz J, Taupin P, Lhommé C, et al. The growing teratoma syndrome: results of therapy and long term follow-up of 33 patients. Eur J Cancer. 2000;36(11):1389-94. [ Links ]
6. Inaoka T, Takahashi K, Yamada T, Miyokawa N, Tokusashi Y, Yoshida M, et al. The growing teratoma syndrome secondary to immature teratoma of the ovary. Eur Radiol. 2003;13(9):2115-8. [ Links ]
7. Tanjitgamol S, Manusirivithaya S, Leelahakorn S, Thawaramara T, Suekwatana P, Sheanakul C. The growing teratoma syndrome: a case report and a review of the literature. Int J Gynecol Cancer. 2006;16 Suppl 1:384-90. [ Links ]
8. Altinbas SK, Turan T, Altinbas NK, Ozfuttu A, Boran N, Tulunay G. An old patient with growing teratoma syndrome of the ovary. Asian pacific Journal of reproduction. 2013;2(2):166-8. [ Links ]
9. Amsalem H, Nadjari M, Prus D, Hiller N, Benshushan A. Growing teratoma syndrome vs. chemotherapeutic retroconversión: case report and review of the literature. Gynecol Oncol. 2004;92:357-60. [ Links ]
10. Gorbatiy V, Spiess PE, Pisters LL. The growing teratoma syndrome: Current review of the literature. Indian J Urol. 2009;25(2):186-9. [ Links ]
11. Goyal LD, Kaur S, Kawatra K. Malignant mixed germ cell tumour of ovary- an unusual combination and review of literature. J Ovarian Res. 2014;7:91. [ Links ]
12. Koshy M, Vijayananthan A, Vadiveloo V. Malignant ovarian mixed germ cell tumour: a rare combination. Biomed Imaging Interv J. 2005;1(2):e10. [ Links ]
13. Kwoi KKM, Loke TKL, Hui JPK, Lai MHY, Chan JCS. Malignant mixed germ cell tumour of the ovary in 10 year old girl. J HK Coll Radiol. 2008;11:92-5. [ Links ]
14. Murugaesu N, Schmid P, Dancey G, Agarwal R, Holden L, McNeish I, et al. Malignant ovarian germ cell tumors: identification of novel prognostic markers and long-term outcome after multimodality treatment. J Clin Oncol. 2006;24(30):4862-6. [ Links ]
15. Pendlebury A, Rischin D, Ireland-Jenkin K, Toner GC, Grant P. Ovarian Growing Teratoma Syndrome With Spuriously Elevated alpha-Fetoprotein. J Clin Oncol. 2014. [ Links ]
16. Moskovic E, Jobling T, Fisher C, Wiltshaw E, Parsons C. Retroconversion of immature teratoma of the ovary: CT appearances. Clin Radiol. 1991;43(6):402-8. [ Links ]
17. Spiess PE, Kassouf W, Brown GA, Kamat AM, Liu P, Gomez JA, et al. Surgical management of growing teratoma syndrome: the M. D. Anderson cancer center experience. J Urol. 2007;177(4):1330-4. [ Links ]
18. Bentivegna E, Azaïs H, Uzan C, Leary A, Pautier P, Gonthier C, et al. Surgical Outcomes After Debulking Surgery for Intraabdominal Ovarian Growing Teratoma Syndrome: Analysis of 38 Cases. Ann Surg Oncol. 2015. [ Links ]
19. Shigeta N, Kobayashi E, Sawada K, Ueda Y, Yoshino K, Hori Y, et al. Laparoscopic excisional surgery for growing teratoma syndrome of the ovary: case report and literature review. J Minim Invasive Gynecol. 2015;22(4):668-74. [ Links ]
20. De Cuypere M, Martinez A, Kridelka F, Balague G, Maisongrosse V, Ferron G. Disseminated ovarian Growing Teratoma Syndrome: a case -report highlighting surgical safety issues. Facts Views Vis Obgyn. 2014;6(4):250-3. [ Links ]
21. Ornadel D, Wilson A, Trask C, Ledermann J. Remission of recurrent mature teratoma with interferon therapy. J R Soc Med. 1995;88(9):533P-4P. [ Links ]
22. Kim DY, Karam JA. Editorial Comment to Growing teratoma syndrome: clinical and radiographic characteristics. Int J Urol. 2014;21(9):909. [ Links ]