INTRODUCCIÓN
Carludovica palmata (Ruiz-L H & Pavón y Jiménez JA), es una planta monocotiledonea que pertenece a la familia Cyclanthaceae. Se caracteriza por poseer hojas adultas palmeadas y laminales que forman dobleces sobre las nervaduras, adquiriendo una forma de sombrilla (Harling et al. 1998). La palma de iraca también conocida como jipijapa o paja toquilla, se encuentra en la zona Neotropical del continente americano, desde Perú hasta México (Fadiman 2001), su distribución y crecimiento se da normalmente a altitudes de 900 a 1800 m., con temperaturas que fluctúan entre los 22 °C y 26 °C (Bennett et al. 1992, Muñoz-R y Tu-berquia-M 1999). Aunque en Colombia puede encontrarse en zonas boscosas por debajo de los 900 m. Históricamente la industrialización del cultivo de la palma de iraca se asocia a la fabricación de sombreros, actividad que inició en el siglo XVI en Montecristi en la provincia de Manabí Ecuador (Anchundia-Rodríguez et al. 2016).
La explotación de la palma de iraca exhibe un gran potencial económico como producto forestal no maderable (te Velde et al. 2006, Galviz-Quezada et al. 2019), producto alimenticio (Álvarez Salas 2015), posible fuente de fibras vegetales en biocompuestos (Bourmaud et al. 2018) y como materia prima en la fabricación de diversas artesanías (Muñoz-R y Tuberquia-M 1999). Sin embargo, los cultivos de palma de iraca se han reducido significativamente dado que han sido reemplazados por otros cultivos (Córdoba y Portilla 2005), incluyendo plantas ilícitas y también por el bajo relevo generacional de productores de iraca.
La palma de iraca se reproduce asexualmente, regularmente, por medio de hijuelos o tallos subterráneos (Harling et al. 1998). Este sistema de propagación no permite amplias tasas de multiplicación, ya que la cantidad de rizomas está limitada por la capacidad natural de la planta para producirlos, además de verse comprometida su integridad, ya que se afecta el sistema radicular al sacar los hijuelos para obtener material vegetal de propagación (Córdoba y Portilla 2005). Por otra parte, la baja tasa de germinación de las semillas producidas sexualmente (Gómez et al. 2011), la inexistencia de semilla certificada y mejorada genéticamente es una limitante para que los productores puedan ampliar sus áreas cultivadas (Córdoba y Portilla 2005), lo que conlleva a una alta demanda de la materia prima requerida para todos los usos mencionados anteriormente.
Se han considerado varios factores que afectan la baja tasa germinativa de las semillas, como la inmadurez del embrión, la estructura de la testa, las condiciones de luz y temperatura, así como el tratamiento de desinfección al que son sometidas tradicionalmente (Orozco-Segovia et al. 2003). Así mismo, en muchas especies de plantas, la germinación de sus semillas es lenta y heterogénea, afectando negativamente la emergencia de las plántulas (Yang et al. 2007). Por ello, se sutilizan diferentes métodos para aumentar el porcentaje de germinación, entre los que están: deshidratación e hidratación (Rubio Neto et al. 2012), uso de reguladores de crecimiento como el ácido giberélico (GA3) (Saldívar-Iglesias et al. 2010), escarificación (Moussa et al. 1998), y cultivo in vitro de embriones aislados (Tzec-Simá et al. 2006), que han permitido superar los problemas causados por la latencia de las semillas.
Por lo tanto, se requiere desarrollar métodos que permitan mejorar la capacidad germinativa de las semillas de la palma de iraca (Hoyos Sánchez et al. 2020), mediante el uso de reguladores de crecimiento y tratamientos de desinfección eficientes, para disponer de material vegetal de propagación, que conlleve a la obtención de protocolos eficientes y económicos y que puedan ser replicados por los productores de palma de iraca para mejorar su productividad. El objetivo de esta investigación fue evaluar la capacidad de germinación de las semillas en condiciones in vitro y ex vitro procedentes de dos estadios de madurez de infrutescencias de Carludovica palmata.
MATERIALES Y MÉTODOS
Las pruebas experimentales de esta investigación se realizaron en el Laboratorio de Biotecnología Vegetal y el Vivero de la Universidad Nacional de Colombia Sede Medellín.
Obtención de material vegetal
Las semillas fueron obtenidas de infrutescencias sanas y frescas de palma de iraca (Figs. 1a y 1b), provenientes de la colección Arboretum y Palmetum de la Universidad Nacional de Colombia sede Medellín, ubicada a los 6°15' Norte y 75°34' Oeste, en una zona geográfica con una temperatura que oscila entre 16 y 26 °C, una precipitación promedio de 2958 mm al año y una altitud de 1475 m. Las infrutescencias cosechadas se lavaron con agua corriente y jabón antibacterial, luego se secaron y se cortaron en trozos pequeños con un bisturí hasta separar las bayas. Se extrajeron manualmente las semillas de las bayas y se colocaron en papel secante y se dejaron a temperatura ambiente, a la sombra, durante ocho días. Pasado este tiempo, las semillas fueron roseadas con una solución del fungicida
Propamocarb® a una concentración de 5,0 mlL-1, después se sumergieron en un recipiente con 15 mL de agua destilada y dos gotas de Tween 20 durante 30 minutos. Luego las semillas fueron lavadas tres veces con agua destilada estéril, para posteriormente sumergirlas en una solución de etanol al 70 % v/v durante cinco minutos y lavarlas de nuevo tres veces con agua destilada estéril.
Estados de madurez de la infrutescencia en la germinación de semillas cultivadas in vitro. Para evaluar la capacidad germinativa de las semillas, según el estado de madurez de las infrutescencias, se partió de dos estadios de desarrollo muy contrastantes a saber: estado E1, el cual fue asignado a las infrutescencias inmaduras de color verde ligeramente oscuro, internamente poco carnosas y sin tejidos blandos (Fig. 1b), y estado E2, a las infrutescencias maduras de color verde amarillento, con tejido interno blando de color rojo intenso (Figs. 1a, 1c y 1d).

Figura 1 Infrutescencia de (Carludovica palmata). a. Infrutescencia madura tipo E2, b. Infrutescencia madura tipo El, c. Bayas de infrutescencia madura, d. Semillas.
Las infrutescencias fueron cosechadas y de estas se registraron las siguientes características: longitud, grosor, número de bayas, número de semillas por cada baya y peso de las semillas. La medición se realizó en una muestra de 24 infrutescencias tipo E2 y 25 infrutescencias tipo E1, muestreadas al azar. El conteo de las semillas se realizó a partir de una muestra de 34 bayas igualmente mues-treadas al azar, obtenidas de cuatro infrutescencias. Las infrutescencias tipo E1 presentaron las siguientes características: longitud 19,2 ± 2,7 cm, grosor 10,4 ± 1,2 cm, cada infrutescencia contenía 279,8 ± 51 bayas y cada baya contenía 88,3 ± 13 semillas sanas. Las infrutescencias tipo E2 presentaron las siguientes características: longitud 20,0 ± 2,6 cm, grosor 12,0 ± 1,4 cm, cada infrutescencia contenía 245 ± 43 bayas, y cada baya contenía un promedio de 87 ± 4,8 semillas sanas (Fig. 1d), con un peso promedio de 0,75 ± 0,04 mg por cada semilla seca.
Las semillas se desinfectaron como se describió anteriormente, pero con la adición de NaClO al 2,0 % p/v. Las semillas se colocaron repartidas en frascos de vidrio de boca ancha de 7 onzas, con 15 ml de medio de cultivo MS cada uno. El medio MS semisólido (Murashige y Skoog 1962) se preparó con sales y vitaminas básicas, suplementado con ácido indol butírico (IBA) 0,05 mgL-1, ácido giberélico (GA3) 0,025 mgL-1, bencil amino purina (BAP) 0,5 mg L-1, sacarosa 20 gL-1, phytagel® 1,8 gL-1 y Myositol 100 mgL-1. Las concentraciones de hormonas fueron definidas a partir de estudios previos realizados en el Laboratorio de Biotecnología Vegetal de la Universidad Nacional de Colombia sede Medellín. El pH del medio fue ajustado con NaOH 2 mol/L antes de la esterilización por autoclave. En cada frasco se colocaron diez semillas y por cada estado de madurez, se usaron seis frascos. Las semillas fueron germinadas con un fotoperiodo 16/8 de luz/oscuridad, temperatura de 25 °C, durante 21 días. De cada frasco, se contaron las semillas que germinaron y a partir de estos datos, se calculó el porcentaje de germinación.
Evaluación del porcentaje de contaminación usando NaClO como desinfectante.
Parte de las semillas desinfectadas obtenidas de infrutescencias E2 se colocaron en una cámara de flujo laminar, en donde se separaron aleatoriamente en cuatro grupos de 80 semillas cada uno, Gr1, Gr2, Gr3 y Gr4, para luego sumergirlas durante 20 minutos en frascos con hipoclorito de sodio (NaClO) en concentraciones de 0, 1, 2 y 3 % p/v; respectivamente. Después del tratamiento de desinfección se realizó un triple lavado con agua destilada estéril. Una vez desinfectadas, se tomaron 80 semillas del grupo Gr1 y con una aguja hipodérmica desinfectada, se sembraron en ocho frascos para el tratamiento correspondiente, con un total de diez semillas por frasco. Cada frasco contenía 15 ml de medio de cultivo semisólido MS preparado como se describió anteriormente. Los cultivos se mantuvieron en fotoperiodo de 16/8 de luz/oscuridad a una temperatura de 25 °C durante 21 días, observando su desarrollo cada siete días. Se repitió el mismo procedimiento para los grupos Gr2, Gr3 y Gr4 en sus respectivas concentraciones de NaClO, con ocho frascos por tratamiento y diez semillas para cada frasco. El porcentaje de contaminación se determinó a partir del conteo de frascos con evidencia de crecimiento de hongos o bacterias frente al número total de frascos evaluados por cada grupo.
Determinación del porcentaje de germinación bajo condiciones in vitro y ex vitro.
Para determinar el porcentaje de germinación de las semillas, se utilizaron cuatro sustratos, de los cuales tres fueron ex vitro: tierra, turba y mezcla tierra-turba en relación 1:1, y uno in vitro con medio de cultivo MS semisólido. Para los tratamientos ex vitro, se emplearon vasos plásticos de cinco onzas, los cuales se llenaron 3/4 partes de su capacidad con cada sustrato previamente esterilizado por autoclave. Cada vaso fue perforado en la parte inferior, para liberar el exceso de agua. Para evitar el daño de las semillas por ataque de hongos, estas se fumigaron con una solución de Propamocarb® a una concentración de 5,0 mil/1. En cada vaso se sembraron diez semillas obtenidas de infrutescencias tipo E2 y fueron empleados seis vasos por cada sustrato, para un total de 60 semillas por cada grupo ex vitro. Las semillas fueron sembradas y colocadas en un vivero con temperatura 16 - 26°C y humedad relativa 82 - 88 % durante 21 días de cultivo; pasado este tiempo se realizó el conteo de las semillas que germinaron por cada vaso. Para el tratamiento in vitro, se utilizaron seis frascos de vidrio de boca ancha con 15 ml de medio MS cada uno, los cuales fueron preparados como se describió anteriormente. En cada frasco se colocaron diez semillas obtenidas de infrutescencias E2, las cuales se cultivaron en una condición de fotoperiodo de 16/8 de luz/oscuridad y temperatura de 25 °C durante 21 días (Figs. 2a y 2b). De cada vaso o frasco se contaron las semillas que germinaron y a partir de estos datos se calculó el porcentaje de germinación con respecto al total de semillas usadas.
Efecto del ácido giberélico (GA3) sobre el porcentaje de germinación
Para la evaluación del porcentaje de germinación con respecto a los eventos fisiológicos asociados a la dormancia en semillas, se tuvo en cuenta el efecto que tiene el ácido giberélico (GA3) mediante un ensayo ex vitro en condiciones de vivero, usando turba como sustrato, y otro in vitro.
Para los experimentos in vitro las semillas extraídas de infrutescencias tipo E2, se sembraron en frascos de vidrio que tenían 15 ml de medio de cultivo MS semisólido de los cuales, ocho frascos fueron suplementados con GA3 a una concentración de 0,025 mgL-1, y ocho frascos sin GA3. En cada frasco se sembraron diez semillas, para un total de 80 semillas expuestas al GA3 y 80 semillas no expuestas a dicha hormona. El porcentaje de germinación se evaluó una vez las semillas presentaron clara evidencia de germinación como es la emergencia de las hojas cotiledonares, proceso que sucedió a los 21 días después de sembradas (Fig. 2a). Una vez pasado este tiempo, se contabilizó el número de semillas germinadas, sobre el número total de semillas sembradas para cada frasco.

Figura 2 Germinación de semillas de palma de iraca (Carludovica pal-mata). a. En medio semisólido MS a los 21 días. b. En medio semisólido MS a los 60 días. c. En turba a los 60 días.
Para evaluar el porcentaje de germinación bajo condiciones ex vitro, las semillas se dividieron en tres grupos (G1, G2 y G3), cada grupo fue embebido durante doce horas en agua esterilizada suplementada con tres concentraciones de GA3: 0; 50 y 100 mgL-1 respectivamente. Luego las semillas fueron sembradas en vasos de plástico desechables de una onza que contenían turba previamente esterilizada por autoclave, con cinco repeticiones para concentración de GA3. En cada vaso se sembraron diez semillas obtenidas de infrutescencias tipo E2 y fueron cultivadas durante 60 días a las mismas condiciones descritas anteriormente (Fig. 2c), pero el conteo de semillas germinadas se realizó a los 21 días y con los valores obtenidos se calculó el porcentaje de germinación.
Análisis estadístico
Para determinar el efecto del estado de madurez de las infrutescencias, el efecto de las condiciones de germinación in vitro y ex vitro, el efecto del GA3 tanto para condiciones in vitro como ex vitro, y el efecto del NaClO sobre el porcentaje de germinación como variable dependiente, se usó la prueba no paramétrica Kruskal-Wallis, con un nivel de significancia del 0,05. Para evaluar el efecto del NaClO sobre el porcentaje de contaminación, se realizó la misma prueba. La comparación de las medias entre los diferentes niveles dentro de cada tratamiento fue realizada empleando la prueba de comparación múltiple de Bonferroni. Las pruebas estadísticas fueron ejecutadas usando el programa estadístico R versión 3.3.1 (R Core Team c2016).
RESULTADOS
Influencia del estado de madurez de la infrutescencia sobre la germinación de semillas cultivadas in vitro
El porcentaje de germinación de las semillas provenientes de las infrutescencias E1 en condiciones in vitro, fue significativamente menor (KW = 25,37, gl = 1, P < 0,05) (17,95 ± 5,17 %), con respecto a las semillas de infrutescencias tipo E2, (86,84 ± 5,27 %). A partir de este resultado, se realizaron los demás experimentos usando semillas obtenidas de infrutescencias tipo E2.
Determinación del porcentaje de contaminación
A pesar de que no hubo diferencias significativas del efecto del NaClO sobre el porcentaje de contaminación (P > 0,05), los valores más bajos en el porcentaje de germinación se dieron en el tratamiento Gr4, cuando se usó la concentración de NaClO de 3,0 % p/v y los valores más altos se dieron cuando no se usó NaClO (P < 0,05) (Tabla 1).
Tabla 1 Efecto de la concentración de hipoclorito de sodio en la germinación y contaminación de semillas de palma de iraca (Carludovica palmata).
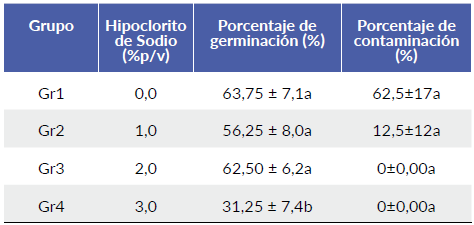
Medias con distinta letra dentro de columnas son estadísticamente diferentes (P < 0,05) Incluir según la prueba de Bonferroni. Los datos están representados como la media ± error estándar. N= 320 semillas.
Evaluación del porcentaje de germinación en condiciones in vitro y ex vitro
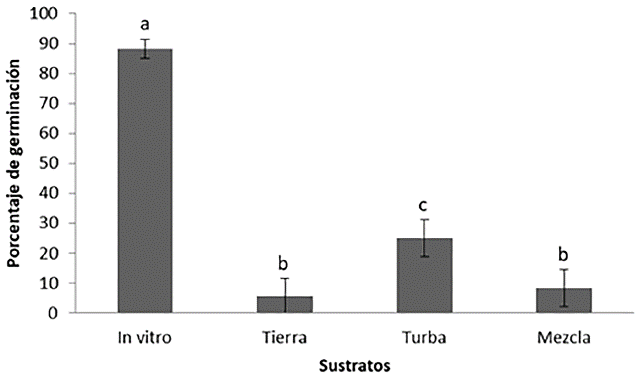
De los sustratos ex vitro la turba presentó el mayor porcentaje de germinación (25 ± 6,24 %), comparado con los sustratos tierra y la mezcla tierra-turba (5,56 ± 6,10 % y 8,33 ± 6,20 % respectivamente). Al comparar estos resultados con los obtenidos en condiciones de cultivo in vitro en medio semisólido MS, se incrementó significativamente el porcentaje de germinación con un valor de 88,2 ± 4,5 % (P < 0,05) (Fig. 3).
Efecto de la concentración de GA3 sobre el porcentaje de germinación
No se encontraron diferencias significativas del efecto de GA3 en el porcentaje germinación entre los tratamientos realizados en condiciones in vitro, ni tampoco en condiciones ex vitro (P > 0,05) (Tabla 2).
Tabla 2 Efecto de GA3 sobre el porcentaje de germinación de semillas de palma de iraca (Carludovica palmata).
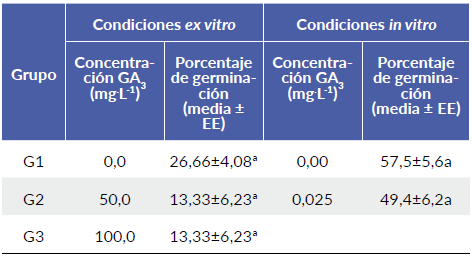
Medias con distinta letra dentro de columnas son estadísticamente diferentes (P<0,05) según la prueba de Bonferroni. Los datos están representados como la media ± error estándar (EE). N = 150 semillas en condiciones ex vitro y 160 semillas en condiciones in vitro.
DISCUSIÓN
Estados de madurez de la infrutescencia en la germinación de semillas cultivadas in vitro
El porcentaje de germinación de las semillas obtenidas del estado E1 fue significativamente menor con respecto a las infrutescencias en estado de desarrollo tipo E2. Esta diferencia podría estar asociada al grado de crecimiento y desarrollo tanto de las infrutescencias, como de las semillas, resultados que, aunque son importantes, sugieren realizar estudios más detallados de este proceso fisiológico. Según Criollo y Upegui-E (2005), la madurez fisiológica de la semilla coincide con el máximo contenido de materia seca, época que concuerda con el máximo valor germinativo como en el caso de las infrutescencias tipo E2 evaluadas en la presente investigación. Si bien, en las infrutescencias tipo E1, solo una parte de las semillas germinaron, lo que sugiere que, para este momento de recolección, como se describió anteriormente, no todas las semillas alcanzaron la madurez adecuada. Esto implicaría que se requiere un periodo más prolongado, en el cual completan la acumulación de reservas, principalmente de almidones, que les permitan alcanzar altos potenciales germinativos y, por esta razón, las semillas completamente maduras presentan un desarrollo físico y fisiológico que les garantiza la máxima expresión del vigor (Criollo et al. 1999). Además, se ha reportado que cuando se alcanza la madurez completa, ésta se asocia al rompimiento de dormancia, determinado por el equilibrio entre los factores de crecimiento giberelinas/ácido abscísico (Baskin y Baskin 2014).
Determinación del porcentaje de contaminación.
A pesar de que en la presente investigación no se encontraron diferencias significativas del tratamiento de NaClO sobre el porcentaje de contaminación, si se observó que afecta el porcentaje de germinación de las semillas de palma de iraca negativamente (P < 0,05), es decir que, a mayor concentración de NaClO, menor es el porcentaje de germinación y esto es evidente, debido principalmente a la citotoxicidad del hipoclorito sobre los tejidos de las semillas. Hasta el momento de escribir este artículo, no se encontraron reportes acerca de la desinfección de semillas para la palma de iraca o de especies relacionados con NaClO o con otras sustancias, por lo que se revisaron publicaciones sobre otras especies, en las cuales se usaron tratamientos similares. Así por ejemplo, para Dendrocalamus strictus (Roxb). Nees, se utilizó un protocolo de desinfección similar al del presente trabajo, aunque con concentraciones de NaClO superiores del 3,0 % y un tiempo de exposición de 30 minutos, encontrándose que, a mayor concentración del desinfectante, el porcentaje de germinación es menor (García-Ramírez et al. 2007), siendo resultados coherentes con los de la presente investigación; Así mismo, en estudios con semillas de bambú se encontró que con concentraciones de 1,5 % de NaClO durante 20 minutos, los porcentajes de germinación fueron de 96 % (Mukunthakumar y Mathur 1992) y 80 % (Madhulika et al. 2000), mostrando mejores porcentajes de germinación a bajas concentraciones de NaClO.
Estudios en orquídeas han mostrado que el uso de NaClO en protocolos de desinfección es una técnica simple y económica para la desinfección de semillas, pero sugieren que se deben usar concentraciones entre 1,0 y 2,0 %, para permitir la germinación (Rodríguez et al. 2007). Sin embargo, en la especie Nolina parviflora (Kunth) Hemsl, a concentraciones de NaClO al 3,0 % y a tiempos de exposición de cinco y diez minutos, no mostró ser eficiente en la desinfección de semillas, con porcentajes de contaminación del 33 y 11 % para cada tiempo respectivamente, evidenciando que el tiempo puede mejorar la germinación y disminuir la contaminación para valores superiores a diez minutos de exposición (Flores-Escobar et al. 2008). Naturalmente que, tanto el efecto de la concentración, así como el tiempo de exposición sobre los tejidos de las semillas está altamente ligado a la especie que se trate, conllevando así, a una posible toxicidad, dada la textura y composición de los tejidos que componen la semilla (Causil et al. 2017).
Evaluación del porcentaje de germinación bajo condiciones in vitro y ex vitro
El mayor porcentaje de germinación ex vitro se registró en el sustrato turba comparado con los sustratos tierra y la mezcla tierra-turba, probablemente debido a que la turba es un material inerte con una capacidad alta de retención de agua, en tanto que los sustratos tierra y mezcla tierra-turba podrían ser más susceptibles a estar contaminados (Franco et al. 2007, Gómez et al. 2011, Azcón-Bieto y Talón 2013). Por otra parte, en condiciones in vitro el porcentaje de germinación fue significativamente mayor comparado con los sustratos ex vitro, dado que las condiciones in vitro son completamente asépticas y cuentan no solamente con ambientes controlados de temperatura y humedad, sino también de macro y micronutrientes disponibles a la semilla, que podrían favorecer el proceso de germinación. Se aprecia una marcada influencia del tipo de sustrato y las condiciones de germinación en la capacidad germinativa de las semillas (Fig. 3). Según Doria (2010), muchos tipos de semillas no germinan porque las condiciones no son las más apropiadas (latencia impuesta), o no germinan, incluso aunque se encuentren en ambientes favorables, ya que ciertas condiciones propias de la semilla lo impiden (laten-cia innata o latencia de semillas); así, la salida del estado de latencia requiere estímulos ambientales tales como luz, bajas temperaturas o niveles de oxígeno adecuados.
Las condiciones in vitro usadas en la presente investigación, son excelentes para la germinación de las semillas de palma de iraca, rompiendo fácilmente la latencia impuesta y la latencia innata. En contraste con las condiciones ex vitro, el porcentaje de germinación de las semillas fue muy bajo. Esto podría justificarse considerando que en condiciones ex vitro es más difícil de controlar variables como luz, temperatura e incluso niveles de oxígeno, que de alguna u otra manera podrían afectar los procesos germinativos de las semillas de la palma de iraca.
Efecto de la concentración de GA3 sobre el porcentaje de germinación
No se encontraron diferencias significativas del efecto del GA sobre la germinación de semillas entre los tratamientos en condiciones in vitro, ni en condiciones ex vitro, descartando que la baja germinación de las semillas se deba a eventos asociados con la dormancia fisiológica (Baskin y Baskin 1998). Las giberelinas están implicadas directamente en el control y promoción de la germinación de las semillas; específicamente el GA3 es capaz de romper la latencia y remplazar la necesidad de estímulos ambientales, tales como luz y temperatura (Araya et al. 2000). Por lo tanto, se recomienda que, en posteriores investigaciones sobre germinación de semillas de palma de iraca, se evalúen otras concentraciones de GA3, al igual que variables fisiológicas y morfológicas relacionadas a la germinación. Saldívar-Iglesias et al. (2010), determinaron que al aumentar las concentraciones de GA3 en un intervalo de 0 hasta 250 mg/L, el porcentaje de germinación de semillas de Jaltomata procumbens (Cav.) J. L. Gentry, aumentó significativamente; de esta manera, cuando la concentración de GA3 fue de 250 mg/L, el porcentaje de germinación fue mayor, con un valor de 87,0 % y la velocidad de germinación igualmente aumentó, obteniendo un valor de 1,71 plántulas/día.
En conclusión, en esta investigación se encontró que las semillas de infrutescencias con madurez tipo E2 y sembradas en medio de cultivo MS in vitro, presentaron los mayores porcentajes de germinación, evidenciando que este método es eficiente para la multiplicación de plántulas de palma de iraca en comparación con protocolos convencionales. De esta manera, es posible conocer detalles que los agricultores puedan usar en el momento de seleccionar las infrutescencias para la extracción de semillas de buena calidad, para producir plántulas a gran escala. Esto permitirá la conservación y siembra de la palma de iraca de una manera más eficiente, en aras de mantener una producción constante de materia prima que conserve viva la actividad artesanal.