I. INTRODUCCIÓN
Las nitroanilinas han sido un grupo de compuestos nitroaromáticos usados en la producción de productos farmacéuticos, pesticidas, tintes y colorantes sintéticos. [1,2] Algunos derivados como la orto y meta nitroanilina son tóxicos, no biodegradables bajo condiciones aerobias, sus principales disposiciones son fuentes hídricas que la contaminan y se acumulan en sedimentos debido a su fuerte interacción con ácidos húmicos. [1-4] Por ello, se han realizado trabajos en degradación para estos compuestos como el reportado por Habibi et al, con reactores fotocatalíticos, lámpara de Hg, catalizado con ZnO en flujo de oxígeno dándose entre un 86 y 90% de degradación en agua para orto y meta nitroanilina, respectivamente. [5] Además, Mirkhani et al, realizó degradación fotocatalítica cambiando el catalizador por Ag-TiO2 en flujo de argón, produciendo para la orto-nitroanilina 91% y meta-nitroanilina 53% de degradación bajo una proporción 1:1 sustrato-catalizador. [6] Para observar el efecto del radical HO● en la meta-nitroanilina, Tariq et al., evidenció por Cromatografía de gases acoplada a detector de masas GC/MS la producción del 2-amino-4-nitrofenol por fotocatálisis con TiO2, lámpara de Hg y flujo de oxígeno. El compuesto obtenido es un paso intermediario que genera la degradación en este sistema. [7] Aunque ambos sistemas presentan bajos valores umbral límite (TLV), se han reportado mayores investigaciones para la degradación de su isómero para-nitroanilinina por diversos métodos fotocatalíticos. [8-16]
Los métodos de oxidación que envuelven la generación de radicales HO● en suficiente cantidad de agua para afectar su purificación son denominados Procesos Avanzados de Oxidación (PAOs). Estos métodos se han extendido al uso del radical sulfato. La principal aplicación de los PAOs se basa en la destrucción de contaminantes orgánicos e inorgánicos en aguas contaminadas. [17-19] Por ello la presente investigación se enfoca en estos métodos, específicamente PAOs basado en UV, donde los radicales son iniciados por fotones en presencia de un catalizador y/o oxidante. De los semiconductores más comunes el TiO2 es de los más ampliamente usados. El mecanismo de degradación se produce por partículas excitadas de TiO2 que generan huecos positivos con capacidad de oxidar y electrones negativos en la banda de conducción con capacidad de reducir. En la superficie del semiconductor se forman los radicales HO● a partir de OH-, H2O y O2. Si en el medio se utiliza H2O2 y O3, la radiación UV ayuda a producir radicales hidroxilos. [17-20] Por ende, este método ha reportado la degradación de muchos compuestos orgánicos [21-24].
Una forma alterna para realizar la fotocatálisis en laboratorio es evaluarla en un reactor heliofotocatalítico cilindro-parabólico compuesto (CPC). El reactor está diseñado con superficies parabólicas reflectantes que concentran y dirigen la radiación electromagnética a los flujos del contaminante a tratar. Su uso permite el aprovechamiento de la luz solar, confiriendo mayor economía a la degradación, es de fácil construcción y operación. En algunos casos han demostrado mejorar el porcentaje de degradación de los compuestos evaluados. [25-28]
En el presente estudio se realizó la degradación de los contaminantes orto-nitroanilina y meta-nitroanilina en medio acuoso, utilizando un reactor Heliofotocatalítico CPC. En el proceso se determinaron las variables de pH, tipo de ácido, flujo de contaminante y agente oxidante, que generan las condiciones óptimas para obtener el mejor porcentaje de degradación de los compuestos tratados.
II. DESARROLLO DEL ARTÍCULO
A. Construcción del reactor Heliofotocatalitico CPC
El reactor está compuesto por 4 tubos de pyrex (5 cm de diámetro, 50 cm de longitud y 2.5 mm de grosor) con separación de 5 cm entre ellos. Inclinación variable de 45° para los colectores CPC. Los colectores fueron elaborados con tubos PVC de 3 pulgadas, cortados diametralmente y recubiertos con papel aluminio como material reflectante. Los tubos de pyrex soportados sobre los colectores se conectaron por tubos de PVC de 1.5 pulgadas y ajustados con acoples recubiertos de caucho. El flujo del contaminante es impulsado y recirculado con una bomba sumergible HJ-931. Con una llave de paso se graduó el flujo volumétrico de la solución y se apoyó sobre una base de madera que permite remover fácilmente los colectores y tubos.
B. Degradación fotocatalítica
Se prepararon disoluciones de 50 ppm de orto-nitroanilina (98%, Sigma-Aldrich) y meta-nitroanilina (98%, Sigma-Aldrich). Las concentraciones iniciales y finales fueron determinadas en un espectofotómetro UV-VIS Lambda 17 Perkin-Elmer a 350 nm, sobre curvas de calibración previamente realizadas (r de 0.9993 y 0.9983 para orto-nitroanilina y meta-nitroanilina, respectivamente).
En el paso de la solución por el reactor heliofotocatalitico se utilizaron 6 L de las soluciones, donde se evalúan dos tipos de caudales dependientes de la potencia de la bomba (1.7 Lmin-1 y 13 Lmin-1). Los pH de las soluciones se fijaron a 4 para meta-nitroanilina y 2 para orto-nitroanilina, donde presentan la mejor degradación a nivel de laboratorio. [29] La evaluación del efecto según el tipo de ácido utilizado se realizó con soluciones de HNO3 (69%, P.E. 1.41, Merck), HCl (37%, P.E. 1.19, Merck) y H2SO4 (96%, P.E. 1.84, Merck), manteniendo el pH constante durante el proceso para cada solución. Por último, la adición de los agentes oxidantes se hizo después de fijar el pH. La primera especie utilizada es peróxido de hidrógeno (30%, P.E. 1.11, Merck) cuya concentración preparada in situ es de 700 ppm. [29] La cantidad de peróxido de hidrógeno se mantuvo constante durante el experimento para cada solución. La segunda especie utilizada es oxígeno molecular procedente del aire, que es introducido por burbujeo en las soluciones por una bomba de aire para acuarios. Cada condición (flujo, ácido, oxidante) se realizó por triplicado.
El proceso de Fotodegradación bajo luz solar se realizó por 4 h, previa fijación del TiO2 sobre la pared del tubo de pyrex. El proceso de retención se efectuó bajo recirculación de una solución acuosa inicial de 4 g en 6 L, luego cada hora se agrega 0.7 g más del fotocatalizador hasta 8 h. Por último, se dejaron 12 h adicionales de recirculación sin añadir óxido, para comprobar que la capa depositada no se removiera con el flujo de la solución.
C. Control biológico
Para la evaluación de la toxicidad de las aguas de trabajo con los contaminantes, se analizó el índice de mortalidad, empleando poblaciones de 50 guppies (Poecilia reticulata) antes, durante y después de la degradación de muestras aleatorias para cada compuesto, como se han reportado en varias investigaciones sobre toxicidad de aguas. [30-33] Las poblaciones fueron expuestas a la solución en un recipiente de 3 L durante 3 h antes (concentración 50 ppm de cada compuesto) y después de la degradación, al final de las cuales se realizó el conteo de sobrevivientes. Durante el proceso fotocatalítico, los guppies fueron introducidos en el recipiente empleado para la recirculación de la solución y separados de la bomba por una malla, realizando el conteo de especies sobreviviente.
III. RESULTADOS Y CONCLUSIONES
La evaluación del proceso fotocatalítico, se inicia calculando el porcentaje de degradación global (ecuación 1), a partir de la concentración inicial.
En la Tabla I, se muestran los resultados promedio de la degradación de cada compuesto bajo las condiciones planteadas. La meta-nitroanilina (meta-NA) presenta mayor facilidad a la degradación que su isómero orto-nitroanilina (orto-NA). Este fenómeno se podría evidenciar por las interacciones intramoleculares que presenta el sistema orto. Debido a la disposición de los grupos amino y nitro se genera un enlace de hidrógeno que favorece la rigidez en la estructura, como lo plantea Panunto. [34] El hidrácido favorece la degradación del sistema meta-nitroanilina, a diferencia de los oxácidos que benefician al isómero orto (Tabla I), como lo muestra el ácido sulfúrico en el porcentaje de degradación.
El tipo de oxidante utilizado exhibe mayor efecto sobre la fotodegradación de los contaminantes. El peróxido de hidrógeno aumenta de un 20% a un 30% el porcentaje en la solución con respecto al O2 del aire, esto se debe a la facilidad del H2O2 en formar radicales libres por acción de la radiación solar, que favorece la mineralización de las sustancias. Por último, el flujo volumétrico del paso de la solución por el reactor es variable, sin mostrar una tendencia hacia el máximo o mínimo caudal. Aunque los valores expuestos en la tabla 1 son heterogéneos, favorecen en algunas condiciones a los reportados por Habibi y Mirkhani et al, con otros fotocatalizadores. [5-6]
Tabla I Porcentaje promedio de degradación de la orto y meta nitroanilina, bajo condiciones evaluadas.

La Fig. 1, muestra que en la mayoría de los casos con días de alta intensidad los porcentajes de degradación se mantienen entre 80% y 100%. Las condiciones que no favorecen la mineralización de las estructuras son: flujo de oxígeno, HCl o HNO3, con ambos caudales para la orto-nitroanilina y flujo de oxígeno, H2SO4, caudal máximo para la meta-nitroanilina.

Fig. 1 Degradación de la orto (línea negra) y meta (línea roja) nitroanilina, en relación al tipo de muestra de la Tabla I.
Para darle validez a las interacciones intra e inter grupos de las condiciones evaluadas, se utiliza el análisis de varianza multifactorial, donde la hipótesis nula (H0) se plantea como: no existe diferencia significativa al variar el tipo de ácido, oxidante y/o el flujo de la solución. La hipótesis alterna (H1): existe diferencia significativa al variar el tipo de ácido, oxidante y/o el flujo de la solución. Se toma como aceptación de H0 si el p-valor es mayor a 0.05 (debido al límite de confianza del 95%) y la prueba F cumple Fcritico > Fcalculado. Los valores de Fcritico al 95% de confianza para el tipo de ácido (4.74), tipo de oxidante y flujo volumétrico (5.59), son iguales para ambos compuestos.
El análisis intra-grupos (Tabla II) para ambos contaminantes no se afecta con el tipo de ácido utilizado y el flujo volumétrico aplicado a la solución, mostrando que los grupos son homogéneos sin contraste significativo, proporcionando cruce de medias. Sin embargo, el tipo de oxidante es una variable que influye en el porcentaje de degradación, observando una diferencia significativa entre el uso de O2 o H2O2. La variación entre los oxidantes se debe a la velocidad de formación de radicales HO● en solución. Las interacciones entre efectos principales no proporcionó una relación significativa entre las variables evaluadas, P > 0.05, y Fcritico > Fcalculado, Tabla II. Esto es concordante con los datos obtenidos en los efectos intra-grupos.
TABLA II análisis de varianza multifuncional de efectos principales intra e inter grupos de la orto y meta Nitroanilina.

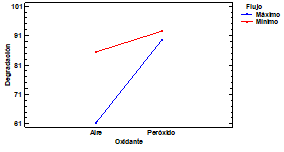
Las Figuras 2, 3 y 4, muestran los gráficos de interacciones obtenidos por el método de ANOVA para predecir las mejores condiciones de degradación en la orto-nitroanilina. En la Fig. 3, se manifiesta la interacción de los tipos de ácido y oxidante, donde refleja una mayor degradación con el ácido sulfúrico utilizando peróxido de hidrógeno. Los otros ácidos evidencian similar conversión entre ellos. Sin embargo, el tipo de oxidante es una variable significativa del sistema, siendo más bajo cuando se utiliza el oxígeno del aire. En la interacción del tipo de ácido con el flujo volumétrico, el ácido nítrico presenta las mayores diferencias. La relación ácido sulfúrico-flujo mínimo genera la mejor degradación. En la última relación flujo-oxidante (Fig. 4) no se observa una diferencia significativa entre los tipos de caudales, por ello aunque el flujo máximo es mejor por un 2%, se evidencian que el flujo mínimo genera mejores resultados.
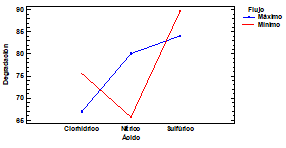
La meta-nitroanilina, exhibe las interacciones en la Fig. 5. De igual manera que su isómero orto, el uso de peróxido de hidrógeno y flujo mínimo, favorecen la conversión (Figuras 5 y 7). Sin embargo, la diferencia se manifiesta en el tipo de ácido utilizado, donde la degradación con el HCl se beneficia cuando se usa H2O2, y se desfavorece con el uso de HNO3 y el H2SO4 (Fig. 6).
La evaluación final de toxicidad de las soluciones con las especies guppies (Poecilia reticulata) se presentan en la Tabla III.
Los resultados para el control biológico mostraron una alta mortalidad de los guppies antes de efectuarse la degradación de los compuestos, con un 68% para el caso de la orto-nitroanilina y 60% en la meta-nitroanilina. Durante la degradación, los guppies no lograban sobrevivir al TiO2, el semiconductor se adhería a la piel de las especies provocando la muerte durante las tres primeras horas en ambos sistemas, 94% y 88% de mortalidad para los isómeros orto y meta, respectivamente.
Sin embargo, al finalizar la degradación el porcentaje de mortalidad evaluado sobre guppys tendió a cero, sobreviviendo la población entera al ser sumergida en las soluciones (Tabla III), por lo que podría inferirse que los compuestos se mineralizaron o se transformaron en sistemas de menor toxicidad.
IV. CONCLUSIONES
La evaluación fotocatalítica por TiO2 en radiación solar, presentó altos porcentajes de degradación para los sistemas orto y meta-nitroanilina, generando 77% y 82% en promedio para estos derivados aromáticos, respectivamente. Las condiciones óptimas del proceso son reflejadas con el uso del peróxido de hidrógeno, sin importar el flujo del caudal. Por su parte, el tipo de ácido beneficia la degradación, por ejemplo, el H2SO4 en la orto-nitroanilina. Además, el análisis biológico indica que la calidad del agua, luego de la degradación, es apropiada en principio para poblaciones de organismos acuáticos, donde se revelaría baja mortalidad de las especies por efecto de las nitroanilinas.