Introducción
En el mundo, la tuberculosis (TB) es la principal causa de muerte por infección en adultos y continúa siendo un problema de salud pública (1). Los dos tipos de manifestación clínica de la TB son la pulmonar y la extrapulmonar, aun cuando la primera es la más frecuente (2).
La TB extrapulmonar se produce por la presencia de micobacterias del complejo tuberculosis en órganos diferentes al pulmón (3) y se ha relacionado especialmente con inmunosupresión, secundaria a infección por virus de inmunodeficiencia humana (VIH) en países endémicos (4); sin embargo, existen pacientes que la desarrollan a pesar de no tener inmunocompromiso aparente o diagnosticado (5).
Los sitios afectados con mayor frecuencia son la pleura, los ganglios linfáticos, el tubo digestivo, peritoneo, el sistema osteoarticular, el sistema nervioso central, el aparato genitourinario, las vías aéreas superiores, el pericardio y la piel (5-10).
Las adenopatías intratorácicas (mediastinales o hiliares) y el derrame pleural tuberculoso sin infiltrados pulmonares constituyen también un caso de TB extrapulmonar (3). Entre el 10 % y el 50 % de estos pacientes pueden tener enfermedad pulmonar concomitante y deben ser evaluados con toma de muestras respiratorias (10), ya que estos casos de afectación del árbol bronquial o miliar se clasifica como caso de TB pulmonar (3).
El proceso diagnóstico de la TB extrapulmonar es, entonces, un reto clínico por la amplia heterogeneidad de las manifestaciones y su naturaleza paucibacilar. El conocimiento de la presentación clínica más frecuente, de acuerdo con el sitio afectado y del rendimiento de los métodos diagnósticos, provee herramientas para un abordaje más dirigido y acertado.
Métodos de búsqueda
Se realizó una búsqueda de la literatura en las bases de datos Pubmed, Embase, SciELO y LILACS de documentos publicados entre el 1.º de enero de 1980 y el 14 de octubre de 2019. Se incluyeron los términos MeSH tuberculosis en combinación con pleura, pleural effusion, lymphadenitis, meningeal tuberculosis, osteoarticular tuberculosis, gastrointestinal tuberculosis, skin tuberculosis, y con el texto libre extrapulmonary tuberculosis. Se incluyó literatura en inglés, español y francés y todos los tipos de artículos. Se priorizaron las publicaciones más recientes y de mayor impacto clínico.
Epidemiología y factores de riesgo
Según la Organización Mundial de la Salud, en 2018 se notificaron aproximadamente 1.050.000 casos nuevos de TB extrapulmonar, correspondientes al 15 % de casos de TB notificados; entre el 8 % y el 24 %, según la región afectada (2). Es de resaltar que su incidencia se ha mantenido relativamente constante en los últimos años; mientras que la de la TB pulmonar ha venido en descenso. En parte, se cree que es debido a la mayor frecuencia de infección por VIH (la coinfección con TB es cercana al 9 %) (10,11), al uso creciente de quimioterapéuticos o agentes biológicos, patrones de migración y también al desarrollo de las herramientas diagnósticas (12,13).
En Colombia, específicamente, la incidencia de la TB se encuentra alrededor de los 24 a los 26 casos por cada 100.000 habitantes y ha mostrado un descenso en las últimas décadas (11,14). No obstante, se ha observado un incremento progresivo en la tasa de TB extrapulmonar: 2,1 casos/100.000 habitantes en 1997; 3,7/100.000 en 2006 y 4,4/100.000 en 2018 (11,15). Un estudio de corte trasversal con 324 pacientes, realizado en Medellín en 2004, mostró una frecuencia del 27,5 % de TB extrapulmonar en pacientes sin VIH (16), en quienes fue más frecuente la forma pleural y la ganglionar. Así mismo, otros estudios descriptivos mencionan como localización más frecuente la pleural, seguida de la meníngea, la ganglionar y la osteoarticular, con algunas diferencias sociodemográficas en comparación con las formas pulmonares, que plantean la necesidad de profundizar en factores de riesgo asociados en TB extrapulmonar (17,18).
Así es como se han descrito diferencias entre los factores asociados con el desarrollo de TB pulmonar y TB extrapulmonar (19). El principal factor de riesgo para TB extrapulmonar es la inmunosupresión, particularmente la infección por VIH (8,14,19); adicionalmente, asociación con alcoholismo, tabaquismo, bajo estrato socioeconómico, raza negra y presencia de comorbilidades como cirrosis (18,19). Por otro lado, dentro del abordaje integral de la TB extrapulmonar, y más aún para la pulmonar, es esencial determinar la noción de contacto o familiares con antecedentes de TB, así como el seguimiento que se les hace (16,19). En general, la TB pleural se relaciona con infección reciente y precisa vigilar a los contactos, ya que en algunos estudios se han descrito incluso brotes de TB a partir de dichos casos (20), contrario a los otros tipos de TB extrapulmonar, que podrían vincularse con reactivación de la enfermedad (19).
Fisiopatología
El Mycobacterium tuberculosis es un bacilo aerobio, no formador de esporas y neutro a la tinción de Gram. Se caracteriza por ser resistente a la decoloración con alcohol ácido (bacilo ácido alcohol resistente [BAAR]), debido al alto contenido de ácidos micólicos y de otros lípidos en su pared celular. La principal afección es pulmonar y la transmisión se hace por vía aérea mediante la inhalación de gotas producidas por individuos con enfermedad pulmonar activa (12). El mecanismo de infección está determinado por la inoculación y por la diseminación de los bacilos por la vía aérea en las porciones inferiores de los lóbulos superiores y las porciones superiores de los lóbulos inferiores (12,21). Posteriormente, se da la primera interacción con el sistema inmune mediada por macrófagos alveolares. Sin embargo, algunos bacilos usan diversas estrategias para evadir la acción de los macrófagos y retrasar el inicio de la activación inmunológica (22).
La respuesta inmune adecuada frente al M. tuberculosis está determinada por la acción de los linfocitos T CD4 y la producción de interleucina 2, factor de necrosis tumoral alfa e interferón gamma. De estos mecanismos también depende la formación del granuloma y el daño tisular (12,22,23). Esto, sumado a la actividad de macrófagos y células dendríticas, es suficiente para controlar la infección y establecer una fase latente. No obstante, en algunos individuos esto no es posible y progresan a una fase activa de la enfermedad de TB (21).
La TB extrapulmonar resulta de la diseminación hematógena o linfática del bacilo, la cual puede darse como resultado de una infección primaria o por la reactivación de un foco latente con la consecuente afectación de cualquier órgano, dentro de ellos la pleura, los ganglios linfáticos, el abdomen, el sistema osteoarticular, el sistema nervioso central, el aparato genitourinario, el pericardio y la piel (1,6,10,16). La diseminación inicial ocurre con el transporte de macrófagos infectados por vía linfática hacia los grupos ganglionares hiliares, mediastinales, supraclaviculares y retroperitoneales, o, también, por vía hematógena a órganos como riñones, las epífisis de huesos largos, vértebras y meninges. Antes de que se desarrolle la respuesta de hipersensibilidad retardada, el crecimiento de los bacilos continúa tanto en el foco inicial como en los focos metastásicos, y ello origina sitios de infección progresiva o infección latente en la mayoría de los casos (12,22).
Métodos diagnósticos
La confirmación bacteriológica requiere la detección de M. tuberculosis en las muestras estudiadas mediante la tinción BAAR, el cultivo de micobacterias o las pruebas rápidas de detección de ácidos nucleicos (3). El carácter pausibacilar y los sitios de infección no hacen fácil tener muestras adecuadas para microscopía, histología, cultivo o pruebas moleculares (24). Las tinciones de Ziehl-Neelsen o la de auramina-rodamina pueden identificar el bacilo cuando su concentración está entre 5000 y 10000 bacilos por mililitro y, por ello, son menos sensibles para el diagnóstico de TB extrapulmonar (10,25). El cultivo tiene mayor capacidad diagnóstica con una sensibilidad cercana al 80 % y permite tipificar las micobacterias y su perfil de resistencia. No obstante, el tiempo necesario para el crecimiento bacteriano limita el diagnóstico oportuno (10,25).
Uno de los avances importantes en el diagnóstico de la TB ha sido el desarrollo de las pruebas de amplificación de ácidos nucleicos. La reacción en cadena de la polimerasa (PCR), diseñada para detectar las secuencias de ácidos nucleicos de M. tuberculosis, genera resultados con mayor precisión y en menos tiempo que los cultivos (26,27). La PCR es capaz de identificar diferentes secuencias de ácidos nucleicos en muestras con concentraciones de bacilos bajas y, además, identifica la resistencia a la rifampicina codificada en el gen rpoB, que puede ser de gran utilidad en escenarios donde es alta la prevalencia de la tuberculosis multirresistente (27-29). Existen diferentes secuencias genéticas para amplificar el genoma del M. tuberculosis; la de mayor uso es la IS6110 por su mayor sensibilidad para detección en tejidos (7,26,27). Debe tenerse en cuenta que la PCR no puede diferenciar los bacilos vivos de los muertos (26,27).
Adicionalmente, en los últimos años se ha venido estudiando el rendimiento del inmunoensayo, que cuantifica la liberación de interferón gamma (QuantiFERON®, ELISpot) para el diagnóstico de la TB pulmonar, la TB extrapulmonar y la TB latente. Las características operativas de las pruebas son variables dependiendo del sitio de infección y aún falta información para su uso de rutina (30-32).
Finalmente, el estudio histopatológico orienta el diagnóstico identificando granulomas con necrosis de caseificación, pero debe hacer diagnóstico diferencial con otras enfermedades granulomatosas (10,25). La sensibilidad de los métodos diagnósticos es variable según el sitio de afectación y el tipo de muestra analizada.
Presentación clínica y diagnóstico de la tuberculosis extrapulmonar
Tal como se mencionó, la presentación clínica de la TB extrapulmonar es variada. En la tabla 1 se resumen sus principales características clínicas y posibles complicaciones de cada una de sus formas. A continuación, se profundiza en cada una de ellas.
Tabla 1 Características clínicas y complicaciones de la tuberculosis extrapulmonar
| Clínica | Complicaciones | |
| Ganglionar Adenitis | Adenopatía unilateral, indolora, indurada y adherida. Sitos más frecuentes: cervical anterior y posterior, supraclavicular y submandibular. | Fístula, úlcera o expansión paradójica con el tratamiento antituberculoso. |
| Pleural Pleuresía Empiema | Derrame pleural unilateral o engrosamiento pleural. Síntomas de menos de un mes, lenta resolución sin tratamiento. | Empiema necessitatis (extensión a la pared del tórax con formación de fístula pleurocutánea) |
| Osteoarticular Espondilitis o discitis Artritis y osteomielitis | Afección principal en porción anterior del cuerpo vertebral y estructuras adyacentes, columna torácica o lumbar. Edema articular insidioso, limitación a la movilidad y destrucción osteoarticular. | Abscesos, síndrome de compresión radicular o medular. |
| Gastrointestinal Ileítis Peritonitis | Engrosamiento, ulceración de asas intestinales, linfadenopatía. Ascitis y cambios fibróticos del peritoneo. | Fístulas, estenosis, abscesos. |
| Sistema nervioso central Meningitis Tuberculoma | Afectación de pares craneanos por lesión meníngea en la base craneal. Focalización neurológica, convulsiones, coma. | Infartos infecciosos por arteritis, trombosis venosa e hipertensión endocraneana. |
| Vía aérea superior Nasosinusitis y laringitis | Nódulos o úlceras. | Obstrucción de la vía aérea superior, infrecuente. |
| Urogenital Salpingitis Orquiepididimitis Renal | Fibrosis, estenosis, calcificaciones, deformidad, hidroureteronefrosis | Abscesos, enfermedad renal crónica, fistulas o estenosis de vía urinaria. Infertilidad, disfunción sexual. |
| Cutánea Escrofulodermia Cutis miliaris acuta disseminate Eritema indurado de Bazin Tuberculides | Afecta cuello, pliegue axilar y región inguinal. Nódulo doloroso con ocasional ulceración y adenopatías adyacente. Máculas, vesículas, pústulas, nódulos y lesiones ulceradas. Placas eritematosas, escamosas y verrugosas de crecimiento excéntrico o exofítico. | Fístula, ulceración o sobreinfección. |
| Cardiovascular Pericarditis Miocarditis | Derrame pericárdico crónico, severo, engrosamiento de pericardio. | Pericarditis constrictiva y taponamiento cardiaco. |
Ganglionar
Es la forma de TB extrapulmonar más frecuente y corresponde a un 30 %-50 % de los casos (8,33). La infección puede ser primaria, por reactivación local o por extensión directa desde la vía aérea superior. Es más común la afectación cervical anterior y posterior, supraclavicular y submandibular (4,25). Se han propuesto cinco estadios para la TB ganglionar: estadio I (hiperplasia), ganglios grandes, firmes y móviles; estadio II (periadenitis), consistencia cauchosa, adheridos e inmóviles; estadio III (absceso en formación), renitencia con escasa o nula sensibilidad; estadio IV (absceso), tumefacción fluctuante cubierta por piel de color púrpura y delgada con induración por debajo de la fascia, y estadio V (fístula) (33-35).
El término escrófula también se usa para describir la inflamación de los ganglios del cuello causada por la TB. Se conocía como el “mal del rey”, ya que se creía que el toque real curaba la enfermedad; una creencia basada en el hecho de que la enfermedad puede resolverse de manera espontánea (33,34,36). Usualmente, es unilateral con compromiso de uno o más ganglios y corresponde al 25 % de los casos de adenitis (28,31). Como ya se mencionó, se presenta como tumefacciones indoloras, firmes, con induración de la piel y en infección crónica se asocia con masas, fístula o úlceras con secreción de material caseoso en el 10 % de los casos (10,12,33).
La afectación mediastinal es común en la TB pulmonar y puede presentar síntomas de disfagia y disfonía, por compresión de estructuras locales como el esófago o el nervio laríngeo recurrente. Puede acompañarse de síntomas sistémicos por inducción de respuesta inmune y también se observa compromiso de las cadenas axilares, mesentéricas e inguinales (10,33).
La linfadenitis es paucibacilar y las tinciones para BAAR muestran baja sensibilidad, entre el 25 % y 45 % (33). Un tercio de los casos tienen radiografía de tórax anormal, y el 15 %, positividad en el cultivo de esputo (37). Para estudios microbiológicos y de citología obtenidos por aspiración con aguja fina bajo guía ecográfica se ha descrito una sensibilidad del 77 % y una especificidad del 80 %. La biopsia excisional de ganglio reporta mejor sensibilidad, cercana al 80 %, y el diagnóstico se hace con la presencia de granulomas epitelioides con necrosis de caseificación o sin esta (2,14,25,28,33). La sensibilidad del cultivo puede ser tan baja como un 50 %, dependiendo de la calidad del espécimen y hay mayor positividad de los cultivos y las tinciones cuando predomina la necrosis (83 %) (33,37).
Por último, las pruebas moleculares muestran un buen rendimiento diagnóstico con sensibilidad agrupada de la PCR genXpert MTB/RIF del 96 % en tejido linfático, con mayor rendimiento en casos de coinfección con VIH, por lo que se recomienda su uso, ante la sospecha clínica de TB extrapulmonar (27).
Pleural
La afección pleural es común y corresponde a casi el 20 % de los casos. Debe tenerse presente que las micobacterias pueden alcanzar el espacio pleural por contigüidad y la infección pulmonar concomitante es habitual, con evidencia de compromiso parenquimatoso en la tomografía de tórax hasta en el 80 % de los casos (38).
La aparición de derrame pleural, por su parte, está relacionada con un proceso inflamatorio reactivo secundario a la respuesta inmune a los antígenos de la micobacteria (12,25). Típicamente, la presentación es aguda con una duración de los síntomas de menos de un mes (dos tercios de los casos) o menos de una semana (un tercio de los casos). Se caracteriza por derrame pleural unilateral, disnea, dolor torácico pleurítico, tos no productiva y síntomas constitucionales como fiebre, sudoración nocturna, escalofríos, debilidad y pérdida de peso (38). La pleuresía tuberculosa se presenta con exudado rico en linfocitos, glucosa baja, proteínas elevadas y pH ácido, aun cuando en etapas iniciales se puede observar predominio de polimorfonucleares que imitan los derrames paraneumónicos (38-40). El curso natural de la pleuresía tuberculosa es de lenta resolución sin tratamiento y con progresión a tuberculosis pulmonar activa en el 65 % de los casos, en los primeros cinco años (38).
Por otro lado, el empiema tuberculoso tiene una gran cantidad de micobacterias con formación de loculaciones; de ahí que la tinción de Ziehl-Neelsen y el cultivo del líquido pleural suelan ser positivos (38). El empiema tuberculoso tiene tres etapas de formación: exudativa, fibrinopurulenta y organización con formación de tejido de granulación y atrapamiento del pulmón (34). Una complicación frecuente es el empiema necessitans o necessitatis, que ocurre cuando hay extensión del líquido purulento a través de la pleura parietal a la pared del tórax con la formación de una fístula pleurocutánea (34,38).
El diagnóstico con microscopía es positivo solo del 10 % al 25 % de los casos, y el cultivo, del 25 % al 75 % de las muestras (25). La demostración de granulomas en la histología puede ser difícil y, por lo tanto, puede ser útil en estos casos cuantificar la adenosina deaminasa (ADA) y el interferón gamma en el líquido pleural (12,26). Más aún, la sensibilidad y especificidad de la PCR es baja en comparación con otros tejidos, lo que refleja la dificultad diagnóstica y la necesidad de integrar la clínica con los factores de riesgo presentes y las imágenes buscando incrementar la certeza diagnóstica (27).
Osteoarticular
La afectación osteoarticular es cercana al 10 %-12 %, según los registros (25,34,41). Se presenta como osteomielitis, espondilitis o discitis, y el sitio más común suele ser la columna vertebral torácica o lumbar, seguido de la cadera, la rodilla y el hombro. También se describen casos no tan frecuentes, como el que muestra la figura 1, una imagen de masa con compromiso costal múltiple en la que se confirmó afectación ósea sin compromiso pleural, por TBC, con cultivo positivo y pruebas de sensibilidad que mostró resistencia a rifampicina.
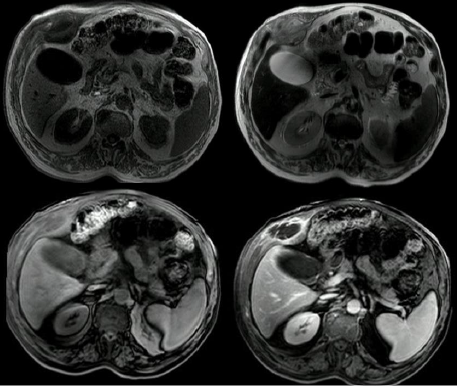
Figura 1. Resonancia magnética nuclear de abdomen. Imagen sugestiva de una masa dependiente del octavo, noveno y décimo arcos costales, hipointensa en T1 e hiperintensa en T2, de paredes gruesas y con tabiques en su interior con gadolinio. Infiltra los músculos intercostales y tiene invasión extraperitoneal con desplazamiento del segmento V hepático
Se produce por extensión local de la infección ganglionar o por diseminación hematógena de la infección primaria; afecta a adultos mayores de 50 años en forma insidiosa, y es de lenta progresión, con dolor regional, limitación de los movimientos, deformidad en cifosis y síntomas constitucionales (12,25,41).
La espondilitis tuberculosa o mal de Pott, usualmente, inicia en la porción anterior del cuerpo vertebral con una extensión subsiguiente a las estructuras adyacentes como el disco, el ligamento espinal anterior, las meninges e incluso el psoas. Se puede complicar con la formación de abscesos fríos o síndromes de compresión radicular o del canal medular y requerir descompresión quirúrgica (12,20). El compromiso de los cuerpos vertebrales favorece la aparición de cifosis con afección del disco. En algunos casos, puede presentarse paraplejía de inicio tardío, incluso después de que se haya resuelto la infección activa (42).
El diagnóstico se realiza con tomografía o resonancia magnética, y la confirmación bacteriológica, mediante biopsia y cultivo del tejido afectado, que, en primera instancia, puede ser de forma no invasiva (10). El tratamiento antituberculoso usualmente alivia el dolor y resuelve el déficit neurológico en la mayoría de los pacientes. Sin embargo, en presencia de una deformidad establecida y ante la persistencia del déficit neurológico o hallazgos de abscesos de gran tamaño está indicado el tratamiento quirúrgico (42).
Por otro lado, la afectación articular se presenta con más frecuencia en articulaciones grandes que soportan peso como la rodilla y la cadera (6); pero también se describen casos en el pie y el tobillo (38). Tiene un cuadro insidioso de edema articular, dolor y limitación funcional de semanas a meses que puede progresar a destrucción osteoarticular y formación de fístulas. El diagnóstico frecuentemente se hace con cultivos del líquido sinovial o con biopsia de la cápsula articular afectada (10,12).
Gastrointestinal y peritoneal
La TB puede afectar cualquier porción del tubo digestivo y es más frecuente en la región ileocecal (25,44,45). Constituye cerca del 3,5 % de los casos de TB extrapulmonar en Estados Unidos; mientras que en países con mayor prevalencia de coinfección con VIH puede corresponder hasta un 12 % (46). Los mecanismos de infección son la ingesta del esputo o de alimentos contaminados (en este caso, generalmente por Mycobacterium bovis), la diseminación hematógena de la infección primaria con posterior reactivación en las vías digestivas o la extensión por contigüidad (25).
El dolor abdominal difuso crónico ocurre en la mayoría de los pacientes, y dada su presentación con engrosamiento de las asas intestinales, ulceración y síntomas inespecíficos el principal diagnóstico diferencial es la enfermedad de Crohn (47). También es frecuente la presencia de linfadenopatías, ascitis, fístulas, estenosis y abscesos (45). El abordaje diagnóstico incluye la combinación de la clínica, las imágenes diagnósticas, el estudio endoscópico y la histopatología (12). Esta última se caracteriza por la presencia de granulomas con necrosis de caseificación, inflamación y ulceración de la mucosa (48).
En cuanto a la TB peritoneal, se considera que es por la reactivación de un estado latente de la infección y se manifiesta usualmente en pacientes con alteración de los mecanismos de defensa asociada a comorbilidades como cirrosis, diabetes mellitus, infección por VIH o enfermedad renal crónica en diálisis peritoneal (48). Las fases iniciales se acompañan de ascitis secundaria al proceso inflamatorio desencadenado; en casos crónicos se observan cambios fibróticos inespecíficos del peritoneo. El estudio del líquido ascítico incluye determinación de ADA y toma de cultivo, el cual es positivo hasta en un 80 %. La biopsia guiada por imágenes o por vía laparoscópica aumenta el rendimiento diagnóstico y constituye el método confirmatorio (25).
Sistema nervioso central
Corresponde al 5 % de casos de TB extrapulmonar. Es una condición grave, secundaria a diseminación hematógena, con alta morbilidad y mortalidad. La meningitis es la presentación más común y se puede acompañar de lesiones ocupantes de espacio (tuberculoma), infartos infecciosos por arteritis, trombosis venosa e hipertensión endocraneana por inflamación de la aracnoides. Hasta en el 50 % de los casos se encuentran cambios pulmonares de TB previa o activa (12,25,49).
El cuadro clínico es subagudo: parte de síntomas constitucionales asociados a cefalea que progresa a alteración del estado mental con focalización neurológica, convulsiones e incluso coma. El cuadro inicial puede durar dos semanas y el daño neurológico severo se presenta entre las semanas quinta y octava. La lesión meníngea es usual en la base craneal, por lo que se acompaña de compromiso de los pares craneanos (10,12,25). El diagnóstico y el tratamiento oportuno son necesarios para la prevención terciaria y para evitar la evolución natural de la enfermedad que usualmente lleva a la muerte (49).
La resonancia magnética nuclear cerebral identifica con precisión lesiones ocupantes de espacio, vasculares o meníngeas; pero se requiere el estudio del líquido cefalorraquídeo para la confirmación diagnóstica. Usualmente, hay aumento de la presión de apertura durante la punción lumbar y el citoquímico muestra pleocitosis con predominio de linfocitos, hipoglucorraquia e hiperproteinorraquia. La identificación de micobaterias en la microscopía es rara y el cultivo contribuye al diagnóstico en cerca del 80 % de los casos (10,12). En presencia de lesiones sólidas, la biopsia por estereotaxia cumple un papel importante. No obstante, por el crecimiento lento de la bacteria en los cultivos, las pruebas de detección de ácidos nucleicos tienen mayor impacto en el diagnóstico temprano con una sensibilidad similar (50). Los niveles de ADA mayores a 9,5 U/L en el líquido cefalorraquídeo también apoyan el diagnóstico con una sensibilidad del 81 % (25).
En cuanto al manejo, cabe destacar una revisión sistemática del grupo Cochrane publicada en 2016, que muestra evidencia estadísticamente significativa (OR: 0,75; IC: 0,65-0,87) de la superioridad del uso de corticoesteroides sistémicos versus placebo para el desenlace de mortalidad en pacientes inmunocompetentes con TB meníngea (51).
Vía aérea superior
La TB en la vía aérea superior predomina en países en vías de desarrollo y puede afectar nariz, laringe, cuerdas vocales, epiglotis y faringe. Al presentarse como úlceras o nódulos, es posible que se malinterpreten como masas tumorales, con las manifestaciones clínicas consecuentes, dadas por disfonía, disfagia, estridor, tos y hemoptisis (52). Por ser una forma bacilífera de la enfermedad, se logra el diagnóstico a través de baciloscopias; entre tanto, la laringoscopia permite la identificación fácil de las lesiones (12,25). Usualmente, responde bien al tratamiento antituberculoso; sin embargo, puede requerir intervenciones quirúrgicas adicionales e incluso quimioterapia concomitante en casos de presentación simultánea con carcinoma laríngeo (52).
Urogenital
Es más común en hombres y sucede por diseminación hematógena de la infección primaria o de la TB posprimaria con posterior colonización del parénquima renal. Ello favorece la aparición de lesiones corticales, glomerulares y prostáticas (53). Al inicio presenta un periodo asintomático con riesgo de progresión sintomática según el sitio afectado (25). La mayoría de las veces, la insuficiencia renal es unilateral y produce dolor lumbar, disuria, hematuria y síntomas constitucionales; mientras que la infección ureteral y vesical causa síntomas irritativos bajos (41).
En el uroanálisis de la primera muestra de la mañana se puede encontrar mayor concentración de bacilos; pero la tinción de BAAR es poco sensible (30%) y su especificidad es variable (53). Los hallazgos son piuria sin bacteriuria y hematuria hasta en el 90 % de los casos (12). El patrón de referencia (gold standard) es el cultivo, que se debe hacer con varias muestras tomadas durante el día, dada la intermitencia de la baciluria. Entre tanto, la confirmación microbiológica con PCR para M. tuberculosis aumenta el rendimiento diagnóstico, por su alta sensibilidad y especificidad (12,25,53).
La afectación de las vías urinarias genera fibrosis, estenosis, calcificaciones, deformidades e hidroureteronefrosis, que se puede demostrar mediante pielografía, ecografía, tomografía o resonancia magnética nuclear. Las lesiones renales pueden acompañarse de abscesos y el aspecto histológico característico es de una nefritis intersticial granulomatosa con necrosis caseosa multifocal (10,12). En la figura 2 se aprecian algunos hallazgos de TB renal en una tomografía de abdomen contrastada, con prueba de PCR IS6110 positiva en orina.
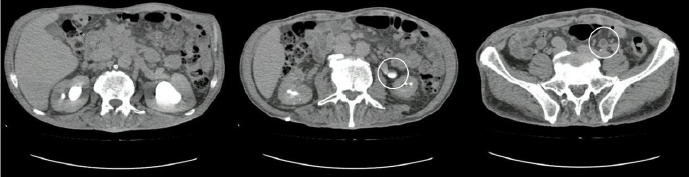
Figura 2. Tomografía de abdomen contrastada. De izquierda a derecha (ver círculos) dilatación pielocalicial izquierda, estenosis del uréter sin paso de medio de contraste y dilatación del uréter inferior, respectivamente
En mujeres, la carga de la enfermedad por TB urogenital se considera subestimada, pues la mayoría de las pacientes se encuentran asintomáticas y se considera un diagnóstico de exclusión (48). La presentación clínica puede ser muy similar a la de la enfermedad pélvica inflamatoria y afecta principalmente las trompas de Falopio, por lo que una de las consecuencias más relevantes es la infertilidad (54). El diagnóstico se basa en el estudio histopatológico mediante biopsia por laparoscopia y en la evaluación bacteriológica por métodos directos o moleculares (53).
Cutánea
Representa del 0,5 % al 2 % de los casos de TB extrapulmonar y ha resurgido con la alta incidencia de la tuberculosis multirresistente (10,25). Se asocia con TB pulmonar o intrabdominal en un 28 % de los casos y la presentación clínica es variada; la mayoría de formas secundarias por reactivación (25,55).
La escrofulodermia aparece por extensión de la TB linfática u osteoarticular a la piel y se expresa en forma de nódulos o gomas no dolorosos que pueden asociarse a fístulas y ulceraciones. Suele aparecer en sitios como la axila, el cuello o la ingle; en pacientes inmunosuprimidos también por diseminación, puede aparecer en las extremidades y el tronco (55).
También se pueden observar placas eritematosas, escamosas y verrugosas de crecimiento excéntrico o exofítico como en la TB luposa o vulgar. Formas más exóticas como cutis miliaris acuta disseminata pueden tener presentaciones con máculas, vesículas, pústulas, nódulos y lesiones ulceradas y se asocian a la diseminación hematógena.
Las lesiones nodulares también pueden afectar las extremidades inferiores y dan lugar al eritema indurado de Bazin. Las tuberculides son otras lesiones características y corresponden a nódulos pequeños eritematosos y violáceos con necrosis central negra (55). Se clasifican dependiendo de la fuente: exógena, endógena o hematógena (56).
La primoinfección cutánea es excepcional y el complejo tuberculoso primario o chancro tuberculoso se manifiesta por un nódulo cutáneo doloroso con capacidad de ulcerarse y se asocia a adenopatías en la región afectada (55). También se puede presentar eritema nodoso asociado, donde la microscopía y el cultivo son poco útiles, y la mayoría de veces el diagnóstico se confirma mediante PCR o biopsia de piel (10,41).
Pericardio
Es un sitio poco usual (menor al 1%). Por lo general, se presenta en pacientes inmunosuprimidos y conlleva un riesgo alto de mortalidad. Los pacientes coinfectados con VIH constituyen cerca del 85 % de los casos (57). Los síntomas suelen ser subagudos e incluyen dolor precordial, síntomas constitucionales, disnea, síncope y, en algunos casos, choque circulatorio por taponamiento cardiaco (12,57). Una complicación frecuente en los pacientes que sobreviven a la fase aguda es la pericarditis constrictiva (12,41).
El drenaje percutáneo o la ventana pericárdica con biopsia son necesarios para el diagnóstico. Regularmente, el ecocardiograma muestra derrames extensos, hiperrefringencia del pericardio, detritus o fibrina; en tanto que el análisis del líquido es de carácter exudativo con aumento en la celularidad y cambios hemorrágicos. El cultivo es diagnóstico en el 66 % de los casos, pero mejora con el estudio histológico (12).
La figura 3 corresponde a una radiografía de tórax que evidencia un importante aumento en el tamaño de la silueta cardiomediastínica, sugestivo de derrame pericárdico, llamado botella de agua. Del mismo paciente, la tomografía confirma la presencia de derrame pericárdico extenso y el ecocardiograma muestra, además de refringencia del pericardio, algunos detritus en un paciente joven con infección por VIH en quien se confirmó TB pericárdica.
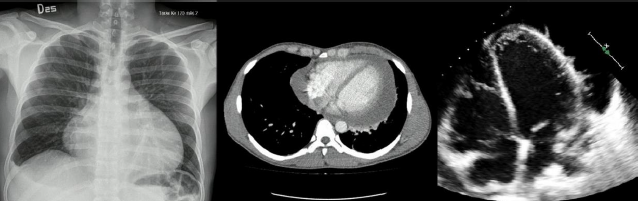
Figura 3. Radiografía de tórax (izquierda) con signo de botella de agua. En el centro, tomografía de tórax con contraste que evidencia derrame pericárdico con grosor máximo de 25 mm. Ecocardiograma transtorácico (derecha) que evidencia pericardio hiperrefringente, derrame pericárdico global con detritus celulares y fibrina en su interior
Conclusiones
La TB extrapulmonar es una entidad con altas incidencia y prevalencia, pese al desarrollo de nuevas técnicas de diagnóstico y manejo. Afecta tanto a pacientes inmunosuprimidos como a aquellos con aparente inmunocompetencia, y la naturaleza de su compromiso multiorgánico hace que las manifestaciones clínicas sean muy variadas. Los sitios que se ven afectados con mayor frecuencia son la pleura y el sistema linfático; sin embargo, también se describe en otros órganos. Las características operativas de las pruebas varían de acuerdo con el daño y, regularmente, se obtiene mejor rendimiento diagnóstico con la combinación de ellas.
Esta enfermedad continúa siendo un reto para los países endémicos. Por un lado, el abordaje clínico es complejo, dada su heterogeneidad; por otro, no siempre se dispone de todas las herramientas para tener un abordaje certero. Debe ser un diagnóstico diferencial a considerar siempre y se requieren estudios que ayuden a identificar factores de riesgo o asociados, aún no conocidos, sobre los cuales se pueda intervenir e impactar a nivel público para su prevención.














