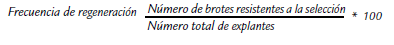INTRODUCCIÓN
P. vulgaris es una leguminosa de amplia producción en el mundo, lo cual se debe a su consumo humano por el contenido proteico de sus semillas (Mendoza-Jiménez et al., 2018). Su productividad en el mundo se encuentra limitada debido a que este cultivo resulta afectado por factores ambientales bióticos o abióticos que le provocan estrés (Hailu et al., 2017).
Entre las estrategias para aumentar la productividad de P. vulgaris se encuentra el mejoramiento genético basado en métodos tradicionales para identificar cultivares con resistencia a factores que provocan estrés (Meziadi et al., 2017). Ello en conjunto con métodos biotecnológicos como la transformación genética, pueden facilitar la generación de cultivares que toleren o resistan estos factores (Espinosa-Huerta et al., 2013).
En P. vulgaris se han realizado varios estudios de transformación genética vía A. tumefaciens (Espinosa-Huerta et al., 2013; Collado et al., 2015; Nanjareddy et al., 2016), en los cuales se ha evaluado el efecto de parámetros como el periodo de co-cultivo, la concentración de la suspensión bacteriana, la infiltración por vacío, y el agente selectivo, en la transferencia de Ácido Desoxirribonucleico (ADN) desde la bacteria hacia el explante. Además, mediante el empleo del nudo cotiledonal con uno o dos cotiledones como explante inicial, se estableció un protocolo para la regeneración in vitro de P. vulgaris vía organogénesis indirecta que posteriormente fue reproducido en cuatro variedades comerciales (Collado et al., 2016b ).
Sin embargo, las investigaciones dirigidas a determinar el efecto de la concentración de la suspensión bacteriana, la infiltración por vacío y el periodo de co-cultivo sobre la regeneración de brotes a partir del tejido transformado, han sido limitadas al empleo de callos nodulares verdes como explante blanco (Iglesias et al., 2017). Por ello, realizar estos estudios en otros explantes blancos resulta importante, pues la regeneración in vitro de P. vulgaris a partir de callos es difícil (Barraza et al., 2015). Basados en la necesidad de regenerar brotes a partir de tejido transformado en P. vulgaris cultivares 'ICA Pijao' y 'BAT 93', se evaluó la siguiente hipótesis: "La estandarización de parámetros que intervienen en la transformación genética vía A. tumefaciens permitiría la regeneración de brotes a partir de tejido transformado en P. vulgaris cultivares 'ICA Pijao' y 'BAT 93'. El objetivo de este trabajo fue regenerar brotes a partir de tejido transformado en P. vulgaris cultivares 'ICA Pijao' y 'BAT 93.
MATERIALES Y MÉTODOS
La investigación se realizó en el instituto de Biotecnología de las Plantas, es su nombre oficial (IBP), Universidad Central "Marta Abreu" de Las Villas, Villa Clara, Cuba, entre enero de 2016 hasta octubre de 2018.
Material vegetal
Se emplearon semillas maduras de P. vulgaris cv. 'ICA Pijao' y 'BAT 93', de tres meses de edad. El cv. 'ICA Pijao' se adquirió en el Instituto Colombiano Agropecuario (ICA) mientras que el cv. 'BAT 93' se obtuvo del Centro Internacional de Agricultura Tropical de Colombia (CIAT). Ambos se cultivaron en Cuba y el material inicial para la realización de estos experimentos fue donado por el Centro de Investigaciones Agropecuarias de la Universidad Central "Marta Abreu" de Las Villas (CIAP). Las semillas de ambos cultivares fueron cosechadas en una casa de cultivos protegidos.
Desinfección y germinación de las semillas
La desinfección de las semillas se realizó siguiendo el procedimiento descrito por Iglesias et al. (2017). Se colocaron 20 semillas en cada frasco de cultivo de polipropileno de 500 mL de capacidad que contenía 30 mL de medio de cultivo de germinación identificado como MG (Tabla 1). El material vegetal se mantuvo en oscuridad total a 27 ± 2 °C por tres días para la germinación.
Tabla 1 Medios de cultivos utilizados para la regeneración de plantas e inoculación de explantes de Phaseolus vulgaris con Agrobacterium tumefaciens *La timentina (200 mg l-1), la geneticina (50 mg l-1) y el glufosinato de amonio (0,5 mg l-1) se esterilizaron por filtración (filtro de 20 µm) y se adicionaron al medio de cultivo cuando este tenía una temperatura entre 40-45 °C en la cabina de flujo laminar

Preparación de los explantes
Después de la germinación de las semillas, a las plántulas de tres días de edad de los dos cultivares objetos de estudio, se les eliminó la testa adherida a los cotiledones y la raíz. Se realizó una herida en la unión del cotiledón con el eje embrionario, se separó el cotiledón con una lámina fina de la epidermis del eje embrionario y de cada plántula se obtuvieron dos explantes que se nombraron como V NC-1 (Fig.1) (Iglesias et al., 2018).
Preparación de la suspensión bacteriana
En un Erlenmeyer con 50 mL de medio de cultivo bacteriano Luria-Bertani (LB) (Tabla 1) fundido, cuando descendió la temperatura a 45°C se le adicionaron los antibióticos: Espectinomicina 100 mg L-1, Rifampicina 50 mg L-1, Estreptomicina 300 mg L-1 y Gentamicina 50 mg L-1 o Rifampicina 50 mg L-1 y Kanamicina 50 mg L-1 para la posterior inoculación con la cepa de A. tumefaciens C58C1RifR, la cual contiene el plásmido pTJK136 MtDHDPS3 o pCAM-BIA3301, respectivamente. La inoculación de A. tumefaciens, se realizó en una caja de Petri de 90 mm de diámetro con este medio de cultivo, por agotamiento por estrías con el objetivo de obtener colonias aisladas. Las placas se incubaron a 28°C durante 48 h en oscuridad.
Se partió de una colonia de A. tumefaciens aislada y se empleó el procedimiento descrito por Iglesias et al. (2017) para obtener suspensiones bacterianas a la DO600nm deseada. A las suspensiones se le adicionó acetosiringona (100 µM) y se incubaron a 26 ± 2°C por 30 min antes de inocular los explantes.
DETERMINACIÓN DEL EFECTO DE LA CONCENTRACIÓN DE LA SUSPENSIÓN BACTERIANA, EL TIEMPO DE INFILTRACIÓN POR VACÍO Y EL PERIODO DE CO-CULTIVO EN LA REGENERACIÓN DE BROTES
Inoculación y co-cultivo
La inoculación y el co-cultivo en todos los tratamientos se realizó en Erlenmeyers de 250 mL de capacidad con 30 mL de la suspensión de A. tumefaciens. En cada frasco se colocaron 50 explantes ½ NC-1 de cada cultivar. Un número similar de explantes sin inocular se emplearon como controles. Para cada tratamiento se realizaron tres réplicas y los experimentos se repitieron una vez.
Finalizado el co-cultivo, los explantes de los tres experimentos, se enjuagaron tres veces en MIB con timentina (200 mg L-1) y se secaron sobre papel de filtro estéril. Posteriormente, se colocaron en medio de cultivo de formación de callos con timentina, indicado como MFCT (Tabla 1) y se mantuvieron por siete días a 25 ± 2 °C, fotoperiodo de 16 h luz/ 8 h oscuridad y una intensidad luminosa de 45 jmol m-2s-1. Transcurrido este período, los explantes se transfirieron al medio de cultivo de regeneración de brotes con timentina, MRBT (Tabla 1) y se mantuvieron por 10 días. A continuación, los explantes se sub-cultivaron al mismo medio de cultivo, donde permanecieron en las condiciones de cultivo anteriormente descritas hasta los 21 días.
Concentración de la suspensión bacteriana
Durante la inoculación se estudiaron dos densidades ópticas de la suspensión bacteriana para determinar el efecto de estas sobre la regeneración de brotes. Se establecieron tres tratamientos: en dos de ellos, los explantes fueron inoculados de forma independiente durante 30 min con la suspensión de A. tumefaciens a las DO600nm de 0,1 y 0,5. Además, se empleó un tratamiento control que no se inoculó con la bacteria. El periodo de co-cultivo fue de cinco días. Para la realización de los experimentos siguientes, se seleccionó la densidad óptica de la suspensión bacteriana con la cual se obtuvo un mayor porcentaje de regeneración de brotes.
Tiempo de infiltración por vacío
Se estudiaron tres tiempos de infiltración por vacío para determinar el efecto de este sobre la regeneración de brotes. Los explantes fueron inoculados con A. tumefaciens a la DO600nm de la suspensión bacteriana seleccionada en el experimento anterior. Se establecieron cinco tratamientos: en tres de ellos durante la inoculación, los explantes fueron infiltrados por vacío de forma independiente durante 1, 4 y 8 min, con un régimen de presión de 60-70 mm de Hg. Se estableció un tratamiento donde los explantes se inocularon con A. tumefaciens y no se les aplicó vacío. También se empleó un control donde los explantes no se inocularon con la bacteria ni se trataron con vacío. El periodo de co-cultivo fue de cinco días. Para la realización de los experimentos siguientes, se seleccionó el tratamiento donde se obtuvo un mayor porcentaje de regeneración de brotes.
Periodo de co-cultivo
Se estudiaron dos periodos de co-cultivo para determinar su efecto en la regeneración de brotes. Los explantes fueron inoculados con A. tumefaciens a la DO600nm de la suspensión bacteriana seleccionada y expuestos al tratamiento seleccionado en el experimento de infiltración por vacío. Se establecieron tres tratamientos: en dos de ellos, después de la inoculación con la bacteria, los explantes fueron co-cultivados de forma independiente durante tres y cinco días. Además, se empleó un control sin inocular. Las placas se incubaron a 22 ± 2 °C en oscuridad.
En los tres experimentos, se realizaron dos evaluaciones durante la regeneración, la primera a los 10 días y la segunda a los 21 días al finalizar el sub-cultivo. Se analizó en cada caso la regeneración a partir del número de explantes que formaron al menos un brote y se calculó el porcentaje de regeneración.
DETERMINACIÓN DEL EFECTO DE LA SELECCIÓN CON GENETICINA Y GLUFOSINATO DE AMONIO
Con el objetivo de determinar el efecto de diferentes regímenes de selección en la regeneración de brotes y la transferencia de ADN a partir de tejido transformado, los explantes V NC-1 fueron inoculados de forma independiente con dos suspensiones de A. tumefaciens cepa C58C1RifR conteniendo el plásmido pTJK136 MtDHDPS3 o pCAMBIA3301. Las suspensiones bacterianas fueron obtenidas mediante el procedimiento y las condiciones descritas en el acápite anterior. La inoculación se realizó a la DO600nm de la suspensión bacteriana seleccionada y el tiempo de co-cultivo escogido en el experimento anterior. Se establecieron cuatro tratamientos. Para ello, se tuvieron en cuenta los dos plásmidos antes mencionados. En dos de los tratamientos, a los explantes inoculados (50) con cada plásmido, se les aplicó el tiempo de infiltración por vacío que menos afectó la regeneración en el experimento descrito anteriormente. En otros dos tratamientos los explantes (50) se inocularon con la bacteria y no se les aplicó vacío. Se utilizó un control donde los explantes no se inocularon con la bacteria, ni se le aplicó vacío. Para cada tratamiento se emplearon tres réplicas y los experimentos se repitieron una vez.
Los explantes inoculados se enjuagaron tres veces con MIB que contenía timentina (200 mg L-1). Posteriormente, se transfirieron a MFBT, durante siete días.
Se emplearon dos agentes de selección: geneticina (50 mg l-1) y glufosinato de amonio (0.5 mg L-1). Para la selección durante 30 días con sub-cultivos cada 15 días, a los explantes V NC-1 se le separaron los brotes iniciales, se transfirieron a medio de cultivo de regeneración de brotes con timentina y geneticina (MRBTG) (Tabla 1) para los explantes inoculados con C58C1RifR conteniendo el plásmido pTJK136 MtDHDPS3. En los tratamientos donde los explantes se inocularon con C58C1RifR conteniendo el plásmido pCAMBIA3301, estos se transfirieron al medio de cultivo de regeneración de brotes con timentina y glufosinato de amonio (MRBTG) (Tabla 1).
Las evaluaciones se realizaron durante la etapa de selección, se analizó en cada caso la regeneración para lo que se tuvo en cuenta el número de explantes que formaron al menos un brote. Se calculó la frecuencia de regeneración mediante la fórmula
Procesamiento estadístico
Los datos se analizaron con el paquete estadístico PASW Statistics, versión 23, para Windows, los supuestos de normalidad se verificaron con Sapiro Wilk. Los datos que no presentaron distribución normal se procesaron mediante análisis de varianza para dos variables no relacionadas H de Kruskal Wallis y para varias muestras independientes, U de Mann Whitney. Las diferencias se consideraron significativas para un valor de p < 0,05 en la prueba H de Kruskal Wallis y p < 0,01 en la prueba U de Mann Whitney.
RESULTADOS
Concentración de la suspensión bacteriana
La inoculación del explante V NC-1 con A. tumefaciens disminuyó la regeneración de brotes en los dos cultivares objeto de estudio, pues existieron diferencias entre los porcentajes de regeneración obtenidos a partir de explantes inoculados y controles (Fig. 2). En el cultivar 'ICA-Pijao' durante el primer periodo de cultivo, cuando aumentó la DO600nm de la suspensión bacteriana de 0,1 a 0,5, el porcentaje de regeneración de brotes disminuyó en un 60 % (Fig. 2c). En el segundo periodo de cultivo, cuando se empleó una DO600nm de 0,5, la regeneración disminuyó en un 30 % (Fig. 2f).
En el cultivar 'BAT 93', durante el primer periodo de cultivo, no se observó regeneración de brotes a partir de los explantes inoculados con A. tumefaciens, independientemente de la concentración de la suspensión bacteriana empleada (Fig. 2h, i). En el segundo periodo de cultivo, el 5 % de los explantes inoculados con A. tumefaciens a la DO600 menor formaron brotes (Fig. 2k). Sin embargo, los explantes V NC-1 tratados con la concentración mayor de la suspensión bacteriana no regeneraron.
En el cultivar 'ICA-Pijao', los brotes formados tanto en tratamientos como controles presentaron una coloración verde claro (código hex: #ccff33) (https://www.w3schools.com), sin nervadura definida (Fig. 2d, e, f) (https://www.w3schools.com). Sin embargo, los brotes formados en los controles del cultivar 'BAT 93', presentaron una coloración verde (código hex: #009900) y una nervadura claramente definida.

Figura 2 Regeneración de explantes ½ NC-1 de P. vulgaris cv. 'ICA Pijao' (a-f) y cv. 'BAT 93' (g-l) inoculados con una suspensión de A. tumefaciens ajustada a diferentes DO. a, g (control), b, h (DO600nm 0.1), c, j (DO600nm 0,5) a los 10 días de cultivo. d, j (control), e, k (DO600nm 0,1), f, l (DO600 0,5 a los 21 días de cultivo) (las flechas indican los explantes con regeneración similar al control).
Tiempo de infiltración por vacío
En el cultivar 'ICA-Pijao', en ambos periodos de cultivo disminuyó el porcentaje de regeneración de brotes a partir de los explantes infiltrados por vacío, así como en los explantes inoculados con A. tumefaciens a los cuales no se les aplicó vacío (Tabla 2). No se observó regeneración de brotes durante el primer periodo de cultivo en los explantes que fueron tratados con 4 y 8 min de vació (Tabla 2). En el segundo periodo de cultivo, el porcentaje de regeneración de brotes fue mayor en los explantes inoculados con A. tumefaciens a los cuales no se les aplicó vacío con respecto a los explantes infiltrados por vacío (Tabla 2). A los 21 días de cultivo no se apreció diferencia en el porcentaje de regeneración de brotes a partir de explantes infiltrados con vacío por 1 y 4 min. Sin embargo, el tratamiento al que se le aplicó 8 min de vacío no presentó regeneración de brotes (Tabla 2).
En el cultivar 'BAT 93' la infiltración por vacío disminuyó la regeneración de brotes a partir del explante V NC-1 durante el primer periodo de cultivo, pues se encontraron diferencias significativas entre los porcentajes de regeneración de brotes de los tratamientos con vacío con respecto al control y los explantes inoculados con la bacteria a los cuales no se le aplicó vacío (Tabla 2). A los 21 días de cultivo, los brotes regenerados a partir de los explantes inoculados con A. tumefaciens tratados o no con vacío habían muerto. Además, no se observó regeneración de nuevos brotes en los explantes inoculados con A. tumefaciens (Tabla 2).
En los tratamientos de inoculación con diferentes DO de la suspensión bacteriana, así como en los de infiltración por vacío, los explantes usados como controles presentaron mayor porcentaje de regeneración de brotes. Esto pudo deberse a que la inoculación con A. tumefaciens provocó un deterioro visible de los cotiledones (Fig. 2) y la infiltración por vacío facilitó una mayor penetración de A. tumefaciens, con un sobre crecimiento de esta, lo cual afecto la viabilidad de los explantes tratados.
Teniendo en cuenta los resultados de este trabajo, no se aplicó la infiltración por vacío durante la inoculación de los explantes V NC-1 con A. tumefaciens en el siguiente experimento.
Tabla 2 Efecto del tiempo de infiltración por vacío en la regeneración de brotes a partir de explantes V NC-1 de Phaseolusvulgaris cv. 'ICA Pijao' y cv. 'BAT 93' inoculados con una suspensión de A. tumefaciens ajustada a una DO600nm 0,1, en dos periodos de sub-cultivos *At= A. tumefaciens, V= vacío
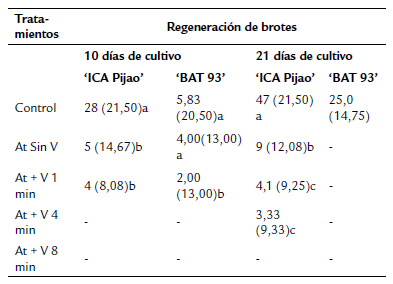
Medias con letras desiguales difieren según prueba H de Kruskal Wallis (p < 0,05) y U de Mann Whitney (p < 0,01) dentro de un mismo periodo de sub-cultivo n=300. Los números delante del paréntesis se refieren a las medias, los números dentro del paréntesis a los rangos medios.
Periodo de co-cultivo
La inoculación de los explantes V NC-1 con A. tumefaciens disminuyó la regeneración de brotes en el cultivar 'ICA Pijao'. No existieron diferencias en la regeneración de brotes obtenidos después de la aplicación de los dos periodos de co-cultivo, durante el primer sub-cultivo. En el segundo sub-cultivo, tanto en el control como en los explantes co-cultivados por tres días, se produjo un incremento en el porcentaje de regeneración con respecto al primer sub-cultivo. Sin embargo, el porcentaje de regeneración de brotes de los explantes co-cultivados durante cinco días disminuyó considerablemente.
En el cultivar 'BAT 93' la regeneración de brotes a partir de los explantes inoculados con A. tumefaciens resultaron menores que el control. Los explantes que fueron co-cultivados por el menor tiempo, presentaron mayores porcentajes de regeneración de brotes en los dos sub-cultivos. En el segundo sub-cultivo, en todos los tratamientos aplicados, se observó un incremento de la regeneración con respecto al primer periodo de cultivo.
Atendiendo a estos resultados, para la realización de los experimentos siguientes los explantes fueron co-cultivados durante tres días.
De modo general, los mayores porcentajes de regeneración de brotes a partir de explantes V NC-1 inoculados con A. tumefaciens se obtuvieron al emplear la suspensión bacteriana ajustada a la menor densidad óptica, sin infiltrar los explantes con vacío y manteniéndolos en el menor periodo de co-cultivo.
Efecto de la selección con geneticina y glufosinato de amonio
En el cultivar 'ICA Pijao' durante el periodo de selección con geneticina y con glufosinato de amonio se observaron explantes resistentes a los agentes selectivos en los tratamientos a los que no se les aplicó vacío (Tabla 3). Solo se observó regeneración de brotes en los explantes inoculados con A. tumefaciens (pTJK136 MtDHDPS3) correspondiente al sistema de selección con geneticina.
En el cultivar 'BAT 93' en los tratamientos que no se aplicó vacío, independientemente del agente selectivo, el número de explantes resistentes fue tres veces superior en comparación con los tratamientos donde se empleó esta técnica de infiltración (Tabla 3). De estos, en el tratamiento en que los explantes se inocularon con A. tumefaciens (PCAMBIA), se observó el mayor valor de explantes V NC-1 resistentes a glufosinato de amonio (Tabla 3). Este fue el único tratamiento que mostró regeneración de brotes durante la etapa de selección (Tabla 3).
Los brotes regenerados resistentes a geneticina y glufosinato de amonio presentaron una coloración verde (código hex: #009900), hojas coriáceas y de tamaño pequeño. La definición de la nervadura no fue clara.
Tabla 3 Regeneración de brotes en explantes V NC-1 de Phaseolus vulgaris cv. 'ICA Pijao' y cv. 'BAT 93' durante la etapa de selección *At (pTJK136 MtDHDPS3): explantes V NC-1 inoculados con A. tumefaciens (pTJK136 MtDHDPS3)
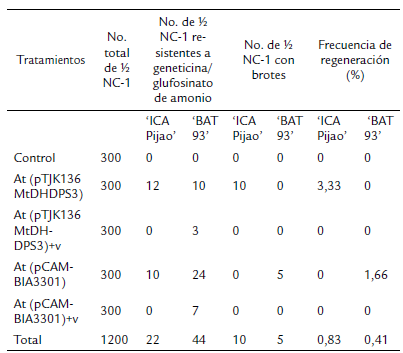
* At (pTJK136 MtDHDPS3)+v: explantes V NC-1 inoculados con A. tumefaciens (pTJK136 MtDHDPS3) + vacío 1 min
* At (PCAMBIA3301): explantes V NC-1 inoculados con A. tumefaciens (pCAMBIA3301)
* At (PCAMBIA3301)+v: explantes V NC-1 inoculados con A. tumefaciens (pCAMBIA3301) + vacío 1 min
DISCUSIÓN
Concentración de la suspensión bacteriana
En los dos cultivares objeto de estudio el tratamiento con A. tumefaciens, produjo deterioro del explante (Fig. 2). Esto fue más visible en los cotiledones, pues muchos de ellos presentaron síntomas de necrosis. El deterioro de los cotiledones debió ser una de las causas fundamentales que provocaron afectación en la regeneración de los explantes V NC-1. Pues ya se ha descrito para los cultivares 'ICA Pijao' y 'BAT 93' que los cotiledones tienen un efecto promotor en la capacidad de regeneración de explantes derivados de plántulas (Collado et al., 2013).
La concentración de A. tumefaciens es un parámetro importante a considerar en cualquier protocolo de transformación genética, ya que bajas concentraciones de la suspensión bacteriana pueden ser insuficientes para lograr una transferencia de ADN eficiente y altas concentraciones pueden causar la muerte del explante (Martirena-Ramírez et al., 2013). En el presente experimento se emplearon dos densidades de la suspensión bacteriana: DO600 de 0,1, basado en los resultados obtenidos por Iglesias et al. (2017) al analizar el efecto de la concentración bacteriana en la regeneración brotes a partir de callos y DO600 de 0,5, basado en los resultados de transformación de nudos cotiledonales en Arachis hypogaea L. (Hsieh et al., 2016). En el caso de A. hypogaea, con una densidad de la suspensión de A. tumefaciens DO600nm de 0,5, la regeneración osciló en un rango de 55 a 75,8 %. Sin embargo, esta concentración de la suspensión bacteriana redujo considerablemente la regeneración de brotes en el cultivar 'ICA Pijao' de P. vulgaris a un 10 %, mientras que en 'BAT 93' no se logró la emisión de brotes. El hecho de que la regeneración de P. vulgaris sea más afectada por altas densidades de la suspensión bacteriana que A. hypogaea, puede estar relacionado con la alta sensibilidad de P. vulgaris a A. tumefaciens, lo que convierte a P. vulgaris en una especie recalcitrante a la transformación genética vía A. tumefaciens.
De modo similar a los resultados de este trabajo, en el cultivar 'Olathe' pinto de P. vulgaris, la inoculación de ejes embrionarios con una DO600nm de 0,5 de la suspensión de A. tumefaciens causó la muerte del 70 % de los explantes (Song et al., 2020. Sin embargo, estos autores con una DO600nm de 0.1, lograron aumentar el número de explantes regenerados, así como una frecuencia de transformación adecuada.
Tiempo de infiltración por vacío
La infiltración por vacío afectó considerablemente el potencial de regeneración del explante V NC-1 en el cultivar 'ICA Pijao'. Esta afectación no pudo ser claramente constatada en 'BAT 93', pues a diferencia de 'ICA Pijao', en este cultivar la respuesta de regeneración, estuvo afectada de forma general por la inoculación de los explantes con A. tumefaciens. La condición cultivar dependiente de P. vulgaris al cultivo de tejidos y a la transformación genética vía A. tumefaciens, debió ser la causa de las respuestas diferentes de los cultivares objeto de estudio bajo las mismas condiciones y con tratamientos similares. Es conocido que el cultivar 'BAT 93' tiene una respuesta de regeneración inferior a 'ICA Pijao' (Collado et al., 2013) y por los resultados de este experimento y los descritos previamente (Iglesias et al., 2017), también es más sensible a la afectación por A. tumefaciens.
La infiltración por vacío durante la inoculación ha sido poco empleada en trabajos de transformación genética de P. vulgaris. Para incrementar la transferencia de ADN en hojas, se sugieren tiempos de 20-25 min (Nanjareddy et al., 2016). En otra investigación, (Liu et al., 2005) mejoraron la eficiencia de la transformación genética a partir de plántulas aplicando sonicación y 5 min de vacío. Sin embargo, en el presente experimento tiempos de infiltración por vacío de 1 y 4 min redujeron significativamente la regeneración y en los explantes tratados con 8 min no se logró la emisión de brotes en los dos cultivares estudiados. Teniendo en cuenta el efecto negativo de periodos prolongados de infiltración por vacío (Sivanandhan et al., 2012), propusieron la aplicación de 1 o 2 min de vacío para lograr un balance adecuado entre la transferencia de ADN y la regeneración en Glycine max L.
El efecto negativo del vacío sobre la regeneración de brotes puede estar relacionado con el modo de aplicación de esta técnica durante el proceso de inoculación. Similar a investigaciones previas (Mariashibu et al., 2013), en el presente trabajo a los explantes se les aplicó vacío sumergidos en una suspensión de A. tumefaciens, lo que provocó la penetración excesiva de la bacteria con el consecuente sobrecrecimiento de la misma durante el co-cultivo y la recuperación. El modo de aplicación de esta técnica en este experimento facilitó la penetración de la bacteria incluso en zonas del explante donde no hay regeneración como los cotiledones, donde se intensificó la necrosis. Puede ser que un cambio en el modo de aplicación de la técnica de infiltración por vacío disminuya su efecto negativo. Un ejemplo de ello lo constituye el resultado en Cicer arietinum L., publicado por Srivastava et al. (2017). Estos autores aplicaron la infiltración por vacío al explante, después de haber vertido con una pipeta la suspensión bacteriana en el interior de una herida realizada a este con anterioridad. Con esta modificación de la técnica, el porcentaje de expresión gus transitoria y el de regeneración de brotes fueron superiores al 70 %. Este procedimiento puede ser una alternativa para disminuir las afectaciones de la infiltración por vacío en futuros trabajo de transformación genética en P. vulgaris.
Periodo de co-cultivo
En P. vulgaris para la transformación genética vía A. tumefaciens de explantes derivados de plántulas, se han indicado periodos de co-cultivo desde tres hasta ocho días (Mukeshimana et al., 2013; Collado et al., 2016 a). En estas investigaciones, la selección del periodo de co-cultivo ha sido basada en la expresión transitoria de los genes reporteros. En la mayoría de los trabajos no se ha tenido en cuenta que P. vulgaris es una especie que ha sido clasificada como recalcitrante para la regeneración in vitro. Si se tiene en cuenta la importancia que tiene la regeneración para mejorar la eficiencia de los protocolos de transformación genética, resultaría útil considerar el efecto del co-cultivo en la regeneración de tejido transformado. En el presente trabajo a diferencia de estudios previos realizados (Mukeshimana et al., 2013; Collado et al., 2016a), la determinación del periodo óptimo de co-cultivo se basó en el efecto de esta variable sobre la regeneración del tejido inoculado con A. tumefaciens.
En el cultivar 'ICA Pijao', cinco días de co-cultivo resultaron en una colonización completa del explante por A. tumefaciens. Ello impidió un eficiente control del crecimiento de la bacteria que afectó la regeneración y causó la muerte de los brotes regenerados. Sin embargo, en 'BAT 93', los dos periodos de co-cultivo empleados (3 y 5 días) condujeron a un decrecimiento en la regeneración. Esta respuesta puede estar relacionada con la extensa colonización que ocurrió en los explantes por la bacteria, lo que debió provocar sobreexpresión de genes relacionados con la defensa de la planta ante condiciones que provocan estrés (Dita et al., 2006). En muchos de los trabajos de transformación genética vía A. tumefaciens, emplean periodos de co-cultivo largos, basados en que este debe ser suficiente para garantizar una transferencia de ADN óptima. No obstante, en P. vulgaris var. Brunca, periodos de co-cultivo de tres a cuatro días, resultaron en una integración adecuada de los genes GUS o nptII (Solís-Ramos et al., 2019). En la presente investigación se demostró que para el cultivar 'ICA Pijao', tres días de co-cultivo reducen las afectaciones en la regeneración de brotes en un 10 %.
Efecto de la selección con geneticina y glufosinato de amonio
La efectividad de los dos sistemas se selección usando los genes nptII y bar en nudos cotiledonales de P. vulgaris transformados vía A. tumefaciens ha sido descrita (EISSA, 2013). Esta autora empleó kanamicina (50 mg l-1) y glufosinato de amonio (1,0 mg L-1) como agentes selectivos. En el presente trabajo a diferencia de la investigación previamente realizada (EISSA, 2013), se emplearon como agentes selectivos geneticina y glufosinato de amonio. En los dos cultivares objeto de estudio, los controles empleados no presentaron explantes capaces de regenerar en los medios de cultivo con geneticina (50 mg L-1) o glufosinato de amonio (0,5 mg L-1). Ello permitió constatar la efectividad de estos agentes selectivos para la selección de tejido transformado regenerado a partir de los explantes V NC-1.
En la presente investigación se resalta la importancia de la regeneración de brotes a partir de tejido transformado vía A. tumefaciens, aspecto que ha sido poco estudiado en P. vulgaris. Los principales parámetros que garantizan una eficiente transferencia de ADN de la bacteria hacia el explante generalmente afectan la regeneración de brotes. Por esta razón resulta de utilidad establecer un balance entre la frecuencia de transformación y la eficiencia de la regeneración, con el objetivo de establecer protocolos de transformación genética estables para especies en las cuales el mejoramiento genético resulta difícil.
El estudio de la regeneración de brotes a partir de tejido transformado vía A. tumefaciens en los cultivares 'ICA Pijao' y 'BAT 93', no descrita en la literatura científica, resulta importante para su posterior aplicación en programas de mejoramiento genéticos de P. vulgaris. La determinación del efecto de la concentración de la suspensión bacteriana, el tiempo de infiltración por vacío, el periodo de co-cultivo y los agentes selectivos sobre la regeneración de brotes a partir del explante V NC-1, arrojó resultados relevantes y sin precedentes, que pueden ser utilizados para desarrollar un protocolo de transformación genética en otros cultivares de P. vulgaris.
CONCLUSIONES
La concentración de la suspensión bacteriana, el tiempo de infiltración por vacío y el periodo de co-cultivo tuvieron efecto negativo sobre la regeneración de brotes a partir de explantes V NC-1 en P. vulgaris cv. 'ICA Pijao' y 'BAT 93'. La geneticina y el glufosinato de amonio fueron efectivos para la selección de brotes regenerados a partir de estos explantes en ambos cultivares. La determinación del efecto de los parámetros estudiados sobre la regeneración de brotes a partir del explante V NC-1 resultan de utilidad para el desarrollo de nuevos protocolos de transformación genética en P. vulgaris.