INTRODUCCIÓN
Los hidrocarburos son fuente de energía y materia prima en diversas industrias, por lo cual la demanda se incrementa constantemente, al igual que los derrames y la contaminación por esos compuestos también van en aumento (Liu et al., 2017; Varjani, 2017). Dicha contaminación se debe principalmente a fugas en los contenedores de almacenamiento, tuberías, derrames durante el transporte y en los sitios de perforación, así como a prácticas inapropiadas con los desechos de hidrocarburos. El diésel es una mezcla compleja de hidrocarburos alifáticos y aromáticos, es un combustible ampliamente utilizado, por lo cual, también es un contaminante importante del suelo y agua (Zanaroli et al., 2010). La presencia de esos contaminantes en el suelo es un problema preocupante a nivel mundial por los efectos adversos que tienen sobre la salud en humanos y en general sobre los seres vivos (Hewelke et al., 2018).
La degradación microbiana de hidrocarburos representa una opción viable y barata para su remoción de diversos ambientes. Sin embargo, la eficiencia de la biorremediación está influenciada por factores como pH, temperatura, disponibilidad de nutrientes, entre otros (Palanisamy et al., 2014; Varjani, 2017). A la fecha, se han descrito especies de diversos géneros bacterianos con capacidad para degradar hidrocarburos, siendo uno de los más frecuentes el de Pseudomonas (Muthukamalam et al., 2017; Varjani, 2017).
Por otro lado, la fitorremediación representa una buena alternativa para la degradación de sustancias tanto orgánicas como inorgánicas, sin embargo, la presencia de contaminantes en el suelo limita el crecimiento de las plantas usadas para este fin. Por lo anterior, se ha propuesto el uso combinado de plantas y bacterias para mejorar la remediación de suelos contaminados. Esta estrategia tiene la ventaja de que las bacterias colonizan la raíz de las plantas y promueven su crecimiento, por su parte las plantas proveen de nutrientes a las bacterias (Arslan et al., 2017). Además, la interacción planta-bacteria favorece que las primeras toleren mejor el estrés abiótico y biótico, entre los cuales se encuentran aquellos ocasionados por hongos fitopatógenos, salinidad y metales. En este sentido, se han descrito bacterias tanto Gram negativas como positivas que promueven el crecimiento de plantas que degradan hidrocarburos. Por ejemplo, Pseudomonas aeruginosa L10, una bacteria aislada de Phragmites australis, degrada hidrocarburos aromáticos y promueve el crecimiento vegetal a través de la producción de fitohormonas, sideróforos y ACC desaminasa (Wu et al., 2018). De igual forma, Bacillus safensis ZY16 tiene la capacidad de degradar hidrocarburos en condiciones de salinidad, así como características de promoción de crecimiento vegetal (Wu et al., 2019). En ambos casos, se sugiere que, por sus características, esas bacterias son buenas candidatas para su uso en fitorremediación. Sin embargo, aunque el uso de la asociación planta-bacterias representa ventajas sobre otras tecnologías, también presenta dificultades como degradación lenta de los compuestos tóxicos, las plantas pueden no ser lo suficientemente tolerantes a los contaminantes, aunado al efecto de factores como disponibilidad de nutrientes, pH, temperatura, presencia de otros contaminantes, entre otros (dos Santos and Maranho, 2018). Por lo cual, se requiere más investigación para comprender mejor los mecanismos de interacción entre esos organismos, así como explorar bacterias autóctonas con potencial en biorremediación. En este sentido, el propósito de este trabajo fue analizar la capacidad de aislados bacterianos para degradar diésel, para inhibir el crecimiento de hongos fitopatógenos, y también estudiar sus características de promoción de crecimiento vegetal y tolerancia a metales.
MATERIALES Y MÉTODOS
Aislamiento e identificación de bacterias
Con ayuda de una cuchara de jardinería previamente desinfectada con alcohol al 70 % se colectaron dos muestras puntuales de 1 kg de suelo de dos talleres de motores a diésel (20°03'05.2"N 102°43'03.4"W y 19°59'43.7"N 102°43'05.9"W) con historial de al menos 25 años de contaminación. Para ello, se retiraron los primeros 5 cm de la capa superficial de suelo y posteriormente se colectó la muestra hasta una profundidad de 15 cm aproximadamente. Para el aislamiento de bacterias con potencial de degradación de diésel, 10 g de cada muestra homogenizada se depositaron en un matraz de 250 mL con 90 mL de medio mínimo M9 (Sigma-Aldrich, México), suplementado con 1 % de diésel comercial (Pemex®) como única fuente de carbono. Los matraces se incubaron a 30 °C con agitación constante (150 rpm) y se creció por 15 días, el proceso de enriquecimiento se repitió dos veces más, tomando 1 mL de cultivo previo y se mezcló con 99 mL de medio mínimo M9 adicionado de 1 % de diésel. Los cultivos se estriaron en agar LB, se incubaron a 30 °C por 24 h y de cada muestra se seleccionó una colonia aislada, de esta forma se obtuvieron los aislados bacterianos denominados J3 y S3.
A los aislados bacterianos se les realizaron pruebas bioquímicas como tinción de Gram, tipo de fermentación, producción de gas y ácido sulfhídrico en agar Kligler con hierro (BD, México), IMViC (indol, rojo de metilo, Voges-Proskauer, citrato), prueba de catalasa y oxidasa, crecimiento y producción de fluorescencia en agar cetrimida. Para la identificación molecular se aisló ADN genómico de las bacterias J3 y S3 mediante los protocolos estándar (Wilson, 2001). Se amplificó por PCR un fragmento de 1498 pb del gen ribosomal 16S con los oligonucleótidos Bac27F (5'-AGAGTTTGATCMTGGCTCAG-3') y Univ1492R (5'-CGGTTACCTTGTTACGACTT-3'). Las condiciones de amplificación fueron: un ciclo inicial a 95 °C por 5 min, seguido de 35 ciclos de desnaturalización a 94 °C por 30 s, alineamiento a 55 °C por 30 s y extensión a 72 °C por 2 min, con un ciclo final de extensión a 72 °C por 7 min (Jiang et al., 2006). Los fragmentos amplificados se purificaron con el sistema comercial MinElute PCR Purification kit (Qiagen, México) y se secuenciaron por secuenciación capilar en el laboratorio de servicios genómicos LABSERGEN (Irapuato, Gto, México). Las secuencias obtenidas se compararon mediante BLAST para determinar la identidad de los organismos.
Se obtuvieron las secuencias de los genes ribosomales 16S de las especies representativas de cada género bacteriano con la mayor identidad en el análisis de BLAST, con las cuales se realizaron alineamientos de múltiples secuencias mediante ClustalW y el análisis filogenético se realizó mediante el método de máxima parsimonia con el programa MEGA6 (Tamura et al., 2013). La confiabilidad de la topología de los árboles se realizó mediante el análisis de bootstrap con 1000 repeticiones.
Efecto de la concentración de diésel, pH y NaCl en el crecimiento bacteriano
Con los aislados bacterianos J3 y S3 se realizaron curvas de crecimiento en medio mineral de sales (MMS) suplementado con solución mineral de acuerdo con lo descrito en la literatura (Ahmad et al., 2014). El medio fue suplementado con 0, 1, 2, 3, 4 y 5 % de diésel como única fuente de carbono. Se monitoreó el crecimiento bacteriano midiendo la densidad óptica a 600 nm a las 24, 48, 72, 96, 168 y 216 h. Los experimentos se repitieron tres veces de forma independiente y con los datos obtenidos de calculó el promedio y la desviación estándar.
Para el análisis del efecto del pH, a 50 mL de MMS se les ajustó el pH a 6,0, 7,0, 8,0 y 9,0; como fuente de carbono se agregó diésel al 3 %, se inocularon los aislados bacterianos J3 y S3 y se crecieron por siete días a 30 °C. De igual forma para NaCl, a 50 mL de MMS se le adicionaron concentraciones de 0, 1, 2 y 4 % de NaCl y diésel al 3 %, las bacterias se inocularon y se crecieron a 30 °C por 7 días. En ambos casos transcurrido el tiempo de incubación se midió la densidad óptica a 600 nm.
Degradación de hidrocarburos mediante la reducción de 2,6-DCPIP
Para observar la degradación de hidrocarburos, se siguió de forma general la metodología descrita en la literatura (Hanafy et al., 2016) con algunas modificaciones menores como se describe a continuación. Los aislados bacterianos se crecieron en 4 mL de caldo LB toda la noche a 30 °C y 150 rpm, al día siguiente 2 mL de cada cultivo se centrifugaron a 13000 rpm por 2 min a temperatura ambiente, se desechó el sobrenadante y las células se lavaron con solución salina (SS, 0,9 %) estéril, después las células se resuspendieron en SS y se ajustó a la densidad óptica de 1 a 600 nm. Posteriormente, se preparó 1 mL de mezcla de reacción conteniendo medio MMS, 150 Mg/mL de FeCl3.6H2O y 10 Mg/mL de 2,6-DCPIP (Sigma-Aldrich) en un tubo de 1,5 mL. A la mezcla se le adicionaron 80 ML de la suspensión bacteriana y diésel al 3 %, los tubos se incubaron a 30 °C y se midió la densidad óptica a 600 nm a las 0, 24 y 48 h. El experimento se repitió tres veces por duplicado, como control negativo se utilizó la mezcla de reacción sin diésel. Con los datos obtenidos se calculó el promedio y desviación estándar de los valores de DO600, se transformaron a porcentaje tomando los datos del tiempo cero como el 100 % y fueron graficados en Microsoft Excel®.
Análisis de la actividad antifúngica
La actividad antagonista hacia hongos fitopatógenos se realizó de acuerdo con la literatura (Martínez-Absalón et al., 2014). Los aislados bacterianos J3 y S3 se sembraron simultáneamente con los hongos en agar papa dextrosa (PDA) (BD). Los hongos analizados pertenecen a la colección del Laboratorio de Biología Molecular de la Licenciatura en Genómica Alimentaria de la UCEMICH, y fueron Alternaria sp. (aislado de Allium cepa con síntomas de mancha púrpura), Botrytis cinerea (aislado de Fragaria xannanasa con síntomas de moho gris), Colletotrichum siammense (aislado de Carica papaya con síntomas de antracnosis), Fusarium proliferatum aislado de Fragariaxannanasa con síntomas de secadera). Los hongos se inocularon colocando un fragmento de PDA-micelio en el centro de cajas Petri con PDA estéril, mientras que las bacterias se inocularon haciendo una línea a 2 cm de distancia del hongo en los cuatro cuadrantes. Las cajas Petri fueron incubadas a 30 °C y el crecimiento micelial se determinó a los 5 días. Como control de crecimiento se utilizó una caja Petri inoculada solo con el hongo. Los experimentos fueron repetidos tres veces por duplicado de forma independiente. El porcentaje de inhibición del crecimiento micelial se cuantificó usando la siguiente formula: % de inhibición = [(Ac-Ab)/Ac] x100, donde Ac es el área del crecimiento micelial del control y Ab es el área del crecimiento micelial del tratamiento (Martínez-Absalón et al., 2014)
Solubilización de fosfato y producción de AIA, surfactantes y sideróforos
La capacidad de solubilizar fosfato se determinó inoculando las bacterias mediante punción en agar NBRIP. Se incubaron a 37 °C durante 21 días y se midió el diámetro del crecimiento de la colonia y del halo translúcido. Se calculó el índice de solubilización usando la siguiente fórmula: índice de solubilización = (diámetro del halo + diámetro de colonia)/ diámetro de colonia (Pereira and Castro, 2014).
Para determinar la producción de ácido indol acético se crecieron las bacterias en caldo LB suplementado con 1 mg/mL de triptófano (Sigma) por 24 h a 37 °C, después 1,5 mL de cultivo se centrifugaron 2 min a 12000 rpm y 1 mL de sobrenadante se mezcló con 0,5 mL de reactivo Salkowski. La mezcla se dejó en oscuridad durante 30 minutos a temperatura ambiente (30 °C) para después medir la absorbancia a 530 nm usando un espectrofotómetro Perkin Elmer, Lambda 25. Para obtener la concentración en mg/L se elaboró una curva estándar de 0, 5, 10, 20, 30, 40 y 50 mg/L de AIA (Sigma) (Sheng and Xia, 2006).
Para la producción de surfactantes, se crecieron cultivos bacterianos por siete días en MMS con 1, 2, 3, 4 y 5 % de diésel y después se determinó el índice de emulsión a las 24 h (E24). Para realizar lo anterior, se tomaron 5 mL de cada cultivo, se centrifugaron a 13 000 rpm por 2 min y por duplicado, 2 mL de sobrenadante se mezclaron vigorosamente con 2 mL de diésel en un mezclador vortex por 2 min. La mezcla se dejó en reposo a temperatura ambiente (30 °C) durante 24 h. Posteriormente se midió la altura de la mezcla, así como la altura de la zona de emulsión y el E24 se calculó de acuerdo con la siguiente formula: E24 = Ae/Am x 100. Dónde, Ae, altura de la capa de emulsión; Am, altura total de la mezcla (Menezes Bento et al., 2005).
La detección de sideróforos se realizó en agar CAS (Chrome azurol S) siguiendo la metodología descrita en la literatura (Schwyn and Neilands, 1987). Los aislados se inocularon por punción en cajas Petri con agar CAS y se incubaron a 37 °C por 72 h. La formación de un halo de color naranja alrededor de las colonias se consideró un resultado positivo.
Tolerancia a metales
Para el análisis de tolerancia a metales se determinó la concentración mínima inhibitoria (CMI) en agar nutritivo, las concentraciones analizadas dependieron de la toxicidad del metal y oscilaron entre 0,01, 0,02, 0,04, 0,08, 1, 1,5, 2, 3, 4 y 5 mM de ZnSO4, CuSO4, Pb(NO3)2, Cd(NO3)2, HgCl2, K2Cr2O7, AgNO3 y BaCl2, para lo cual se siguió la metodología previamente descrita (Caballero-Flores et al., 2012) y la CMI se determinó como la concentración más baja a la que no se observó crecimiento bacteriano.
RESULTADOS
Aislamiento e identificación de bacterias con capacidad para degradar diésel
En el 2016 se colectaron dos muestras de suelo en dos sitios con al menos 25 años de historial de contaminación con hidrocarburos. A partir del enriquecimiento de las muestras de suelo con diésel como única fuente de carbono se aislaron las bacterias denominadas J3 y S3.
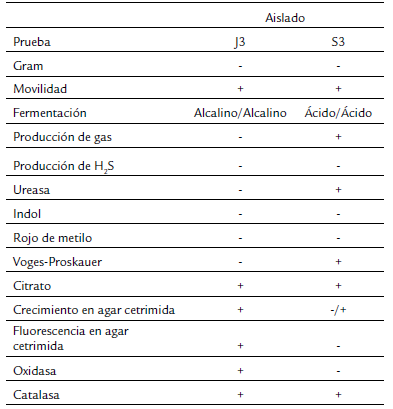
Para el caso de J3, se determinó que es una bacteria Gram negativa, poco móvil, creció en agar cetrimida con pigmentación verde, catalasa y oxidasa positiva, no fermenta lactosa ni glucosa y negativo a la producción de gas y H2S en agar Kligler con hierro, indol, rojo de metilo, Voges-Proskauer y ureasa negativa y citrato positiva. Mientras que S3, también es Gram negativa, móvil, crece muy poco en agar cetrimida y sin pigmentación, ureasa y catalasa positiva y oxidasa negativo, fermenta lactosa y glucosa, produce gas y sin producción de H2S en agar Kligler con hierro, rojo de metilo e indol negativo y Voges-Proskauer, y citrato positivo (Tabla 1).
A partir del ADN genómico purificado, se amplificó un fragmento de 1490 pb del gen ribosomal 16S de cada bacteria y se secuenció en las dos direcciones. Las secuencias obtenidas fueron depositadas en la base de datos del GenBank con los números de acceso MW474733 y MW474734. La comparación de las secuencias obtenidas mediante BLAST, arrojó que los 1401 nucleótidos obtenidos para J3 presentaron 100 % de identidad con diversas cepas de Pseudomonas aeruginosa. Mientras que los 1407 nucleótidos obtenidos de S3 presentaron 99,79 % de identidad con Enterobacter sp. SAUBS1-5, E. cloacae y E. hormaechei, seguido de 99,71 % de otras especies del género Enterobacter. De acuerdo con lo anterior, el análisis filogenético de los genes ribosomales 16S con especies del género Pseudomonas indicó que J3 se localizó con P. aeruginosa, por lo cual fue nombrada P. aeruginosa J3 (Fig. 1a). Por su parte, S3 mostró mayor identidad con Enterobacter sp. y E. hormaechei, por lo que se denominó Enterobacter sp. S3 (Fig. 1b).
Efecto de la concentración de diésel, pH y salinidad en el crecimiento bacteriano
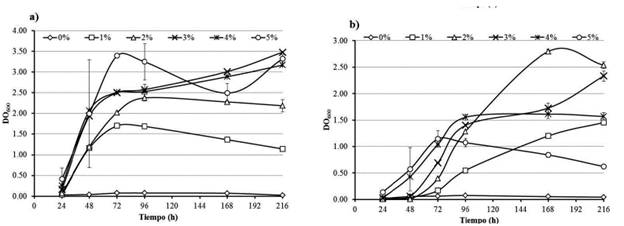
De acuerdo con los datos obtenidos durante el monitoreo del crecimiento bacteriano para J3 las concentraciones en las que se observó mejor desarrollo fueron a 3, 4 y 5 % de diésel (Fig. 2a) y para S3 fueron 2 y 3 % (Fig. 2b). Por lo anterior, dado que la concentración de 3 % de diésel es una de las mejores concentraciones de crecimiento para las dos bacterias se decidió utilizarla para el resto de los experimentos. También se determinó que el pH al cual las bacterias mostraron mejor crecimiento en presencia de 3 % de diésel, el cual fue de 7,0 para J3 y de 8,0 para S3. Además, S3 fue capaz de crecer en medio de cultivo conteniendo 3 % de diésel y hasta 4 % de NaCl, por su parte J3 lo hizo en medio con 3 % de diésel con 2 % de NaCl.
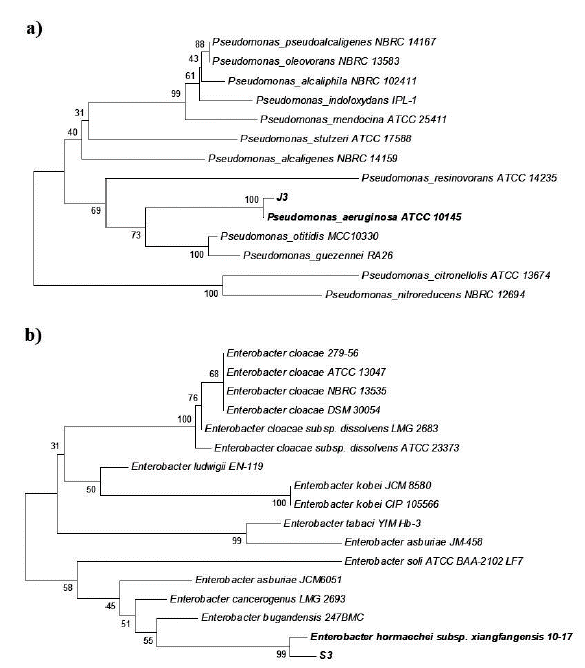
Figura 1 Análisis fi logenético donde se muestra la ubicación del aislado J3 comparado con especies del género Pseudomonas (a) y S3 comparado con especies de Enterobacter (b). Los números representan el porcentaje de 1000 repeticiones.
Análisis de la degradación de diésel
Las dos bacterias fueron capaces de degradar el diésel, como se puede observar por la decoloración del indicador 2,6-DCPIP (Fig. 3a). Para el control negativo (C) no se observó cambio en la coloración del indicador 2,6-DCPIP, mientras que en J3 y S3 a las 24 h se observó cambio en la intensidad del color del compuesto, el cual fue más pronunciado a las 48 h. La cuantificación de la reducción de 2,6-DCPIP mediante espectrofotometría visible indicó que en el control no hubo cambio, mientras que con J3 y S3 a las 24 h se observó una disminución de alrededor del 50 % y a las 48 h de 70 % (Fig. 3b).
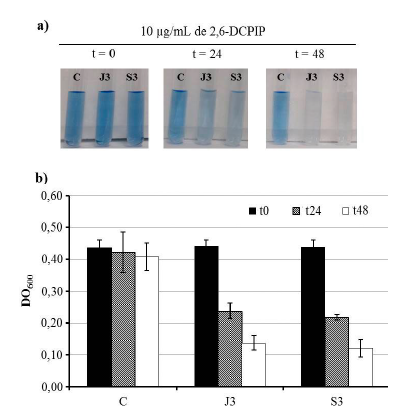
Figure. 3 Observación indirecta de la degradación de diésel. a) Reducción de 2,6-DCPIP a las 0, 24 y 48 h. Control sin diésel (C), P. aeruginosa J3 (J3) y Enterobacter sp. S3. (S3). b) Medición espectrofotométrica a 600 nm de la reducción del 2,6-DCPIP para el control sin diésel, J3 y S3. Las barras representan la desviación estándar entre las repeticiones.
Efecto antifúngico de las bacterias degradadoras de hidrocarburos
El efecto inhibitorio de J3 y S3 sobre cuatro hongos fitopatógenos fue determinado contra Alternaria sp., Botrytis cinerea, Colletotrichum siamense y Fusarium proliferatum. Para S3 se obtuvieron porcentajes de inhibición considerables para tres hongos, Alternaria sp. (26 %), B. cinerea (33 %) y F. proliferatum (27 %) (Fig. 4a y 4b). Mientras que para J3 se observó inhibición del crecimiento micelial de los cuatro hongos estudiados (Fig. 4a) con índices que oscilaron entre 42,5 % para C. siamense y 61,4 % para B. cinerea (Fig. 4b).
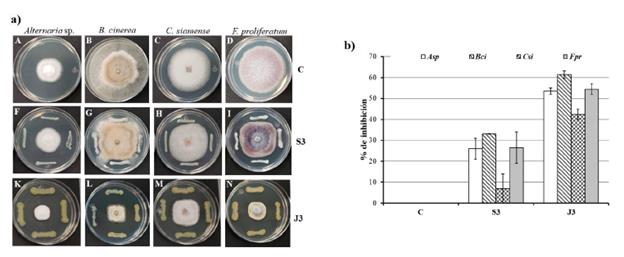
Figura 4 Actividad antifúngica de S3 y J3 contra cuatro hongos fitopatógenos. a) Fotografías representativas de la inhibición de Alternaria sp., B. cinerea, C. siamense, F. proliferatum. Fila C: hongos crecidos en PDA sin ningún tratamiento (control); fila S3: inhibición de los cuatro hongos por Enterobacter sp. S3; fila J3: inhibición de los hongos por P. aeruginosa J3. a) Gráfica de los porcentajes de inhibición del control, S3 y J3 sobre los cuatro hongos fitopatógenos. Las gráficas indican el promedio y las barras la desviación estándar.
Características de promoción de crecimiento vegetal y tolerancia a metales
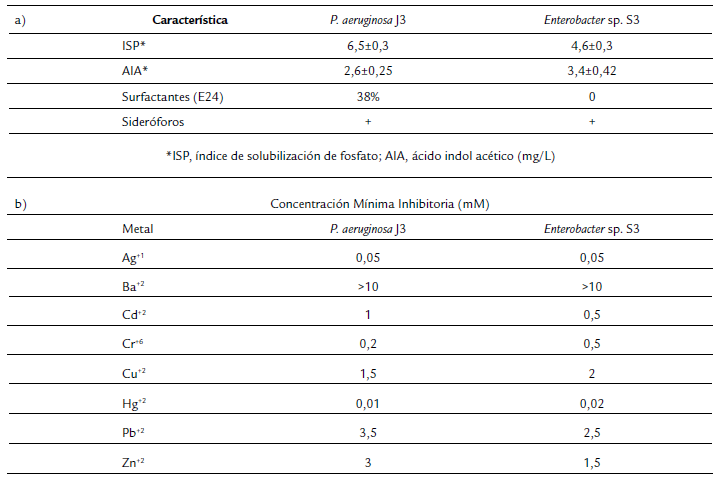
Los dos aislados bacterianos fueron capaces de solubilizar fosfato en agar NBRIP, con índices de solubilización de 6,5 para J3 y de 4,6 para S3. Mientras que en la producción de AIA, J3 y S3 produjeron 2,6 y 3,4 mg/L, respectivamente. De igual forma, las dos bacterias produjeron sideróforos. Solo J3 produjo surfactantes en presencia de 4 % de diésel, con un índice de emulsión de 38 % a las 24 h (Tabla 2a). El análisis de tolerancia a ocho metales reveló que las bacterias toleraron mayores concentraciones de bario, plomo, zinc y cobre. Mientras que fueron más susceptibles a cadmio, mercurio, plata y cromo (Tabla 2b).
DISCUSIÓN
Los hidrocarburos son fuente importante de energía y materia prima para varias industrias, sin embargo, esos compuestos cuando se encuentran en el ambiente se consideran contaminantes recalcitrantes (Varjani, 2017). El diésel es una mezcla compleja de hidrocarburos alifáticos y aromáticos que frecuentemente se encuentra como contaminante de agua y suelo. Por lo cual, se ha planteado que la biorremediación de hidrocarburos es una buena alternativa para la degradación y remoción de esos compuestos, aunque una limitante de esa estrategia es la baja diversidad de microorganismos autóctonos capaces de degradar hidrocarburos (Varjani, 2017). A la fecha se han descrito bacterias, hongos y algas con capacidad para degradar hidrocarburos alifáticos y aromáticos, siendo las bacterias el grupo de microorganismos más abundante en sitios contaminados (Garrido-Sanz et al., 2019). De acuerdo con esto, en el presente trabajo se identificaron dos bacterias con capacidad para utilizar diésel como única fuente de carbono, las cuales son capaces de crecer hasta en 5 % (v/v) de diésel en condiciones de laboratorio. Esas bacterias fueron identificadas como P. aeruginosa J3 y Enterobacter sp. S3. En este sentido, en la literatura se ha descrito que Pseudomonas es uno de los géneros predominantes en sitios contaminados con hidrocarburos y, aunque en menor proporción, también se ha encontrado a Enterobacter (Ramasamy et al., 2017; Varjani, 2017; Garrido-Sanz et al., 2019).
Por otro lado, se ha observado que diversos factores influyen en la degradación de hidrocarburos, tal es el caso de la composición y concentración del contaminante, la temperatura, el pH, salinidad, entre otros (Varjani, 2017). De acuerdo con lo anterior, en este trabajo se encontró que el crecimiento bacteriano fue mejor en presencia de 2-3 % de diésel, el pH de 7,0-8,8, salinidad de hasta 2 y 4 % para J3 y S3, respectivamente y temperatura de 30 °C. En la literatura se han descrito condiciones similares para la degradación bacteriana de diésel y se ha postulado que el conocimiento del efecto de esos factores es crucial para el diseño de estrategias de biorremediación de hidrocarburos (Dahalan et al., 2014; Varjani, 2017). Las condiciones descritas en la literatura sugieren que el intervalo de pH al cual las bacterias muestras la mejor degradación de hidrocarburos es de 6,5 a 8,5; mientras que la temperatura se ha observado entre 30 y 40 °C, con salinidad de hasta 28 % (Al-Hawash et al., 2018). Además, se ha descrito que en muchas ocasiones las bacterias que degradan hidrocarburos en condiciones de laboratorio lo pueden hacer en las mismas condiciones en experimentos de campo. Aunque, también se ha observado que lo obtenido en laboratorio no refleja en su totalidad lo observado en campo (Xu et al., 2018).
Durante la degradación de hidrocarburos, los electrones son transferidos a un aceptor de electrones como el oxígeno, de tal forma que incorporando un aceptor de electrones al medio como el 2,6-DCPIP, se puede estudiar la habilidad de los microorganismos para degradar esos compuestos monitoreando el cambio en la coloración de azul (oxidado) a incoloro (reducido) (Hanson et al., 1993). Lo anterior ha sido demostrado por varios autores en la degradación bacteriana de hidrocarburos (Mariano et al., 2008; Hanafy et al., 2016; Obi et al., 2016; Lee et al., 2018). De acuerdo con lo anterior, a las 48 h, las dos bacterias fueron capaces de reducir el 70 % del 2,6-DCPIP, indicando la degradación bacteriana del diésel. Estos datos concuerdan con lo descrito en la literatura (Peixoto et al., 2018), quienes determinaron que Bacillus toyonensis fue capaz de reducir 47,2 % de 2,6-DCPIP a las 24 h y 74 % a las 48 h.
Por otro lado, en la literatura se han descrito bacterias resistentes a metales con capacidad para degradar hidrocarburos y se ha sugerido que esas dos características las hacen buenas candidatas para estudios de biorremediación de suelos contaminados con mezclas de esos contaminantes. Por ejemplo, se ha documentado que bacterias degradadoras de hidrocarburos aisladas de suelo contaminado son capaces de tolerar a metales con IC50 (concentración que inhibe el 50 % del crecimiento bacteriano) entre 27 y 62 mg/L para cadmio, zinc, plomo y cobre. Además, tienen la capacidad de degradar hidrocarburos incluso en presencia de esos metales (Ramadass et al., 2016). De forma similar, las bacterias estudiadas en este trabajo fueron capaces de crecer en presencia de esos metales en concentraciones de entre 0,5 - 1 mM (1 18 - 236 mg/L) de cadmio, 1,5 - 2 mM (239 - 219 mg/L) de cobre, 1,5 - 3 mM (242 - 484 mg/ ml) de zinc y 2,5 - 3,5 mM (828 - 1159 mg/L), aunque
aquí no se analizó el efecto que tienen en la degradación de hidrocarburos. La concentración de metales en suelo contaminado con hidrocarburos varia de un sitio a otro, por ejemplo, un estudio determinó que las concentraciones de cadmio, zinc y plomo fueron de 0,02, 0,9 y 0,39 mg/kg de suelo, respectivamente (Nwaichi et al., 2014). Mientras que en otro trabajo se determinó que la concentración promedio de cadmio, plomo y zinc fueron de 39, 2,27 y 1,14 mg/kg, respectivamente (Alshahri and El-Taher, 2018). De igual forma, se ha descrito que bacterias con características de promoción de crecimiento vegetal son capaces de degradar hidrocarburos, lo cual indica que tienen buen potencial para la fitorremediación de suelos contaminados con hidrocarburos (Pawlik et al., 2017). Acorde con lo anterior, las bacterias degradadoras de hidrocarburos aquí estudiadas presentaron características de promoción de crecimiento vegetal como, producción de AIA, solubilizar fosfato, producción de sideróforos y surfactantes, además, inhibieron el crecimiento de hongos fitopatógenos. La relación entre la promoción de crecimiento vegetal y la degradación de hidrocarburos por bacterias no ha sido estudiada a fondo, por lo cual no está del todo clara. Pero estudios recientes han descrito que Bacillus pumilus PDSLzg-1 promueve el crecimiento de trigo lo que se atribuyó a características de producción de fitohormonas, también fue capaz de inhibir el crecimiento del hongo Colletotrichum truncatum. De acuerdo con lo anterior los autores postulan que esa bacteria es una buena candidata para fitorremediación de suelos contaminados por hidrocarburos (Hao et al., 2019).
Aunado a lo anterior, se han documentado casos de fitorremediación mediada por la asociación planta-bacteria de contaminantes orgánicos tóxicos, entre ellos los hidrocarburos, en los cuales las bacterias presentan diversas características de promoción de crecimiento vegetal (Arslan et al., 2017; Feng et al., 2017). Además, debido a sus características de inhibición de hogos fitopatógenos, solubilización de fosfato, producción de ácido indol acético, sideróforos y surfactantes, así como a la capacidad de tolerar metales, las bacterias estudiadas en este trabajo son buenas candidatas para la remediación de hidrocarburos en diferentes condiciones de estrés, o incluso para la fitorremediación por la asociación de esas bacterias con plantas. Aunque todavía falta demostrar el efecto benéfico directamente en plantas. Para abundar más sobre dichas posibilidades, actualmente se encuentran en proceso diversos experimentos que permitirán analizar y profundizar más en el tema.
CONCLUSIONES
Se aislaron e identificaron dos bacterias capaces de utilizar diésel como única fuente de carbono, las cuales mostraron mejor degradación a concentraciones de 2 y 3 % de diésel, pH de 7,0 a 8,0 y 30 °C. Las bacterias mostraron capacidad para inhibir el desarrollo de hongos fitopatógenos con índices de inhibición de hasta 62 %, además presentaron características de promoción de crecimiento vegetal y crecimiento en concentraciones de entre 1,5 a >10 mM de Ba+2, Cu+2, Pb+2 y Zn+2, lo cual las hace buenas candidatas para estudios de biorremediación o fitorremediación en diferentes condiciones de estrés vegetal.