Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Colombian Journal of Anestesiology
Print version ISSN 0120-3347
Rev. colomb. anestesiol. vol.43 supl.1 Bogotá Feb. 2015
http://dx.doi.org/10.1016/j.rca.2014.06.001
Reflexión
Oximetría cerebral: tres preguntas esenciales
Cerebral oximetry: Three questions to ask
Lingzhong Menga,*, y Adrian W. Gelbb
a Profesor Asociado, Departamento de Anestesia y Cuidado Perioperatorio, Universidad de California , San Francisco, California, Estados Unidos
b Profesor, Departamento de Anestesia y Cuidado Perioperatorio, Universidad de California, San Francisco, California, Estados Unidos
Autor para correspondencia. Department of Anesthesia and Perioperative Care, University of California San Francisco, 521 Parnassus Avenue, Suite C450, San Francisco, California 94143.
Correo electrónico: MengL@anesthesia.ucsf.edu (L. Meng).
Recibido el 5 de febrero de 2014 Aceptado el 16 de junio de 2014 On-line el 4 de agosto de 2014
Resumen
La oximetría cerebral basada en la espectroscopia cercana al infrarrojo puede medir de manera no invasiva la saturación de oxígeno de la hemoglobina en la sangre mixta arterial, venosa y capilar en el cerebro. A fin de determinar si este monitor es deseable en la clínica, es preciso responder 3 preguntas, en su orden. La primera es si la oximetría cerebral monitorea un aspecto importante de la fisiología. La segunda es si se puede optimizar la fisiología con base en este monitor. La tercera es si se puede mejorar el desenlace mediante una intervención clínica basada en la oximetría cerebral. En esta revisión presentamos nuestras respuestas a estas 3 preguntas.
Palabras clave: Oximetría cerebral, Fisiología esencial, Optimización de la fisiología, Mejora de resultados.
Abstract
Cerebral oximetry based on near-infrared spectroscopy can non-invasively measure hemoglobin oxygen saturation in mixed arterial, venous and capillary blood in the brain. In order to determine if this is a clinically desirable monitor, we need to answer three questions in order. The first question is if cerebral oximetry monitors an important aspect of physiology. The second question is if the physiology can be optimized based on this monitor. The third question is if the outcome can be improved based on cerebral oximetry-guided clinical care. In this review, we share our answers to these three questions.
Keywords: Cerebral oximetry, Essential physiology, Physiology optimization, Outcome improvement.
Introducción
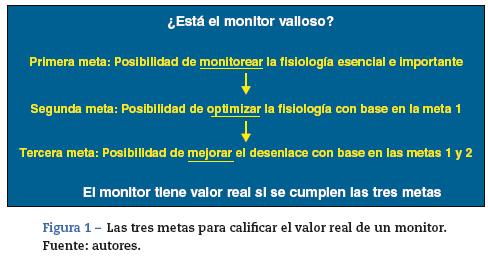
La oximetría cerebral basada en la espectroscopia cercana al infrarrojo (NIRS) es una modalidad no invasiva de monitorización fácil de usar que aún se encuentra en evolución. La tecnología propiamente y el estado de su aplicación clínica han sido el tema de una revisión reciente1. Desde el punto de vista filosófico, los siguientes 3 criterios consecutivos sirven para caracterizar a un monitor como deseable (fig. 1). El primero es que sirva para monitorear un aspecto esencial o importante de la fisiología; el segundo es que permita optimizar la fisiología esencial; y el tercero es que mejore el desenlace con base en la monitorización y la optimización de la fisiología. En esta revisión analizamos si la oximetría cerebral cumple con esos criterios.
Primera pregunta. ¿Sirve la oximetría cerebral para monitorear aspectos esenciales e importantes de la fisiología?
La primera pregunta busca responder si aquello que la oximetría cerebral mide califica como fisiología esencial. A diferencia de la oximetría de pulso, la cual monitorea la saturación de la hemoglobina en la sangre arterial (SpO2), la oximetría cerebral monitorea la saturación de la hemoglobina en sangre mixta arterial, venosa y capilar en el tejido cerebral (SctO2). Por consiguiente, la SctO2 se determina con base en 2 consideraciones fisiológicas. La primera se refiere a los volúmenes proporcionales de sangre arterial, venosa y capilar en la región del cerebro que se enciende en la oximetría cerebral. La SctO2 es más alta si la sangre arterial saturada es más y/o la sangre venosa desaturada es menos, y viceversa. El porcentaje de volumen de los distintos compartimentos de la sangre del cerebro no es fijo sino que varía de una persona a otra, y posiblemente también entre las distintas regiones del cerebro de una misma persona2. Además, se ha sugerido que puede cambiar en condiciones de hipoxia2, hipercapnia/hipocapnia3, excitación neural4, y cuando se administra fenilefrina5. La segunda consideración es el equilibrio entre el suministro y la demanda de oxígeno en el cerebro. El aporte de oxígeno al cerebro se determina mediante el flujo sanguíneo cerebral y el contenido de oxígeno en la sangre arterial. Si el contenido de oxígeno en la sangre arterial es estable, un aumento del flujo sanguíneo cerebral ampliará el volumen de sangre arterial y desplazará la relación de volumen hacia una mayor proporción de sangre arterial. La demanda de oxígeno en el cerebro la determina la tasa metabólica del oxígeno en el cerebro. Si el aporte de oxígeno es estable, un aumento de la tasa metabólica del oxígeno ampliará el volumen de sangre venosa y desplazará la relación hacia una mayor proporción de sangre venosa. Estos procesos fisiológicos alteran la lectura de la SctO2. Por consiguiente, puede ser difícil descifrar la causa exacta del cambio de la SctO2 cuando no se dispone de la información complementaria necesaria. Cuando la tasa metabólica de oxígeno cerebral, el contenido de oxígeno en la sangre arterial y el porcentaje de volumen de los distintos compartimentos de la sangre son todos relativamente estables, se puede tomar la SctO2 como sustituto de la perfusión cerebral.
La perfusión y la oxigenación de los tejidos son componentes fisiológicos esenciales porque la isquemia y la hipoxia son nocivas (y el daño ocurre muy rápidamente). Se puede afirmar que la perfusión y la oxigenación de los tejidos son el objetivo final de todo manejo fisiológico realizado en la sala de cirugía y en la unidad de cuidados intensivos. Por tanto, cualquier dispositivo que esté en capacidad de monitorear los índices de perfusión y oxigenación de los tejidos será útil. La oximetría cerebral se incluye dentro de esa categoría tecnológica porque: a) si se monitorea continuamente la misma región del cerebro en el mismo paciente, la tendencia de los cambios de la SctO2 refleja el equilibrio entre el suministro y el consumo de oxígeno en el cerebro, y b) si la tasa metabólica cerebral es relativamente constante, la SctO2 se determina con base en el aporte de oxígeno al cerebro. Por tanto, puede afirmarse que la oximetría cerebral basada en NIRS monitorea aspectos esenciales e importantes de la fisiología como son la perfusión y la oxigenación del tejido cerebral, siempre y cuando se conozcan o al menos se consideren todos los componentes de los procesos fisiológicos determinantes de la SctO2.
Segunda pregunta. ¿Puede la oximetría cerebral optimizar la fisiología esencial?
La monitorización pierde todo significado clínico si no se puede hacer nada por la fisiología en respuesta a los resultados. La característica universal de los monitores corrientes como la presión arterial y la oximetría de pulso utilizados en los pacientes anestesiados es que siempre se puede hacer algo en respuesta a la monitorización. Para la SctO2 medida con NIRS se han adoptado protocolos de intervención en cirugías cardíacas6,7 y no cardíacas8, encaminados a aumentar la SctO2 cuando está disminuida (conocida también como desaturación cerebral). Los protocolos adoptados por diversos estudios son similares pero con algunas variaciones6–8.Sepropuso un algoritmo para tratar la desaturación transoperatoria de una manera más sistemática9. Sin embargo, aún hace falta un estudio multicéntrico para su validación.
El principio rector en el tratamiento de la desaturación cerebral consiste en aumentar el aporte de oxígeno al cerebro y/o disminuir la tasa metabólica de oxígeno cerebral. Al aumentar el flujo sanguíneo cerebral puede aumentar el aporte de oxígeno. Entre las intervenciones que se pueden considerar para aumentar el flujo sanguíneo cerebral están: a) aumentar la presión de perfusión cerebral si se encuentra por debajo del límite inferior de la autorregulación cerebral y esta se encuentra intacta10; b) aumentar la presión de perfusión cerebral independientemente del límite inferior si la autorregulación está alterada10; c) aumentar el gasto cardíaco11; d) evitar la hiperventilación y la hipocapnia12; e) administrar un vasodilatador cerebral6, y f) usar agentes anestésicos inhalados con base en sus propiedades vasodilatadoras cerebrales intrínsecas13. Además de aumentar el flujo sanguíneo cerebral, también se deben considerar intervenciones que puedan aumentar el contenido de oxígeno en la sangre arterial, como aumentar la fracción inspirada de oxígeno y transfundir eritrocitos, a fin de reforzar el aporte de oxígeno al cerebro, es decir, el lado del suministro. Del lado del consumo, con la profundización de la anestesia se produce una disminución progresiva de la tasa metabólica del oxígeno cerebral hasta que la electroencefalografía se torna isoeléctrica14. Sin embargo, advertimos en contra de disminuir la tasa metabólica del oxígeno cerebral mediante la profundización de la anestesia porque hay evidencia de que una anestesia innecesariamente profunda puede asociarse con peores desenlaces15,16. Además, un plano más profundo de anestesia puede producir más hipotensión y hasta alterar la autorregulación cerebral si se utiliza un agente volátil > 1 CAM. Un estudio reportó que la desaturación cerebral se puede manejar exitosamente en el 80% de los pacientes que han tenido uno o más episodios de desaturación cerebral7.
Tercera pregunta. ¿Puede una intervención guiada por oximetría cerebral mejorar el desenlace?
Es práctica común creer que tratar un valor inapropiado del monitor es lo correcto. Sin embargo, esa es solamente una hipótesis. La fisiología es complicada y multifactorial, mientras que los monitores por lo general presentan un panorama simplificado y localizado. Es necesario realizar estudios de desenlace a fin de evaluar si una intervención guiada por un determinado monitor es benéfica o no. Una intervención clínica que mejora la lectura de un parámetro puede afectar a otros. Por ejemplo, cuando se corrige la hipotensión inducida por la anestesia mediante un bolo de fenilefrina, disminuyen tanto la SctO2 medida por NIRS como el gasto cardíaco derivado del Doppler17. Por otro lado, la SctO2 y el gasto cardíaco permanecen estables aunque la inducción de la anestesia disminuya significativamente la presión arterial y no se trate la hipotensión asociada18.
La oximetría cerebral se ha estudiado en pacientes sometidos a cirugía cardíaca desde que se introdujera en los quirófanos6,7,19,20. En un estudio retrospectivo, Goldman et al.6 estudiaron a 1.034 pacientes cardíacos en quienes se utilizó la oximetría cerebral como guía para mantener la SctO2 en el nivel basal previo a la inducción o cerca de él, y compararon la incidencia de infarto cerebral en este grupo con el grupo de control (n = 1.245) en el cual no se incorporó la oximetría cerebral. Encontraron que el accidente cerebrovascular permanente en el grupo del tratamiento (n = 10; 0,97%) fue significativamente menor que en el grupo de control (n = 25; 2,5%) (p < 0,044). En un estudio prospectivo, Murkin et al.7 estudiaron a 200 pacientes sometidos a cirugía de puentes coronarios, aleatorizados a un grupo de intervención (n = 100) y un grupo de control (n = 100). La desaturación cerebral transoperatoria se trató de conformidad con el protocolo uniforme. El desenlace medido fue morbimortalidad orgánica mayor: muerte, ventilación durante más de 48 h, infarto cerebral, infarto del miocardio y necesidad de una nueva exploración. Determinaron que la morbimortalidad orgánica mayor fue significativamente menor en el grupo de la intervención (n = 3) que en el grupo de control (n = 11) (p = 0,048). En el grupo de la intervención hubo un caso de accidente cerebrovascular, mientras que en el grupo de control hubo 4 casos; sin embargo, el poder del estudio no fue el apropiado para detectar una diferencia en la tasa de accidente cerebrovascular. Zheng et al.20 realizaron una revisión sistemática para determinar si la desaturación cerebral medida con NIRS se asociaba con infarto cerebral, disfunción cognitiva posquirúrgica o delirio en pacientes cardíacos adultos. Concluyeron que la evidencia que relacionaba la desaturación cerebral con las complicaciones neurológicas posquirúrgicas era baja.
En adultos mayores (> 65 años) sometidos a cirugía abdominal mayor, Casati et al.21 estudiaron a 122 pacientes de manera prospectiva, aleatorizados a un grupo de intervención (n = 56) o a un grupo de control (n = 66). El objetivo en el grupo de la intervención era mantener la SctO2 en ≥ 75% de los valores previos a la inducción. Se determinó que el valor promedio de la SctO2 en el grupo de la intervención fue significativamente superior al del grupo de control (66% vs. 61%, p = 0,002), y el área bajo la curva por debajo del 75% del valor basal en el grupo de la intervención fue significativamente menor que en el grupo de control (0,4 min% vs. 80 min%, p = 0,017), lo cual sugiere que la oximetría cerebral ayuda a reducir la posible exposición a la hipoxia cerebral. Además, atribuyeron este posible beneficio a una puntuación más alta en el estado observado con el examen Mini Mental evaluado el séptimo día posquirúrgico (p = 0,02), una permanencia más corta en la unidad de cuidado postanestésico (p = 0,01) y menos días de hospitalización (p = 0,007) en el grupo de la intervención comparado con el grupo de control, al considerar solamente a los pacientes que tuvieron desaturación cerebral durante la cirugía. En otro estudio prospectivo de cohorte el cual incluyó un ensayo aleatorizado controlado de intervención, Ballard et al.8 estudiaron el efecto de la monitorización del índice biespectral y la SctO2 sobre el deterioro cognitivo en adultos mayores (> 60 años) después de ser sometidos a cirugía ortopédica o abdominal. Aunque solamente 34 pacientes del grupo de la intervención y 39 del grupo de control se incluyeron en el ensayo aleatorizado controlado, los resultados preliminares sugieren que el deterioro cognitivo se puede reducir significativamente a la semana 1, 12 y 52 del postoperatorio cuando se instituye un protocolo pragmático de intervención centrado en el BIS y la SctO2. Sin embargo, este estudio no diferencia el efecto del manejo guiado por el BIS y la SctO2 sobre el deterioro cognitivo. La oximetría cerebral también se ha investigado en pacientes sometidos a endarterectomía carotídea para determinar si sirve como medio confiable para predecir la isquemia cerebral durante el período de clampeo de la carótida. Hasta la fecha, la respuesta no es concluyente debido a la inconsistencia de los resultados22–27.
Conclusión
La oximetría cerebral basada en NIRS es diferente de la oximetría de pulso. Esencialmente, los cambios de la SctO2 se determinan a partir del equilibrio entre el suministro de oxígeno al cerebro y la tasa metabólica cerebral del oxígeno cuando se monitorea continuamente la misma región del cerebro en un mismo paciente. Por tanto, refleja la información integrada relativa al suministro y el consumo de oxígeno en el cerebro. Se intuye que la concordancia entre el suministro y el consumo del sustrato metabólico es esencial para el bienestar tisular. Por otro lado, la oximetría de pulso refleja solamente la información sobre el suministro porque monitorea únicamente la sangre arterial. En este sentido, la oximetría cerebral es una tecnología prometedora porque monitorea la fisiología esencial e importante. Es importante que los clínicos comprendan claramente la forma como los distintos procesos fisiológicos afectan la medición NIRS en el cerebro. Se han propuesto protocolos de intervención para optimizar la SctO2 o corregir la desaturación cerebral con base en los principios del flujo sanguíneo cerebral, el aumento del contenido de oxígeno en la sangre arterial y el aumento de la profundidad anestésica. Los informes sobre la tasa de éxito de los diversos protocolos no son muy abundantes. Se han hecho muy pocos ensayos aleatorizados controlados para determinar si la intervención transoperatoria guiada por la oximetría cerebral mejora el resultado neurológico o compuesto. Aunque los resultados preliminares parecen prometedores, se necesitan ensayos aleatorizados controlados grandes y bien ejecutados para evaluar en definitiva el efecto benéfico de la oximetría cerebral sobre el desenlace a corto y a largo plazo. Todavía se requieren más estudios para aclarar las respuestas a las tres preguntas que nos hemos planteado.
Financiación
Ninguna.
Conflicto de intereses
Ninguno.
Referencias
1. Ghosh A, Elwell C, Smith M. Review article: cerebral near-infrared spectroscopy in adults: a work in progress. Anesth Analg. 2012;115:1373-83. [ Links ]
2. Bickler PE, Feiner JR, Rollins MD. Factors affecting the performance of 5 cerebral oximeters during hypoxia in healthy volunteers. Anesth Analg. 2013;117:813-23. [ Links ]
3. Ito H, Ibaraki M, Kanno I, Fukuda H, Miura S. Changes in the arterial fraction of human cerebral blood volume during hypercapnia and hypocapnia measured by positron emission tomography. J Cereb Blood Flow Metab. 2005;25:852-7. [ Links ]
4. Kim T, Kim SG. Temporal dynamics and spatial specificity of arterial and venous blood volume changes during visual stimulation: implication for BOLD quantification. J Cereb Blood Flow Metab. 2011;31:1211-22. [ Links ]
5. Meng L, Gelb AW, Alexander BS, Cerussi AE, Tromberg BJ, Yu Z, et al. Impact of phenylephrine administration on cerebral tissue oxygen saturation and blood volume is modulated by carbon dioxide in anaesthetized patients. Br J Anaesth. 2012;108:815-22. [ Links ]
6. Goldman S, Sutter F, Ferdinand F, Trace C. Optimizing intraoperative cerebral oxygen delivery using noninvasive cerebral oximetry decreases the incidence of stroke for cardiac surgical patients. Heart Surg Forum. 2004;7:E376-81. [ Links ]
7. Murkin JM, Adams SJ, Novick RJ, Quantz M, Bainbridge D, Iglesias I, et al. Monitoring brain oxygen saturation during coronary bypass surgery: a randomized, prospective study. Anesth Analg. 2007;104:51-8. [ Links ]
8. Ballard C, Jones E, Gauge N, Aarsland D, Nilsen OB, Saxby BK, et al. Optimised anaesthesia to reduce post operative cognitive decline (POCD) in older patients undergoing elective surgery, a randomised controlled trial. PLOS ONE. 2012;7:e37410. [ Links ]
9. Denault A, Deschamps A, Murkin JM. A proposed algorithm for the intraoperative use of cerebral near-infrared spectroscopy. Semin Cardiothorac Vasc Anesth. 2007;11:274-81. [ Links ]
10. Paulson OB, Strandgaard S, Edvinsson L. Cerebral autoregulation. Cerebrovasc Brain Metab Rev. 1990;2:161-92. [ Links ]
11. Ogoh S, Brothers RM, Barnes Q, Eubank WL, Hawkins MN, Purkayastha S, et al. The effect of changes in cardiac output on middle cerebral artery mean blood velocity at rest and during exercise. J Physiol. 2005;569 Pt 2:697-704. [ Links ]
12. Harper AM, Glass HI. Effect of alterations in the arterial carbon dioxide tension on the blood flow through the cerebral cortex at normal and low arterial blood pressures. J Neurol Neurosurg Psychiatry. 1965;28:449-52. [ Links ]
13. Matta BF, Mayberg TS, Lam AM. Direct cerebrovasodilatory effects of halothane, isoflurane, and desflurane during propofol-induced isoelectric electroencephalogram in humans. Anesthesiology. 1995;83:980-5. [ Links ]
14. Michenfelder JD. The interdependency of cerebral functional and metabolic effects following massive doses of thiopental in the dog. Anesthesiology. 1974;41:231-6. [ Links ]
15. Radtke FM, Franck M, Lendner J, Krüger S, Wernecke KD, Spies CD. Monitoring depth of anaesthesia in a randomized trial decreases the rate of postoperative delirium but not postoperative cognitive dysfunction. Br J Anaesth. 2013;110 Suppl. 1:i98-105. [ Links ]
16. Chan MT, Cheng BC, Lee TM, Gin T, CODA Trial Group. BIS-guided anesthesia decreases postoperative delirium and cognitive decline. J Neurosurg Anesthesiol. 2013;25: 33-42. [ Links ]
17. Meng L, Cannesson M, Alexander BS, Yu Z, Kain ZN, Cerussi AE, et al. Effect of phenylephrine and ephedrine bolus treatment on cerebral oxygenation in anaesthetized patients. Br J Anaesth. 2011;107:209-17. [ Links ]
18. Meng L, Gelb AW, McDonagh DL. Changes in cerebral tissue oxygen saturation during anaesthetic-induced hypotension: an interpretation based on neurovascular coupling and cerebral autoregulation. Anaesthesia. 2013;68:736-41. [ Links ]
19. Heringlake M, Garbers C, Käbler JH, Anderson I, Heinze H, Schön J, et al. Preoperative cerebral oxygen saturation and clinical outcomes in cardiac surgery. Anesthesiology. 2011;114:58-69. [ Links ]
20. Zheng F, Sheinberg R, Yee MS, Ono M, Zheng Y, Hogue CW. Cerebral near-infrared spectroscopy monitoring and neurologic outcomes in adult cardiac surgery patients: a systematic review. Anesth Analg. 2013;116:663-76. [ Links ]
21. Casati A, Fanelli G, Pietropaoli P, Proietti R, Tufano R, Danelli G, et al. Continuous monitoring of cerebral oxygen saturation in elderly patients undergoing major abdominal surgery minimizes brain exposure to potential hypoxia. Anesth Analg. 2005;101:740-7. [ Links ]
22. Pennekamp CW, Bots ML, Kappelle LJ, Moll FL, de Borst GJ. The value of near-infrared spectroscopy measured cerebral oximetry during carotid endarterectomy in perioperative stroke prevention. A review. Eur J Vasc Endovasc Surg. 2009;38:539-45. [ Links ]
23. Samra SK, Dy EA, Welch K, Dorje P, Zelenock GB, Stanley JC. Evaluation of a cerebral oximeter as a monitor of cerebral ischemia during carotid endarterectomy. Anesthesiology. 2000;93:964-70. [ Links ]
24. Rigamonti A, Scandroglio M, Minicucci F, Magrin S, Carozzo A, Casati A. A clinical evaluation of near-infrared cerebral oximetry in the awake patient to monitor cerebral perfusion during carotid endarterectomy. J Clin Anesth. 2005;17:426-30. [ Links ]
25. Moritz S, Kasprzak P, Arlt M, Taeger K, Metz C. Accuracy of cerebral monitoring in detecting cerebral ischemia during carotid endarterectomy: a comparison of transcranial Doppler sonography, near-infrared spectroscopy, stump pressure, and somatosensory evoked potentials. Anesthesiology. 2007;107:563-9. [ Links ]
26. Ritter JC, Green D, Slim H, Tiwari A, Brown J, Rashid H. The role of cerebral oximetry in combination with awake testing in patients undergoing carotid endarterectomy under local anaesthesia. Eur J Vasc Endovasc Surg. 2011;41: 599–605. [ Links ]
27. Stilo F, Spinelli F, Martelli E, Pipitó N, Barillà D, De Caridi G, et al. The sensibility and specificity of cerebral oximetry, measured by INVOS – 4100, in patients undergoing carotid endarterectomy compared with awake testing. Minerva Anestesiol. 2012;78:1126–35. [ Links ]











 text in
text in