Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Colombian Journal of Anestesiology
Print version ISSN 0120-3347On-line version ISSN 2256-2087
Rev. colomb. anestesiol. vol.49 no.2 Bogotá Apr./June 2021 Epub May 30, 2021
https://doi.org/10.5554/22562087.e934
REPORTE DE CASOS
Neuroestimulación medular en el manejo del dolor neuropàtico en pacientes con cáncer: reporte de caso
a Unidad de Dolor y Cuidados Paliativos, Instituto Nacional de Cancerología. Bogotá, Colombia.
Introducción
El dolor neuropático está presente hasta en el 40 % de los pacientes con cáncer. Un número considerable de pacientes no logran un alivio suficiente del dolor con el tratamiento convencional, por lo cual deben considerarse alternativas terapéuticas como la estimulación de la médula espinal.
Descripción del caso y resultados
Caso de una paciente con dolor neuropático crónico secundario a lesión parcial de nervio femoral durante cirugía de resección y vaciamiento ganglionar con objetivos curativos de carcinoma escamocelular de célula grande T2N0M0 estadio II, localizado en la fosa poplítea derecha, quien cursó con dolor neuropático crónico de difícil manejo a pesar de recibir múltiples analgésicos orales y bloqueos nerviosos. Se implantó un neuroestimulador medular con lo cual se logró un alivio hasta del 80 % en intensidad de dolor de la paciente, además de una mejoría de su funcionalidad y calidad de vida.
Conclusiones
La estimulación de la médula espinal se considera una intervención neuromoduladora eficaz, que ha demostrado resultados satisfactorios para tratar diversas formas de dolor crónico refractario en los pacientes con cáncer, incluido el dolor neuropático.
Palabras clave: Dolor neuropático; estimulación de la médula espinal; cáncer; dolor crónico; reporte de caso
Introduction
Neuropathic pain is present in up to 40 % of all cancer patients. A considerable number of patients fail to achieve enough pain relief with conventional treatment, which is why therapeutic alternatives such as spinal cord stimulation should be considered.
Case description and results
This is the case of a female patient with chronic neuropathic pain secondary to a partial femoral nerve injury sustained during resection and lymph node dissection surgery with curative intent for a large stage II cell squamous cell carcinoma T2N0M0, localized in the right popliteal fossa. The patient presented with difficult to manage chronic neuropathic pain, despite receiving multiple oral analgesics and nerve blocks. A medullary neurostimulator was implanted that relieved the patient's pain intensity in up to 80%, in addition to improved function and quality of life.
Conclusions
Spinal cord stimulation is considered an effective neuromodulatory intervention which has shown satisfactory results in the treatment of various types of refractory chronic pain in cancer patients, including neuropathic pain.
Key words: Neuropathic pain; spinal cord stimulation; cancer; chronic pain; case report
¿Qué sabemos acerca de este problema?
El dolor neuropático en los pacientes con cáncer es un síntoma altamente prevalente y puede tener origen en el daño directo generado por la neoplasia o por daño secundario derivado del tratamiento oncológico, como es el caso de la paciente de este caso, el cual se presentó después de la lesión del nervio femoral durante la cirugía oncológica.
La evidencia de manejo de dolor neuropático, específicamente en pacientes con cáncer, por medio de la neuroestimulación medular es limitada, se basa en estudios pequeños y reportes de caso.
¿Qué aporta este estudio de nuevo?
Evidencia que apoya el uso de neuroestimulación medular para manejo del dolor neuropático en pacientes con cáncer.
Discusión y resumen breve de la literatura sobre dolor neuropático, datos epidemiológicos, factores de riesgo, neuroestimulación medular y sus indicaciones en pacientes con dolor crónico por cáncer, en particular dolor de origen neuropático.
INTRODUCCIÓN
El dolor en pacientes oncológicos es un síntoma con alta prevalencia, se estima que entre 65 % y 85 % de los pacientes con cáncer experimentan dolor en algún punto de la trayectoria de su enfermedad, de estos, el 20 % corresponde a dolor neuropático y hasta el 40 % a dolor mixto (neuropático y nociceptivo 1,2. El dolor neuropático se define como el "dolor causado por una lesión o enfermedad que afecta el sistema somatosensorial" 2,3 y puede conducir tanto a la pérdida de la función como al aumento de la sensibilidad y al dolor espontáneo 3,4.
En los pacientes con cáncer, el dolor neuropático puede originarse en el daño directo al sistema nervioso por el tumor primario o por metástasis, o puede ser secundario al tratamiento oncológico (cirugía, quimioterapia o radioterapia 5. Se ha asociado con malos desenlaces, mayores requerimientos analgésicos, peor funcionamiento físico, cognitivo y social comparado con los pacientes con dolor nociceptivo 6,7. Aproximadamente del 10 % al 15 % de los pacientes con dolor relacionado con cáncer no logran alivio del dolor con opioides solos o en combinación con analgésicos adyuvantes 8 La estimulación de la médula espinal (EME) se ha propuesto como una técnica efectiva dentro del arsenal terapéutico para el manejo de diversos tipos de dolor relacionado con el cáncer 8,9.
REPORTE DE CASO
Mujer de 60 años de edad, vendedora ambulante, con antecedente de carcinoma escamocelular de célula grande T2N0M0 estadio II, localizado en la fosa poplítea derecha, a quien se le realizó resección local ampliada más vaciamiento ganglionar con objetivos curativos en julio de 2006. Sufrió lesión parcial del nervio femoral a la altura de la ingle, confirmada por estudio de electrodiagnóstico, presenta posteriormente dolor neuropático localizado en la cara anterior de miembro inferior derecho, desde el tercio medio del muslo hasta el tercio medio de la pierna, con intensidad 9/10 según la escala numérica análoga de dolor (ENA), que disminuía a 8/10 con analgesia oral y/o reposo, pero con el movimiento aumentaba la intensidad del dolor.
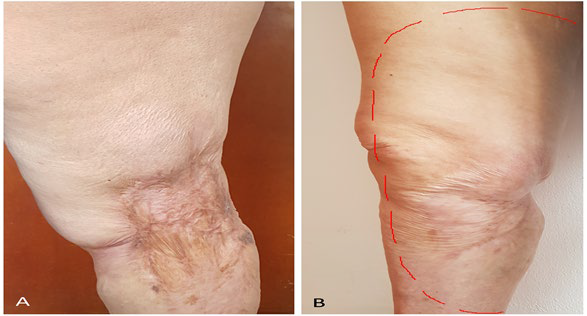
HALLAZGOS CLÍNICOS
La paciente presentaba áreas de alodinia e hyperalgesia en el territorio de los nervios femoral y safeno derechos (dermatomas L2, L3, L4) (Figura 1), disminución de la fuerza muscular 3/5 en los flexores de la cadera y de la rodilla derecha, 4/5 en los dorsi y plantiflexores del pie derecho y marcha en estepaje que requería apoyo de bastón. El dolor se tornó de difícil manejo, por lo que requirió diferentes esquemas analgésicos en altas dosis durante aproximadamente 8 años, con diferentes tipos de fármacos, neuromoduladores (pregabalina y gabapentina), antidepresivos (amitriptilina), antiepilépticos (oxcarbacepina), y opioides potentes (metadona, oxicodona y buprenorfina transdérmica), además de manejo intervencionista (dos bloqueos epidurales translaminares L2-L3 y un bloqueo simpático L4 derecho), con lo que logró un control parcial del dolor.
INTERVENCIÓN TERAPÉUTICA
La paciente cursa con dolor neuropático crónico, de gran intensidad, con pobre respuesta a los múltiples esquemas analgésicos farmacológicos y al manejo intervencionista. Tiene limitación de la movilidad y la funcionalidad, con una importante afectación de su calidad de vida. En 2014 se planteó el manejo con estimulación medular y, previa prueba positiva realizada en octubre de 2017, se le implantó el neuroestimulador (NE) en enero de 2019 (Figura 2), sin complicaciones inmediatas ni posteriores a la intervención.
Es pertinente aclarar que, a pesar de la indicación temprana del manejo con NE, tanto la prueba como el implante se retrasaron por un lapso aproximado de 5 años, debido a múltiples problemas administrativos y de autorizaciones por parte de su entidad promotora de salud.
SEGUIMIENTO Y RESULTADOS
Posterior al implante del NE se evidenció una mejoría progresiva del dolor, con una disminución de intensidad hasta "de un 80 %" referido por la paciente a los 3 meses del procedimiento (ENA 2/10), lo cual le permitió reintegrarse a sus actividades laborales y de la vida diaria. Se cambió el opioide potente con opioide débil y, dada la persistencia de áreas de alodinia, continúa el manejo con fármacos neuromoduladores en dosis bajas.
DISCUSIÓN
El dolor neuropático es un proceso complejo que involucra mecanismos maladaptativos y cambios neuroplásticos en respuesta a una lesión del sistema nervioso periférico (SNP)9. Independientemente de la causa, el dolor neuropático se debe a fenómenos de hiperexcitabilidad y sensibilización 10. La hiperexcitabilidad es secundaria a la generación de descargas espontáneas y a respuestas anormales a estímulos despolarizadores (mecánicos, térmicos o químicos) que ocurren en el nervio lesionado. Las descargas ectópicas producen cambios tanto en el SNP como en el sistema nervioso central (SNC), que se engloban en el concepto de sensibilización central 10. Estos cambios explican el fenómeno de alodinia, en el que un estímulo inocuo desencadena un dolor desproporcionado, debido a la reducción del umbral de activación de los nociceptores 10,11.
La EME es un enfoque no farmacológico, mínimamente invasivo, para el manejo del dolor neuropático y nociceptivo 12. Se ha demostrado su efectividad especialmente en cuadros de dolor crónico como el síndrome doloroso regional complejo (SDRC) y el síndrome de cirugía de espalda fallida 12,13. Desde su primer uso para el control del dolor en 1967 por Norman Shealy 14, múltiples estudios han demostrado su eficacia en el tratamiento del dolor crónico intratable por una variedad de causas, incluido el dolor por cáncer 15-17.
La técnica de EME consiste en la aplicación de electricidad a las columnas dorsales de la médula espinal para modular/manipular las señales de dolor transportadas por las vías ascendentes 9,12. El concepto de EME se basa en la "teoría de la compuerta del dolor" propuesta por Melzack y Wall en 196518, que postula la existencia de una "puerta" en el asta dorsal de la médula espinal (ADME) que controla el tráfico de los impulsos neuronales desde las neuronas sensoriales aferentes hasta los centros superiores del cerebro 8,9. Las fibras Aß (responsables de transportar los estímulos no nociceptivos) y las fibras C (responsables de transportar los estímulos dolorosos) forman sinapsis con las neuronas de proyección del tracto espinotalámico en el ADME, responsables de la transmisión del dolor 12,18. La estimulación de las fibras Aß en la misma región que las fibras C puede provocar el cierre de la "puerta" y, por lo tanto, bloquear la transmisión de los impulsos de dolor 9,18.
Basados en esta teoría, Shealy y colaboradores implantaron el primer estimulador de columna dorsal en 1967 para el tratamiento del dolor 12,14. Sin embargo, varias décadas de investigación han demostrado que los mecanismos exactos subyacentes a la analgesia inducida por la EME para el dolor son mucho más complejos y continúan en estudio y, específicamente, en dolor neuropático no se han explorado completamente 9,12,17.
Se ha demostrado que la EME puede modular diferentes elementos del dolor neuropático, incluida la alodinia, y además tiene una acción antiisquémica, por lo cual resulta efectiva en el manejo de síndromes dolorosos específicos tanto isquémicos como neuropáticos 11,15. La evidencia disponible sobre la utilización de EME en el manejo del dolor neuropático en pacientes con cáncer aún es escasa; sin embargo, la evidencia acumulada de estudios en modelos animales respalda un mecanismo sugerido para el control del dolor neuropático 8; adicionalmente, hay reportes de caso que pueden sustentar su uso cuando el dolor es refractario a otras modalidades de tratamiento 16,17.
CONCLUSIONES
Se presentó un caso de dolor neuropático secundario al tratamiento del cáncer, refractario a los tratamientos convencionales, que fue tratado con éxito mediante neuroestimulador medular. Esta técnica puede ser una alternativa terapéutica efectiva y segura para pacientes oncológicos con dolor neuropático de difícil manejo en quienes se han agotado los tratamientos disponibles. La paciente experimentó mejoría del dolor neuropático, disminuyó el consumo de analgésicos opioides y neuromoduladores, logró retornar a sus actividades diarias y mejorar su calidad de vida; así mismo, continúa en seguimiento por el servicio de Dolor y Cuidados Paliativos, y autorizó la publicación de su caso.
RESPONSABILIDADES ÉTICAS
Protección de personas y animales Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos Los autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informado La paciente dio su consentimiento por escrito, autorizando a los autores el uso de datos, fotografías e imágenes clínicas para el reporte de su caso con fines académicos y científicos.
RECONOCIMIENTOS
Contribuciones
VQC: planificación del estudio, obtención de datos, búsqueda de literatura, análisis de los datos, redacción inicial del manuscrito y redacción final del manuscrito.
BMMA y CHRM: identificación del caso, planificación del estudio, análisis de los datos, redacción final del manuscrito y aprobación final del manuscrito.
REFERENCIAS
1. Boland E, Mulvey M. Classification of neuropathic pain in cancer patients, Review. Curr Opin Support Palliat Care. 2015;9:112-5. doi:10.1097/SPC.0000000000000136. [ Links ]
2. Edwards H, Mulvey M, Bennett M. Cancer-related neuropathic pain. Cancers. 2019;11(3):373. doi: 10.3390/cancers11030373. [ Links ]
3. Jensen TS, Baron R, Haanpaa M, Kalso E, Loeser JD, Rice AS, Treede RD. A new definition of neuropathic pain. Pain. 2011;152:2204-5. doi: 10.1016/j.pain.2011.06.017. [ Links ]
4. Pérez S, Acosta A. Consenso mexicano de manejo de dolor por cáncer. Gaceta Mexicana de Oncología. 2016;15(Supl 1):3-34. [ Links ]
5. Bennett MI, Rayment C, Hjermstad M, Aass N, Caraceni A, Kaasa S. Prevalence and aetiology of neuropathic pain in cancer patients: A systematic review. Pain . 2012;153:359-65. doi: 10.1016/j.pain.2011.10.028. [ Links ]
6. Rayment C, Hjermstad MJ, Aass N, Kaasa S, Caraceni A, Strasser F, et al. Neuropathic cancer pain: Prevalence, severity, analgesics and impact from the European Palliative Care Research Collaborative-Computerised Symptom Assessment study. Palliat Med. 2013;27:714-21. doi: 10.1177/0269216312464408. [ Links ]
7. Fallon M. Neuropathic pain in cancer. Br J Anaesthesia. 2013;111(1):105-11. doi:10.1093/bja/aet208. [ Links ]
8. Flagg A, McGreevy K, Williams K. Spinal cord stimulation in the treatment of cancer-related pain: "Back to the Origins". Curr Pain Headache Rep. 2012;16(4):343-9. doi:10.1007/s11916-012-0276-9. [ Links ]
9. Eisenberg E, Burstein Y, Suzan E. Spinal cord stimulation attenuates temporal summation in patients with neuropathic pain. PAIN. 2015;156(3):381-5. doi: 10.1097/01.j.pain.0000460342.69718.a2. [ Links ]
10. Zarranz JJ. Dolor. En: Neurología. Sexta edición. Elsevier España, S.L.U; 2018. p. 235-48. [ Links ]
11. Papuc E, Rejdak K. The role of neurostimulation in the treatment of neuropathic pain. Ann Agric Environ Med. 2013;20(1):14-7. [ Links ]
12. Deer T, Jain S, Hunter C, Chakravarthy K. Neurostimulation for intractable chronic pain. Brain Sci. 2019;9(2):23. doi:10.3390/brainsci9020023. [ Links ]
13. Cameron T. Safety and efficacy of spinal cord stimulation for the treatment of chronic pain: a 20-year literature review. J Neurosurg. 2004;100:254-67. doi: 10.3171/spi.2004.100.3.0254. [ Links ]
14. Shealy CN, Mortimer JT, Reswick JB. Electrical inhibition of pain by stimulation of the dorsal columns: Preliminary clinical report. Anesth Analg. 1967;46:489-91. [ Links ]
15. Yakovlev AE, Ellias Y. Spinal cord stimulation as a treatment option for intractable neuropathic cancer pain. Clin Med Res. 2008;6(3-4):103-6. doi: 10.3121/cmr.2008.813. [ Links ]
16. Yakovlev AE, Resch BE. Spinal cord stimulation for cancer-related low back pain. Am J Hosp Palliat Med . 2011;29(2):93-7. doi:10.1177/1049909111410414. [ Links ]
17. Yakovlev AE, Resch BE, Karasev SA. Treatment of cancer-related chest wall pain using spinal cord stimulation. Am J Hosp Palliat Med . 2010;27(8):552-6. doi:10.1177/1049909110373240. [ Links ]
18. Melzack R, Wall PD. Pain mechanisms: A new theory. Science. 1965;150(3699):971-8. doi:10.1126/science.150.3699.971. [ Links ]
Recibido: 27 de Enero de 2020; Aprobado: 08 de Julio de 2020; Aprobado: 01 de Septiembre de 2020











 text in
text in