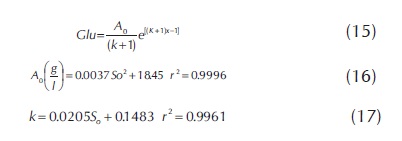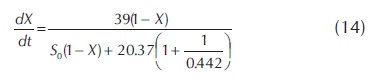Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Biotecnología
Print version ISSN 0123-3475
Rev. colomb. biotecnol vol.14 no.1 Bogotá Jan./June 2012
ARTÍCULO DE INVESTIGACIÓN
Hidrólisis enzimática de residuos de la cosecha de caña de azúcar
Hydrolysis Enzymatic of crop residues sugar cane
Salcedo Mendoza Jairo G.1, Galán López Jorge E.2, Pardo Flórez Luz Marina 3.
1 C. Ph.D. Escuela de Ingeniería Química. Universidad del Valle. Universidad de Sucre. jairo.salcedo@unisucre.edu.co
2 Dr. Sci. Grupo Interinstitucional de Investigación en Biocombustibles. GRUBIOC. Universidad del Valle. jorge.lopez@correounivalle.edu.co
3 Dr. Sci. Grupo Interinstitucional de Investigación en Biocombustibles. GRUBIOC. Universidad Autónoma de Occidente.lmflorez@uao.edu.co
Recibido: enero 2 de 2012 Aprobado: junio 29 de 2012
Resumen
En esta investigación, se hidrolizó un sustrato deslignificado proveniente de residuos de la cosecha caña de azúcar (hojas y cogollos) usando un preparado enzimático con 27.53 unidades de papel filtro (FPU), obtenido a partir de enzimas comerciales. La hidrólisis se llevó a cabo a un pH de 4.2 y una temperatura de 50 oC. Fueron analizados modelos de inhibición por sustrato, glucosa e inhibición total por producto. Los resultados mostraron que los modelos que mejor se ajustan a los datos experimentales, son los modelos de inhibición competitiva por glucosa, con una constante de Michaelis (Km) de 20.37 g/L, velocidad máxima (Vmax) 39 g/L h y una constante de inhibición (ki) de 0.442. En el caso que las relaciones enzima - Sustrato (E/S) sean mayores de 0.5, se puede aplicar el modelo cinético de Michaelis-Menten.
Palabras clave: Inhibición, modelos cinéticos, hojas y cogollos, coctel de enzimas
Abstract
In this research, a delignified substrate from crops residues sugar cane residues (leaves and top cane) was hydrolyzed using an enzyme preparation with 27.53 FPU. This enzyme was obtained from trade. Hydrolysis was carried out to pH of 4.2 and a temperature of 50 oC. Models of inhibition models substrate, glucose and total inhibition product was analyzed. The results showed that models that best fit the data experimental was the models competitive glucose inhibition (Km= 20.37, Vmax=39 and ki= 0.442). In the event that E/S is above 0.5, can applied kinetic models of Michaelis - Menten.
Key words: Inhibition, kinetic models, leaves and tops cane, enzyme cocktail.
Introducción
En el Valle del Cauca (Colombia) se siembran alrededor de doscientas mil hectáreas de caña y se cosechan 16 millones de toneladas de caña de azúcar por año (Cenicaña, 2007). Esta producción genera en el Valle del Cauca abundantes desechos lignocelulósicos, alrededor de 7 millones de toneladas por año constituidos principalmente por las hojas y cogollos, los cuales pueden ser aprovechados en la producción de combustibles de segunda generación. Entendiendo este escenario, es necesario buscar alternativas tecnológicas que permitan la conversión a azúcares fermentables de estos residuos agrícolas. En éste trabajo se evalúan experimentalmente parámetros de modelos cinéticos de la hidrólisis enzimática encontrados en la literatura, utilizando como sustratos residuos de la cosecha de caña de azúcar (hojas y cogollos), para que puedan ser utilizados en la modelación y simulación de procesos de obtención de alcohol carburante.
La hidrólisis enzimática de la celulosa es una reacción de pasos múltiples que toma lugar en un sistema heterogéneo, en el cual la celulosa insoluble se fracciona en la interface sólido - líquido por la acción sinérgica de la ß-1-4 endoglucanasa, ß-1-4 exo celobiohidrolasas, ß-1-4 glucan hidrolasas y las ß-1-4 glucosidasas (Selby et al., 1976; Kadam et al., 2004; Kubicek, 1992; Zhang et al., 2004). Numerosos intentos se han hecho experimentalmente para encontrar modelos que describan los mecanismos de inhibición de glucosa y celobiosa sobre celulasas, entre los que se encuentran: modelos competitivos, no-competitivos o mezclados en concordancia con los esquemas clásicos de Michaelis- Menten (Philippidis et al., 1993; Beltrame et al., 1984; Al-zuhair et al., 2007; Kadam et al., 2004; Gruno et al., 2004). También, ha sido evaluada la inhibición por celobiosa sobre diferentes sistemas enzimáticos celulíticos usando principalmente Celulosa "pura" (Andric et al, 2010). En la búsqueda de la producción de alcohol carburante de residuos de caña de azúcar se han propuesto diferentes alternativas para la producción de azúcares fermentables como la hidrólisis química (Rodríguez - Chong et al., 2004; Geddes et al., 2010) y diferentes pretratamientos del material lignocelulósico seguido de hidrólisis enzimática (Fuentes et al., 2011; Adsul et al., 2005; Rolz et al., 1987; Martin et al., 2002).
Materiales y métodos
Las hojas y cogollos usados en este estudio provienen de los residuos de cosecha de dos variedades Colombianas de caña de azúcar cultivadas en el Valle del Cauca (CC 8475 - CC 8592), siendo suministradas por el Centro de Investigaciones de la Caña de Azúcar "CENICAÑA"
Pretratamiento de residuos de cosecha de caña de azúcar.
Los residuos de la cosecha de la caña que se usaron en esta investigación, se sometieron a secado y molienda hasta que el 94.5% del material pasara una malla 10 (2 mm) y el 22% una malla 60 (0.25 mm). Se preparó un sustrato obtenido por un tratamiento con organosolvente, con alcohol etílico al 45% v/v como solvente, hidróxido de sodio al 3% p/v como catalizador, se utilizó una relación sólido/líquido de 1:8 p/v. La reacción se llevó a cabo en un reactor de 10 litros durante dos horas a una temperatura de 160 oC (Mutis, 2009). El material obtenido se lavó y secó y se le denominó S1 (ver tabla 1).
El sustrato S1, se continúo deslignificando para separar hemicelulosa. Inicialmente, se le adiciono ácido sulfúrico 1N hasta un pH de 5, manteniendo una relación sólido/líquido 85:15 p/v. Seguidamente, se agregó EDTA en relación de 1/1000 p/p con respecto al material sólido. La mezcla se agitó a 1000 rpm durante10 minutos, luego se filtró y se lavó el sólido con agua suficiente para lograr un pH neutro. Luego, éste sólido se disolvió con hidróxido de sodio 1N, hasta llevar la mezcla a un pH de 10.8, con una relación sólido/líquido de 85:15 y agregando 4% de peróxido de hidrógeno con respecto al sólido, durante dos horas. Después, se filtró, lavó y secó. A este sustrato, se le denomino sustrato S2. Para el análisis composicional de los sustratos, se utilizó el método Van Soest (Van Soest, 1893).
Coctel de enzimas.
La enzima usada en esta investigación estuvo compuesta por un preparado enzimático de mezclas de enzimas comerciales donadas por Genecor® International. Las cuales tuvieron las siguientes actividades: Celulasa 27.53 unidades de papel filtro /ml, Endoglucanasa 1782.1 CMC/ml, Exoglucanasa 0.37 UI/ml, ß- glucosidasa 550 p NPG U/ml, Xilanasa 28.23 UI/ml, Galactosidasa 7.11 UI/ml, Mananasa 2.76 UI/ml, Ramnosidasa 14.63 UI/ml. Este coctel se caracterizó por la distribución de sus actividades enzimáticas, las cuales están dirigidas a la degradación de celulosa y hemicelulosa; además del alto contenido de actividad ß- glucosidasa, que genera una mayor velocidad de degradación de celobiosa (Salcedo et al., 2010).
Evaluación del pH y temperatura sobre la actividad de la enzima.
El sustrato S1 se utilizó para determinar las condiciones de temperatura y pH a los que puede operar la enzima. Las actividades enzimáticas fueron determinadas por los métodos descritos por Stemberg et al., 1977; Mandels et al., 1976;, 1987; Megazyme, 2009; Jong-Rok et al., 2008. Se recurrió a un diseño experimental rotacional compuesto con puntos estrellas para evaluar la relación entre las variables pH y temperatura, en un diseño factorial para la combinación del tiempo de reacción en dos niveles (1 y 3 horas) y pH en cinco niveles (3.5, 3.8, 4, 4.5 y 5). Las reacciones enzimáticas se realizaron en tubos de ensayo de 10 ml, como medio de calentamiento se usó un baño termostatado con control de temperatura. Se utilizó una relación enzima /sustrato de 0.3 ml/g, en cinco mililitros de buffer citrato de sodio 0.05 M. Cada 10 minutos se agitaron las muestras hasta cumplir el tiempo de reacción. Al final de cada ensayo, las muestras se sometieron a centrifugación a 5000 rpm en una centrifuga Marca Beckman®, Modelo 5414. El líquido sobrenadante se centrifugó a 14000 rpm a -5 oC durante 10 minutos. Al nuevo sobrenadante se le determinó los azúcares reductores por el método DNS (Miller, 1959).
Determinación del modelo cinético.
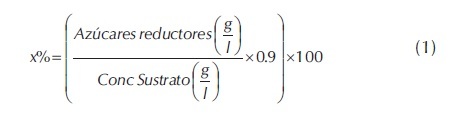
La información recolectada para validar los modelos cinéticos, se obtuvo a partir de reacciones de hidrolisis enzimáticas de residuos de caña de azúcar. Estas reacciones se realizaron en matraces de 250 ml con una agitación de 250 rpm. Al material pretratado (S2), se le adicionaron 100 ml de una solución buffer 0.05 M de citrato de sodio a pH 4.2 y temperatura de 50 oC. Se mantuvieron relaciones enzima (ml)/sustrato (gr) de 1.5, 0.75, 0.5, 0.375, 0.25, 0.187. Los tratamientos se realizaron por triplicado durante 51 horas, coleccionando muestras para análisis a (0, 0.5, 1, 1.5, 2, 6, 9, 24, 27, 33, 48 y 51 horas). Las muestras recolectadas se sometieron a centrifugación a -5 oC durante 10 minutos, al líquido sobrenadante se le determino azúcares reductores por el método DNS. La cuantificación de glucosa y celobiosa se hizo por cromatografía liquida, empleando un equipo HPLC Shimadzu con una columna Sugar Pack I, detector de Indice de refracción con agua como fase móvil a flujo de 0.4 ml/min y un tiempo de retención promedio de 8.6 minutos para celobiosa y 11.5 para glucosa. Para la medición de glucosa y celobiosa las muestras se centrifugaron a 14000 rpm a- 5 oC por 30 minutos, para luego proceder a la precipitación de proteínas con acetona (CINVESTAV-UGPM, 2009). Seguidamente se sometieron a rota-evaporación a 40 oC y 450 mbar a 50 rpm para retirar la acetona, finalmente se retoma la centrifugación por 10 minutos y se somete a filtrado (0.22µm). Con la información recolectada se construyeron curvas de progreso para la producción de azúcares reductores y glucosa. El porcentaje de conversión se calculó a través de la Ecuación 1 (Ghose, 1987).
Determinación de los parámetros cinéticos (Michaelis - Menten).
Con los datos de azúcares reductores obtenidos de las curvas de progreso para diferentes concentraciones iniciales de sustrato, se determinaron las velocidades iniciales, a partir de las pendientes cuando el tiempo tiende a cero (Marangoni, 1987; Dixon et al., 1979; Duarte, 1995). Por este método se calculó la constante de Michaelis - Menten (Km) y la velocidad máxima (Vmax).
Evaluación de la inhibición por sustrato.
Se basa en la determinación de la velocidad inicial de hidrólisis, con el objetivo de evitar altas concentraciones de producto que incidan sobre la velocidad intrínseca de reacción. Se consideraron, como variable independiente la relación enzima/concentración de sustrato (E/S) y como variable dependiente la velocidad inicial de hidrólisis. Para confirmar los modelos de inhibición incompetitiva por sustrato, inhibición no competitiva por sustrato (ecuaciones 2 y 3), se utilizó la metodología propuesta por Alberty (2008). Estas ecuaciones se reordenaron, formulándose las ecuaciones 4 y 5, las cuales pueden ser expresadas por un modelo en función de las constantes a, b y c (ver ecuación 6). A través de la construcción de figuras de la relación Sustrato/Velocidad de reacción (S/V) contra la concentración de sustrato (S), conjuntamente con un análisis de regresión polinomial y de un análisis de regresión no lineal basado en el algoritmo Marquardt recurriendo al software estadístico STATGRAPHICS®, se calculó la constante cinética de inhibición por sustrato ks
Modelos de Inhibición por producto.
Evaluada la constante de Michaelis- Menten y la velocidad máxima, se procede con la evaluación de las constantes cinéticas de los modelos que presenten inhibición por productos. Entre los modelos cinéticos analizados se encuentran aquellos que tienen en cuenta la inhibición representada por todos los productos generados durante la reacción, que son expresados como la conversión total de azúcares reductores (X), Ecuaciones 7, 8 y 9. Además, se analizaron modelos que especifican la injerencia de la glucosa como inhibidor, tomando como base el modelo general de inhibición propuesto por Bezerra et al. (2004). Todos los modelos cinéticos propuestos se basaron en la integración matemática de modelos típicos de inhibición como son: modelos de inhibición competitiva, incompetitiva, no-competitiva y mezclada. Los modelos tenidos en cuenta son representados por las ecuaciones 10, 11, 12 y 13. La determinación de los parámetros de inhibición de los modelos cinéticos, se basó en el balance de masa en un reactor por lotes de la hidrólisis enzimática (Coraza et al., 2005; Orsi et al., 1979; Chau et al., 1977). Para la evaluación de los parámetros cinéticos a partir de los datos experimentales, se utilizó un análisis de regresión no lineal basado en el algoritmo Marquardt, a través del software estadístico STATGRAPHICS®.
Resultados y discusión
Caracterización de los sustratos y enzimas obtenidas.
Los residuos de la cosecha de la caña de azúcar tenían un contenido porcentual (p/p) de celulosa de 37.6%, hemicelulosa 34.6 %, lignina de 21.2 3% y un número de Kappa de 47 (Gómez, 2010). Después del pretratamiento, el sustrato S1 alcanzó un contenido de celulosa de 80.53, hemicelulosa de 13.35 %, lignina de 1.35 % y número de Kappa de 5.85. De la misma forma, el sustrato S2 obtuvo un contenido de celulosa de 82.6%, hemicelulosa de 7.37%, lignina de 4.79 % y número de Kappa de 6.21 (ver tabla 1). Lo cual, muestra la eficiencia de los pretratamientos, al lograr una reducción considerable de lignina y hemicelulosa con respecto al residuo sin tratar. Algunos trabajos de investigación sobre pretratamiento de materiales lignocelulósicos muestran las bondades del proceso organosolvente: Cuando se utiliza acetona - agua, se presenta un aumento de glucanos en pinus radiata de 45.3% a 70.9%, y para pajas de caña de azúcar con 5 horas de tratamiento, el resultado muestra un contenido porcentual de lignina y celulosa que pasa de 21.5%, 39.4% hasta 11.7% y 64%, respectivamente (Araque et al., 2008; Saad et al., 2008). Igualmente, cuando se emplea alcohol sobre bagazo de caña de azúcar, iniciando con una composición de glucanos de 49.3%, xilanos de 15.65% y lignina insoluble de 27.22%, después del pretratamiento se obtiene un producto con 62.08% de glucanos y 8.71% de xilanos (Mesa et al., 2010)
Condiciones de operación de la enzima.
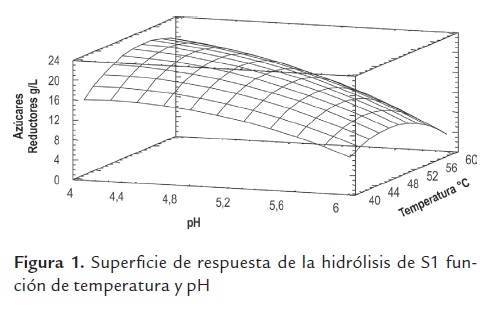
La información obtenida para determinar las condiciones de operación del preparado enzimático se expresan en la figura 1, estos resultados presentan un coeficiente de determinación 0.9864 con un nivel de confianza del 95%. Se observa como el pH tiene un mayor efecto sobre la producción de azúcares reductores. Los valores máximos de la superficie de hidrólisis para el sustrato S1 corresponden a una temperatura cercana a los 50 oC y a un pH entre 4 y 4.4.
El cambio de los azúcares reductores producidos en la hidrólisis del material S1 en el rango de pH obtenido en la superficie de respuesta, muestra un valor máximo entre un pH de 3.8 y 4.2 (Ver figura 2 ). Estos resultados están dentro de las condiciones de operatividad propuestos Genecor® para mezclas de enzimas como: endoglucanasa y beta glucosidasa (temperatura 50- 60 oC y pH 4.5), endoglucanasa y xilanasa (temperatura 45-65 oC y pH 3.5- 6.5). En forma similar, para betaglucosidasa (temperatura 30-55 oC, pH 4-6) y para hemicelulasas (50 -75 oC, pH 4- 7)
Parámetros cinéticos.
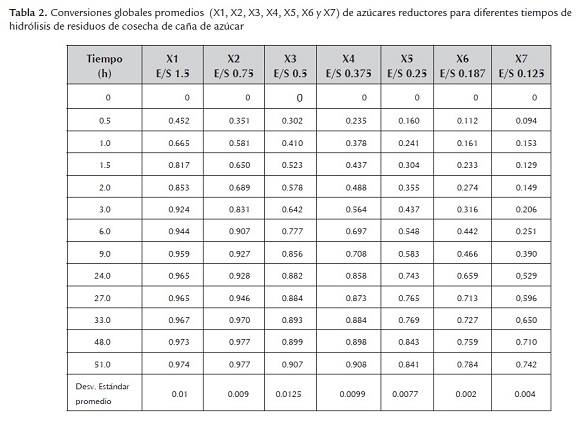
La tabla 2 presenta los datos que se utilizaron para la construcción de las curvas de progreso de producción de azúcares reductores en la hidrólisis del sustrato S2 con sus respectivas desviaciones estándar. En esta tabla, las siglas X1, X2, X3, X4, X5, X6 y X7 representan conversiones globales promedios, que están referidos a todos los azúcares reductores involucrados en la reacción de hidrólisis, para concentraciones de sustrato de 10, 20, 30, 40, 60, 80 y 120 g/L, que corresponden a relaciones enzima/sustrato (E/S) 1.5, 0.75, 0.5, 0.375, 0.25, 0.187 y 0.125 ml/g, respectivamente. Además, equivalen a cargas de actividad celulolítica de 41.3, 20.64, 13.76, 10.32, 6.88, 5.09 y 3.44 FPU/g de sustrato, respectivamente.
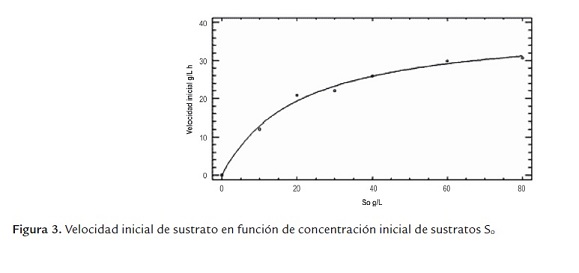
Con esta información se evalúa la velocidad inicial de hidrólisis, la cual se obtiene al evaluar la pendiente cuando el tiempo tiende a cero, con un coeficiente de determinación (r2) por encima de 0.99 de una regresión polinómica de tercer orden, de la curva obtenida al graficar la conversión (X) contra el tiempo para cada relación enzima/sustrato. Los resultados de la velocidad inicial en función de la concentración inicial de sustrato se pueden ver en la figura 3, la cual permitió determinar las constantes del modelo de Michaelis-Menten como son la velocidad máxima Vmax y la constante de Michaelis Km
Para establecer las constantes de inhibición por sustrato se utilizo un modelo matemático de segundo orden (ecuación 14), generado al graficar la relación entre la concentración inicial y la velocidad inicial de hidrólisis (Vo/So) obtenida de la figura 4 contra concentración inicial de sustrato (So).
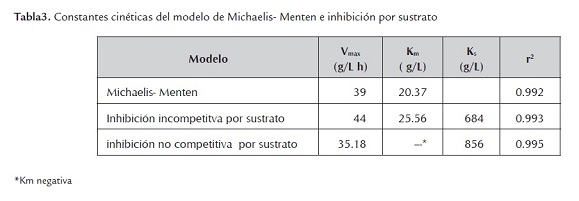
Los resultados de las constantes cinéticas se presentan en la tabla 3. Se observa que no hay una diferencia estadística entre el modelo de Michaelis - Menten y de inhibición incompetitiva por sustrato. En este último modelo, la constante de inhibición por sustrato Ks es 20 veces mayor que Km. Un análisis de valor de la constante del modelo cinético de inhibición incompetitiva, conduce a despreciar el término adicional de inhibición (S2/Ks ) con respecto a la constante de Michaelis, ya que no genera un cambio sobre el resultado de la velocidad de hidrólisis. Con estos argumentos se puede afirmar que la inhibición por sustrato no tiene un papel importante en el modelo cinético. Además, el modelo de inhibición no competitiva por sustrato no aplica por presentar valores de Km negativos.
En el desarrollo de los modelos cinéticos, se hizo necesario encontrar una correlación matemática entre la relación E/S, la conversión total y el contenido de glucosa, a partir de los datos experimentales. Esta correlación permitió resolver analíticamente las ecuaciones diferenciales que representaban los diferentes modelos. La figura 5 presenta las curvas de progreso para el contenido de glucosa, datos que suministran la información necesaria para obtener la relación entre el % conversión y el contenido de glucosa (ver ecuaciones 15, 16 y 17)
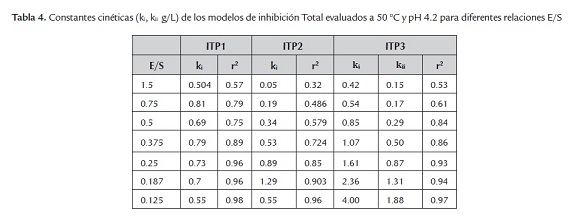
Es importante hacer notar que las concentraciones de celobiosa presentadas durante las diferentes corridas experimentales alcanzaron valores máximos de 0.7 g/L, los cuales son valores menores comparados con la producción de glucosa. Esta diferencia se debe a que el preparado enzimático usado en esta investigación, contiene un alto contenido de actividad ß-glucosidasa. En la tablas 4 y 5, se presentan los resultados para las evaluaciones de las constantes cinéticas para los modelos que involucran como inhibidores a todos los azúcares reductores expresados como % conversión total (ITP1, ITP2 e ITP3) y los modelos que tengan como inhibidor solamente glucosa (IC, INC, IIC e INCM). Además, en estas tablas se presentan los coeficientes de determinación (r2) que permiten decidir cual modelo se ajusta mejor a los datos experimentales.
El modelo que presentó mayores coeficientes de determinación en este estudio, fue el de inhibición competitiva (IC). Estos resultados están de acuerdo con los modelos propuestos por Andric et al. (2010), donde se precisa que los modelos de inhibición más comunes en este tipo de reacciones son la inhibición competitiva y no competitiva. Además, reporta constantes de inhibición ki (g/L) entre 0.01 y 54 g/L. Igualmente, el National Renewable Energy Laboratory (NREL), usando como sustrato residuos de la cosecha de maíz, propuso modelos de inhibición competitiva por glucosa (Kadan et al., 2004). En dicho estudio, se definió como referencia el modelo de inhibición (IC), para indicar la velocidad de hidrólisis de residuos de cosecha de caña de azúcar, el cual presenta una constante de inhibición entre 0.427 g/L y 0.464 g/L hasta relaciones E/S de 0.375, con un promedio de 0.442 g/L.
En el caso de concentraciones menores a 30 g/l ó E/S mayores que 0.5, donde los coeficientes de determinación fueron bajos, se buscó una alternativa para distinguir qué tipo de modelo podía representar los datos experimentales. Como una primera aproximación, se hizo una comparación entre los datos arrojados por el modelo de Michaelis-Menten y los datos experimentales para las relaciones E/S menores a 30 g/L. Las figuras 6 y 7, presentan las curvas de progreso para datos arrojados en la simulación del modelo de Michaelis - Menten (XM) y los datos obtenidos experimentalmente para cada una de las relaciones E/S.
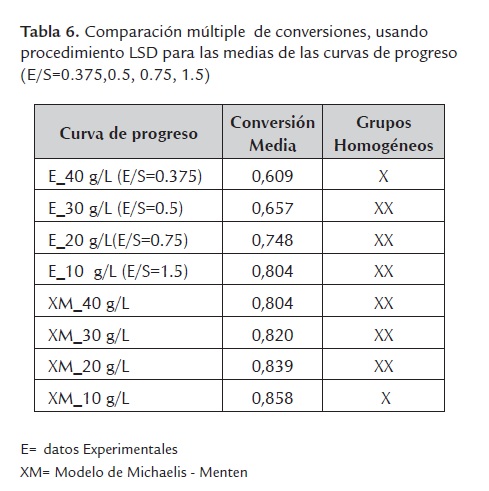
Para determinar cuáles medias son significativamente diferentes de las otras, en el rango de E/S de 0.375 hasta 1.5, se utilizó el procedimiento de diferencia mínima significativa (LSD) de Fisher, con un riesgo de un 5% de que cada par de media es significativamente diferente. El análisis se expresa en la tabla 6, donde se puede concluir que puede existir diferencia entre las curvas de progreso correspondiente E/S= 0.375 y E/S=1.5
Se puede concluir que para relaciones E/S por encima de 0.5 es posible aplicar el modelo encontrado de Michaelis-Menten sin tener en cuenta los fenómenos de inhibición.
En resumen, puede decirse que en este trabajo, para el modelo de Michaelis-Menten, el análisis de los datos experimentales arroja las siguientes constantes cinéticas: Km= 20.37 g/L y Vmax= 39 g/L h. El modelo cinético de inhibición competitiva (IC), es el que presenta los mejores ajustes con los datos experimentales, muestra una constante de inhibición promedio de 0.442 g/L, puede ser aplicado para relaciones E/S menores a 0.375. Este modelo cinético queda definido por la ecuación 14:
La inhibición por sustrato no tiene un papel importante en la hidrólisis de residuos de la cosecha de caña de azúcar. En la hidrólisis de residuos de la cosecha de caña de azúcar para relaciones E/S mayor de 0.5, se puede aplicar el modelo cinético de Michaelis-Menten
Agradecimientos
Los autores agradecen el soporte financiero dado al proyecto 2007D-3719-346-07 por el Ministerio de Agricultura y Desarrollo Rural, la Universidad Autónoma de Occidente (Laboratorio de Bioprocesos) y la Universidad del Valle, lo mismo que a la Agencia de Cooperación Suiza a través del proyecto: EPFL DDC 2009-2012 SCIENTIFIC COOPERATION FUND.
Bibliografía
1 Adsul, M.G., Ghule, J.E., Shaikh, H., Singh, R., Bastwde, K.B., Gokhale, D.V., Varma, A. J. 2005 Enzymatic hydrolysis of delignified bagasse polisaccharides. Carbohydrates Polymers, 62 (1): 6-10. [ Links ]
2 Alberty R. 2008. Determination of kinetic parameters of enzyme - catalyzed reactions with a minimum number of velocity measurements. Journal of theoretical Biology, 254: 156-163. [ Links ]
3 Al-Zuhair, S., Fan, Y.L., Chui, K.S., Rizwan, S. 2007. Kinetics of Aspergillus niger cellulase inhibition by reducing sugar produced by the hydrolysis of carboxymethylcellulose. Int J Chem React Eng, 5:1-9. [ Links ]
4 Andric, A., Meyer, A.S., Jensen, P., Dam-Johansen, K. 2010. Reactor design for minimizing product inhibition during enzymatic lignocelluloses hydrolysis: I, significance and mechanism of cellobiose and glucose inhibition on cellulitic enzymes. Biotechnology Advances, 28 (3): 308-324. [ Links ]
5 Araque, E., Parra, C., Freer, J., Contreras, D., Rodríguez, J., Mendonça, R., Baeza, J. 2008. Evaluation of organosolv pretreatment for the conversion of Pinus radiata D. Don to ethanol. Enzyme and Microbial Technology, 43 (2): 214-219. [ Links ]
6 Bailey, M., Biely, P., Pountanen, K. 1992. Interlaboratory testig of methods for assay of xylanase activity. Journal of Biotechnology. 23 (3): 257 - 270. [ Links ]
7 Beltrame, P.L., Carniti, P., Focher, B., Marzetti, A., Sarto, V. 1984. Enzymatic hydrolysis of cellulosic materials: a kinetic study. Biotechnol Bioeng, 26 (10):1233-1238. [ Links ]
8 Bezerra, R., Días, A. 2004. Discrimination among eight modified Michaelis-Menten kinetics models of cellulose hydrolysis with a large range of substrate/enzyme ratios. Applied Biochemistry and Biotechnology, 112: 173-182. [ Links ]
9 CENICAÑA. 2007. Indicadores de productividad de la industria azucarera colombiana entre enero y agosto de 2006 - 2007 [Informe Anual]., Florida, Valle del Cauca. [ Links ]
10 Chau, T., Talalay, P. 1977. Simple generalized equation for the analysis of multiple inhibitions of Michaellis - Menten kinetics system. The Journal of Biological Chemistry, 252 (18): 6438- 6442. [ Links ]
11 CINVESTAV-UGPM. Métodos de precipitación para limpieza de proteínas. Disponible en http://www.cinvestav.mx. (Consultado en Noviembre 2009) [ Links ]
12 Coraza, F.C., Calsavara, L.P., Moraes, F.F., Zanin, G.M., Neitzel, I. 2005. Determination of inhibition in the enzymatic hydrolysis of cellobiose using hybrid neural modeling. Brazilian Journal of Chemical Engineering, 22 (1): 19- 29 [ Links ]
13 Dixon, M., Webb, E. C. 1979. Enzyme. 3rd. ed. Longman Group Limited. London. chap. 2. [ Links ]
14 Duarte, A. 1995 introducción a la Ingeniería Bioquímica. Departamento de Ingeniería Química, Universidad Nacional, Bogotá, Colombia. [ Links ]
15 Fuentes, L., Rabelo, S., Filho, R., Costa, A. 2011. Kinetics of line pretreatment of sugar cane bagasse to enhance enzymatic hydrolysis. Appl. Biochem. Biotechnol., 163 (5): 612 - 625. [ Links ]
16 Geddes, C.C., Peterson, J.J., Zacchi, G., Mullinnix, K.T., Shanmugan, K.T., Ingram, M.O. 2010. Optimizing the saccharification of sugar cane bagasse using dilute phosphoric acid followed by fungal cellulases. Bioresourse Technology. 101 (6): 1851-1857. [ Links ]
17 GENENCOR®, DANISCO DIVISION, Product information, Cellulase enzyme complex for lignocellulosic biomass hydrolysis, accessory beta- glucosidase enzyme for biomass hydrolysis, Xylanas/cellulose enzyme complex for biomass hydrolysis,, accessory Xylanase enzyme for biomass hydrolysis. Disponible en http://www.genencor.com (consultado el diciembre 2010) [ Links ]
18 Ghose, T.K. 1987. International Union Of Pure And Applied Chemistry (IUPAC). Measurement of cellulose activities. Pure & Appl. Chem, 52 (2): 257-268 [ Links ]
19 Gómez, C. 2010. Caracterización preliminar de los polisacáridos presentes en los residuos de cosecha (Hojas y cogollos) de tres variedades (CC8475, CC8592, V7151) de caña de azúcar. [Tesis para optar titulo de Msc], Universidad del Valle, Cali, Colombia [ Links ]
20 Gruno, M., Väljamäe, P., Pettersson, G., Johansson, G. 2004. Inhibition of the Trichoderma reesei cellulases by cellobiose is strongly dependent on the nature of the substrate. Biotechnol. Bioeng, 86 (59): 503-11. [ Links ]
21 Jong-Rok, J., Murugesan, K., Kim, Y., Kim, E., Chang, Y. 2008. Synergistic effect of laccase mediators on pentachlorophenol removal by Ganoderma lucidum laccase. Appl Microbiol Biotechnol, 81: 783-790. [ Links ]
22 Kadam, K.L., Rydholm, E.C., Mcmillan, J.D. 2004. Development and validation of a kinetic model for enzymatic saccharification of lignocellulosic biomass. Biotechnol Prog, 20 (39): 698-705. [ Links ]
23 Kubicek, C.P. 1992. The cellulase proteins of Trichoderma reesei: structure, multiplicity, mode of action and regulation of formation. Adv Biochem Eng Biotechnol, 45:1-26. [ Links ]
24 Mandels, M., Andreotti, R., Roche, C. 1976. Measurement of saccharifying cellulase. Biotech. Bioeng. Symp, 6:21-33. [ Links ]
25 Martin, C., Galbe, M., Whalbon, C., Jonsson, L. 2002. Ethanol production from enzymatic hydrolysates of sugar cane bagasse using recombinant xylose - utilizing Saccharomyces cerevisiae. Enzyme and Microbial Technology, 31 (3): 274- 282. [ Links ]
26 Marangoni, A. 2003. Enzyme kinetics. A modern approach. Department of food science. University of Guelh. Wiley Interscience. [ Links ]
27 Megazyme International Ireland Limited. Assay 1-4-ß xilanase using Azo Xilan (OAT), SAXYO. Disponible en http//:www.Megazyme.com. (consultado diciembre 2009) [ Links ]
28 Megazyme International Ireland Limited. Assay of rhamnogalacturonanase using Azo- Rhamnogalacturonan AZRH 11/99. Disponible en http//:www.Megazyme.com. (Consultado diciembre 2009). [ Links ]
29 Megazyme International Ireland Limited. Assay of endo 1-4-ß-D Galactanase using AZO -GALACTAN (AGALP). Disponible en http//:www.Megazyme.com. (Consultado diciembre 2009). [ Links ]
30 Megazyme International Ireland Limited. Assay of 1-4-ß- endo Mannanase using AZO- CAROB GALACTOMANNAN. Disponible en http//:www.megazyme.com. (Consultado diciembre 2009). [ Links ]
31 Mesa, L., Gonzales, E., Ruiz, E., Romero, I., Cara, C., Felissia, F., Castro, E. 2010. Preliminary evaluation of organosolv pre-treatment of sugar cane bagasse for glucose production: Application of 23experimental design, Applied Energy. 87: 109-114. [ Links ]
32 Miller, G.L. 1959. Use of dinitrosalicylic acid reagent for determination of reducing sugars. Analytical chemistry, 31 (3): 426- 426 [ Links ]
33 Mutis, D. 2009. Delignificación de residuos de la caña de azúcar (hojas y cogollos) con procesos químicos, [Tesis de grado para optar título de ingeniero Químico], Escuela de Ingeniería Química, Cali, Colombia, Universidad del Valle. [ Links ]
34 Orsi, B.A., Tipton, T.K., 1979. Kinetic analysis progress. Methods in Enzymology. 63: 159-183, Academic Press, Inc. [ Links ]
35 Philippidis, G.P., Smith, T., Wyman, C. 1993. Study of the enzymatic hydrolysis of cellulose for production of fuel ethanol by the simultaneous saccharication and fermentation process. Biotechnol Bioeng, 41 (9):846-53. [ Links ]
36 Rolz, C., De Leon, R., De Ariola, M.C., Cabrera, S. 1987. White rot fungal growth on sugar cane lignocellulosic residues. Appl. Microbiol. Biotechnol. 25 (6): 535- 541. [ Links ]
37 Rodríguez - Chong, A., Ramírez, J.S., Garrote, G., Vásquez M. 2004. Hydrolysis of sugar of bagasse cane using nitric acid: a kinetic assessment. Journal of Food Engineering, 61 (2): 143-152. [ Links ]
38 Saad, M., Oliviera, L., Candido, R., Quintana, G., Rocha G. 2008 preliminary studies on fungal treatment of sugar cane straw for organosolv pulping. Enzyme and Microbial Technology 43 (2): 220-225. [ Links ]
39 Salcedo, J., Pardo, L., López, J. 2011. Evaluación de enzimas para la hidrólisis de residuos (hojas y cogollos) de la cosecha de la caña de azúcar, Revista Dyna; 168: 182- 190. [ Links ]
40 Selby, A., Maitland, C. 1976. The cellulose of trichodermaviride, separation of the components involved in the solubilization of cotton. Biochem J, 104 (3): 716-72. [ Links ]
41 Sternberg, D., Vijay Kumar, P., Reese, E.T. 1977. ß-Glucosidase: microbial production and effect on enzymatic hydrolysis of cellulose. Canadian Journal of Microbiology 23: 139-147. [ Links ]
42 Van Soest, P. J. 1983. Use of detergents in the Analysis of fibrous feeds. I. Preparation of fiber residues of low nitrogen content. Journal of the AOAC, 46(5), 829 - 835 [ Links ]
43 Wood, T., Bhat, M. 1988. Methods for measuring Cellulase activities. Methods in Enzymology, 60: 87 - 112. [ Links ]
44 Zhang, Y., Lynd, L. 2004. Toward an aggregated understanding of enzymatic hydrolysis of cellulose: non-complexed cellulase systems. Biotechnol. Bioeng, 88 (7):797-824. [ Links ]