Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO  Similars in Google
Similars in Google
Share
Revista Colombiana de Obstetricia y Ginecología
Print version ISSN 0034-7434On-line version ISSN 2463-0225
Rev Colomb Obstet Ginecol vol.57 no.3 Bogotá Sept. 2006
* Candidato a Magíster en Epidemiología Departamento de Salud Pública. Facultad de Salud. Universidad Industrial de Santander. Centro de Investigaciones Epidemiológicas UIS. Carrera 32 No. 29-31. Telefax: (57-7)6345781. Móvil: (57)3156753127. Correo electrónico: mcastro2505@yahoo.es Bucaramanga. Colombia
** Magíster en Epidemiología. Profesor Auxiliar del Departamento de Salud Pública. Facultad de Salud. Universidad Industrial de Santander. Carrera 32 No. 29-31. Telefax: (57)-7-6345781 Bucaramanga. Colombia.
*** Magíster en Epidemiología. Profesor Auxiliar. Dirección de Postgrados. Facultad de Medicina. Universidad Militar Nueva Granada. Carrera 5 No. 49-00 Bogotá. Colombia.
RESUMEN
El objetivo de este artículo es describir el conocimiento actual en cáncer de cuello uterino desde una perspectiva epidemiológica. El carcinoma cervical invasivo es una enfermedad prevenible que afecta con mayor frecuencia a los países en desarrollo (83,1% de casos y 85,5% de muertes). El grado de lesión de una citología de base está asociado con el riesgo de desarrollar posteriormente esta enfermedad. El virus del herpes simple tipo 2 y otros agentes infecciosos han sido estudiados como posibles causas de esta enfermedad pero sólo algunos virus del papiloma humano (VPH) han demostrado cumplir los criterios de causalidad. Algunas características clínicas pueden afectar la supervivencia de las mujeres que padecen esta enfermedad.
Palabras clave: neoplasias de cuello uterino, epidemiología, pronóstico, virus del papiloma humano
SUMMARY
This review was aimed at summarising the current state of knowledge about cervical cancer using epidemiological information. Invasive cervical cancer is a potentially preventable disease involving a disproportionate burden in developing countries (83.1% of cases and 85.5% of deaths). Women’s pap smear histories are related to the risk of subsequent cervical cancer. Herpes simplex virus type 2 and other infectious agents have been evaluated in causality studies related to cervical cancer; however, only some types of human papillomavirus have been shown to fulfill the criteria of causality. Clinical factors change survival rates.
Key words: cervical carcinoma, epidemiology, prognosis, human papillomavirus.
INTRODUCCIÓN
Aunque el cáncer invasivo de cuello uterino es una enfermedad potencialmente prevenible sigue siendo un problema de salud pública debido a que afecta con una frecuencia desproporcionada a los países menos desarrollados (83,1% de casos y 85,5% de muertes).1,2 Globalmente, esta entidad se diagnostica a 490.000 mujeres y causa 273.000 muertes anua-les.2 Los programas de tamizaje que introdujeron a la citología del cuello uterino como herramienta fundamental en las actividades de prevención, ya han demostrado su efectividad en los países desarrollados.3 La probabilidad de cambio con el tiempo de una lesión observada en una citología es dependiente de su grado de compromiso inicial. El pronóstico de las mujeres con cáncer de cuello uterino varía según las características del tumor, del agente y de la paciente. El objetivo de este artículo es realizar una revisión de la información actual sobre algunos aspectos del cáncer cervical invasivo desde una perspectiva epidemiológica.
Frecuencia y distribución del cáncer de cuello uterino
1. Según el grado de desarrollo: Se estima que más del 80% de los casos y muertes atribuibles al cáncer del cuello uterino ocurre en las regiones en desarrollo.2,4,5 Las tasas crudas de incidencia son de 16,6 casos nuevos por 100.000 mujeres-año en las regiones menos desarrolladas y de 13,6 por 100.000 en las más desarrolladas; mientras que las de mortalidad son de 9,5 y 6,4 muertes por 100.000, respectivamente. Luego de comparar sus tasas estandarizadas por edad, los países con menos desarrollo tienen 1,8 veces más incidencia y 2,8 veces más mortalidad que los más desarrollados.2
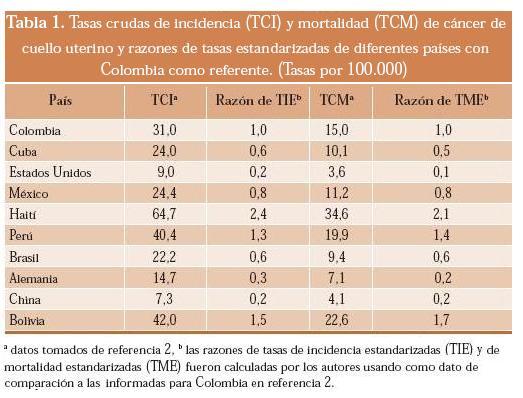
2. Según el país: Las tasas crudas de incidencia varían entre 1,4 (Siria) y 64,7 (Haití) casos nuevos por 100.000 mientras que las de mortalidad lo hacen entre 0,7 (Siria) y 37,6 (Lesotho) muertes por 100.000.2 La tabla 1 muestra las tasas crudas de incidencia y mortalidad de algunos países seleccionados y sus razones de tasas estandarizadas. Para el cálculo de estas razones, los autores de esta revisión utilizan como cifras de comparación las tasas estandarizadas de Colombia informadas en la base Globocan 2002.2
Historia natural de la enfermedad
Los estudios del cambio de las displasias con el tiempo han mostrado que las probabilidades de regresión a citología normal y de progresión a carcinoma in situ e invasivo son dependientes del grado de lesión obtenido en el examen de base. Según Holowaty6 existe una mayor probabilidad de progresión y de regresión de las lesiones citológicas durante los primeros dos años de seguimiento, en su estudio se observó un mayor riesgo de progresión a “al menos” carcinoma in situ en las mujeres con displasia moderada (riesgo relativo (RR) 8,1 IC95% 6,1-10,6) y severa (RR 22,6 IC95% 16,0-32,1) que en aquellas con displasia leve; después de dos años, los riesgos de progresión fueron 2,5 (IC95% 2,1-3,0) y 4,1 (IC95% 3,0-5,7), respectivamente. En cuanto a progresión a carcinoma invasivo durante los primeros dos años, se encontraron RR de 4,5 (IC95% 1,9-10,3) en mujeres con displasia moderada y 20,6 (IC95% 7,7-55,5) en aquellas con severa; después del período inicial, los riesgos de carcinoma invasivo fueron 2,0 (IC95% 1,3-3,1) y 5,6 (IC95% 2,8-11,6), respectivamente. En total, durante los dos primeros años, el 2,1% (IC95% 1,7%-2,4%) de las mujeres con displasia leve y el 16,3% (IC95% 15,0%-17,7%) de las mujeres con displasia moderada progresaron “al menos” a displasia severa. En este estudio, los riesgos pueden estar subestimados debido a pérdidas durante el seguimiento o a problemas inherentes a la toma y lectura de citologías. La descripción de la historia natural del cáncer de cuello uterino propuesta por los autores de esta revisión se presenta en la Figura 1 siguiendo los conceptos de historia natural de la enfermedad.7,8

Causalidad
Los virus del papiloma humano (VPH) de alto (tipos 16 y 18) y de mediano riesgo (tipos 31, 33, 35, 39, 45, 51, 52, 56, 58 y 59) cumplen con los criterios de causalidad.9-11 Los de alto riesgo fueron reclasificados como carcinogénicos aunque se sugirió incluir también a los de mediano riesgo y a los tipos 68, 73 y 82 y denominar a los tipos 26, 53 y 66 como probable-mente carcinogénicos.12 Los criterios de causalidad pueden ser analizados de la siguiente forma:
- a) intensidad: La exposición a VPH de alto riesgo es mínimo 15 veces mayor en mujeres con cáncer de cérvix9 y, según su tipo, los riesgos oscilan entre 66 y 119 para carcinoma escamoso y entre 6,6 y 63 10,13 para adenoescamoso y adenocarcinoma;
- b) consistencia: La asociación se ha observado en países de alto y bajo riesgo y en mujeres de diferentes edades y culturas informándose virtualmente 13-17 en todos los estudios;
- c) especificidad: Más del 90% de los casos pueden atribuirse a VPH de alto riesgo,9 además no existen hipótesis biológicas alternas para explicar su etiología;17
- d) secuencia temporal: Ante la evidencia inicial de la asociación con VPH, el siguiente paso fue demostrar que la infección precedía a la neoplasia14,17 usando estudios de cohortes;
- e) gradiente biológico: Los niveles elevados de material genético del VPH16 tienen alto valor predictivo en la progresión de la enfermedad. El riesgo de neoplasia cervical es proporcional al número de infecciones por VPH y existe una curva dosis-respuesta que muestra que sólo la exposición persistente a la infección puede producir carcinogénesis;15,18
- f ) verosimilitud: El potencial oncogénico de los VPH de alto riesgo ha sido demostrado tanto in vitro como en animales9,17 y en estudios de cohortes que buscan establecer la historia natural de la enfermedad;14
- g) coherencia: Las mujeres con actividad sexual de inicio reciente y negativas al VPH que luego adquieren una infección por VPH16 desarrollan posteriormente neoplasia cervical.14 En términos generales, el virus interfiere con los mecanismos de regulación del crecimiento celular, de reparación del DNA e inmunológicos;9,19
-h) experimento: La investigación de vacunas contra el VPH ha demostrado que el control de esta infección puede traducirse en el control del cáncer;20
- i) analogía: Más del 15% de neoplasias involucran agentes infecciosos que podrían inducir carcinogénesis. Según las revisiones de Kuper21 y Mueller22 se deduce que la asociación entre el VPH y el cáncer de cuello uterino es análoga con las descritas para otros agentes y carcinomas.
Aunque la evidencia epidemiológica ha sugerido que el VPH es causa necesaria para el desarrollo del cáncer de cuello uterino, no ha podido demostrar que sea también causa suficiente.9,19 Por el contrario, diferentes cofactores que ayudan a definir grupos de riesgo se involucran en el proceso de carcinogénesis formando parte de la red de causalidad y, dependiendo de su acción, pueden clasificarse en directos (aquellos que por mecanismos propios ayudan a la transformación celular) e indirectos (aquellos que aumentan el riesgo de infección por VPH).
Dentro del grupo de factores directos se encuentran el tabaquismo, la influencia hormonal, la infección por Chlamydia trachomatis, el tipo de HLA, la inmunosupresión y la susceptibilidad genética. Los carcinógenos del tabaco pueden encontrarse en el moco cervical de las mujeres fumadoras y, por tanto, el consumo de tabaco es una variable obligatoria en los estudios de causalidad.23,24 La asociación entre el uso de contraceptivos orales y el carcinoma cervical no es consistente24-26 y pierde significación cuando se ajusta por la presencia de infección por VPH.10 La C. trachomatis actuaría como cofactor del VPH considerándose de alto riesgo a sus tipos I, D y 27,28 La dieta y la actividad física no han mostrado asociación causal.29-31 Otros agentes virales como herpes simple tipo 2, citomegalovirus y el virus de Epstein-Barr tampoco han mostrado asociación causal con el cáncer de cuello uterino.9,32
Los factores indirectos más frecuentemente estudiados son el inicio temprano de la actividad sexual, el número de compañeros sexuales, el tener un compañero sexual de alto riesgo, el antecedente de enfermedades sexualmente transmitidas, el estado civil y el antecedente de citología anormal.33,34
En un estudio de poblaciones de alto riesgo se concluyó que el riesgo del cáncer cervical aumentaba con el inicio precoz de la actividad sexual, el número de compañeros sexuales y el antecedente de infección gonocócica.34 La escolaridad muestra una asociación fuerte con el cáncer de cuello uterino hasta el punto de considerarse una forma para definir grupos de riesgo.35
Factores pronósticos
La probabilidad de supervivencia de las mujeres con cáncer de cuello uterino es afectada por el tipo de VPH, la tensión de oxígeno tumoral, la presión del fluido intersticial tumoral, el subtipo histológico, el estadio clínico al diagnóstico, la profundidad de invasión tumoral, la presencia de invasión vascular, las metástasis a nódulos linfáticos, la edad y el esquema de tratamiento.36-42 Las mujeres infectadas con VPH18 tienen un pronóstico más pobre como consecuencia de mayor compromiso nodal y mayor profundidad de invasión del estroma.36 La baja tensión de oxígeno tumoral antes de iniciar el tratamiento puede inducir resistencia a la radiación.37 El tiempo libre de enfermedad a tres años es del 34% en las pacientes con presión de líquido intersticial mayor a 19 mmHg y aumenta a 68% si esa presión es menor; esta variable sigue siendo significativa después de ajustar por la presencia de nódulos linfáticos positivos y el tamaño tumoral.38 La supervivencia es menor en pacientes con carcinomas indiferenciados y de células pequeñas y mixtas comparadas con las que tienen subtipos endocervicales o de células en anillo de sello39,40
Según el estudio de Alfsen,40 la mortalidad de las mujeres con cáncer de cuello uterino aumenta 1,8 veces después de los 35 años; su supervivencia a 5 años es del 76% en estadio I, 46% en estadio II, 19% en estadio III y 0% en estadio IV; además el autor encontró que la mortalidad aumenta dos veces si hay infiltración del cuerpo uterino, 2,2 veces si hay invasión vascular, 1,8 veces si hay hasta dos nódulos linfáticos positivos y 4,7 veces si son más. Thoms41 encontró una supervivencia de 66% a 26 meses en pacientes en estadio IB tratadas con radioterapia mientras que el 100% de las que fueron intervenidas quirúrgicamente seguían vivas. Wang42 observó que al comparar con radioterapia, el tratamiento con quimioterapia disminuía en un 38% el riesgo de muerte de las pacientes con enfermedad recurrente. En una revisión sistemática se concluyó que la quimiorradiación aumentaba la supervivencia general (hazard ratio (HR)=0,71), la supervivencia libre de progresión (HR=0,61) y que disminuía la recurrencia local (HR=0,61) y distante (HR=0,57) con efectos más significativos en las mujeres tratadas en estadios iniciales de la enfermedad.43
CONCLUSIONES
El cáncer invasivo de cuello uterino es una enfermedad que, a pesar de ser susceptible a la prevención secundaria, sigue siendo un problema de salud pública en los países en desarrollo debido a su baja capacidad para organizar programas de tamizaje adecuados. Existe evidencia de una relación entre el grado de displasia informado en un examen citológico de base y el riesgo de progresión o regresión de la lesión durante el seguimiento, de forma que hay mayor probabilidad de progresión a cáncer y menor de regresión a la normalidad en las displasias moderadas y severas que en las leves. Sin embargo, debido a las características inherentes a la citología, los estudios que se basan en este examen no están exentos de errores de clasificación de las lesiones iniciales y siguientes, lo cual produce variaciones de los riesgos calculados con respecto a los reales. La asociación observada entre algunos tipos de VPH y el cáncer de cuello uterino cumple con los criterios de causalidad definidos por Hill.11 Actualmente, algunas investigaciones se han dirigido a encontrar vacunas que sirvan como medida preventiva. Aunque ya se conoce porqué no es causa suficiente, el uso de las vacunas contra el VPH podría demostrar si este virus es o no una causa necesaria única para la enfermedad, es decir, esta medida preventiva ofrecería la oportunidad de evaluar cuáles exposiciones tienen o no la capacidad de iniciar un proceso maligno en el cuello uterino cuando el virus está controlado. El pronóstico de una paciente con cáncer de cuello uterino es dependiente de las características de la paciente (por ejemplo, edad), del tumor (por ejemplo, estadio clínico al momento del diagnóstico) y del esquema tratamiento. Un factor que puede afectar el pronóstico de las pacientes con cáncer de cuello uterino, pero que hasta el conocimiento de los autores no ha sido estudiado, es el retraso en el inicio del tratamiento o su intermitencia una vez iniciado, por causas administrativas del sistema de salud o por creencias de la mujer y su pareja. Por último, aunque los programas de tamizaje ya demostraron disminuir la incidencia y la mortalidad por cáncer invasivo de cuello uterino es necesario que en los países en desarrollo se garanticen los recursos necesarios para cumplir con los dos objetivos principales de estos programas: aumentar la cobertura del examen citológico y resolverles a las usuarias sus problemas de anormalidad.
REFERENCIAS
1. Cannistra SA, Niloff JM. Cancer of the uterine cervix. N Engl J Med 1996;334:1030-8. [ Links ]
2. Ferlay J, Bray F, Pisani P, Parkin DM. GLOBOCAN 2002: Cancer incidence, mortality and prevalence worldwide, version 2.0. IARC Cancer Base N.º 5. Lyon, France: IARC Press; 2004. [ Links ]
3. Sankaranarayanan R, Budukh AM, Rajkumar R. Effective screening programmes for cervical cancer in low- and middle-income developing countries. Bull World Health Organ 2001;79:954-62. [ Links ]
4. Restrepo HE, González J, Roberts E, Litvak J. Epidemiología y control del cáncer de cuello uterino en América Latina y el Caribe. Bol Oficina Sanit Panam 1987;102:578-93. [ Links ]
5. World Health Organization. Cervical cancer control in developing countries: memorandum from a WHO meeting. Bull World Health Organ 1996;74:345-51. [ Links ]
6. Holowaty P, Miller AB, Rohan T, To T. Natural history of dysplasia of the uterine cervix. J Natl Cancer Inst 1999;91:252-8. [ Links ]
7. Leavell HR, Clark EG. Preventive medicine for the doctor in his community: an epidemiologic approach. New York: McGraw-Hill Company; 1965. p. 14-38. [ Links ]
8. Beaglehole R, Bonita R, Kjellstrom T. Epidemiología básica. Washington: OPS; 1994. [ Links ]
9. Arends MJ, Buckley CH, Wells M. Aetiology, pathogenesis, and pathology of cervical neoplasia. J Clin Pathol 1998;51:96-103. [ Links ]
10. Chichareon S, Herrero R, Munoz N, Bosch FX, Jacobs MV, Deacon J, et al. Risk factors for cervical cancer in Thailand: a case-control study. J Natl Cancer Inst 1998;90:50-7. [ Links ]
11. Hill AB. Ambiente y enfermedad: ¿Asociación o causación? Bol Oficina Sanit Panam 1992;113:233-42. [ Links ]
12. Munoz N, Bosch FX, de Sanjose S, Herrero R, Castellsague X, Shah KV, et al. Epidemiologic classification of human papillomavirus types associated with cervical cancer. N Engl J Med 2003;348:518-27. [ Links ]
13. Sellors JW, Mahony JB, Kaczorowski J, Lytwyn A, Bangura H, Chong S, et al. Prevalence and predictors of human papillomavirus infection in women in Ontario, Canada. Survey of HPV in Ontario Women (SHOW) Group. CMAJ 2000;163:503-8. [ Links ]
14. Woodman CB, Collins S, Winter H, Bailey A, Ellis J, Prior P, et al. Natural history of cervical human papillomavirus infection in young women: a longitudinal cohort study. Lancet 2001;357:1831-6. [ Links ]
15. Cuzick J, Terry G, Ho L, Hollingworth T, Anderson M. Type-specific human papillomavirus DNA in abnormal smears as a predictor of high grade cervical intraepithelial neoplasia. Br J Cancer 1994;69:167-71. [ Links ]
16. Schiffman MH. New epidemiology of human papillomavirus infection and cervical neoplasia. J Natl Cancer Inst 1995;87:1345-7. [ Links ]
17. Bosch FX, Lorincz A, Munoz N, Meijer CJ, Shah KV. The causal relation between human papillomavirus and cervical cancer. J Clin Pathol 2002;55:244-65. [ Links ]
18. Franco EL, Villa LL, Sobrinho JP, Prado JM, Rousseau MC, Desy M, et al. Epidemiology of acquisition and clearance of cervical human papillomavirus infection in women from a high-risk area for cervical cancer. J Infect Dis 1999;180:1415-23. [ Links ]
19. Villa LL. Vaccines against papillomavirus infections and disease. Salud Publica Mex 2003;45 suppl 3:S443-8. [ Links ]
20. Koutsky L A, Ault KA, Wheeler CM, Brown DR, Barr E, Alvarez FB, et al. A controlled trial of a human papillomavirus type 16 vaccine. N Engl J Med 2002;347:1645-51. [ Links ]
21. Kuper H, Adami HO, Trichopoulos D. Infections as a major preventable cause of human cancer. J Intern Med 2000;248:171-83. [ Links ]
22. Mueller N. Overview: viral agents and cancer. Environ Health Perspect 1995;103 Suppl 8:259-61. [ Links ]
23. Prokopczyk B, Cox JE, Hoffmann D, Waggoner SE. Identification of tobacco-specific carcinogen in the cervical mucus of smokers and nonsmokers. J Natl Cancer Inst 1997;89:868-73. [ Links ]
24. Franco EL, Duarte-Franco E, Ferenczy A. Cervical cancer: epidemiology, prevention and the role of human papillomavirus infection. CMAJ 2001;164:1017-25. [ Links ]
25. Ursin G, Peters RK, Henderson BE, d’Ablaing G III, Monroe KR, Pike MC. Oral contraceptive use and adenocarcinoma of cervix. Lancet 1994;344:1390-4. [ Links ]
26. Madeleine MM, Daling JR, Schwartz SM, Shera K, McKnight B, Carter JJ, et al. Human papillomavirus and long-term oral contraceptive use increase the risk of adenocarcinoma in situ of the cervix. Cancer Epidemiol Biomarkers Prev 2001;10:171-7. [ Links ]
27. Anttila T, Saikku P, Koskela P, Bloigu A, Dillner J, Ikaheimo I, et al. Serotypes of Chlamydia trachomatis and risk for development of cervical squamous cell carcinoma. JAMA 2001;285:47-51. [ Links ]
28. Smith JS, Munoz N, Herrero R, Eluf-Neto J, Ngelangel C, Franceschi S, et al. Evidence for Chlamydia trachomatis as a human papillomavirus cofactor in the etiology of invasive cervical cancer in Brazil and the Philippines. J Infect Dis 2002;185:324-31. [ Links ]
29. Key TJ, Allen NE, Spencer EA, Travis RC. The effect of diet on risk of cancer. Lancet 2002;360:861-8. [ Links ]
30. Ziegler RG, Weinstein SJ, Fears TR. Nutritional and genetic inefficiencies in one-carbon metabolism and cervical cancer risk. J Nutr 2002;132:2345S-2349S. [ Links ]
31. Friedenreich CM. Physical activity and cancer prevention: from observational to intervention research. Cancer Epidemiol Biomarkers Prev 2001;10:287-301. [ Links ]
32. Lehtinen M, Koskela P, Jellum E, Bloigu A, Anttila T, Hallmans G, et al. Herpes simplex virus and risk of cervical cancer: a longitudinal, nested case-control study in the nordic countries. Am J Epidemiol 2002;156:687-92. [ Links ]
33. Stuver S, Adami HO. Cervical cancer. En: Adami HO, Hunter DJ, Trichoponlos D, eds. Textbook of Cancer Epidemiology. Oxford: Oxford University Press; 2002. p. 340-58. [ Links ]
34. Herrero R, Brinton LA, Reeves WC, Brenes MM, Tenorio F, de Britton RC, et al. Sexual behavior, venereal diseases, hygiene practices, and invasive cervical cancer in a high-risk population. Cancer 1990;65:380-6. [ Links ]
35. Corral F, Cueva P, Yépez J, Montes E. La baja escolaridad como factor de riesgo en el cáncer de cuello de útero. Bol Of Sanit Panam 1996;121:511-7. [ Links ]
36. Im SS, Wilczynski SP, Burger RA, Monk BJ. Early stage cervical cancers containing human papillomavirus type 18 DNA have more nodal metastasis and deeper stromal invasion. Clin Cancer Res 2003;9:4145-50. [ Links ]
37. Lyng H, Sundfor K, Trope C, Rofstad EK. Disease control of uterine cervical cancer: relationships to tumor oxygen tension, vascular density, cell density, and frequency of mitosis and apoptosis measured before treatment and during radiotherapy. Clin Cancer Res 2006;6:1104-12. [ Links ]
38. Milosevic M, Fyles A, Hedley D, Pintilie M, Levin W, Manchul L, et al. Interstitial fluid pressure predicts survival in patients with cervix cancer independent of clinical prognostic factors and tumor oxygen measurements. Cancer Res 2001;61:6400-5. [ Links ]
39. Grisaru D, Covens A, Chapman B, Shaw P, Colgan T, Murphy J, et al. Does histology influence prognosis in patients with early-stage cervical carcinoma? Cancer 2001;92:2999-3004. [ Links ]
40. Alfsen GC, Kristensen GB, Skovlund E, Pettersen EO, Abeler VM. Histologic subtype has minor importance for overall survival in patients with adenocarcinoma of the uterine cervix: a population-based study of prognostic factors in 505 patients with nonsquamous cell carcinomas of the cervix. Cancer 2001;92:2471-83. [ Links ]
41. Thoms WW, Unger ER, Carisio R, Nisenbaum R, Spann CO, Horowitz IR, et al. Clinical determinants of survival from stage Ib cervical cancer in an inner-city hospital. J Natl Med Assoc 1998;90:303-8. [ Links ]
42. Wang CJ, Lai CH, Huang HJ, Hong JH, Chou HH, Huang KG, et al. Recurrent cervical carcinoma after primary radical surgery. Am J Obstet Gynecol 1999;181:518-24. [ Links ]
43. Green JA, Kirwan JM, Tierney JF, Symonds P, Fresco L, Collingwood M, et al. Survival and recurrence after concomitant chemotherapy and radiotherapy for cancer of the uterine cervix: a systematic review and meta-analysis. Lancet 2001;358:781-6. [ Links ]
Conflicto de intereses: ninguno declarado.














