Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO  Similars in Google
Similars in Google
Share
Revista colombiana de Gastroenterología
Print version ISSN 0120-9957On-line version ISSN 2500-7440
Rev Col Gastroenterol vol.20 no.1 Bogotá Mar. 2005
Rolando J. Ortega Q.(1)
(1) MD. Medicina Interna-Gastroenterología-Hepatología. Departamento de Investigaciones, Facultad de Bacteriología. Universidad San Buenaventura. Servicio de Gastroenterología y Hepatología, Hospital de Bocagrande; Cartagena de Indias, Bolívar, Colombia.La infección por el virus de la hepatitis C es una condición frecuente en pacientes con insuficiencia renal crónica en programa de hemodiálisis y representa la principal causa de enfermedad hepática en este grupo.
El impacto del virus C en esta población se hizo evidente una vez empezó a utilizarse el tamizaje para detectar anticuerpos a comienzo de los noventa. La adquisición del virus puede ocurrir en ausencia de los factores de riesgo clásicamente conocidos para su transmisión en la comunidad, sugiriendo que la diseminación puede producirse en las unidades de diálisis por la falta de control en las medidas de bioseguridad.
El pronóstico del paciente con enfermedad renal terminal se ve ensombrecido por la infección con el virus de hepatitis C disminuyendo la sobrevida global aun después del trasplante renal.
La identificación de los pacientes utilizando pruebas diagnósticas (serológicas y moleculares), permite que pueda evaluarse el estadio evolutivo de la enfermedad (biopsia) y que sea discutida su posible inclusión en protocolos de tratamiento. Los interferones permanecen como la principal estrategia terapéutica, alcanzando respuestas sostenidas en una tercera parte de los pacientes tratados, pero con marcadas limitaciones en el perfil de seguridad al comparar su uso con pacientes de la población general (1, 2).
Epidemiología
El virus de la hepatitis C se transmite en forma eficiente por exposición percutánea directa a sangre contaminada y los pacientes en hemodiálisis se encuentran bajo riesgo por tener accesos vasculares prolongados. Además, las personas con infección crónica por este virus desempeñan un papel central en la epidemiología por lo que el contacto en las unidades de diálisis con estos pacientes y con equipos contaminados representan vías importantes de transmisión (3). Con el advenimiento del tamizaje en los bancos de sangre y el uso de eritropoyetina para el manejo de la anemia en pacientes con enfermedad renal terminal, se ha eliminado virtualmente la infección postransfusional del virus de la hepatitis C. A pesar de esto, la prevalencia continúa siendo 5 a 10 veces mayor que en la población general (4).
En países desarrollados, la prevalencia de la infección por el virus de la hepatitis C en pacientes hemodializados va desde un 2,6 hasta un 22,9% con una media de 13,5%, mientras que en países en vías de desarrollo alcanza hasta un 70% en algunas unidades (2) (ver tabla 1). Los datos en América Latina son limitados, pero un estudio reciente realizado en México en 149 pacientes demostró una prevalencia de 6,7% y otro en Brasil con 752 pacientes de 12 unidades de diálisis, evidencio una prevalencia del 52% (6 a 72%) (5, 6). En nuestro hospital (datos no publicados) al analizar 85 pacientes en hemodiálisis, se encontraron dos positivos con anticuerpos Elisa de 3 generación y PCR para una prevalencia de 2,35%.
| PAÍSES | PREVALENCIA (%) |
| Reino Unido | 2,6 |
| Alemania | 3,8 |
| Francia | 10,4 |
| USA | 14 |
| Japón | 14,8 |
| Italia | 20,5 |
| España | 22,9 |
| PROMEDIO | 13,5 |
Tabla 1. Prevalencia de Hepatitis C en pacientes hemodializados.
En un estudio multicéntrico internacional realizado en 8.615 pacientes de 308 unidades de diálisis, el principal factor de riesgo para infección por el virus de hepatitis C fue el tiempo de permanencia en hemodiálisis. En los pacientes con menos de 5 años la prevalencia fue menor del 13% y alcanzó hasta un 58% en los que tenían más de 20 años. Otros factores de riesgo encontrados fueron la raza negra, sexo masculino, diabetes mellitus, historia de sangrado digestivo, infección por el virus B y trasplante renal previo (7).
La transfusión de sangre (antes de 1992) sigue siendo importante como quedó evidenciado en un estudio en 2.796 pacientes de 43 unidades de diálisis, en las cuales, el número de unidades de sangre transfundidas (prevalencia de 30% en pacientes con más de 5 unidades transfundidas) y el tiempo en hemodiálisis representaron los principales factores de riesgo (8).
La seroconversión de anticuerpos (pacientes negativos al inicio del seguimiento) es variable y puede ir desde 0 hasta un 20%. En USA la tasa de seroconversión es de 1 a 3% anual y ha sido asociada con diálisis en la misma máquina inmediatamente después de un paciente crónicamente infectado. La transmisión del virus se da por prácticas inadecuadas para el control de infecciones (transmisión nosocomial) que incluyen la falta de desinfección de equipos y suministros, el uso de bandejas comunes para repartir medicamentos, los viales de múltiples dosis (Ej. heparina), la falta de limpieza inmediata de gotas de sangre, la ausencia de lavado de manos y el no cambio de guantes por parte del personal de enfermería al manipular las fístulas entre los pacientes (3, 9).
La importancia de la aplicación de las medidas de bioseguridad en la transmisión de la infección del virus C quedó demostrada en un estudio realizado en 963 pacientes de 15 unidades de diálisis, donde en tres períodos sucesivos de 18 meses pudo reducirse la tasa de seroconversión desde 1,4% y 0,56% en los dos primeros períodos de observación hasta un 0% en el tercer período (10).
No se ha demostrado que la reutilización de filtros, ni el aislamiento de pacientes infectados (a diferencia de la infección por el virus de la hepatitis B) intervengan en la transmisión nosocomial facilitándola o previniéndola. Es claro que la única medida a favor es la adherencia estricta a las medidas de prevención universal (3). (Ver tabla 2).
| a. Medidas específicas de bioseguridad en la unidad renal |
| b. Pruebas serológicas para hepatitis B y C |
| c. Vacunación para hepatitis B |
| d. Aislamiento de pacientes con AgHBs positivo |
| 2. Entrenamiento y educación permanente del personal |
Tabla 2. Medidas de prevención para la transmisión nosocomial.
Diagnóstico
Desde comienzos de los años noventa se comenzaron a utilizar las pruebas de Elisa de primera y segunda generación, informándose desde entonces una elevada prevalencia de infección por el virus de hepatitis C en pacientes hemodializados (los esquemas serológicos actuales en pacientes en hemodiálisis se ven en la tabla 3). También se hizo evidente que existía una elevada tasa de falsos negativos detectadas al emplear técnicas de biología molecular que alcanzaban un 5%. La introducción más reciente de las pruebas serológicas de tercera generación (Elisa 3) ha mejorado la seguridad diagnóstica en esta población (11). Dos estudios recientes con 2.576 y 2.796 pacientes en hemodiálisis mostraron un 0,23% y un 0,8% de falsos negativos (pacientes virémicos por PCR y negativos por anticuerpos de tercera generación), lo que indica que las pruebas serológicas son altamente confiables para el diagnóstico de la infección por el virus de la hepatitis C y no se justifica la realización de PCR de rutina (8, 12). En nuestro centro no se encontraron falsos negativos en 85 pacientes evaluados utilizando Elisa de tercera generación para la detección de anticuerpos y PCR Amplicor para la detección del ARN viral.
| INGRESO | MENSUAL | SEMESTRAL | ANUAL | |
| Todos | AgHBs, antiHBc AntiHBs, antiVHC ALT | |||
| Susceptibles | AgHBs | |||
| AntiHBs > 10 | antiHBs | |||
| Anti-VHC (-) | ALT | antiVHC |
Tabla 3. Esquemas diagnósticos en la Unidad de Diálisis.
Las muestras para PCR en pacientes hemodializados deben ser obtenidas antes del procedimiento, evitando el uso de heparina que puede interferir con la técnica. El suero es separado de los componentes celulares dentro de las 2 a 4 horas después de la recolección y congelado a temperatura entre –20 y –70 oC hasta su análisis. En caso de requerir transporte, se hace necesario tomar medidas para evitar que haya descongelamiento, lo que dañaría el material genético (3).
La carga viral de los pacientes en hemodiálisis suele ser menor que la de los pacientes en la población general, debido a que el procedimiento disminuye los niveles de ARN por la absorción dentro de la superficie interna del dializador, por la destrucción de partículas virales secundaria a la presión hidráulica ejercida por la sangre y por la mayor actividad del interferón endógeno (13).
Los análisis genómicos muestran una clara preponderancia del genotipo 1 (80%) con variaciones entre el genotipo 1a que predomina en USA y el 1b en Europa (2,8). No se ha encontrado diferencia entre el genotipo y la mortalidad, pero llama la atención que hasta en un 10% de los pacientes pueden encontrarse 2 o más genotipos, situación infrecuente en la población general (14).
La determinación seriada de aminotransferasas no correlaciona con la viremia ni con la histología de los pacientes en hemodiálisis infectados por el virus C. Además, es bien conocido que los pacientes con insuficiencia renal terminal en hemodiálisis tienen valores más bajos de aminotransferasas en comparación con los sujetos sanos, lo que dificulta la evaluación de cualquier elevación por enfermedad ya que es posible que ésta no sobrepase el nivel superior de normalidad aceptado (4).
Un estudio reciente dirigido a evaluar las aminotransferasas en pacientes con ARN positivo (infectados) y ARN negativo (no infectados), no observó diferencias significativas entre los grupos utilizando como límite de detección 37 UI , pero sí cuando el límite se disminuía a 27 UI (40% elevada en infectados vs. 9% en no infectados con una p<0,05) (15).
Las recomendaciones actuales para el enfoque diagnóstico de la hepatitis C en pacientes hemodializados se resume en la figura 1.

Figura 1. Algoritmo diagnóstico en pacientes con Hepatitis C
Historia natural
El análisis de la historia natural de la infección por el virus de hepatitis C en pacientes con insuficiencia renal en manejo con hemodiálisis es muy complejo por diversas situaciones:
1. Los pacientes con enfermedad renal terminal tienen una elevada tasa de morbilidad y mortalidad en relación con la población general, lo que hace que sea difícil apreciar la historia natural de la infección por el virus C que es de larga evolución.
2. No existe correlación entre los niveles de aminotransferasas y la actividad histológica de la enfermedad.
3. La mayoría de estudios con biopsia hepática sólo incluyen una pequeña cantidad de pacientes (16).
La infección por el virus C en pacientes hemodializados es por lo general asintomática con un curso indolente. El período de incubación va desde 14 hasta 180 días y la infección aguda se caracteriza por una elevación intermitente de aminotransferasas que precede a la seroconversión de los anticuerpos. En personas inmunocompetentes, entre un 15 y 25% pueden resolver la infección sin secuelas, lo que se expresa con la ausencia sostenida del ARN viral y la normalización de las aminotransferasas. La progresión hacia la cronicidad y un curso más acelerado de la infección suelen presentarse en pacientes con estados de inmunosupresión debido a que la respuesta inmune celular está muy deprimida (17, 18). La actividad de la enfermedad ha sido informada como leve a moderada y más del 60% de los pacientes tienen aminotransferasas normales (19).
La proporción de pacientes con fibrosis oscila entre el 3 y el 11% y la presencia de cirrosis se demuestra entre el 5 y 24% (3). Sin embargo, la mortalidad en los pacientes cirróticos es superior estando cercana al 35% y correlaciona directamente con la presencia de
daño hepático avanzado y hepatocarcinoma (8,8 y 5,5% respectivamente) (20).
Un reciente metanálisis de 4 estudios que incluyó 2.341 pacientes en hemodiálisis en USA, Europa y Asia revela, con un seguimiento entre 3 y 8 años, una mayor mortalidad en pacientes con anticuerpos para hepatitis C. La causa de muerte está relacionada con cirrosis y hepatocarcinoma y el RR en el metanálisis fue de 1,57 con 95% de IC (1,33-1,86) (21). (Ver tabla 4).
| PACIENTES | SEGUIMIENTO | RR | |
| Pereira et al (1998) | 496 | 73 meses | 1,41 |
| Stehman et al (1998) | 200 | 37 meses | 1,97 |
| Nakayama et al (2000) | 1.470 | 72 meses | 1,57 |
| Espinosa et al (2001) | 175 | 96 meses | 1,62 |
Tabla 4. Riesgo de mortalidad y Hepatitis C en hemodiálisis.
HISTORIA NATURAL Y TRASPLANTE RENALLa historia natural de la infección por el virus de la hepatitis C en pacientes trasplantados renales es muy compleja de interpretar debido a los pocos estudios disponibles. El trasplante renal mejora la sobrevida global de los pacientes infectados por el virus C en hemodiálisis. Sin embargo, un estudio en 33.500 trasplantados renales demostró que la infección por este virus se asocia con un RR de 1,23 para mortalidad (22).
El curso inicial después del trasplante renal es usualmente benigno, excepto para los pocos pacientes que desarrollan una rara complicación conocida como hepatitis colestásica fibrosante, que se caracteriza por una ictericia severa, seguida por una falla del injerto y la muerte sin cirrosis (23).
Un estudio que incluyó 834 pacientes, evidenció que durante los primeros 5 años postrasplante, la sobrevida de los pacientes infectados y del injerto es similar a los no infectados (87 y 78% respectivamente). Al hacer una evaluación a los 10 años se encontró que hay una reducción significativa en la sobrevida del paciente (85 vs. 65%) y del injerto (63 vs. 49%), al comparar pacientes infectados y no infectados (24).
Las dos principales causas de mortalidad (hepática y sepsis por gram negativos) después del trasplante renal son una consecuencia directa de la cirrosis hepática. La sobrevida a 5 años en pacientes con cirrosis hepática, demostrada con biopsia dentro de los 3 primeros años de trasplante renal, es similar a la de los pacientes con menores grados de fibrosis (84 vs. 77%). Sin embargo, a 10 años la sobrevida se reduce a un 33% y si el diagnóstico de cirrosis era evidente antes del trasplante la sobrevida alcanza sólo un 26% (24). La inmunosupresión postrasplante acelera la evolución de la enfermedad posiblemente al facilitar la replicación del virus C, lo que se manifiesta por un aumento de los niveles de ARN (1,8 a 30 veces) en los pacientes con viremia detectable al momento del trasplante renal (25).
La progresión de la enfermedad hepática en el postrasplante está relacionada con la severidad del daño previo. Un estudio que analizó pacientes trasplantados renales (30), en hemodiálisis (30) e infectados por virus C de la población general (30), demostró que el estadio de fibrosis basal utilizando METAVIR es mayor en el último grupo (1,25-1,03-1,70). La progresión de la enfermedad valorada con una nueva biopsia, 37 meses después, en los grupos trasplantados y de la población general, fue mayor en estos últimos (26).
Papel de la biopsia hepática
Los estudios previamente expuestos ponen en evidencia que debido a la pobre correlación entre las enzimas hepáticas y los cambios histopatológicos, la biopsia de hígado representa el instrumento más confiable para evaluar la severidad de la enfermedad. Debido a que la mortalidad de los pacientes cirróticos que van a trasplante renal es muy alta, la severidad del daño hepático es el mejor predictor de sobrevida postrasplante. Aquellos pacientes con cambios leves en la histología pueden ser aceptados para trasplante sin reservas. Cuando hay un daño más severo, incluyendo hepatitis severa y cirrosis temprana, existen dudas debido a la activación del virus relacionada con la inmunosupresión postrasplante. En pacientes con cirrosis descompensada debe evaluarse la posibilidad de trasplante combinado. Todo este enfoque se modifica si el paciente recibe tratamiento y se consigue una respuesta sostenida de erradicación del virus (8, 27).
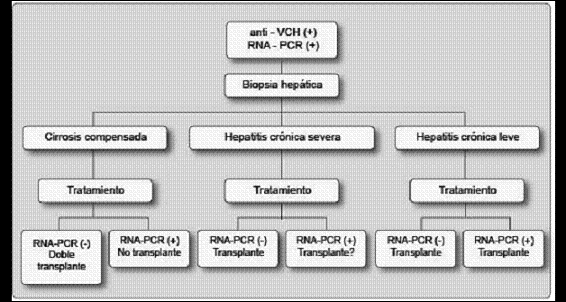
La mayoría de nefrólogos son reacios a realizar una biopsia hepática a sus pacientes por el alto riesgo de complicaciones asociadas, sobre todo la hemorragia. La vía preferida es la transyugular, la cual no se encuentra disponible en muchos centros. Como alternativa puede realizarse una biopsia bajo visión laparoscópica, permitiendo de esta forma un control más fácil de cualquier sangrado. No se recomienda realizar biopsia percutánea a ciegas o aun bajo guía ecográfica. Las recomendaciones actuales para biopsia hepática y su relación con el tratamiento pueden verse en la figura 2.
Figura 2. Biopsia hepática y tratamiento
Tratamiento
En los últimos años hemos sido testigos de la notable mejoría de los esquemas terapéuticos en pacientes inmunocompetentes con hepatitis C crónica. El uso de interferones pegilados combinados con Ribavirina permite alcanzar una respuesta sostenida en un 65% de los pacientes que tienen una adecuada adherencia al tratamiento. Los genotipos 2 y 3 poseen una mejor respuesta sostenida, cercana al 80%, necesitando un tiempo más corto de tratamiento y menores dosis de Ribavirina (28).
El interferón representa la piedra angular del tratamiento debido a la alta toxicidad con la Rivabirina, expresada por una anemia hemolítica. Sin embargo, las diferencias en las dosis empleadas, el tiempo de tratamiento, el número de pacientes incluidos y la falta de estudios comparativos hacen que sea muy difícil obtener recomendaciones generales.
Farmacocinética y tratamiento con Interferón
El interferón alfa es una proteína sérica natural no glicosilada que circula en concentraciones nanomolares. Es filtrado por los glomérulos y sufre un proceso de degradación proteolítica durante su reabsorción por el túbulo proximal. La vida media del interferón es de 6 a 8 horas alcanzando un pico 2 a 4 horas después de su administración por vía subcutánea. En pacientes con enfermedad renal terminal la vida media se aumenta a 10 horas, lo que resulta en un aumento del área bajo la curva. Esto puede explicar porqué en la mayoría de los estudios la respuesta sostenida alcanzada con el interferón es superior a la de pacientes de la población general (29).
Dos metanálisis recientes evalúan los estudios de tratamiento con interferón en pacientes hemodializados. El primero de ellos incluyó 14 estudios publicados entre 1994-2001 con un total de 269 pacientes. El tiempo en hemodiálisis antes de iniciar tratamiento osciló entre 36 y 122 meses y la mayoría de pacientes no eran cirróticos, tenían genotipo 1. La dosis media administrada de interferón fue de 3 millones tres veces por semana durante 6 meses. La respuesta sostenida global fue de 37% con una tasa de abandono del 17% debido a la presencia de efectos secundarios neurológicos, cardiovasculares, psiquiátricos, síndrome gripal, anorexia y alteraciones hematológicas entre otros. La respuesta sostenida en pacientes con genotipo 1 fue de 30,6%, muy superior a la respuesta sostenida en la población general que no sobrepasa el 10% (30). (Ver tabla 5)
| PAÍS | PACIENTES | T EN DIÁLISIS (MESES) | DOSIS IFN (MILLONES) | RVS (%) | |
| Koenig | Austria | 37 | 84 | 5 | 30 |
| Pol | Francia | 19 | 94 | 3 | 20 |
| Raptopolou | Grecia | 19 | Nd | 3 | 68 |
| Fernández | Argentina | 14 | 45 | 1,5-3 | 21 |
| Izopep | Francia | 23 | 99 | 3 | 52 |
| Chan | China | 11 | 122 | 3 | 27 |
| Uchihara | Japón | 9 | 96 | 3-6 | 33 |
| Benci | Italia | 10 | Nd | 1 | 20 |
| Huraib | Arabia | 17 | 36 | 3 | 71 |
| Campistol | España | 19 | 77 | 3 | 42 |
| Espinosa | España | 13 | 96 | 3 | 46 |
| Casanovas | España | 29 | 69 | 1,5-3 | 62 |
| Hanrotel | Francia | 12 | 88 | 3 | 33 |
| Degos | Francia | 37 | nd | 1,5-3 | 19 |
RVS: Respuesta virológica sostenida
Tabla 5. Interferón en pacientes hemodializados.
El segundo metanálisis incluyó 11 estudios publi-cados entre 1986-2001 con un total 213 pacientes. Las dosis empleadas de interferón oscilaron entre 3 y 5 millones tres veces por semana durante seis meses promedio. La respuesta virológica sostenida se alcanzó en un 33% de los pacientes, con una tasa de abandono de 29% por efectos secundarios tales como síndrome gripal, leucopenia, depresión, síntomas neurológicos (confusión y convulsiones). En pacientes con genotipo 1 la respuesta sostenida fue del 26% (31).
Las principales conclusiones de estos metanálisis son:
1. La respuesta al interferón en pacientes con hepatitis C en hemodiálisis se observa en una tercera parte de los pacientes, muy superior a la respuesta en la población general.
2. Los pacientes con genotipo 1 tienen una elevada respuesta al tratamiento.
3. La tasa de abandono va entre un 17 y un 29% muy superior a la de la observada en la población general.
4. No parece haber diferencia entre seis meses y un tiempo más prolongado de tratamiento en la respuesta. Complicaciones graves como edema pulmonar, hemorragia cerebral, pancreatitis aguda, miocarditis y sepsis hacen de ésta una terapia de mucho cuidado.
La respuesta sostenida al interferón se mantiene después del trasplante, como se demuestra en un estudio en el cual 55 pacientes infectados por el virus C recibieron tratamiento. La respuesta sostenida fue de 38% y un 76% de los pacientes se trasplantaron 38 meses postratamiento. El seguimiento con PCR 22 meses postrasplante no evidenció recaída en ninguno de los pacientes, a pesar de permanecer con anticuerpos positivos (32).
El uso de interferón en pacientes con trasplante renal no se recomienda debido al riesgo elevado de rechazo del injerto, sepsis, deterioro de la función renal, encefalopatía y trombocitopenia. Además del riesgo previamente descrito del deterioro de la función hepática en pacientes trasplantados infectados por el virus de la hepatitis C, se han descrito casos de glomerulonefritis membrano-proliferativa poco tiempo después del trasplante, manifestada con proteinuria, hematuria y azoemia (33).
Farmacocinética de la Ribavirina
La Ribavirina es un fármaco con acción antiviral que mejora la respuesta al tratamiento al disminuir la recaída al final del tratamiento. Es aclarada por los riñones y puede ocasionar una hemólisis severa que compromete en muchos casos la vida del paciente con enfermedad renal. La causa de la hemólisis está relacionada con la vía metabólica dentro de la célula. La Ribavirina es captada por un transportador en la superficie de la célula y fosforilada en el citoplasma a Ribavirina trifosfato (RTF). El glóbulo rojo, al carecer de núcleo, es incapaz de defosforilar o secretar la Ribavirina trifosfato, acumulándose en su interior, lo que resulta en una depleción de ATP con daño de la membrana y destrucción en el bazo (2). En pacientes con enfermedad renal terminal, los niveles séricos de Ribavirina se aumentan 3 veces en relación con sujetos que poseen función renal normal. Los pocos estudios realizados no evidencian mejoría en la tasa de respuesta sostenida, pero sí un aumento de la mortalidad con este fármaco. Las dosis utilizadas se encuentran entre 170 y 300 mg/día, manteniendo niveles séricos de 10 a 15 umol/L. Sólo se recomienda el uso de este medicamento dentro de protocolos muy estrictos (34, 35). La Viramidina, una prodroga de la Ribavirina, no tiene metabolismo celular y podría convertirse en una opción terapéutica.
Farmacocinética de los interferones pegilados
La pegilación consiste en unir una molécula de polietilenglicol (PEG) a un compuesto biológico. En años recientes este procedimiento ha mejorado la utilidad clínica de proteínas y péptidos para tratamientos. Existen en la actualidad dos tipos de interferones pegilados que se administran una vez a la semana. El interferón pegilado alfa 2b, es el resultado de la unión de una molécula lineal de PEG de 12 kD con lo cual se disminuye la excreción renal, aumenta su vida media (70 horas) y las concentraciones séricas. Los estudios iniciales muestran una respuesta sostenida de 25% en comparación a un 12% con la forma de interferón estándar. El interferón pegilado alfa 2a resulta de la unión con una molécula ramificada de 40 kD de PEG, conduciendo a un aumento dramático en su absorción, su vida media (hasta 168 horas) y a una disminución de su aclaramiento. Debido a que tiene un volumen de distribución entre 6 y 14 litros, comparado con 40 litros con el Interferón pegilado alfa 2b, puede administrarse en dosis fijas de 180 mcg semana y no por cálculo de peso. Los resultados iniciales evidencian una respuesta sostenida del 39% contra un 19% con el interferón estándar (36, 37, 38, 39).
En un estudio comparativo utilizando dosis de interferón pegilado alfa 2a de 45, 90, 135 y 180 mcg en pacientes hemodializados, las concentraciones séricas alcanzadas con 135 mcg son similares a las que se obtienen dosis estándar de 180 mcg en sujetos con función renal normal. A mayor dosis se observaron más efectos secundarios. Con base en estos resultados se recomienda iniciar tratamiento con dosis de 135 mcg (40).
El interferón pegilado alfa 2b ha sido evaluado recientemente con dosis de 1 mcg/kg en sujetos con deterioro variable de la función renal y pacientes hemodializados. El área bajo la curva y las concentraciones séricas resultaron dos veces mayores en los pacientes con deterioro de la función renal y la vida media aumentó un 40%. El perfil de farmacocinética del interferón pegilado alfa 2b no cambió en las mediciones realizadas antes, durante y después de la diálisis (41).
Con el uso de filtros que utilizan poros de tamaño mediano entre 27 y 33 A, ninguno de los interferones pegilados es removido durante la hemodiálisis. No es el caso del interferón convencional que es completamente removido por lo que se recomienda su administración después de este procedimiento (42). (Ver figura 3).
Figura 3. Filtración de interferones pegilados durante la diálisis
Existen en la actualidad pequeños estudios publicados con los nuevos interferones pegilados que no permiten sacar conclusiones definitivas (43). Se desconoce si su eficacia para alcanzar una respuesta sostenida es superior, el papel de los genotipos en la respuesta, su perfil de seguridad (debido a la vida meda más prolongada), el tiempo de administración (seis o doce meses) y las dosis más recomendables. Un algoritmo para el tratamiento de pacientes con infección por el virus C y hemodiálisis se propone en la figura 4.
Figura 4. Propuesta de tratamiento en pacientes con Hepatitis C
Referencias
1. Fabrizi, F; Bunnapradist, S; Lunghi, G, et al,. Epidemiology and clinical significance of hepatotropics infections in dialysis patients, Minerva Urol Nefrol, 2004, 56: 249-257. [ Links ]
2. Meyers, C; Seeff, L; Stehman, C, et al., Hepatitis C and renal disease: An update, Am J kidney Dis, 2003, 42: 631-657. [ Links ]
3. Alter, M; Lyerla, R; Tokars, J, et al., Recommendations for preventing transmission of infections among chronic hemodialysis patients, MMWR, 2001, 50: 1-67. [ Links ]
4. Gane, E; Pilmore, H., Management of chronic viral hepatitis before and after renal transplantation, Transplant, 2002, 74: 427-437. [ Links ]
5. Méndez, N; Motola, D; Chávez, N, et al., Prevalence of hepatitis C virus infection among hemodialysis patients at a tertiary care hospital in Mexico City, Mexico, J Clin Microbiol, 2004, 42: 4321-4322. [ Links ]
6. Gonçalves, M; de Castro, M; Oliveira, J, et al., Prevalence and associated factors to hepatitis C in hemodialysis patients in Brasil, Rev Saude Publica, 2004, 38: 187-193. [ Links ]
7. Fissel, R; Bragg, J; Woods, J, et al., Patterns of hepatitis C prevalence and seroconversion in hemodialysis units from three continents: The DOPPS, Kidney Int, 2004, 65: 2335-2342. [ Links ]
8. Hinrichsen, H; Leimenstoll, G; Stegen, G, et al., Prevalence and risk factors of hepatitis C virus infection in hemodialysis patients: a multicenter study in 2.796 patients, Gut, 2002, 51: 429-433. [ Links ]
9. Fabrizi, F; Poordad, F; Martin, P., Hepatitis C infection and the patient with end-stage renal disease, Hepatology, 2002, 36: 3-10. [ Links ]
10. Jadoul, M; Cornu, Ch; Van Ypersele, Ch, et al., Universal precautions prevent hepatitis C virus transmission: A 54 month follow-up of the Belgian multicenter study, Kidney Int, 1998, 53: 1022-1025. [ Links ]
11. Lai, K., Hepatitis C infection screening in hemodialysis units, Am J Kidney Dis, 2001, 38: 186-188. [ Links ]
12. Scheneeberger, PM; Keur, I; Van der Vliet, W, et al., Hepatitis C virus infections in dialysis center in Netherlands: a national survey by serological and molecular methods, J Clin Microbiol, 1998, 36: 1711-1715. [ Links ]
13. Fabrizi, F; Bunnapradist, S; Lunghi, G, et al., Kinetics of hepatitis C virus load during hemodialysis: novel perspectives, J Nephrol, 2003, 16: 467-475. [ Links ]
14. Natov, S; Lau, J; Ruthazer, R, et al., Hepatitis C virus genotype does not affect patient survival among renal transplant candidates, Kidney Int, 1999, 56: 700-706. [ Links ]
15. Milotic, I; Pavic, I; Maleta, I, et al., Modified range of alanine amonotransferase is insufficient for screening of hepatitis C virus infection in hemodialysis patients, Scand J Urol Nephrol, 2002, 36: 447-449. [ Links ]
16. Okuda, K; Yokosuka, O., Natural history of chronic hepatitis C in patients on hemodialysis: case control study with 4-23 years follow-up, World J Gastroenterol, 2004, 10: 2209-2212. [ Links ]
17. Poynard, T; Yueng, M; Ratziu, V, et al., Viral hepatitis C, The Lancet, 2003, 362: 2095-2100. [ Links ]
18. Kew, M; Francois, G; Lavanchy, D, et al., Prevention of hepatitis C virus infection, J Viral Hepatitis, 2004, 11: 198-205. [ Links ]
19. Contreras, A; Chung, R., Hepatitis C virus in solid organ transplantation: not always a bad thing?, Gastroenterol, 2002, 123: 1729-1733. [ Links ]
20. Nakayama, E; Akiba, T; Marumo, F, et al., Prognosis of anti-hepatitis C virus antibody-positive patients on regular hemodialysis therapy, J Am Soc Nephrol, 2000, 11: 1896-1903. [ Links ]
21. Fabrizi, F; Martin, P; Dixit, V, et al., Meta-analysis: effect of hepatitis C virus infection on mortality in dialysis, Aliment Pharmacol Ther, 2004, 20: 1271-1277. [ Links ]
22. Fabrizi, F; Martin, P; Ponticelli, C., Hepatitis C virus infection and renal transplantation, Am J Kidney Dis, 2001, 38: 919-934. [ Links ]
23. Natov, S; Pereira, B., Management of hepatitis C infection in renal transplant recipients, Am J Transplant, 2002, 2: 483-490. [ Links ]
24. Mathurin, P; Mouquet, C; Poynard, T, et al., Impact of hepatitis B and C virus on kidney transplantation outcome, Hepatology, 1999, 29: 257-263. [ Links ]
25. Morales, J; Campistol, J., Transplantation in the patient with hepatitis C, J Am Soc Nephrol, 2000, 11: 1343-1353. [ Links ]
26. Alric, L; Di-Martino, V; Selves, J, et al., Long-term impact of renal transplantation on liver fibrosis during hepatitis C virus infection, Gastroenterol, 2002, 123: 1494-1499. [ Links ]
27. Gane, E., Renal transplantation in chronic hepatitis C, J Gastroenterol Hepatol, 2004, 19: 99-102. [ Links ]
28. Strader, D; Wright, T; Thomas, D, et al., Diagnosis, management and treatment of hepatitis C, Hepatology, 2004, 39: 1147-1171. [ Links ]
29. Lin, O; Keeffe, E., Current treatment strategies for chronic hepatiBb and C, Ann Rev Med, 2001, 52: 29-49. [ Links ]
30. Fabrizi, F; Dulai, G; Dixit, V, et al., Meta-analysis: interferon for the treatment of chronic hepatitis C in dialysis patients, Aliment Pharmacol Ther, 2003, 18: 1071-1081. [ Links ]
31. Russo, M; Goldsweig, C; Jacobson, I, et al., Interferon monotherapy for dialysis patients with chronic hepatitis C: an analysis of the literature on efficacy and safety, Am J Gastroenterol, 2003, 98: 1610-1615. [ Links ]
32. Kamar, N; Toupance, O; Buchler, M, et al., Evidence that clearance of hepatitis C virus RNA after alfa interferon in dialysis patients is sustained after renal transplantation, J Am Soc Nephrol, 2003, 14: 2092-2098. [ Links ]
33. Poordad, F; Fabrizi, F; Martin, P., Hepatitis C infection associated with renal disease and chronic renal failure, Sem Liver Dis, 2004, 24: 69-77. [ Links ]
34. Bruchfeld, A; Stahle, S; Andersson, J, et al., Ribavirin treatment in dialysis patients with chronic hepatitis C virus infection-a pilot study, J Viral Hepatitis, 2001, 8: 287-292. [ Links ]
35. Lindahl, K; Schvarcz, R; Bruchfeld, A, et al., Evidence that plasma concentration rather than dose per kilogram body weight predicts ribavirin-induced anemia, J Viral Hepatitis, 2004, 11: 84-87. [ Links ]
36. Harris, JM; Martin, N; Modi, M., Pegylation, Clin Phrmacokinet, 2001, 40: 539-551. [ Links ]
37. Pedder, S., Pegylation of interferon alfa: structural and pharmacokinetic properties, Sem Liver Dis, 2003: 19-22. [ Links ]
38. Lindsay, K; Trepo, C; Heintges, T, et al., A randomized, doubled-blind trial comparing pegylated interferon alfa 2b to interferon alfa 2b as initial treatment for chronic hepatitis C, Hepatology, 2001, 34: 395-403. [ Links ]
39. Zeuzem, S; Feinman, V; Rasenack, J, et al., Peginterferon alfa 2a in patients with chronic hepatitis C, N Eng J Med, 2000, 343: 1666-1672. [ Links ]
40. Lamb, M; Marks, I; Modi, M, et al., Peginterferon alfa 2a can be administered safely in patients with end-stage renal disease, Hepatology, 2001, 34: 300A. [ Links ]
41. Gupta, S; Pittenger, A; Suzonne, P, et al., Single-dose pharmacokinetics and safety of pegylated interferon alfa 2b in patients with chronic renal dysfunction, J Clin Pharmacol, 2002, 42: 1109-1115. [ Links ]
42. Barril, G; Quiroga, J; Sanz, P, et al., Pegylated interferon alfa 2a kinetics during experimental haemodialysis: impact of permeability and pore size of dialyzers, Aliment Pharmacol Ther, 2004; 20: 37-44. [ Links ]
43. Annichiarico, B; Siciliano, M., Pegylated interferon alfa 2b monotherapy for hemodialysis patients with chronic hepatitis C, Aliment Pharmacol Ther, 2004, 20: 123-127. [ Links ]