1 Introducción
A nivel mundial es notable el incremento de la población con enfermedades que afectan el tejido óseo como la osteoporosis y la osteoartritis [1]. Sólo la osteoporosis causa más de 8,9 millones de fracturas al año, un promedio de una fractura osteoporótica cada 3 segundos [2]. Esto sin contar otro tipo de fracturas que se presentan por patologías diferentes a la osteoporosis. En cuando a la osteoartritis, segun la Organización para la Cooperación y el Desarrollo Económicos (OECD por sus siglas en inglés), la osteoartritis es una de las diez enfermedades más incapacitantes que se presentan en los países desarrollados. Alrededor del mundo, el 10% de los hombres y el 18% de las mujeres mayores de 60 años padecen osteoartritis, incluidas las formas moderadas y graves. La cirugía de reemplazo articular se considera la intervención más eficaz para artrosis severa y fracturas de cadera [3].
Los cementos óseos pueden indicarse para la fijación de prótesis a hueso vivo en intervenciones ortopédicas quirurgicas musculoesqueléticas para tratar artritis reumatoide, artrosis, artritis traumática, anemia de células falciformes, osteoporosis, necrosis avascular, enfermedad del colágeno, destrucción articular importante como consecuencia de traumatismos u otras afecciones, revisión de una artroplastia anterior y fijación de fracturas patológicas [4]. También se utilizan en la reparación de defectos óseos en procedimientos como la reconstrucción craneal y del oído medio(5-7). Con el constante avance de la ciencia y la continua busqueda de biomateriales para mejorar las propiedades de los cementos óseos, se ha seleccionado la HA como uno de los biomateriales con componente bioactivo, ideal para brindar a los cementos óseos dicha propiedad, de manera que todas sus propiedades y comportamientos como aditivo están siendo estudiadas (1,8-11).
En el 2017, los colombianos consumieron la cifra de 13.827 millones de unidades de huevos. Es decir, más de 1.150 millones de huevos al mes, mostrando un incremento del 7,7% en comparación al 2016, y ubicando al país en el tercer puesto en Latinoamérica después de México y Brasil [12]. En China se produjeron 529 billones de huevos en 2017, y en Estados Unidos, 106,7 billones (unidades en inglés (x109)) [13], de manera que el huevo es un alimento que se consume en grandes cantidades a nivel mundial y así mismo, que produce abundancia de residuos que podrían ser aprovechados como materia prima para un producto de uso biomédico.
Existe la posibilidad de sintetizar hidroxiapatita a partir de una fuente natural, de un desecho como la cáscara de huevo de gallina (14-19)teniendo en cuenta su composición rica en Calcio [20], sin embargo, aunque hay numerosos estudios en los que se ha obtenido Ha-h, hay pocos estudios documentados que hablan de la bioactividad de dicho material [21], se tienen preguntas en cuanto al comportamiento de este material en un ambiente fisiológico, de su grado de biocompatibilidad y bioactividad necesarias para aplicaciones biomédicas [22-24], en este caso, necesarias para determinar si es viable o no usar este material como aditivo para cementos óseos. Por lo tanto, en este trabajo se tuvo como objetivo evaluar el carácter bioactivo de muestras de HA-h para posible aplicación como cemento óseo.
2 Metodología
Este trabajo se divide en 2 partes, la primera es la síntesis y caracterización de la Hidroxiapatita sintetizada a partir de la cáscara de huevo de gallina (HA-h) y la segunda es la prueba In Vitro para determinar la bioactividad. Se comparó con la HA comercial (HA-c) marca Strem Chemicals CAS #: 7758-87-4.
2.1 Técnica de lavado de cáscara de huevo
El diseño consistió en realizar dos tipos de limpieza a las cáscaras de huevo: Se lavó 500 g de cáscaras de huevo únicamente con agua destilada, y otros 500 g con una mezcla de agua destilada y peróxido de hidrógeno (H2O2) al 30%. Se dejaron sumergidas en las soluciones por 1 hora y se lavaron al final con agua destilada nuevamente. Se secaron en un horno de convección forzada marca Jeio Tech modelo OF 22 G a 100 °C por 24 horas.
2.2 Molienda de cáscaras de huevo
Con el fin de determinar el tiempo más efectivo de molienda teniendo en cuenta que se necesitaban tamaños de partícula iguales o menores a 75 µm, se procedió a moler las cáscaras en un molino de bolas marca MRC, modelo RJM-103. Se realizaron moliendas introduciendo 400 g y 250 g de cáscaras por 4, 6 y 8 horas a 200 rpm.
2.3 Tamizado de partículas de cáscara de huevo
El material obtenido de la molienda, se separó en diferentes tamaños de partícula, utilizando una tamizadora RO-TAP con los tamices No. 100, 140, 200, 230 y 270 por 3 minutos. Se pesó el contenido de polvo que quedó en cada tamiz. Se realizó para cada tiempo de molienda.
2.4 Tratamiento térmico para obtener el óxido de calcio (CaO)
Se introdujeron en la mufla marca Terrigeno crisoles con las muestras del polvo de cáscara de huevo con tamaño de partícula igual o menor a 75 µm, ya que se ha demostrado que con polvo de tamaño 54 µm y 74 µm, se puede obtener CaO por medio de tratamiento térmico [25] y para aumentar el área superficial del material. Se realizaron dos tipos de tratamiento térmico, teniendo en cuenta las rampas de la bibliografía encontrada [26 - 28]:
Se programó una velocidad de 5 °C/min hasta llegar a la temperatura de 450 °C, se mantuvo esta temperatura por 2 horas. Luego, con una velocidad de 0,5 °C/min, se llevó hasta 900 °C por 2 horas. El CaO obtenido por ésta rampa se llamó CaO1.
Se programó una velocidad de 5 °C/min hasta llegar a 900 °C y se mantuvo en esta temperatura por 3 horas. El CaO obtenido por esta rampa se llamó CaO2.
El carbonato de calcio se transformaba en óxido de calcio al liberar dióxido de carbono (CO2) como se muestra en ecuación(1) [26].
2.5 Síntesis de la HA-h
Se realizó por precipitación, se dio la reacción descrita en la ecuación (2). Para los cálculos de tuvo en cuenta que la HA en fase pura tiene una relación Ca/P de 1,67 [29], relación estequiométrica que revela la estructura cristalina de apatita de la fórmula química de fosfatos de calcio [30].
Se adicionó 96,64 g de CaO2 a 1 litro de agua destilada y agitó hasta obtener una mezcla homogénea (los cálculos se describen en ecuación (3 - 7)). Mediante agitación constante se adicionó gota a gota 52,12ml de ácido fosfórico (H3PO4) (los cálculos se describen en ecuación (8-10)) [29, 31, 32]. Se Medió el pH y dependiendo de su valor, se ajustó a 10 bien sea con hidróxido de amonio o con ácido clorhídrico [29, 31, 32]. Una vez el pH se encontró estable, se filtró al vacío y se secó en un horno a 80 °C durante 24 horas. El tratamiento térmico se realizó con temperaturas por debajo de la temperatura de sinterización de la HA (800 °C-1000 °C) [33, 34], normalmente de 500 °C [35 - 37]. Se maceró manualmente en un mortero. Se tamizó y dejó únicamente la HA-h con tamaño de partícula entre 63 y 75 µm. Estudios realizados en los que se añade HA como relleno inorgánico a los cementos óseos [28, 38-41], se utilizan tamaños de partícula entre 56 µm a 80 µm [8, 42].
2.6 Caracterización Espectroscopía Raman
Se utilizó el espectrofotómetro DXR SmartRaman de Thermo Scientific bajo la excitación del láser de longitud de onda 532nm, tiempo de exposición 10 seg, exposiciones de muestra 40. Se caracterizaron todas las muestras de CaO obtenidas luego del tratamiento térmico del polvo de cáscara de huevo (HA-h) y la HA comercial (HA-c), ambas antes y después de la prueba de bioactividad. Para verificar que el equipo estuviera funcionando correctamente, se analizó una muestra estándar de estireno antes de cada uso del equipo.
2.7 icroscopía electrónica de barrido (SEM)
Para observar la morfología de la HA(43,44) y sus cambios luego de la prueba de bioactividad, se utilizó el equipo de microscopía electrónica SEM NeoScope JCM-5000. Se secaron las muestras a una temperatura de 80 °C durante toda una noche, luego se les realizó un recubrimiento con oro con un equipo Cressington Sputter Coater 108 auto y posteriormente se tomaron las imágenes.
2.8 Espectroscopía de rayos X de energía dispersiva (EDS)
Para la composición química por elementos de las muestras de HA-c e HA-h antes y después de la inmersión en fluido biológico simulado (SBF), se utilizó el equipo de SEM-EDS JEOL JSM6490LV. Para el recubrimiento con oro, se utilizó el equipo Denton Vacuum Desk IV.
Se realizó análisis EDS a las muestras de HA-c e HA-h antes de la inmersión en el SBF, y después de 28 días de inmersión. La medición se realizó en diferentes puntos de una muestra (mínimo 6) y los cálculos y análisis realizados a partir de los resultados obtenidos se hicieron con base en el promedio de dichos valores.
2.9 Medición de bioactividad in vitro
Se preparó el SBF teniendo en cuenta el método de preparación propuestos por Kokubo y Takadama [45]. En un vaso de precipitado de plástico de 1.000ml se preparó la solución, éste se encontraba dentro de un baño de agua que permitió controlar la temperatura de la solución de manera que no cambiara de forma brusca. Se calentó el agua contenida en el vaso de precipitado hasta 36,5 ± 1,5 ° C. Se añadieron los reactivos siguiendo el orden del 1 al 8 en la Tabla 1.
Tabla 1 Reactivos y cantidades a añadir para preparar 1Lde SBF [45].
| Orden | Reactivo | Cantidad | Pureza [%] |
|---|---|---|---|
| 1 | NaCl | 8,035 g | 99,5 |
| 2 | NaHCO3 | 0,355 g | 99,5 |
| 3 | KCl | 0,225 g | 99,5 |
| 4 | K2HPO4 • 3H2O | 0,231 g | 99,0 |
| 5 | MgCl2 • 6H2O | 0,311 g | 98,0 |
| 6 | 1m-HCl | 39 ml | - |
| 7 | CaCl2 | 0,292g | 95,0 |
| 8 | Na2SO4 | 0,072 g | 99,0 |
| 9 | Tris | 6,118 g | 99,0 |
| 10 | 1M-HCl | 0-5ml | - |
Se agregó el reactivo Tris cuidadosamente hasta que la mezcla alcanzó un pH de 7,43 ± 0,05. Se mantuvo el pH en el rango de 7,42 a 7,45, ajustándolo con gotas de 1,0M-HCl. Se adicionaron ambos reactivos alternados cuidando el rango de pH, hasta que se completó la cantidad de 6,118g de Tris (Tabla 1). La solución se enfrió a 20 °C y se filtró al vacío con un filtro de 0,22 pm. La solución se guardó en una botella de plástico que fue sellada y conservada a 5 a 10 °C.
Para evaluar el comportamiento de la HA-h en un ambiente fisiológico [45], se sumergieron dos muestras en polvo de 1g por triplicado de la HAh y dos muestras de 1g de la HA-c en 30ml del SBF(como control positivo) por 14 y 28 días a 36,5 °C en una incubadora Fisher Scientific. Se realizó por triplicado.
Como control negativo se tuvo la misma cantidad de muestras de HA-h y HA-c sumergidas en agua bajo las mismas condiciones que las experimentales (HA-h y HA-c sumergidas en SBF) y agua y SBF sin ningún material (para descartar algún tipo de contaminación en el medio). Los materiales fueron esterilizados en autoclave. La nomenclatura usada en el diseño experimental se describe en la Figura 1.

Figura 1 Nomenclatura de diseño experimental para realizar estudio de bioactividad a muestras de HA.
Posterior a la prueba de bioactividad. Se retiró el SBF con cuidado y las muestras se lavaron dos veces con agua destilada desionizada. Luego, se secaron a temperatura ambiente en cajas petri cubiertas con papel aluminio, con agujeros para permitir que pasara el aire.
3 Resultados y discusión
3.1 Análisis granulométrico por tamizado
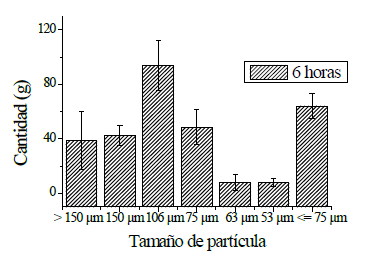
Resultado de la molienda de 400 g de cáscaras a 4, 6 y 8 horas se obtuvo 23,97%, 26,1%, y 17,55% respectivamente. En la Figura 2, muestra la cantidad de material tamizado a las 6 horas que obtuvo mayor cantidad de material de interés (75, 63 y 53 pm). Se tomaron datos de 4 réplicas.
3.2 Tratamiento térmico para la obtención de óxido de calcio
En la literatura se reporta que las bandas de absorción presentadas en la longitud de onda 356 cm-1, 653 cm-1 y 1.073 cm-1, se presentan en función del contenido de óxido de calcio. La banda de absorción en 1.073 cm-1 muestra el estiramiento simétrica del anión carbonato, y las bandas en 653 cm-1 y 356 cm-1 a los enlaces Ca-O [45].
La Figura 3 muestra el espectro de los materiales obtenidos luego de someter el polvo de cáscaras de huevo lavadas con agua y lavadas con H2O2. Con ambas rampas de temperatura se obtiene CaO, y el proceso de lavado de las cáscaras no influye en la obtención del material.
3.3 Análisis mediante Espectroscopia Raman
La Figura 4, muestra la comparación del espectro Raman de la HA-h, con el espectro de la HA-c. No existen diferencias significativas en ambos espectros Raman y la bibliografía consultada [47]. Se pudo determinar que se logró obtener una HA similar a la HA-c usando como precursor de calcio las cáscaras de huevo.
El modo de estiramiento simétrico (vi) del enlace P-O del grupo fosfato (PO4), aparece en 964,26 cm-1 para la HA-h y en 963,29 cm-1 para la HA-c, que es la banda de absorción de mayor intensidad y característico de la HA pura; el modo vibracional a 434,89 cm-1 para la HA-h y a 432,96 cm-1 para la HA-c, se atribuye a los modos de flexión simétrico del enlace O-P-O de PO4 (v2); la banda de absorción presente en 1049,11 cm-1 en ambos espectros, corresponde a vibraciones de estiramiento asimétricas de P-O (v3); y el modo de flexión asimétrico O-P-O (v4), se muestra en 593,99 cm-1 para la HA-h, y en 593,03 cm-1 para la HA-c [47 - 49].
3.4 Análisis mediante SEM
La Figura 5 muestra las imágenes de HA-c y HA-h a diferentes magnificaciones. Tanto la HA-c como la HA-h presentan una forma irregular de granos que forman aglomerados. Se logró obtener una HA-h con morfología y tamaños de grano semejantes a la HA-c.
3.5 Ensayo de bioactividad
La Figura 6 muestra los espectros Raman de las muestras usadas en el estudio de bioactividad con sus respectivas réplicas. Se observa que no hay presencia de nuevas bandas de absorción en el espectro Raman con respecto a las muestras antes de la inmersión, ni el agua ni el SBF alteraron la composición química de los materiales en cuestión, por lo que se dice que tanto la HA-c como la HA-h son estables.
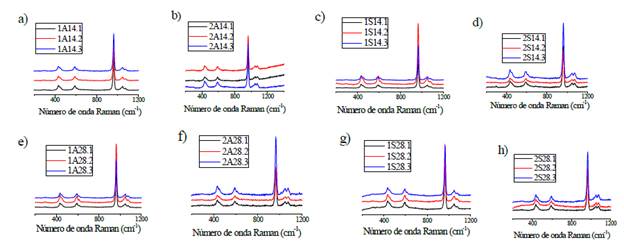
Figura 6 Espectros Raman de las muestras de HA-c e HA-h y sus réplicas, después de la inmersión en SBF.
En cuanto a los resultados visibles al momento de lavar las muestras que se encontraban en presencia del SBF, se observó que el tiempo de precipitado de la HA-h con respecto a la HA-c fue mayor debido a que la HA-h se suspendía más fácilmente en el medio que la HA-c.
La Figura 7 muestra las imágenes SEM de las muestras luego de la inmersión en el SBF. La comparación de las imágenes tomadas con microscopía SEM e las muestras de HA-c y de HAh se observa un grano de HA-c de 25 µm, que es muy similar al presentado en la Figura 7b) de HA-h, ambos granos antes de la inmersión en el SBF. En la Figura 7c), se muestra un aglomerado de partículas de 1S14, y en la Figura 7d), igualmente se presenta un aglomerado de partículas pero de 2S14. Así mismo, se muestra la similitud entre 1S28 y 2S28 en las Figura 7e), f), g) y h), donde se muestran ambos materiales a un aumento de 500X y 10 000X. Se observa tanto para HA-h como para la HA-c que exhiben la misma morfología antes y después de sumergirse durante 28 días en el SBF, y comparando a las dos HA se observa que son semejantes.

Figura 7 Microscopia SEM de HA. (a)HA-c antes de la inmersión en SBF, (b) HA-h antes de la inmersión en SBF, (c) 1S14, (d) 2S14, (e) 1S28 a 500X, (f) 2S28 a 500X, (g) 1S28 a 10 000X, (h) 2S28 a 10 000X.
El comportamiento de la HA-h y HA-c se puede ver afectado gracias a que el ensayo de bioactividad se realizó en un SBF estático. Se ha demostrado que la capa de apatita formada sobre una superficie bioactiva en contacto con el SBF [50], es mayor en un sistema con SBF dinámico que en uno con SBF estático [51]. En las imágenes obtenidas mediante microscopía SEM, se logra observar la presencia de nuevas estructuras en la superficie de las muestras. Sin embargo, en algunas tomas no se alcanza a diferenciar microestructuralmente la formación de dichos fosfatos de calcio, esto puede deberse a que la formación de éstas estructuras se dio en pequeña proporción debido igualmente al ensayo de bioactividad en SBF estático [51].
El análisis EDS permitió observar que los elementos químicos de interés presentes en las muestras fueron los mismos tanto antes como después de la inmersión en SBF (Figura 8). No se encontraron elementos adicionales luego del estudio de bioactividad que pudieran dar evidencia de generación de materiales tóxicos para el organismo.
Mediante la espectroscopía EDS [52, 53], pudo notarse que los principales componentes de las muestras son Ca, P y O, elementos que conforman la fórmula química de la HA (Ca10(PO4)6(OH)2) y en comparación con la HA-c presenta valores similares (Figura 8a) y c)). En la Figura 8a) (HA-h), se observa un pico adicional alrededor de 2,6keV, que corresponde al Cl [54]. Podría deberse a que dicho elemento se encuentra presente en el material gracias al uso de HCl durante el proceso de síntesis. Como se observa, luego de la inmersión en el SBF (Figura 8b)), dicho pico se muestra casi imperceptible en el análisis composicional del material, debido a que a las muestras se les realiza varios lavados al final del estudio de bioactividad, lo que indica que un proceso de lavado adicional al final de la síntesis, podría eliminar el cloro presente en el material.
Se determinó que la relación Ca/P de la HA-c era de 2,0766, y la de la HA-h sintetizada de 2,1875. El comportamiento en la prueba de bioactividad de la HA-h en comparación con la HA-c presentó resultados similares. Durante la prueba, la relación Ca/P disminuye en el tiempo en porcentaje de 0,02% tanto para HA-h como para HA-c (ver Tabla 2). Con dicho cambio, la relación Ca/P de ambas muestras se acercan más a 1.67 que corresponde a la relación Ca/P de la HA pura, cambio que puede atribuirse a la formación de nuevas estructuras apatíticas en ambas muestras. Al final de la prueba de bioactividad (28 días), la relación Ca/P de la HA-h es mayor que la de HA-c con una diferencia de 0,1087.
Tabla 2 Análisis relación Ca/P obtenido mediante EDS.
| Material | % O | % P | % Ca | Ca/P |
|---|---|---|---|---|
| HA-c | 50,59 | 16,06 | 33,35 | 2,0766 |
| 1S28 | 52,8 | 15,52 | 31,68 | 2,0412 |
| HA-h | 54,77 | 14,19 | 31,04 | 2,1875 |
| 2S28 | 53,76 | 14,68 | 31,56 | 2,1499 |
El O, P y Ca son elementos que permiten una interacción con el hueso y definen su bioactividad, por lo que la HA-h con una relación Ca/P de 2,14 se comportaría de forma estable, permitiría la interacción y unión con el tejido óseo y no presentaría reacciones adversas producto de la generación de nuevas sustancias o enlaces con los iones corporales.
De acuerdo con el autor Raii [30], la pureza de la HA depende de la razón Ca/P que presente, que debe ser mayor o igual a 1,67. La relación estequiométrica Ca/P de 1,67 revela la estructura cristalina de apatita de la fórmula química de fosfatos de calcio, mientras las relaciones Ca/P menores a 1,67, se asignan a estructuras cristalinas del complejo de fosfato de calcio no apatíticas para minerales de fosfato más solubles [30]. Por lo tanto, la HA-h obtenida presenta características de alta pureza e insolubilidad y esto la hace un material bioactivo. Sin embargo, se recomienda hacer una caracterización mediante Difracción de Rayos X para establecer su cristalografía.
4 Conclusiones
El estudio de bioactividad y la posterior caracterización de la HA-h permiten determinar que dicho material presenta propiedades bioactivas que lo hace un gran candidato para usarse como adición a los cementos óseos y dotarlos de bioactividad.
Se logró determinar mediante el análisis composicional de las muestras estudiadas por EDS que la HA-h tiene una composición de elementos muy similar a la de la HA-c y que se comportan de igual forma en presencia del fluido biológico simulado. Se determinó que la relación de Ca/P disminuye en porcentaje de 0,02% en el tiempo de estudio (28 días) tanto para HA-h como para HA-c. La relación Ca/P de la HA-c fue de 2,0766, y la de la HA-h sintetizada de 2,1875, con una diferencia de 0,1109. La HA-h obtenida con una relación Ca/P de 2,1875 se comportaría de forma estable, permitiría la interacción y unión con el tejido óseo y no presentaría reacciones adversas producto de la generación de nuevas sustancias o enlaces con los iones corporales.