Introducción
La Leucosis Enzoótica Bovina (LEB) es una enfermedad infecciosa causada por un retrovirus perteneciente a la familia Retroviridae y clasificado como un oncovirus tipo C (Dinter & Morein, 1990). Inicialmente, la LEB tiene una sintomatología imperceptible y, a lo largo de su desarrollo, se manifiesta de diferentes formas dependiendo del órgano afectado. No obstante, en algunos casos se evidencia inapetencia, pérdida de peso, debilidad general y manifestaciones neurológicas (Pulido et al., 2017), anemia, historial de emaciación e infertilidad, así como momificaciones por tumoraciones en las paredes del útero y en los cuernos uterinos. Adicionalmente, aproximadamente el 30 % del ganado infectado desarrolla linfocitosis persistente (LP) por afección del virus a los linfocitos B, lo cual puede producir un incremento y acumulación de células, así como la aparición de neoplasias. Por ello, un pequeño porcentaje del ganado infectado muere a causa de un linfoma maligno, que suele ser más recurrente en los nódulos linfáticos, el abomaso, el corazón, los riñones y el útero (Garcés Sánchez et al., 2020; Yang et al., 2019).
El mecanismo de replicación del virus de la LEB integra su material genético en el ADN del huésped al convertir el ARN en ADN por medio de la transcriptasa inversa. De esta manera se transmite a otros linfocitos, dando lugar a una respuesta inmune humoral dentro de las 8 primeras semanas post-inoculación, exacerbando la afección de los linfocitos B y los monocitos, desestabilizando los linfocitos T (Corredor Figueroa, 2018) y generando una disfunción de la inmunidad mediada por células. Esto predispone a la incidencia de agentes patógenos oportunistas, los cuales pueden empeorar el cuadro clínico. En consecuencia, el curso crónico y silencioso de la enfermedad limita su identificación y la evaluación de su impacto en términos de pérdidas productivas, e imposibilita el tratamiento (Duran Canchon & Duran Canchon, 2022).
Es importante señalar que cualquier tipo de secreción y excreción constituye un factor de contagio y, por tanto, prácticas veterinarias comunes facilitan la transmisión, e.g., el uso compartido de mangas de palpación, agujas, tatuadoras e instrumental quirúrgico sin desinfectar en procesos cotidianos como apofisectomías (Monge-Rojas & Elizondo-Salazar, 2019). Así, es de gran importancia realizar pruebas diagnósticas que permitan la identificación certera de la enfermedad, especialmente en hatos lecheros, donde se reporta mayor contagio (Del Real et al., 2022).
La LEB presenta una distribución global con algunas excepciones, especialmente en Europa, donde se ha logrado erradicar o mitigar mediante programas de control (Gutiérrez et al., 2020). Globalmente, la LEB representa cuantiosas pérdidas económicas a causa de la disminución de la eficiencia reproductiva y la producción láctea y cárnica, la vulnerabilidad de los animales a la incidencia de otras enfermedades de etiología infecciosa y el cierre de mercados internacionales ante las restricciones que se imponen para los países que reportan este tipo de enfermedades (Marawan et al., 2021). Un aspecto relevante del virus de la LEB es su capacidad de generar patologías en los bovinos, así como su aparente potencial zoonótico de tipo oncogénico, con especial incidencia en las mujeres. Esto se ha relacionado con el cáncer de seno, pues se ha determinado la presencia de un antígeno gp51 en el 7 % de los casos encontrados (Duran Canchon & Duran Canchon, 2022).
Teniendo en cuenta las complejidades a las que se enfrentan los profesionales del sector productivo, se requieren soluciones para garantizar soberanía alimentaria a la totalidad de la población mientras atraviesan problemáticas sociales y medioambientales, así como una continua demanda de productos de origen animal. Esto implica evitar que crezcan y se propaguen nuevos agentes patógenos de animales a seres humanos, para lo cual es necesario un adecuado diagnóstico que vaya de la mano de buenas prácticas productivas y de consumo (Úsuga-Monroy et al., 2018a). Teniendo en cuenta que no hay reportes publicados de la enfermedad para el municipio de Chiquinquirá, y por ende tampoco de su interacción y repercusión en la ganadería local, el objetivo de este trabajo fue determinar la seroprevalencia de LEB y los factores de riesgo en bovinos del trópico alto de Boyacá, Colombia.
Metodología
Ubicación geográfica
El municipio de Chiquinquirá está ubicado en la provincia occidental del departamento de Boyacá. En Chiquinquirá, el comercio es la principal actividad, pues este municipio es un centro de acopio regional y la cabecera de provincia. No obstante, resalta el hecho de que el sector agropecuario gira principalmente alrededor de la producción de leche y sus derivados; en 2019 se reportó un 81 % de la productividad derivada de la ganadería lechera. La temperatura promedio del municipio es de 15 °C, posee una extensión territorial de 133 m2 y se encuentra a 2587 msnm (Alcaldía de Chiquinquirá, 2023).
Tamaño de la muestra
Chiquinquirá cuenta con un inventario total de 33 398 ejemplares bovinos, según lo reportó el Instituto Colombiano Agropecuario (ICA) en el censo pecuario para el año 2022 (ICA, 2022). Según estos datos, se calculó un tamaño de muestra de 385 animales en el programa estadístico WinEpi, utilizando la siguiente Ecuación (1):
Donde: n: tamaño necesario de la muestra; Z α/2: valor de Z para el nivel de confianza NC = 1-α; p: proporción esperada; E: error aceptado o precisión deseada.
Se tuvo en cuenta un error aceptado del 5 %, un nivel de confianza del 95 % y una prevalencia esperada de 50 %, pues no se han realizado estudios de este tipo en la región.
Las 385 muestras se obtuvieron de un total de 25 hatos que accedieron a ser partícipes en el desarrollo del proyecto.
Recolección y procesamiento de las muestras
Para obtener las muestras serológicas, se extrajeron aproximadamente 7 ml de sangre por punción de la vena coccígea de cada ejemplar. Esto se hizo mediante tubos BD Vacutainer tapa roja y con agujas calibre 21, desinfectando previamente el área área con alcohol antiséptico. Las muestras fueron rotuladas, almacenadas y transportadas al laboratorio de Parasitología Veterinaria de la Universidad Pedagógica y Tecnológica de Colombia (UPTC). Simultáneamente, se realizó una encuesta epidemiológica con los productores bovinos, utilizando una ficha de tipo descriptivo para recolectar las variables de importancia asociadas a la infección por LEB. Estas se agruparon en variables propias del animal: edad, sexo y raza; de tipo reproductivo: inseminación artificial, monta natural, semen certificado, semen no certificado y uso de toro compartido; de manejo: presencia de ganado de otros propietarios, implementación de aguja individual, ordeño mecánico, ordeño manual; y de tamaño del hato: pequeño o grande. Las respuestas posibles eran ‘presencia’ o ‘ausencia’.
Una vez en el laboratorio, las muestras fueron centrifugadas a 2500 rpm por 10 min para obtener suero. A través de una pipeta Pasteur, se transfirió el suero a un tubo Eppendorf para su almacenamiento a -20 °C y posterior procesamiento. Las muestras fueron procesadas mediante la técnica de ELISA competitivo, utilizando el kit comercial SERELISA BLV Ab Mono Blocking (Zoetis, Estados Unidos), con una sensibilidad del 97 % y una especificidad del 98 %, siguiendo las instrucciones del fabricante.
Análisis estadístico
El estudio fue de tipo descriptivo y de corte transversal, con un muestreo aleatorio simple para que todos los individuos tuvieran la misma probabilidad de ser parte de la muestra representativa. La prevalencia aparente y real se determinó con el programa estadístico WinEpi. Posteriormente, se recopilaron los datos y se introdujeron en la base de datos para su posterior análisis con el programa estadístico Epi Info, versión 7.2.4.0. Con ello, se establecieron factores determinantes calculando la razón de prevalencia (RP). La variable dependiente del eje (Y) incluyó los resultados serológicos, y las variables independientes (X) fueron todos los factores determinantes establecidos en la encuesta epidemiológica. Una vez establecidos estos factores, se construyó el modelo final utilizando análisis de regresión logística.
Consideraciones éticas
El estudio se realizó de acuerdo con la Resolución 8430 del Ministerio de Salud y Protección Social de Colombia y la Ley 84 de 1989, las cuales establecen las normas para garantizar el bienestar de los animales durante la investigación. Asimismo, antes de tomar muestras de sangre, se obtuvo el consentimiento informado de los propietarios de los bovinos. El proyecto fue avalado por el Comité de Ética de la UPTC el 20 de diciembre de 2022.
Resultados
La seroprevalencia de LEB se determinó en 385 muestras de suero obtenidas de ganado Holstein, Normando y cruces del municipio de Chiquinquirá, en los siguientes rangos de edad: 6 meses a 2 años, de 2 a 4 años y más de 4 años. Se encontró una prevalencia aparente (PA) del 19.72 % (76/385) y una prevalencia real (PR) del 18.1 %, con un valor predictivo positivo (VP+) de 91.5 % y un valor predictivo negativo (VP-) de 99.3 %. Las hembras fueron más seropositivas (19.94 %) que los machos (14.29 %). Los bovinos de 2 a 4 años presentaron la mayor seropositividad de anticuerpos contra el virus de Leucosis Enzootica Bovina (vLEB) (21.21 %), seguido de los individuos de más de 4 años (20.63 %) y los animales entre los 6 meses y los 2 años (16.6 %). Por otra parte, la raza Normando fue la menos seropositiva (17.4 %), mientras que los cruces raciales presentaron mayor seroprevalencia (22.22 %) (Tabla 1).
Tabla 1 Prevalencia aparente (PA) y prevalencia real (PR) de anticuerpos contra LEB por sexo, grupo etario y raza en bovinos de Chiquinquirá, Boyacá

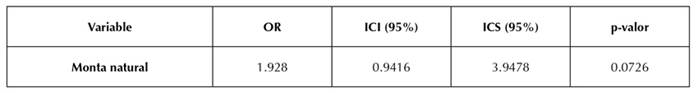
No se encontró asociación estadística significativa entre la seropositividad de LEB y las variables sexo, grupo etario y razas (p≥0.05) (Tabla 2). Respecto a las prácticas de manejo, se observó una significancia estadística entre la compra de animales y la prevalencia de la enfermedad (p=0.0049), así como una relación con la asistencia a exposiciones ganaderas (p=0.0457), aunque este factor no se estableció como factor de riesgo, ya que el valor RP y ambos intervalos de confianza no fueron mayores a 1. La variable monta natural mostró una asociación estadística significativa (p= 0.04428535) y, mediante los valores de RP e IC (>1), fue identificada como el único factor de riesgo de LEB (IC: 1.0077-1.2296; RP: 1.1132) (Tabla 3), por lo cual fue la única variable que se sometió al análisis de regresión logística (Tabla 4).
Tabla 2 Análisis de las variables edad, sexo y raza como posibles factores de riesgo asociados a infecciones por LEB. Los resultados se presentan con su razón de prevalencia (RP) e intervalo de confianza (IC) de 95 %
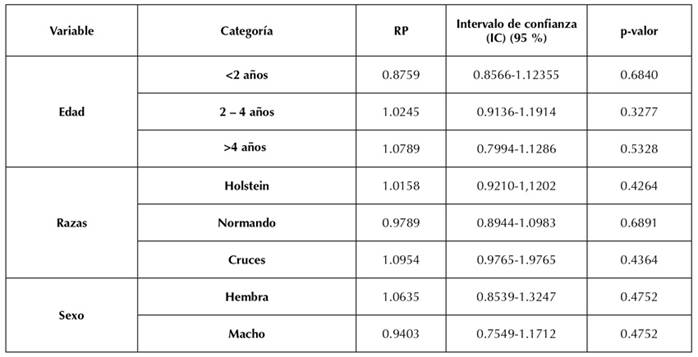
Tabla 3 Análisis de prácticas de manejo y variables reproductivas como posibles factores de riesgo asociados a infecciones por LEB. Los resultados se presentan con su razón de prevalencia (RP) e intervalo de confianza (IC) de 95 %

Tras el análisis de regresión logística, se estableció que la variable monta natural no es factor de riesgo de LEB en los hatos evaluados (p>0.05) (Tabla 4).
Discusión
De acuerdo con nuestro estudio, la prevalencia encontrada de LEB (PA=19.72 %) representa un riesgo para la producción lechera de la región, pues esta enfermedad no muestra signos o síntomas en los primeros años de infección. Según Rincón Flórez et al. (2021), la LEB repercute en una baja productividad y en la presencia de linfosarcomas, y presenta una tasa de recuperación nula; reporta una alta morbilidad pero baja mortalidad, lo que la hace una peligrosa fuente de contaminación para los demás animales.
Asimismo, la LEB es una patología que afecta el sistema ganadero de varias maneras, por lo que su diagnóstico es de gran importancia. Si bien la LEB hace parte de las enfermedades de declaración obligatoria para el Instituto Colombiano Agropecuario (ICA), no se evidencian suficientes reportes para el impacto que genera. Esto constituye limitaciones económicas y compromete las acciones directas a ejecutar si la enfermedad se manifiesta (ICA 2015). Según escasos reportes a nivel regional, se han encontrado prevalencias de 13.5 % en el municipio de Toca (Pulido-Medellín et al., 2017), 31.1 % en Sotaquirá (Bulla-Castañeda et al., 2021), 14.64 % en Puerto Boyacá (Naranjo Guerrero et al., 2022) y 31.1 % en Paipa (Jiménez Sánchez et al., 2022). Recientemente, un estudio que abarca los municipios de San Miguel de Sema, Chiquinquirá y Villa de San Diego de Ubaté ratificó la presencia de este virus en la zona, con prevalencias de 15.61 a 23.61 % (Lancheros-Buitrago et al., 2023).
A nivel nacional, se han reportado diversos estudios sobre la prevalencia de la seropositividad de leucosis bovina mediante la técnica ELISA, con valores de 26.5 % en Pacho, Cundinamarca (Vega Ahumada & Barragán Garnica, 2015), 17.93 % en Tauramena, Casanare (Marín Cárdenas & Valenzuela Fúquene 2019), 36 % en Aguachica y Río de Oro, Cesar (Galvis García et al., 2016), y 25.18 % en Caquetá (Motta-Delgado et al., 2019). Por otra parte, algunas investigaciones han implementado la técnica de reacción en la cadena de la polimerasa (PCR), reportando valores de 22.6 % en 4 zonas de Colombia y de 54.6 % en Antioquia (Meza-Barreto et al., 2016; Úsuga-Monroy et al., 2018b). Úsuga-Monroy et al. (2018b) mencionan que existe una gran similitud entre los resultados si se compara la efectividad de las dos técnicas empleadas, pues se detectó un número similar de animales positivos.
Por otra parte, en estudios por conglomerados a nivel nacional, Meza-Barreto et al. (2016) revelaron el alto impacto de la LEB en la zona centro (Cundinamarca y Boyacá), reportando las prevalencias más elevadas: el 22.6 % de animales era positivo y, de estos, el 50.7 % correspondía a la zona centro. Esto puede deberse a que estos dos departamentos conforman la lista de los mayores productores de leche. Por ende, la mayoría de hatos en la región están enfocados en esta actividad económica, lo cual se asocia con una mayor predisposición a adquirir la enfermedad (Gutiérrez et al., 2020; Lozano Maturana et al., 2020).
Aunque este estudio no identificó una asociación estadística significativa entre las razas y la enfermedad (p<0.05), es importante resaltar que los estudios anteriormente mencionados coinciden con lo encontrado en Chiquinquirá: se evidencia una mayor prevalencia por grupos raciales en la raza Holstein y sus cruces, seguidos de la raza Normando, las razas doble-propósito y las de tipo cárnico. Este comportamiento puede estar relacionado con las diferentes prácticas de manejo de cada raza, las cuales se aplican de manera intensiva con las razas de leche a causa del hacinamiento, así como a diferentes prácticas veterinarias que facilitan la transmisión, como lo son el uso compartido de mangas de palpación, agujas, tatuadoras e instrumentos quirúrgicos (Meza-Barreto et al., 2016).
Se reportó una mayor prevalencia en los grupos etarios de 2-4 y de > 4 años. Sin embargo, esta variable no mostró significancia estadística ni se consideró como un factor de riesgo de LEB. Sin embargo, es importante mencionar que estudios previos han reportado que, a mayor edad, mayor probabilidad de contagio; al estar en contacto con más animales por más tiempo y por verse enfrentados a momentos de estrés, estos pueden volverse más susceptibles (Briceño Corrales & Castillo Urbina, 2017).
Los resultados de este estudio coinciden con lo reportado por Frías et al. (2021), quienes encontraron las prevalencias más altas en grupos etarios específicos, pero tampoco pudieron relacionar estadísticamente esta variable con la presencia de la enfermedad. Esto lleva a suponer que el virus de la leucosis afecta a los bovinos sin importar su edad, y que incluso puede ocurrir una infección en la fase embrionaria (OIE 2018; Vega Ahumada & Barragán Garnica, 2015).
En cuanto a la relación entre a la compra de animales (p=0.0049), la asistencia a exposiciones ganaderas (p= 0.0457) y la prevalencia de la enfermedad, se ha reportado que factores que influyen en la transmisión. Es por esto que países como España han establecido protocolos de control que consideran estas variables como fuentes de contagio de LEB, realizando pruebas diagnósticas frecuentes para combatir la presencia de esta enfermedad (Ministerio de Agricultura de España, 2021).
Se debe resaltar que la compra de animales no solo influye en los mercados regionales o nacionales, sino también a nivel mundial con las importaciones de ganado en pie. Existe un riesgo al importar ganado de otros países que no están libres de la enfermedad; se encontró una relación filogenética en las variantes de ganado de Tailandia, China, Myanmar y Vietnam, asociada al movimiento de estos animales entre países del sudeste Asiático y China (Le et al., 2023). Esto implica medidas restrictivas por parte de muchos países para evitar el ingreso de patógenos externos, limitando las exportaciones de los países que no están libres de la enfermedad (Gutiérrez et al., 2020).
Según Garcés Sánchez et al. (2020), se obtuvo un 0% de prevalencia en el departamento de Quindío (Colombia) con la implementación de buenas prácticas ganaderas y un sistema cerrado, pues toda la genética empleada fue generada al interior de una finca ganadera; no se hacía compra de animales, reduciendo así el ingreso de agentes infecciosos procedentes de otras explotaciones pecuarias.
La variable monta natural reportó una asociación estadística significativa con la seropositividad de LEB (p= 0.0443). Aunque esta variable no se identificó mediante regresión logística como un factor de riesgo para la población estudiada, nuestros hallazgos se relacionan con lo reportado por Benítez et al. (2019). Estos autores, a pesar de encontrar una baja susceptibilidad al vLEB en novillas preñadas de forma natural por toros seropositivos, resaltan la necesidad de vigilancia y control sanitario, pues, con el pasar del tiempo, los ejemplares pueden incrementar sus niveles de carga viral en sangre y esmegma, llegando a transmitir el virus con facilidad. Es importante señalar que la transmisión insuficiente de virus en el momento de la monta natural de las novillas pudo haberse debido a la acción de las barreras inmunológicas naturales de las hembras en el epitelio vaginal y del útero (Benítez et al., 2019).
De igual manera, nuestros resultados coinciden con lo reportado por Lancheros-Buitrago et al. (2023), quienes encontraron una asociación estadística significativa con la monta natural, pero tampoco llegaron a establecerla como factor de riesgo mediante regresión logística (p= 0.0726). Sin embargo, la reutilización de agujas en Ubaté (p=0.0146), la raza Holstein (0.0244) y el ordeño manual en San Miguel de Sema (0.0428) sí fueron identificados como factores de riesgo.
Teniendo en cuenta el impacto de esta enfermedad en los sistemas productivos, se han planteado medidas de prevención en los últimos años. Estas medidas consisten en selección genética, para lo cual se considera el complejo mayor de histocompatibilidad (MHC), que en los bovinos se denomina sistema de antígeno leucocitario bovino (BoLA), el cual es muy complejo, pues posee alrededor de 154 genes funcionales. Dentro de sus múltiples variantes, la selección del ganado portador del marcadorBoLA-DRB3*0902surge como una estrategia natural para combatir la diseminación del vLEB. Esta estrategia es de carácter acumulativo y permanente, y resultar en la cría de animales más sanos (Juliarena et al., 2017).
Por otro lado, la caracterización de los principales mecanismos de transmisión del vLEB en los rebaños puede mejorar la toma de decisiones respecto a medidas sanitarias (Benítez et al. 2019). Esto incluye la prueba y el sacrificio de animales infectados, así como la implementación de un sistema de comercio cerrado que impida la introducción de nuevos animales de áreas infectadas. Este esquema, adoptado principalmente en la Unión Europea, ha generado excelentes resultados en materia de salud animal (Marawan et al., 2021).
Conclusiones
Este estudio encontró una prevalencia aparente de 19.72 % respecto a la exposición al vLEB en el municipio de Chiquinquirá, Boyacá. Aunque este valor es relativamente bajo, representa un riesgo importante a futuro debido al alto grado de contagio y afecciones que esta enfermedad puede generar a largo plazo.
Este estudio ofrece información epidemiológica que permite establecer medidas de prevención, las cuales también se pueden implementar en zonas aledañas, donde es de gran importancia realizar más estudios diagnósticos para obtener información clara sobre la situación sanitaria. Aunque las variables de edad, monta natural, asistencia a eventos y compra de animales no se identificaron como factores de riesgo en este caso particular, se debe considerar su posible influencia en la transmisión del virus, según reportan otros estudios a nivel mundial