Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Colombian Journal of Anestesiology
versión impresa ISSN 0120-3347
Rev. colomb. anestesiol. vol.47 no.4 Bogotá Oct/Dic. 2019 Epub 16-Oct-2019
https://doi.org/10.1097/cj9.0000000000000141
REVISIÓN
Impacto de la ketamina sobre la presión intraocular en niños: revisión sistemática y síntesis cualitativa de la literatura
c Oftalmóloga, Universidad Nacional de Colombia, Bogotá, Colombia.
a Anestesiólogo, Universidad Nacional de Colombia, Bogotá, Colombia.
b Residente de Anestesiología y Reanimación, Universidad Nacional Autónoma de México, Ciudad de México, México.
Introducción:
La medición de la presión intraocular (PIO) en niños es desafiante para el oftalmólogo debido a la falta de colaboración por parte del paciente; esto hace necesario llevar a cabo estos exámenes bajo anestesia (EBA) para facilitar la medición. Entre los medicamentos anestésicos generales, la ketamina es segura tanto en adultos como en niños, y se ha planteado en varios estudios que puede tener menor efecto sobre la PIO que otros fármacos anestésicos.
Objetivo:
Determinar si la ketamina tiene un efecto sobre la presión intraocular en población pediátrica. De esta manera, definir si es recomendable utilizar este medicamento para realizar los exámenes bajo anestesia general en niños con diagnóstico de glaucoma.
Métodos:
Se realizó una revisión sistemática de la literatura de los artículos publicados en Ovid, PubMed, ScienceDirect, Cochrane y LILACS desde enero de 1970 hasta febrero de 2019. Se incluyeron aquellos estudios con pacientes menores de 18 años en quienes se realizó tonometría ocular. La intervención fue la administración de ketamina y se evaluó como desenlace primario los cambios en la PIO después de su administración. También se evaluaron las complicaciones intra y posoperatorias como desenlaces secundarios. Se reporta de acuerdo con los lineamientos PRISMA.
Resultados:
Un total de nueve artículos se incluyeron para la revisión sistemática; en 293 niños se describió la administración de ketamina y medición de presión intraocular después de la misma. Tres estudios encontraron elevación de la PIO y seis refieren cambios mínimos o sin significancia clínica.
Conclusiones:
En niños existe evidencia de baja calidad que sugiere un impacto mínimo de la ketamina sobre la modificación en la PIO. Se requieren estudios de mejor calidad (ensayos clínicos controlados) que permitan crear una recomendación clara sobre el uso de este medicamento para realizar EBA en niños con glaucoma.
Palabras clave: Ketamina; Presión intraocular; Glaucoma; Tonometría Ocular; Anestesiología
Introduction:
Intraocular pressure (IOP) measuring in children is a defiant challenge for ophthalmologists due to the unwillingness to collaborate of patient; therefore, it is necessary to perform these examinations under anesthesia (EUA) in order to facilitate the measuring. Among the anesthetic drugs, ketamine is safe in both children and adults and different studies have stated that it might have lower impact on IOP than other anesthetic drugs.
Objective:
To determine whether ketamine has any impact on IOP in pediatric patients. Also, defining if this drug can be recommended to perform EUA in children with glaucoma.
Methods:
Systematic review of literature was conducted including articles published in Ovid, PubMed, ScienceDirect, Cochrane, and LILACS from January 1970 to February 2019. The studies included were those with patients aged under 18 years to whom ocular tonometry had been performed. Intervention consisted on administering ketamine and the primary outcome to be assessed was changes in IOP after ketamine administration. Intra operative and postoperative complications were also assessed as secondary outcomes. Report is made according to the Preferred Reporting Items for Systematic Reviews and Meta-analysis guidelines.
Results:
Nine studies were selected for the systematic review. The administration of ketamine and its effects on intraocular pressure values were described in 293 children. Three studies found rising of intraocular pressure and 6 little or clinically not significant changes.
Conclusion:
In children, there is low-quality evidence that suggests a minimal impact of ketamine on IOP modification. Better quality studies (controlled clinical trials) are required to clearly recommend the use of ketamine to perform EUA in children with glaucoma.
Keywords: Ketamine; Intraocular Pressure; Glaucoma; Ocular Tonometry; Anesthesiology
Introducción
La presión intraocular (PIO) elevada es el principal factor de riesgo para glaucoma y es la única condición modificable de la patología, razón por la cual su medición es indispensable para el diagnóstico, seguimiento y tratamiento de la enfermedad.1 En pediatría esta medición es especialmente compleja, dado que se requiere quietud y colaboración por parte del paciente durante la tonometría, condiciones difíciles de alcanzar en población infantil. En adultos, los valores de PIO oscilan entre 9 y 21 mmHg, pero en niños los valores normales no son tan claros. Varios autores han medido y establecido los valores de PIO en niños sanos, y los resultados se encuentran desde 13.3 mmHg ± 3.4 hasta 17.7 mmHg± 2.7.2-4. El glaucoma es una patología amplia y variada, causa ceguera a largo plazo y en niños se caracteriza por su rápida progresión, cuadro clínico severo y difícil manejo.5,6 La incidencia de glaucoma pediátrico es de 1/10.000 en recién nacidos vivos;7 según la Organización Mundial de la Salud (OMS), hace parte de las primeras cinco causas de ceguera a nivel mundial en población general,8 y es la cuarta en Colombia en población pediátrica.9
La ceguera en niños oscila entre 0.3 y 1.5 por cada 1000, según las condiciones socioeconómicas de la población.10,11 Un diagnóstico temprano y control adecuado de la PIO constituyen la piedra angular del tratamiento, a fin de evitar morbilidad ocular severa.12-14 Existen tecnologías nuevas de tonometría sin contacto ideales en pacientes pediátricos, con precisión y concordancia aceptables en comparación con el estándar de oro de la tonometría por aplanamiento de Goldmann; sin embargo, el acceso a estas es aun limitado en muchos escenarios.15,16
Debido a la incapacidad para cooperar, los neonatos, lactantes y niños no pueden tolerar el examen oftalmoscópico y la medición de la PIO, y así la anestesia general garantiza una evaluación meticulosa del ojo. La intervención anestésica puede alterar la exactitud en la medida de la PIO; la hipertensión, el aumento en la presión venosa central (PVC), la hipoxia y la hipoventilación incrementan la PIO, mientras que la mayor parte de los anestésicos (inhalados, inductores, benzodiacepinas y opioides) la disminuyen.17,18 Algunos autores coinciden en que la ketamina puede aumentar la PIO o producir un efecto despreciable en esta.19,20 Su perfil de sedación balanceada, analgesia, poca depresión respiratoria y cardiovascular, la convierte en una alternativa interesante para proveer anestesia a pacientes pediátricos que requieran el examen.21,22
Diferentes autores apoyan la hipótesis de que la PIO después de la administración de ketamina es la representación más exacta de la PIO en el paciente despierto y tranquilo.17,23 El objetivo de este estudio fue describir los cambios en los valores de presión intraocular en población pediátrica después de la administración de ketamina como anestésico general.
Métodos
Se realizó una revisión sistemática de la literatura, consultando en las bases de datos PubMed, LILACS, Ovid, Cochrane y ScienceDirect, mediante las estrategias de búsqueda que pueden ser consultadas en el Anexo 1. No se registró el protocolo de la investigación en bases de datos (PROSPERO); sin embargo, este no sufrió modificaciones durante la ejecución del proyecto.
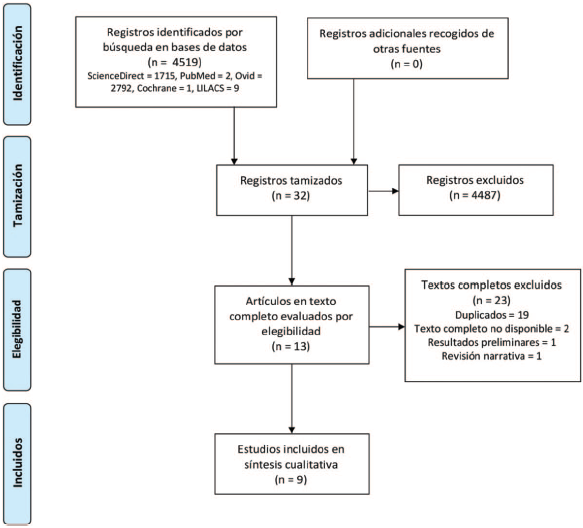
Los criterios de inclusión fueron artículos publicados desde 1970 hasta febrero de 2019, estudios observacionales descriptivos, casos y controles, cohortes y ensayos clínicos aleatorizados controlados, en inglés, español, francés y portugués. Se excluyeron aquellos estudios que no cumplieran estas características. La estructura PICO de los estudios debía contar con pacientes menores de 18 años en quienes se realizó tonometría ocular. La intervención fue la administración de ketamina por vía intravenosa (IV), intramuscular (IM), oral (VO) o intrarrectal (IR) para sedación o anestesia durante el examen. Se realizó comparación con placebo o la administración de otro anestésico (sevoflurano, halotano, propofol, etomidato, tiopental) y se estableció como desenlace la presión intraocular medida después de la administración del medicamento. En la Figura 1 se ilustra la inclusión y exclusión de artículos con las respectivas causas.
Fuente: Autores.
Figura 1 Diagrama de flujo PRISMA que ilustra el proceso de identificación, tamización y selección de estudios. No se muestran estudios incluidos en metanálisis, puesto que no se incluyeron en esta revisión sistemática.
Los resultados de las búsquedas en cada base de datos se recopilaron en un formato previamente creado en Excel por los autores; en dicho formato se registraron autores, título, fecha de publicación y resumen de cada artículo. De forma independiente, cada autor identificó los artículos susceptibles para evaluación según título y resumen. Los desacuerdos se resolvieron por consenso. Los artículos incluidos se resumen en la Tabla 1 de forma cualitativa. Se recopiló como desenlace primario el valor absoluto de variación de la PIO después de administrarse ketamina por las vías descritas; en caso de no darse valores absolutos, el porcentaje de variación de la PIO se emplearía como alternativa. En aquellos estudios que reportan datos de seguridad, se utilizaron como desenlaces secundarios las variables de seguridad sobre complicaciones respiratorias, agitación psicomotora y sedación.
Tabla 1 Resumen cualitativo de los estudios incluidos.
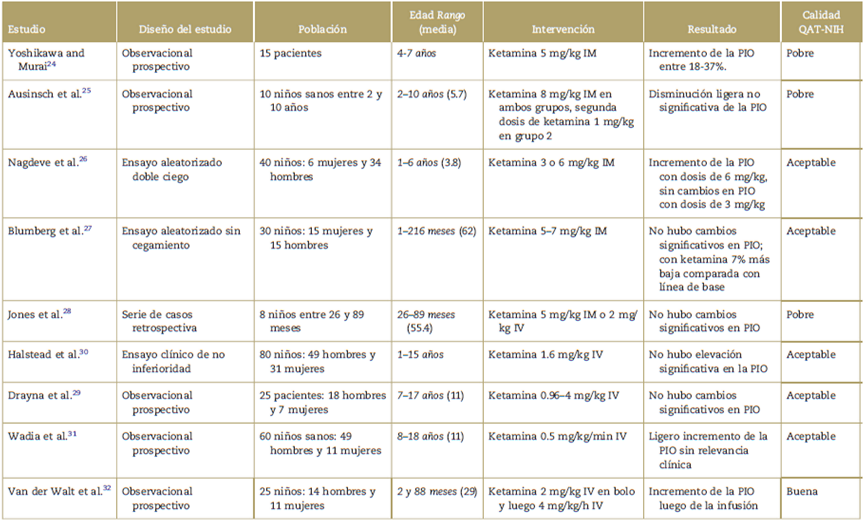
Mg=miligramos, Kg=kilogramos, PIO=presión intraocular, QAT-NIH=Quality Assesment Tool - National Institute of Health.
Fuente: Autores.
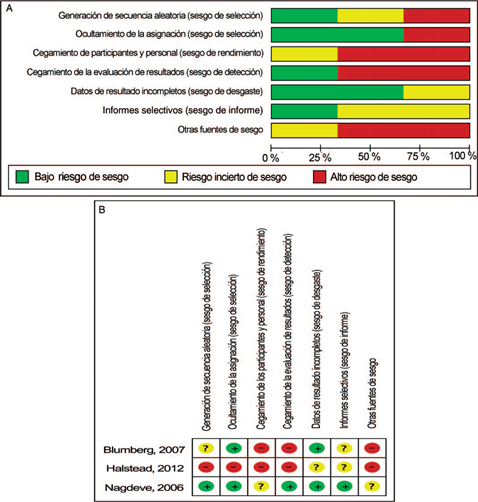
Los estudios observacionales se evaluaron mediante el instrumento para evaluación de la calidad de la evidencia del Instituto Nacional de Salud (NIH, por sus siglas en inglés), QAT-NIH para estudios observacionales. En el caso de los ensayos clínicos aleatorizados se utilizó el QAT-NIH para estudios controlados aleatorizados. Adicionalmente, se utilizó la escala de evaluación del riesgo de sesgo de la colaboración Cochrane (Figura 2a y 2b). Se realizó búsqueda adicional sobre resultados preliminares de investigación e investigaciones en curso sin resultados finales, sin encontrar más información para la revisión sistemática. Ningún estudio fue susceptible de incluirse en un metanálisis, por lo cual se realizó una síntesis cualitativa de la literatura.
Resultados
Se encontraron 4519 estudios, de los cuales 4487 no correspondían a las características planificadas para la revisión sistemática por ser artículos sobre ensayos hechos en adultos, que no incluían en su mayoría la administración de ketamina en su metodología, que no realizaban medición de la presión intraocular o no estaban en los idiomas descritos en los criterios de inclusión (Figura 1).
Se incluyeron nueve estudios, de los cuales tres fueron ensayos clínicos, dos de ellos con pacientes sin diagnóstico de glaucoma y uno en pacientes con sospecha o diagnóstico de glaucoma. Los resultados generales y el resumen de los estudios se muestran en la Tabla 1.
En el estudio de Yoshikawa et al.24 se pretendió evaluar el impacto de la ketamina en la presión intraocular de niños sanos; se incluyeron pacientes entre 4 y 7 años, y la intervención realizada consistió en la administración de ketamina por vía intramuscular a dosis de 5 mg/kg, sin premedicación. Los autores refieren haber tomado una PIO basal previa a la inyección, seguida de mediciones cada 5 minutos hasta los 30 minutos posinyección. No describen en su metodología las pruebas empleadas para evaluar la significancia estadística de los resultados; sin embargo, registran un incremento en la PIO desde el minuto 5 estadísticamente significativo (18% de aumento en las mediciones, p < 0.001) hasta el minuto 15 (37% de aumento en las mediciones, p < 0.005), y retorno a los valores basales en el minuto 30 con una p < 0.4. Este cambio se vio acompañado por incremento en la presión arterial y la frecuencia cardiaca en los primeros 5 minutos posteriores a la inyección. Un paciente con estrabismo fue reportado con una caída temprana de la PIO después de la administración del fármaco. No describieron complicaciones respiratorias, cardiovasculares o comportamentales durante el estudio.
Ausinsch et al.25 buscaban evaluar el efecto de la ketamina en la PIO de niños con ojos sanos, para lo cual reclutaron a 10 niños sin evidencia de patología ocular. Todos fueron premedicados con atropina 0.02 mg/kg IM, y cinco de ellos recibieron 1.1 mg/kg IM de meperidina y 4.4mg/kg IM de pentobarbital. Se tomaron valores basales con instilación ocular de clorhidrato de proparacaína solución oftálmica en ambos ojos. Dividieron el estudio en dos fases. Inicialmente a todos los pacientes les administraron 8 mg/kg de ketamina IM y tomaron mediciones a los 5, 10, 15 y 20 minutos. Después administraron una segunda dosis de ketamina de 1mg/kg a todos los pacientes y cinco de ellos recibieron además 0.8mg/kg de d-tobocurarina IV, se intubaron 5 minutos después y se les dio mantenimiento anestésico con óxido nitroso. Se tomaron mediciones de la PIO a los 5, 10 y 15 minutos después de la primera dosis.
Los autores encontraron una disminución entre el promedio de PIO basal y posinducción con ketamina (22.2 ± 4.8 mmHg vs. 16.7 ± 3.3 mmHg) que describen como estadísticamente significativa (p < 0.001); no obstante, en ninguna parte del artículo mencionan las pruebas empleadas. De los 5 niños premedicados, tres cooperaron con la medición de PIO basal, y en ellos el valor medido fue significativamente menor que en aquellos pacientes que no cooperaron (17.5 ± 2.6 mmHg vs. 24± 3.5 mmHg, p <0.05). Posteriormente, con la administración de una segunda dosis menor a la de inducción, no hubo cambios significativos en la PIO y la administración de relajante neuromuscular (RNM) no generó cambios clínica ni estadísticamente significativos. Los valores de PIO posinducción con ketamina en la fase I entre pacientes premedicados y no premedicados fueron similares, sin cambios estadísticamente significativos.
Nagdeve et al.26 quisieron responder a la misma pregunta mediante un ensayo clínico aleatorizado doble ciego; incluyeron 40 pacientes pediátricos clasificados como categoría I de la American Society of Anesthesiologists (ASA I), de más de 25 kg, programados para cirugías de 30 a 90 minutos bajo anestesia general. Descartaron pacientes con PIO previamente alta, hipertensión endocraneana, trauma ocular abierto, aneurismas vasculares, desórdenes psiquiátricos y síndromes convulsivos. Todos recibieron premedicación 60 a 90 minutos antes de cirugía con triclofos oral (100mg/kg). La inducción anestésica fue inhalatoria con halotano hasta 4%; siguiendo los planos de Güedel, una vez alcanzaban anestesia quirúrgica continuaban mantenimiento con halotano 1%. 10 minutos después de la inducción, aleatorizaban los pacientes a los brazos de dosis baja (3 mg/kg) o alta (6 mg/kg) de ketamina. Administraban el fármaco por vía IM en el deltoides e iniciaban mediciones de la PIO cada 5 minutos. Durante 20 minutos no se permitía estimulación quirúrgica en el paciente. Hubo cegamiento del observador que realizaba las mediciones sobre la dosis administrada, quien hizo mediciones de la PIO en ambos ojos a menos que uno de ellos fuera a ser intervenido quirúrgicamente, situación en la cual se excluía el ojo a operar.
Ambos grupos fueron comparables en distribución demográfica (sexo, peso, edad). Entre cada grupo, los datos fueron sometidos a análisis de varianza de medidas repetidas (RMANOVA) y se compararon con las mediciones definidas como basales, utilizando la prueba t de Student. En el grupo de dosis de inducción hubo un incremento de la PIO en las mediciones de los 5 y 10 minutos (basal 10.8 ± 2.2 mmHg, 5 minutos 12.6 ± 2.8 mmHg y 10 minutos 11.9 ± 2.5 mmHg, p < 0.001). En el grupo de dosis baja no hubo cambios en la PIO. No obstante, cuando se comparaban los valores de PIO en el minuto 10 y 15 de ambos grupos, no hubo diferencias estadísticamente significativas; los resultados fueron basal 11.4±2.0 mmHg, 11.1±2.2 mmHg a los 5 minutos, y 11.1±2.2 mmHg a los 10 minutos. En cuanto a complicaciones, en el grupo de dosis alta la obstrucción de la vía aérea fue más frecuente, de 18 pacientes en comparación con 4 del grupo de dosis baja (p < 0.001). Así mismo, la sedación postoperatoria fue mayor en el grupo de mayor dosis (p < 0.001). Se presentaron dos reacciones disociativas al despertar, ambas en el grupo de dosis alta.
Blumberg et al.27 reportaron los resultados de un ensayo clínico aleatorizado publicado en 2007. Incluyeron pacientes de cualquier edad con diagnóstico o sospecha de glaucoma que fueron programados para tonometría con anestesia por baja colaboración. Utilizaron tablas de contingencia para comparar las características de los niños en los dos brazos del estudio y valoraron los cambios en varios periodos de seguimiento (2, 4, 6 y 8 minutos).
No se contó con estandarización en la administración o no de premedicación; algunos pacientes recibieron midazolam por vía oral (0.5-1 mg/kg - máx.: 20mg), intravenosa (0.05-0.1 mg/kg - máx.: 5 mg) o rectal (0.5-1 mg/kg -máx.: 20mg), y algunos también recibieron atropina por vía intramuscular (0.02mg/kg) o intravenosa (0.01mg/kg). Los autores realizaron inducción con sevoflurano 8% y FiO2 al 100% y mantenimiento 1 a 2 minutos después con 2-4 Vol. %. Para el grupo de ketamina, las dosis se encontraron entre el rango de 5-7 mg/kg intramusculares. Se excluyó un paciente que requirió intubación en el grupo de sevoflurano más tres pacientes en quienes, después de ser aleatorizados, no fue posible tomar la PIO. La medición de la línea de base en PIO fue hecha inmediatamente después de la inducción (T1), así que los valores de los pacientes despiertos no fueron recolectados. El tiempo de T1 osciló entre 3 y 10 minutos posinducción. Los demás valores se registraron en los minutos 2, 4, 6 y 8.
Para aproximarse a la PIO basal, realizaron una regresión del mejor ajuste extrapolando los datos hacia atrás, y encontraron el punto de cruce de ambas variables entre los 2 y 4 minutos previos a T1. Las medias para las PIO tomadas en T1 entre ambos grupos no presentaron diferencias (p = 0.15). Con sevoflurano se mostró una disminución mayor y consistente en los minutos 2, 4, 6 y 8 posinducción al compararlo con T1, del 11.5%, 19.2%, 18.5% y 16.7% respectivamente (p <0.001). En el grupo de ketamina hubo disminución de la PIO en los tiempos medidos, pero su variación respecto a T1 no fue clínicamente significativa (7.4%), aunque el resultado fue estadísticamente relevante (p=0.03), asumiéndose un IC 95% con un error del 5%, datos que no fueron reportados en el artículo.
Jones et al.28 quisieron describir los cambios de la PIO posteriores a la administración de ketamina intramuscular o intravenosa y el mantenimiento final con sevoflurano, mediante una revisión de casos retrospectiva. Revisaron historias clínicas registradas durante un periodo de 3 años, en los cuales se evaluaron los pacientes llevados a EBA por falta de cooperación o medidas poco confiables tomadas con paciente despierto. Se administraron 5 mg/kg de ketamina IM o 2 mg/kg IV. Las mediciones se promediaron por grupos de tres (alternativamente entre ambos ojos). Encontraron una diferencia promedio entre las mediciones con ketamina y las mediciones con sevoflurano de 7.39 mmHg (p < 0.001), un 28.5% menos con sevoflurano. El valor de PIO promedio fue de 17.0 mmHg en el grupo de sevoflurano y 24.4 mmHg en el grupo de ketamina.
Drayna et al.29 reclutaron pacientes de forma prospectiva, para realizar un análisis descriptivo del impacto de diferentes dosis de ketamina sobre la PIO de pacientes pediátricos programados para procedimientos bajo sedación con este fármaco. Calcularon la PIO basal midiéndola en ambos ojos y promediando antes de administrar la ketamina. No encontraron elevaciones clínica ni estadísticamente significativas entre la línea de base y las mediciones de PIO realizadas en los minutos 1, 3, 5, 15 y 30 (p = 0.15). Un análisis de Bland Altman mostró un nivel de concordancia apropiado entre las mediciones de cada ojo en diferentes momentos. La asociación de dosis de ketamina con PIO no fue estadísticamente significativa (p = 0.90); la dosis IV promedio fue 1.88 (mg/kg). Los valores promedio fueron: línea de base 14.66 mmHg, 1 minuto 14.84 mmHg, 3 minutos 15.18 mmHg, 5 minutos 15.46 mmHg y 15 minutos 15.75 mmHg.
Halstead et al.30 plantearon un estudio de no inferioridad donde incluyeron pacientes pediátricos ASA I o II, programados para procedimientos bajo sedación con ketamina por problemas diferentes a lesión ocular, en el cual todos los pacientes recibieron ketamina a dosis entre 1 y 2 mg/kg IV, y se controlaron con valores basales tomados inmediatamente después de haberse administrado el medicamento. Según sus hallazgos, no hubo cambios en la PIO clínicamente significativos (>15%, 2.6 mmHg); estos resultados se aplicaron a los tres grupos etarios del estudio: 1-5,6-10 y 1115 años. En sus resultados el valor promedio de PIO inicial fue de 17.5 mmHg y a los 2.5 minutos de 18.9 mmHg, con una diferencia promedio entre las dos mediciones de 1.4 mmHg.
Wadia et al.,31 en su estudio observacional prospectivo mediante una muestra por conveniencia que incluyó niños con edades hasta 18 años, realizaron mediciones basales de la PIO antes de administrar sedación procedimental con ketamina en urgencias. El incremento promedio de PIO fue 3 mmHg (0-8 mmHg). Reportaron los resultados de forma descriptiva, utilizando intervalos de confianza 95% de Clopper-Pearson, medias y medianas según aplicara.
Van der Walt et al.32 estudiaron niños con glaucoma o sospecha de este, que requirieron evaluación bajo anestesia. Se protocolizó la anestesia: inducción con sevoflurano, canalización de vena periférica, administración de ketamina a 2 mg/kg IV y mantenimiento con ketamina en infusión a 4mg/kg/h por 15 minutos. Al comparar la PIO promedio al tiempo 0 (solo sevoflurano) con el tiempo 15 min (ketamina sola), se mostró un incremento de 3.68 mmHg en la PIO (IC 95% 1.35-6.02 mmHg) (p = 0.002). Al compararla media de PIO a los 15 minutos (ketamina sola) y al minuto 20 (cerca al despertar), hubo un incremento de 0.28 mmHg (p=0.826).
La evaluación de la calidad de la evidencia realizada permitió identificar que los estudios de Yoshikawa et al., Ausinsch et al., Nagdeve et al., Blumberg et al. y Jones et al. tienen deficiencias en el reporte de la metodología empleada para reclutar pacientes, determinar las pérdidas y el porcentaje de participación, justificar los tamaños muestrales y describir el poder estadístico buscado. Algunos también presentaron dificultades en su metodología para medir el efecto de diferentes dosis del medicamento (ketamina) en la presión intraocular (desenlace primario). Unicamente el estudio de Nagdeve et al. habla de cegamiento doble, y en los demás estudios no lo reportan o niegan haberlo realizado en sus manuscritos.
De acuerdo con la evaluación realizada con el instrumento QAT-NIH, se concluyó que los estudios de Yoshikawa, Ausinsch y Jones son de calidad pobre, los de Nagdeve, Blumberg, Halstead, Drayna y Wadia son de calidad aceptable, y el de Van der Walt es de buena calidad.
En términos de complicaciones y seguridad, los primeros en reportar resultados al respecto fueron Nagdeve et al., quienes en su trabajo encontraron que las dosis mayores (6 mg/kg IM) comparadas con dosis de 3 mg/kg IM produjeron mayor número de complicaciones de vía aérea (obstrucción), con 18 pacientes vs. 4. La sedación a las 0 y2 horas después del procedimiento fue mayor en el grupo de dosis alta: para el posprocedimiento inmediato (0 horas) fueron 13 pacientes en comparación con 8 del grupo de dosis baja, y a las 2 horas posmediciones fueron 19 pacientes en comparación con 2 del grupo de dosis baja. Todas estas comparaciones presentaron diferencias entre los grupos de estudio (p <0.005).
En la experiencia de Van der Walt et al., estos autores refieren en su metodología haber registrado la presentación de complicaciones; sin embargo, no hay reporte en los resultados de su trabajo acerca de si estas se presentaron o no durante el estudio. Ningún otro de los estudios incluidos en el análisis de este manuscrito tuvo en cuenta o reportó la aparición de complicaciones.
El riesgo de sesgo del trabajo de Blumberg et al.,27 evaluado con la escala de evaluación del riesgo de sesgo de estudios individuales de la colaboración Cochrane, identificó como fuentes de alto riesgo la falta de cegamiento de participantes y personal y de la evaluación de resultados. En el caso de Halstead et al.,30 las fuentes antes descritas, más la ausencia de una secuencia aleatoria para la selección de pacientes y el ocultamiento de la selección, lo convirtieron en un trabajo con alto riesgo de sesgo, según la misma herramienta. Por su parte, el estudio de Nagdeve et al.26 fue el trabajo con menor riesgo de sesgo entre los evaluados; la única fuente identificada como riesgo incierto de sesgo fue el cegamiento de participantes y personal, pues su descripción no fue completamente clara en el manuscrito. Los resultados de estas evaluaciones se consignan en la Figura 2a y 2b.
Discusión
Como se mencionó previamente, la medición de la PIO es de suma importancia para el diagnóstico, seguimiento y tratamiento del glaucoma; sin embargo, en los niños pequeños, quienes no están en condiciones de colaborar para hacer posible la medición o por lo menos una de carácter confiable, es necesario realizarla bajo anestesia. El problema es que se ha descrito ampliamente cómo los medicamentos sedantes y anestésicos disminuyen la presión intraocular, y por eso es importante encontrar una opción que no genere ningún efecto sobre la misma, para que la medición sea confiable y no afecte la evaluación y el adecuado análisis clínico del paciente y sus necesidades terapéuticas.
En la presente revisión sistemática se pretendió evaluar el impacto de la administración de ketamina sobre la presión intraocular en población pediátrica. Los resultados, aunque de baja calidad de evidencia, sugieren que la administración de ketamina en pacientes pediátricos para realización de tonometría ocular tiene un efecto mínimo o nulo en la presión intraocular. De los nueve artículos incluidos en la revisión, dos mostraron un impacto significativo estadística o clínicamente en la medición de la presión intraocular posterior a la administración de ketamina, y otros siete tuvieron resultados que apoyan su uso en la realización de estos exámenes. En los estudios que mostraron un impacto significativo de la ketamina en la PIO, las dosis de esta fueron mayores (> 4mg/kg). También se documentaron dosis de hasta 0.96 mg/kg en bolo, que produjeron condiciones apropiadas para la tonometría en términos de sedación.
Las limitaciones de esta revisión están dadas por la heterogeneidad de los estudios en cuanto a tamaño de poblaciones y dosis empleadas de ketamina, el alto riesgo de sesgo de varios de los componentes de los estudios incluidos y la falta de estudios de buena calidad para determinar recomendaciones con mayor fuerza de evidencia. El uso de ketamina por diferentes vías (IM e IV) hace que varíen las dosis y los tiempos de instauración del efecto clínico para hacer la medición de la PIO. La imposibilidad de realizar un metanálisis por las dificultades descritas en la metodología es otra limitación.
Ausinsch et al.25 encontraron una leve disminución de la PIO después de administrar ketamina por vía intramuscular en dosis inicial y en una segunda dosis. Su población fue pequeña y realizaron varias cointervenciones, situación que afecta negativamente la fuerza de su metodología. Administraron a un pequeño subgrupo relajación neuromuscular y dividieron adicionalmente el grupo principal en dosis única y dosis repetida de ketamina. Es difícil valorar el peso real que tiene la administración de un único fármaco sobre el desenlace a medir, y por esta razón la valoración final de la calidad de la evidencia en este estudio no fue satisfactoria.
Para otros estudios evaluados en la revisión, como el caso de Halstead et al.30 y Jones et al.,28 una dificultad importante fue la identificación adecuada de una línea de base de la PIO para poder determinar el impacto real de la administración de ketamina. En algunos casos el paciente se encontraba bajo efectos de anestésicos inhalados, y en otros medir la presión intraocular en niños conscientes poco colaboradores resultó en valores poco confiables a veces incluso mayores a los valores normales del paciente.
En los estudios de mejor calidad (aceptable y buena en el QAT-NIH) no se reportaron cambios significativos en la PIO a dosis desde 0.96 mg/kg a 2 mg/kg por vía intravenosa, y desde 3 mg/kg a 5 mg/kg por vía intramuscular. No obstante, no se encontró evidencia disponible sobre la administración de ketamina por otras vías para realización de tonometría ocular en niños, y por esta razón no es posible identificar una dosis apropiada para vías alternativas con la evaluación de la presente revisión; una revisión sistemática de la literatura identificó el uso de ketamina y su efectividad por vía intranasal para sedación, al encontrarse dosis entre 3 y 9 mg/kg por vía intranasal con buenos resultados en cuanto a sedación y analgesia.33
Los resultados del presente trabajo no permiten recomendar el uso de ketamina como anestésico general para la medición de la presión intraocular en niños; aunque la mayoría de los resultados de los estudios evaluados muestran un impacto mínimo o nulo sobre esta, no se cuenta con estudios cuya fortaleza metodológica permita hacer la recomendación. Se requieren aun ensayos clínicos con poblaciones mayores y fortaleza metodológica mayor.
Conclusiones
La ketamina es un medicamento anestésico confiable y que puede tener menor efecto sobre la presión intraocular que otros medicamentos usados con el mismo objetivo; sin embargo, los estudios encontrados no cuentan con las características necesarias para contemplar la posibilidad de recomendar de forma asertiva este medicamento para realizar EBA en niños con glaucoma. Es necesario, entonces, ampliarla evidencia realizando ensayos clínicos con mayor fuerza estadística que permita recomendar su uso de manera protocolaria.
En caso de ser empleada entre las diferentes alternativas existentes, los clínicos deben saber que la evidencia disponible, aunque de baja calidad, se inclina por mostrarla como una elección segura y confiable para la medición, esto con base en los resultados de seguridad del único artículo que las reporta y en las variaciones mostradas en términos absolutos en la presión intraocular en los diferentes estudios incluidos, donde se encontraron valores desde 1.4 mmHg hasta un máximo de 3 mmHg que no revisten relevancia clínica para el diagnóstico y seguimiento de la patología.
Responsabilidades éticas
Los resultados y conclusiones reportados en el documento son fieles a lo descrito en la literatura, sin alteraciones o modificaciones hechas por los autores para ajustar sus resultados.
La producción escrita es producto del ejercicio intelectual de los autores, referenciando apropiadamente en cada uno de los casos pertinentes las referencias que corresponden a otros autores ajenos al equipo de trabajo.
REFERENCIAS
1. Luna-Martínez I, Brechtel-Bindel M, De la Fuente-Torres MA. Relationship between central corneal thickness and intra ocular pressure variation with optic nerve damage in Mexican patients with glaucoma. Rev Mex Oftalmol 2009;83:193-196. [ Links ]
2. Yang DY, Guo K, Wang Y, et al. Intraocular pressure and associations in children. The Gobi Desert Children Eye Study. PLoS One 2014;9:e109355. [ Links ]
3. Jiang WJ, Wu JF, Hu YY, et al. Intraocular pressure and associated factors in children: the shandong children eye study. Investig Opthalmology Vis Sci 2014;55:4128-4134. [ Links ]
4. Sanabria A, González L, Mattar P, et al. Valores normales de presión intraocular en niños/Intraocular pressure normal values in children. Rev Oftalmol Venez 1957;59:85-88. [ Links ]
5. Albert DM, Miller JW, Azar DT. Albert & Jakobiec's Principles and Practice of Ophthalmology. 3rd ed.2008;Saunders. [ Links ]
6. Shields M, Ritch R, Krupin T. Clasification of the glaucomas. En: The Glaucoma's 1996;Mosby, St. Louis:717-720. [ Links ]
7. Walton DS. Infantile, childhood, and juvenile glaucomas. En: The Glaucoma Book London: Springer; 2010;567-579. [ Links ]
8. Gilbert C. Changing challenges in the control of blindness in children. Eye 2007;21:1338-1343. [ Links ]
9. Zuluaga C, Sierra MV, Asprilla E. Childhood blindness causes in Cali, Colombia. Colomb Med 2005;36:235-238. [ Links ]
10. Villaseca E. Prevention and treatment of ocular diseases in child. Rev Medica Clin Las Condes 2010;21:972-977. [ Links ]
11. Knappe S, Schittkowski M, Schroder W, et al. The currently most common causes of childhood blindness in Kinshasa (d. R. Congo). Klin Monbl Augenheilkd 2007;224:597-602. [ Links ]
12. Samples JR. Childhood glaucomas. En: Glaucoma Science and Practice 2003;Thieme, New York:182-193. [ Links ]
13. Giangiacomo A, Beck A. Pediatric glaucoma. Curr Opin Ophthalmol 2016;161:1. [ Links ]
14. Gupta N, Aung T, Congdon N, et al. Guías del Consejo Internacional de Oftalmología (ICO) para el Glaucoma. 2016. [ Links ]
15. Tonnu PA, Ho T, Sharma K, et al. A comparison of four methods of tonometry: method agreement and interobserver variability. Br J Ophthalmol 2005;89:847-850. [ Links ]
16. De Moraes CGV, Prata TS, Liebmann J, et al. Modalities of tonometry and their accuracy with respect to corneal thickness and irregularities. J Optom 2008;1:43-49. [ Links ]
17. Moyao-García D, Maldonado-Sánchez KA, Díaz-Sánchez M. Anesthetic management of pediatric eye surgery. Rev Mex Anestesiol 2014;374:271-282. [ Links ]
18. James I. Anaesthesia for paediatric eye surgery. Contin Educ Anaesth Crit Care Pain 2008;8:5-10. [ Links ]
19. American Academy of Ophthalmology Section 10: Glaucoma. 2014th-2015th ed2014;American Academy of Ophthalmology. [ Links ]
20. Lord J. Anaesthesia for eye surgery in paediatrics. Anaesth Intensive Care Med 2007;8:393-396. [ Links ]
21. Javier E, Manjarrez A, Loraine L, et al. Ketamine vs fentanyl for neonatal sedation. Med UPB 2007;26:97-108. [ Links ]
22. Altiparmak B, Akca B, Yilbas AA, et al. All about ketamine premedication for children undergoing ophtalmic surgery. Int J Clin Exp Med 2015;8:21525-21532. [ Links ]
23. Haberer JP, Obstler C. Anesthesia in ophthalmology. EMC- Anesthésie-Réanimation 2008;5:1-24. [ Links ]
24. Yoshikawa K, Murai Y. The effect of ketamine on intraocular pressure in children. Anesth Analg 1971;50:199-202. [ Links ]
25. Ausinsch B, Rayburn RL, Munson ES, et al. Ketamine and lntraocular pressure in children. Anesth Analg 1976;55: 773-775. [ Links ]
26. Nagdeve NG, Yaddanapudi S, Pandav S. The effect of ketamine on intraocular pressure in children. J Pediatr Ophthalmol Strabismus 2006;43:219-223. [ Links ]
27. Blumberg D, Congdon N, Jampel H, et al. The effects of sevoflurane and ketamine on intraocular pressure in children during examination under anesthesia. Am J Ophthalmol 2007;143:494-499. [ Links ]
28. Jones L, Sung V, Lascaratos G, et al. Intraocular pressures after ketamine and sevoflurane in children with glaucoma undergoing examination under anaesthesia. Br J Ophthalmol 2010;94:33-35. [ Links ]
29. Drayna PC, Estrada C, Wang W, et al. Ketamine sedation is not associated with clinically meaningful elevation of intraocular pressure. Am J Emerg Med 2012;30:1215-1218. [ Links ]
30. Halstead SM, Deakyne SJ, Bajaj L, et al. The effect of ketamine on intraocular pressure in pediatric patients during procedural sedation. Acad Emerg Med 2012;19:1145-1150. [ Links ]
31. Wadia S, Bhola R, Lorenz D, et al. Ketamine and intraocular pressure in children. Ann Emerg Med 2014;64:385-388.e1. [ Links ]
32. Van der Walt JG, Roodt F, Tinley C. How does sevoflurane induction, followed by a ketamine maintenance infusion, affect intraocular pressure? Establishment of an anaesthetic protocol for paediatric glaucoma examinations under anaesthesia. Br J Ophthalmol 2018;102:902-905. [ Links ]
33. Poonai N, Canton K, Ali S, et al. Intranasal ketamine for procedural sedation and analgesia in children: a systematic review. PLoS One 2017;12:e0173253. [ Links ]
Cómo citar este artículo: Ruiz-Villa JO, Jaramillo-Rivera DA, Pineda-Gutierrez LM. Ketamine impact on intraocular pressure of children: a systematic review and qualitative synthesis of evidence. Colombian Journal of Anesthesiology. 2019;47:226-235.
Copyright © 2019 Sociedad Colombiana de Anestesiología y Reanimación (S.C.A.R.E.). Published by Wolters Kluwer. This is an open access article under the CC BY-NC-ND license (https://creativecommons.org/licenses/by-nc-nd/4.0/).
Anexo 1
ScienceDirect (Elsevier®)
“ketamine” AND “intraocular pressure” OR “ocular tonometry” AND “children”
PubMed
(”Ketamine“[Mesh]) AND (”Intraocular Pressure“[Mesh]) AND (”Child“[Mesh]) OR (”Child, Preschool“[Mesh]) AND (”Tonometry, Ocular“[Mesh]) AND (”Pragmatic Clinical Trial“ [Publication Type] OR ”Controlled Clinical Trial“ [Publication Type] OR ”Clinical Trial, Phase IV“ [Publication Type] OR ”Clinical Trial, Phase II“ [Publication Type] OR ”Clinical Trial, Phase I“ [Publication Type] OR ”Randomized Controlled Trial“ [Publication Type] OR ”Clinical Trial“ [Publication Type] OR ”Adaptive Clinical Trial“ [Publication Type] OR ”Equivalence Trial“ [Publication Type] OR ”Cross- Over Studies“[Mesh] OR ”Clinical Trial, Phase III" [Publication Type])
Ovid® (Wolters Kluwer®)
“Ketamine AND Intraocular Pressure AND Ocular tonometry AND Children AND Child AND Clinical Trial AND Randomized Controlled Trial NOT Adults”











 texto en
texto en