Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Colombia Médica
versión On-line ISSN 1657-9534
Colomb. Med. vol.52 no.3 Cali jul./set. 2021 Epub 05-Jun-2021
https://doi.org/10.25100/cm.v52i3.4600
Articles
Parámetros maternos y de sangre de cordón asociados con medidas placentarias y del recién nacido: Un estudio de casos en madres indígenas de la cohorte MINDI
1 McGill University (Macdonald Campus), School of Human Nutrition, Faculty of Agricultural and Environmental Sciences. Ste-Anne-de-Bellevue, Canada
2 Ministerio de Salud, Departamento de Salud Nutricional, Ciudad de Panamá, Panamá
3 Ministerio de Salud, Región de Salud “Panamá Norte”, Ciudad de Panamá, Panamá
4 Ministerio de Salud, Región de Salud “Comarca Ngäbe-Buglé” San Félix, provincia de Chiriquí, Panamá
5 Universidad de Panamá, Departamento de Bioquímica, Ciudad de Panamá, Panamá
6 McGill University (Macdonald Campus), Institute of Parasitology, Faculty of Agricultural and Environmental Sciences. Ste-Anne-de-Bellevue, Canada
Antecedentes:
Las Múltiples Infecciones, Nutrición Deficiente e Inflamación (MINDI), son frecuentes en comunidades indígenas, sin embargo, sus asociaciones con resultados de salud perinatales no han sido descritos.
Objetivo:
Evaluar la inflamación y los micronutrientes en sangre materna y de cordón de madres en trabajo de parto en la comarca Ngäbe-Buglé en Panamá, así como sus asociaciones con medidas placentarias y del recién nacido.
Métodos:
En 34 pares madre-recién nacido, se midieron peso y diámetro placentario, y se analizaron muestras de sangre materna y de cordón umbilical para hemograma completo, proteína-C reactiva (PCR), ferritina, receptor sérico de transferrina (RsTf), vitaminas A y D. Se usó la fórmula de Nadler para calcular volúmenes sanguíneos.
Resultados:
Las madres presentaron volumen plasmático (<2.8 L, 96%), vitamina A (52.9%), vitamina D (29.4%), hierro (58.8%) y hemoglobina (23.5%) bajos, pero el 17.6% presentaron hematocrito >40% y 85.3% presentaron inflamación (PCR >8.1 mg/L). Los pesos al nacer fueron normales, pero se identificó bajo peso placentario (35.3%), bajo puntaje-z de circunferencia cefálica neonatal, y en sangre de cordón, bajos hemoglobina (5.9%), hierro (79.4%), vitamina A (14.7%) y vitamina D (82.3%). Se encontró una fuerte correlación positiva entre la vitamina D materna y de sangre de cordón. Un mayor volumen plasmático materno se asoció con placentas de mayor peso (β= 0.57), en tanto que concentraciones más altas de vitamina D (β= 0.43) y mayor número de eosinófilos (β= 0.43) se asociaron con mayor diámetro placentario. Una mayor hemoconcentración (hematocrito en cordón más alto) se asoció con menores peso al nacer (β= -0.48) y circunferencia cefálica (β= -0.56). La inflamación [mayor número de neutrófilos maternos (β= -0.50) y plaquetas en sangre de cordón (β= -0.32)] se asoció con menor talla y circunferencia cefálica neonatales.
Conclusión:
La hemoconcentración materna y del recién nacido, la inflamación subclínica y las múltiples deficiencias en micronutrientes, particularmente la deficiencia de vitamina D neonatal, se identificaron como potenciales áreas de intervención para mejorar los resultados de salud del embarazo en comunidades vulnerables.
Palabras clave: población indígena; sangre de cordón; volumen plasmático; vitamina D; receptor sérico de transferrina; plaquetas
Background:
Multiple infections, nutrient deficiencies and inflammation (MINDI) occur in indigenous communities, but their associations with perinatal outcomes have not been described.
Objective:
To assess maternal and cord blood micronutrient and inflammation status in peripartum mothers from the Ngäbe-Buglé comarca in Panama, and their associations with placental and infant outcomes.
Methods:
In 34 mother-newborn dyads, placental weight and diameter were measured, and maternal and cord blood were processed for complete cell counts, serum C-reactive protein, ferritin, serum transferrin receptor (sTfR), vitamins A and D. Blood volumes were calculated using Nadler’s formula.
Results:
Mothers had low plasma volume (<2.8 L, 96%), vitamin A (52.9%), vitamin D (29.4%), iron (58.8%) and hemoglobin (23.5%), but high hematocrit (>40%, 17.6%) and inflammation (C-reactive protein >8.1 mg/L, 85.3%). Birthweights were normal, but low placental weight (35.3%), low head circumference Z-scores (17.6%), and low cord hemoglobin (5.9%), iron (79.4%), vitamin A (14.7%) and vitamin D (82.3%) were identified. Maternal and cord vitamin D were highly correlated. Higher maternal plasma volume was associated with heavier placentae (β= 0.57), and higher cord D (β= 0.43) and eosinophils (β= 0.43) with larger placentae. Hemoconcentration (higher cord hematocrit) was associated with lower newborn weight (β= -0.48) and head circumference (β= -0.56). Inflammation [higher maternal neutrophils (β= -0.50), and cord platelets (β= -0.32)] was associated with lower newborn length and head circumference.
Conclusion:
Maternal-newborn hemoconcentration, subclinical inflammation and multiple nutrient deficiencies, particularly neonatal vitamin D deficiency, were identified as potential targets for interventions to improve pregnancy outcomes in vulnerable communities.
Key words: indigenous population; cord blood; plasma volume; vitamin D; transferrin receptors; blood platelets
Contribución del estudio
| 1) ¿Por qué se realizó este estudio? |
| No se ha estudiado el impacto de la coexistencia de múltiples infecciones, deficiencias nutricionales e inflamación en resultados de salud placentarios y neonatales en comunidades indígenas. |
| 2) ¿Cuáles fueron los resultados más relevantes del estudio? |
| La malnutrición materna subclínica expresada como hemoconcentración en sangre materna y de cordón y como deficiencia en micronutrientes, se asoció con bajo peso placentario y menores medidas antropométricas del recién nacido. Indicadores de inflamación materna se asociaron con menor talla y circunferencia cefálica neonatales. |
| 3¿Qué aportan estos resultados? |
| Este estudio reporta datos de medidas maternas, placentarias y neonatales, así como de biomarcadores de inflamación y nutrición en sangre materna y de cordón umbilical en pares madre-recién nacido de una comunidad indígena remota en Panamá. Los resultados del estudio revelaron inflamación materna y deficiencias nutricionales maternas y neonatales subclínicas, que requieren intervenciones a nivel de salud pública. |
Introducción
Las comunidades indígenas en las Américas constituyen minorías vulnerables con mayores desventajas de salud 1,2. Las mujeres indígenas tienen mayor riesgo de tener bebés de bajo peso, de mayor mortalidad materna e infantil, y sus niños tienen mayores proporciones de malnutrición y menor expectativa de vida 3. Los pueblos indígenas de Norteamérica tienen tasas altas de parto pretérmino y mortalidad infantil 4,5, mas no de recién nacidos pequeños para la edad gestacional 4. La mayor prevalencia de estas complicaciones se asocia frecuentemente con el aislamiento geográfico de la mayoría de las comunidades indígenas 6.
El estudio de medidas placentarias en poblaciones indígenas es escaso. Un estudio que comparó especímenes placentarios de embarazos a término de bajo riesgo en mujeres indígenas y no indígenas mostró que la inflamación placentaria era más frecuente en mujeres indígenas 7. También, la infección placentaria de madres indígenas por malaria fue un factor de riesgo para bajo peso al nacer 8. A nuestro entender, no se han desarrollado estudios de medidas placentarias en mujeres indígenas de Latinoamérica.
También se conoce que el estado nutricional de madres y niños indígenas difiere de aquellos no indígenas. En Canadá, la malnutrición calórica no es un problema, pero las deficiencias en micronutrientes, particularmente de hierro, vitaminas A, D, ácido fólico y flúor, así como la presencia de infecciones, son problemáticos 9. Tanto las madres 10) como los recién nacidos 10,11 de comunidades indígenas en el norte de Canadá tienen menores concentraciones de vitamina A que poblaciones no indígenas.
Las comunidades indígenas de Latinoamérica tienen aún mayores desventajas dadas las condiciones de lejanía, así como de pobreza extrema, falta de agua y saneamiento, acceso a los servicios de salud y educación, y menor ingesta de alimentos de calidad durante los periodos críticos de crecimiento y desarrollo 12. Encuestas nacionales en países mesoamericanos que incluyen comunidades indígenas han reportado proporciones altas de anemia y emaciación [puntaje-z de peso para talla <-2 desviaciones estándar (DE)Α en la infancia temprana 13.
Aunque se conoce que las comidas tradicionales indígenas son una buena fuente de micronutrientes incluyendo hierro y vitamina D, la inseguridad alimentaria y las transiciones de la dieta han dado como resultado un incremento en la malnutrición en comunidades indígenas 14. Se ha encontrado que las deficiencias de hierro 15, vitaminas A 16 y D 17,18 son más prevalentes en comunidades indígenas. Esto es de particular interés dado el vínculo existente entre la deficiencia de hierro materna y resultados adversos del embarazo 19,20, y entre las deficiencias de micronutrientes durante el embarazo y los impactos a largo plazo en la vida adulta 21.
A pesar de la evidencia de que las deficiencias en micronutrientes en mujeres de edad reproductiva son un problema de salud mayor 22, los factores asociados con resultados adversos del embarazo en comunidades indígenas son menos conocidos. Nosotros reportamos previamente que mujeres embarazadas y lactantes indígenas de la comunidad Ngäbe-Buglé, la más grande y de más rápido crecimiento en Panamá, tenían múltiples infecciones y co-existentes 23, múltiples deficiencias en micronutrientes e inflamación 24, y que la presión de pulso materna se asociaba con fetos más pequeños usando la altura uterina como indicador 25. Para el presente estudio exploratorio de corte transversal, nuestro objetivo principal fue evaluar la inflamación y el estado nutricional de pares madre-recién nacido, incluyendo deficiencias de hierro, vitaminas A y D, así como sus asociaciones con medidas placentarias y antropométricas del recién nacido, que fueron los indicadores disponibles al momento del parto en esta Comarca.
Materiales y Métodos
Se obtuvo aprobación ética del Instituto Conmemorativo Gorgas en Panamá (No. 1618/CNBI/ICGES/10) el cual tuvo como prerrequisito la firma de un acuerdo con las autoridades indígenas de la Comarca Ngäbe-Buglé y con el Ministerio de Salud de Panamá. También se obtuvo aprobación ética de la Universidad de McGill en Canadá (No. A03-M25-08B). Las aprobaciones estuvieron conformes con las recomendaciones de las Guías Operacionales de Bioética en la Investigación. Las participantes dieron consentimiento informado por escrito de acuerdo con la Declaración de Helsinki 26.
Contexto y participantes
El Hospital General del Oriente Chiricano en San Félix, Panamá, presta servicio principalmente a la población indígena. En el 2010, en esta población, la atención institucional del parto se realizó solamente en 43.9%, mientras los demás partos fueron domiciliarios y atendidos por parteras tradicionales. En un esfuerzo por incrementar la atención institucional del parto en mujeres indígenas de áreas remotas, las Autoridades de Salud Comarcal, junto con la iglesia católica, ofrecen un albergue temporal, cerca al hospital de San Félix, donde las mujeres en etapa final del embarazo pueden quedarse con un acompañante hasta por varias semanas, mientras esperan el momento del parto. Ellas reciben educación en salud y seguimiento por parte de enfermería. El hospital atendía estas mujeres y aquellas que vivían cerca de la localidad de San Félix. El hospital reportó 620 partos en 2010 27. Para el presente estudio y en un mes de tamizaje entre noviembre y diciembre de 2010 se incluyeron 34 mujeres al momento del parto (65% de los partos esperados/mes). Los embarazos complicados, incluyendo aquellos que requirieron cesárea, fueron remitidos al hospital de segundo nivel más cercano, a una hora en carro desde San Félix. Estas mujeres no se incluyeron en el estudio.
Se invitó a participar a embarazadas indígenas en trabajo de parto activo normal que ingresaban a la Unidad Obstétrica, solamente si sus contracciones eran espaciadas, tenían deseos de conversar y se sentían suficientemente bien para recibir explicación del proyecto y para dar consentimiento informado. Se colectó información de las historias clínicas incluyendo la historia obstétrica, signos vitales y antropometría maternas al momento del ingreso.
Indicadores clínicos
La presión arterial se tomó al momento del ingreso a sala de trabajo de parto, en posición supina, entre contracciones uterinas, usando un esfigmomanómetro de mercurio. La presión de pulso se calculó restando la presión diastólica a la sistólica 28, y una presión de pulso <42 mmHg fue considerada como baja 29. Se calculó la presión arterial media [ presión arterial media = (presión sistólica + 2x presión diastólica)/3] 28, y una presión arterial media >86 mmHg fue clasificada como elevada 30.
Al momento del ingreso, se aprovechó la toma rutinaria de muestras de sangre venosa materna, para tomar otros 10 mL para análisis de micronutrientes. Los partos fueron atendidos por un médico local, con la asistencia de 1-2 enfermeros. Al momento del parto se registró el Apgar al minuto y a los 5 minutos, así como las características macroscópicas del líquido amniótico. El pinzamiento retardado del cordón umbilical hacía parte del protocolo institucional. Se tomó muestra de sangre de cordón inmediatamente después del pinzamiento umbilical y antes del alumbramiento placentario.
Medidas biométricas
Placenta: El peso placentario se obtuvo usando una balanza electrónica, y su diámetro, usando una cinta métrica no extensible. Se registraron las características macroscópicas de la placenta, incluyendo la presencia visual de nódulos que se clasificaron como pequeños (puntiformes), o grandes (placas de ≥5 mm de diámetro). Se calcularon los puntajes-z del peso placentario para el peso fetal, usando estándares derivados del registro de 20,635 partos con recién nacido único tomados de la base de datos obstétrica y neonatal de McGill 31.
Antropometría del recién nacido: Los enfermeros del departamento de obstetricia del hospital de San Félix tomaron rutinariamente medidas antropométricas (peso, talla y circunferencia cefálica) de los bebés inmediatamente después del parto. Las medidas registradas en las historias clínicas se usaron para calcular los puntajes-z de peso para edad, talla para la edad, peso para talla y circunferencia cefálica para la edad, basados en los estándares INTERGROWTH-21 32.
Hemogramas completos
La sangre materna y la del cordón umbilical se procesaron para conteo celular completo usando un Analizador Mindray Auto Hematology BC-5500. La anemia materna se definió como hemoglobina <11 g/dL 33. Para otros índices de células sanguíneas rojas se utilizaron puntos de corte para el tercer trimestre 34. Los índices plaquetarios para los cuales no se han establecido puntos de corte durante el embarazo (plaquetocrito y variación del ancho de distribución de plaquetas) se compararon con valores establecidos para la población general 35. Se utilizaron los puntos de corte descritos por Glasser et al. por sexo y edad gestacional para establecer anormalidades de células sanguíneas en los recién nacidos 36. La anemia del recién nacido se definió como hemoglobina de cordón <116 g/L en niñas y <120 g/L en niños 36. Los rangos normales para plaquetocrito y variación del ancho de distribución de plaquetas en sangre de cordón se tomaron del estudio de Basu et al37.
Análisis séricos
Los sueros de sangre materna y de cordón se congelaron a -20o C antes de ser procesados en el Instituto Conmemorativo Gorgas de la Ciudad de Panamá. Se utilizó el inmunoensayo enzimático para ferritina (ELISA, MP Biomedicals, Orangeburg, NY) con una concentración detectable mínima de 5 ng/mL, también el inmunoensayo enzimático Ramco para receptor sérico de transferrina (RsTf) basado en el método sándwich de doble anticuerpo con un valor límite inferior de 1 µg/L, y se usó el inmunoensayo enzimático de alta sensibilidad para proteína-C reactiva (PCR), basado en el principio de ELISA de fase sólida, con una concentración detectable mínima de 0.1 mg/L (MP Biomedicals, Orangeburg, NY). La deficiencia de hierro materna se definió como RsTf >8.3 mg/L (Ramco®) o ferritina sérica <20 µg/L (según lo establecido por la OMS al momento del estudio) 33, y la deficiencia de hierro del recién nacido como RsTf de cordón >9.6 mg/L o ferritina de cordón <114 µg/L 38. La PCR se consideró elevada si estaba por encima de 8.1 mg/L en suero materno 34, o >0.5 mg/L en sangre de cordón 39.
Las concentraciones de vitamina A se determinaron usando la técnica de cromatografía líquida de alto rendimiento (HPLC) en el Instituto de Investigaciones Científicas y de Servicios de Alta Tecnología INDICASAT en Ciudad de Panamá. El suero restante fue transportado a Montreal (Canadá) para el posterior procesamiento de 25OH vitamina D usando LIAISON en la Escuela de Nutrición Humana de la Universidad de McGill. En madres y neonatos se consideraron concentraciones <0.35 µmol/L como deficiencia de vitamina A, y concentraciones <1.05 µmol/L 11,40,41, como insuficiencia de vitamina A. Una 25(OH)D se consideró baja si las concentraciones eran <50 nmol/L tanto en madres como en recién nacidos 42,43.
Para explorar la posibilidad de hipovolemia materna sugerida por investigaciones previas en esta población 25, se realizó el cálculo del volumen sanguíneo materno y neonatal usando la fórmula de Nadler (volumen sanguíneo total = 0.3561 x (talla en metros)3 + 0.03308 x peso en kilos + 0.1833 44,45. Se consideró como volumen sanguíneo normal del recién nacido el promedio ± DE (82.28 ± 16.9 mL/kg) encontrado en neonatos a término, calculado usando densitometría de pulso con contraste de verde indocianina 46. Volumen de plasma materno se calculó como el volumen total des angre x (1-hematocrito) 47. Se consideró que había un volumen plasmático materno bajo si estaba por debajo del 5o percentil para embarazos a término (<2.8 L), según descrito por de Haas et al48.
Análisis estadísticos
Los análisis estadísticos se realizaron usando el software SPSS para Mac (SPSS Inc., Chicago, IL, USA) y Stata/IC 16.1 para Mac (TX, USA). Se usó estadística descriptiva para calcular promedios, medianas, rangos intercuartílicos y proporciones. Se evaluaron correlaciones entre índices de células sanguíneas y biomarcadores séricos, maternos y neonatales. Se usó la prueba t de Student para comparar el número de eosinófilos en sangre de cordón con la presencia/ausencia de eosinofilia materna, definida como >0.6 x103/mm3. Un valor de p <0.05 se consideró como estadísticamente significativo.
Para evaluar asociaciones de medidas placentarias (peso y diámetro), y de antropometría del recién nacido [peso (kg), talla (cm) y circunferencia cefálica (cm), así como puntajes-z de peso para la edad, peso para talla, talla para edad y circunferencia cefálica para la edad], se agruparon las características maternas (edad, paridad, edad gestacional, clasificación de peso para talla materno, medidas de presión arterial y volumen plasmático), y se dividieron las variables de sangre materna/sangre de cordón en cuatro grupos: indicadores de inflamación (PCR, total y diferencial de glóbulos blancos, incluyendo la razón de neutrófilos/linfocitos), índices eritrocitarios y plaquetarios; e indicadores nutricionales (ferritina, RsTf, vitaminas A y D). Se incluyó la edad gestacional en los modelos para peso (kg) y talla (cm) del recién nacido. Cada grupo de covariables se evaluó usando regresiones ‘bootstrap’ (de remuestreo) con 1,000 repeticiones. Aquellas variables que entraron ≥50% repeticiones fueron seleccionadas 49 y utilizadas en modelos de regresión polinómica fraccional multivariable. El algoritmo de regresión polinómica fraccional multivariable combina la eliminación retrógrada y la determinación de formas funcionales de la clase de polinomios fraccionales que se adaptan al modelo, para ajustar por posible no-linearidad 50. Para obtener un máximo de 4 variables en los modelos finales, el nivel de significancia para remover covariables del modelo se fijó en p= 0.15. Los datos faltantes (3 de peso materno, 3 de talla materna, 1 de PCR materna y 1 de talla del recién nacido) no fueron imputados y se desarrolló un análisis de casos completos. Para explorar con más detalle la asociación entre neutrófilos maternos y peso al nacer, se calculó el punto de corte de neutrófilos para la detección de peso para talla <-2, usando el método de Liu, el cual maximiza el producto de la sensibilidad y especificidad 51. Se calculó la ausencia de colinearidad y la estabilidad de los coeficientes de regresión usando un factor de inflación de la varianza <10 y un número condicional <30 respectivamente.
Resultados
Características de la población
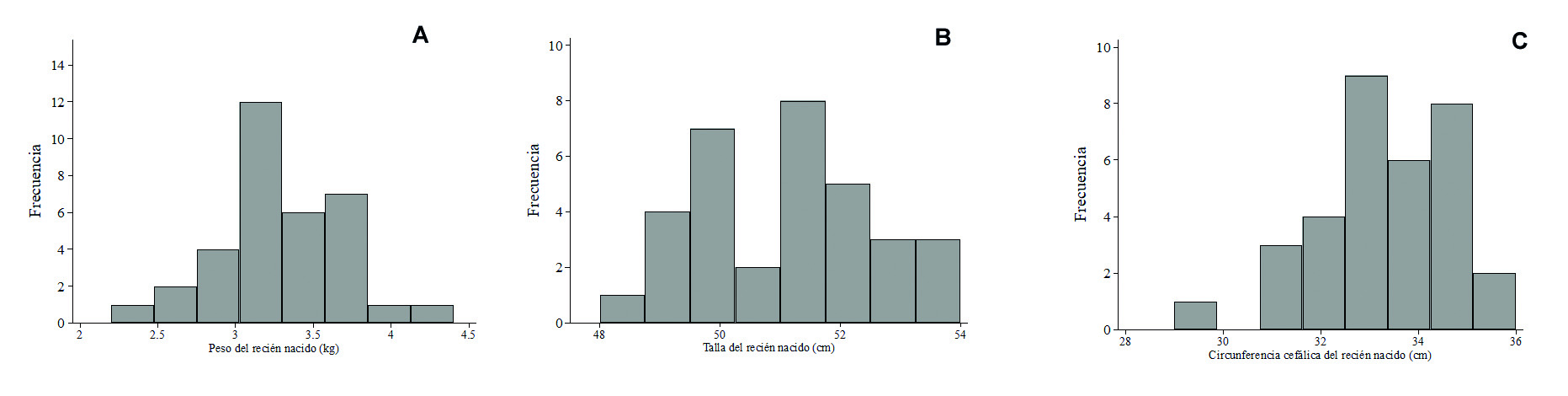
Las características de las madres, placentas y recién nacidos se muestran en la Tabla 1. Entre los riesgos conocidos para resultados adversos del embarazo, nuestra muestra incluyó embarazo adolescente (35.3%), gran multiparidad (29.4%), presión arterial media elevada (55.9%) y baja presión de pulso (82.3%). Todas las mujeres tuvieron partos a término con edades gestacionales entre 37 y 42 semanas. Las placentas estuvieron por debajo del percentil 10 para la edad gestacional en 35.3%; se observaron lesiones sub-amnióticas en 70.6% de las placentas, de las cuales 41.2% eran puntiformes y 29.4%, en forma de placas.
Tabla 1 Características de las madres, de las placentas y de recién nacidos
| Características maternas | Mediana (min-max) o frecuencia | Características de las placentas | Promedio ± DE o frecuencia |
|---|---|---|---|
| Edad (años), | 23 (16-37) | Peso (gr) | 565.6 ± 113.8 |
| ≤19 yr | 12 (35.3%) | Diámetro (cm) | 20.1 ± 2.2 |
| ≥35 yr | 3 (8.8%) | Peso placentario <10o percentil para la EG | 12 (35.3%) |
| Paridad | 3 (1-10) | Presencia de nódulos | 24 (70.6%) |
| Primigestantes | 5 (14.7%) | Líquido amniótico | |
| ≥ 5 | 10 (29.4%) | Claro | 23 (67.6%) |
| Signos vitals preparto | Promedio ± DE o frecuencia | Meconio diluído | 7 (20.6%) |
| Temperatura (oC) | 37.0 ± 0.4 | Meconio denso | 4 (11.8%) |
| Frecuencia cardiaca, lpm | 79 ± 6 | Características de los recién nacidos | |
| Presión arterial (PA), mmHg | Niños | 21 (61.8%) | |
| PA sistólica | 108 ± 12 | Niñas | 13 (38.2%) |
| PA diastólica | 73 ± 8 | EG, sem | 39.4 ± 1.16 |
| Presión de pulso | 35 ± 10 | Peso (kg) | 3.3 ± 0.43 |
| Presión de pulso < 42 mmHg | 28 (82.3%) | Talla (cm) | 51.02 ± 1.5 |
| Presión arterial media | 85 ± 9 | Circunferencia cefálica (cm) | 33.3 ± 1.6 |
| Presión arterial media >86 mmHg | 19 (55.9%) | Puntaje-z peso para edad | 0.09 ± 1.0 |
| Antropometría materna | Peso para edad <-2 DE | 1 (2.9%) | |
| Peso (kg) (n=31) | 62.8 ± 8.9 | Puntaje-z peso para talla | -0.3 ± 1.1 |
| Talla (m) (n=31) | 1.49 ± 0.05 | Peso para talla <-2 DE | 2 (6.0%) |
| Peso para talla según EG (n=29) | Puntaje-z de talla para edad | 1.0 ± 0.9 | |
| Bajo peso | 5 (16.1%) | Talla para edad <-2 DE | 0 |
| Peso normal | 18 (58.1%) | Puntaje-z de circunferencia cefálica para edad | -0.47 ± 1.3 |
| Sobrepeso | 8 (25.8%) | Circunferencia cefálica para edad < -2 DE | 6 (17.6%) |
| Volumen plasmático materno (L) | 2.18 ± 0.26 | Volumen sanguíneo del recién nacido (L/kg) | 0.34 ± 0.02 |
EG: edad gestacional, DE: desviación estándar
Se reportan datos de 34 pares madre-recién nacido, a no ser que se especifique otra cifra
Las distribuciones de peso, talla y circunferencia cefálica del recién nacido se muestran en la Figura 1. No se observó bajo peso al nacer, las prevalencias de bajo puntaje-z de peso para edad, peso para talla y talla para edad estuvieron por debajo del 6%, pero un puntaje-z <-2 de circunferencia cefálica para edad se encontró en 17.6% de los recién nacidos (Tabla 1).
Hemograma completo y biomarcadores séricos
Los conteos celulares sanguíneos se muestran en la Tabla 2, y la comparación de los análisis séricos en sangre materna y de cordón en la Tabla 3. Es de anotar que no se encontraron correlaciones significativas entre células o biomarcadores de sangre materna y sus correspondientes análisis en sangre de cordón, a excepción de la vitamina D materna y de cordón, los cuales estuvieron positivamente correlacionados (r2= 0.79, p <0.0001).
Tabla 2 Conteo completo de células sanguíneas en sangre materna y sangre de cordón
| Sangre materna | Sangre de cordón | |
|---|---|---|
| Índices de glóbulos rojos | ||
| Eritrocitos x106 | 3.94 (3.65-4.20) | 3.68 (3.42-3.84) |
| Hemoglobina (g/L) | 119 (110-142) | 132 (126-141) |
| Anemia a, n (%) | 8 (23.5%) | 2 (5.9%) |
| Hematocrito (%) | 36.55 ( 34.70-38.70) | 41.90 (349.00-45.10) |
| Hematocrito bajo b, n (%) | 1 (2.9%) | 5 (14.7%) |
| Hematocrito alto, a n (%) | 6 (17.6%) | 5 (14.7%) |
| Volumen corpuscular medio (fL) | 93.00 (89.10-97.90) | 114.00 (111.00-117.00) |
| Microcitosis c, n (%) | 2 (5.9%) | 5 (14.7%) |
| Macrocitosis c, n (%) | 4 (11.8%) | 5 (14.7%) |
| Hemoglobina corpuscular media (pg/L) | 30.30 (28.80 ± 31.90) | 35.85 (35.20-36.80) |
| Baja hemoglobina corpuscular media d | 9 (26.5%) | 7 (20.6%) |
| Concentración de hemoglobina corpuscular media (g/L) | 326 (316-332) | 315 (310-322) |
| Baja concentración de hemoglobina corpuscular media e | 11 (32.3%) | 0 |
| Ancho de distribución eritrocitario-coeficiente de variación (CV) | 13.15 (12.40-13.70) | 15.25 (14.70-15.50) |
| Elevado ancho de distribución eritrocitario-CVf | 2 (5.9%) | 0 |
| Ancho de distribución eritrocitario-DE | 45.35 (43.60-48.00) | 63.30 (62.20-66.60) |
| Elevado ancho de distribución eritrocitario-DEg | 15 (44.1%) | 0 |
| Glóbulos blancos totales y diferencial | ||
| Total de leucocitos x103/mm3 | 11.53 (10.10-14.30) | 11.09 (9.62-13.02) |
| Leucocitos elevados h, n (%) | 3 (8.8%) | 0 |
| Neutrófilos | 8.75 (7.40-11.06) | 6.14 (5.15-6.98) |
| Neutrófilos elevados i, n (%) | 2 (5.8%) | 1 (2.9%) |
| Linfocitos j | 1.98 (1.37-2.58) | 3.93 (2.98-4.42) |
| Monocitos k | 0.46 (0.33-0.55) | 1.00 (0.84-1.13) |
| Eosinófilos | 0.13 (0.07-0.21) | 0.07 (0.05-0.09) |
| Eosinófilos elevados l | 26 (76.5%) | 0 |
| Basófilos m | 0.03 (0.02-0.05) | 0.08 (0.05-0.10) |
| Índices plaquetarios | ||
| Plaquetas x106/mm3 n | 0.24 (0.20-0.27) | 0.20 (0.19-0.24) |
| Volumen plaquetario medio (VPM) (fL) | 8.90 (8.00-10.20) | 7.70 (7.40-8.10) |
| Bajo VPM o | 9 (26.5%) | 29 (85.3%) |
| Alto VPM o | 6 (17.6%) | 0 |
| Plaquetocrito (%) | 21.95 (18.50-23.90) | 16.30 (13.80-19.00) |
| Plaquetocrito bajo p | 17 (50%) | 21 (61.8%) |
| Plaquetocrito alto p | 8 (23.5%) | 0 |
| Ancho de distribución de plaquetas q | 16.20 (15.90-16.60) | 16.80 (16.50-17.10) |
Se reportan promedios ± desviaciones estándar (DE) de variables con distribución normal, y medianas (rango intercuartílico) de variables con distribución no-normal.
Los valores normales maternos en el tercer trimestre se tomaron de Abbassi-Ghanavati et al 33, y los valores normales en sangre de cordón según Glasser et al 37, a menos que se especifique otra referencia.
a Hemoglobina normal: madres, ≥110 g/L 43; sangre de cordón, ≥116 g/L (niñas) y ≥120 (niños)
b Hematocrito normal: madres, ≥28 y ≤40%; sangre de cordón, ≥37.2% y ≤46.4%
c Volumen corpuscular medio normal: madres, ≥82.4 fL y ≤100.4 fL; sangre de cordón, ≥99 fL (niñas) y ≥98 fL (niños), ≤120 fL (niñas) y ≤119 fL (niños)
d Baja hemoglobina corpuscular media: madres, <29 pg; sangre de cordón, <31.1 (niñas) y <31.0 (niños)
e Baja concentración de hemoglobina corpuscular media: madres, <31.9 g/dL; sangre de cordón, <28.9 g/dL (niñas) y <29.1 g/dL (niños)
f Ancho de distribución eritrocitario-CV elevado: madres, >16.6%; sangre de cordón, >19.5%
g Ancho de distribución eritrocitario-DE elevado: madres, >46 fL; sangre de cordón, >82 fL (niñas) y >81 fL (niños)
h Leucocitos elevados: madres, >16.9 x103/mm3; sangre de cordón, >24.15 (niñas) y >22.9 (niños)
i Neutrófilos elevados: madres, >13.1 x103/mm3; sangre de cordón, >14.90 x103/mm3 (niñas) y >13.5 x103/mm3 (niños)
j Linfocitos elevados: madres, >3.6 x103/mm3; sangre de cordón, >7.36 x103/mm3 (niñas) y > 7.42 x103/mm3 (niños)
k Monocitos elevados: madres, >1.4 x103/mm3; sangre de cordón, >2.91 x103/mm3 (niñas) y >2.88 x103/mm3 (niños)
l Eosinófilos elevados: madres, >0.6 x103/mm3; sangre de cordón >1.00 x103/mm3 (niñas) y >1.20 x103/mm3 (niños)
m Basófilos elevados: madres, >0.1 x103/mm3; sangre de cordón >0.24 x103/mm3 (niñas) y > 0.28 x103/mm3 (niños)
n Conteo plaquetario normal: madres, 146-429 x103/mm3; sangre de cordón, 84 - 288 x103/mm3 (niñas) y 88-280 x103/mm3 (niños)
o Volumen plaquetario medio (VPM) normal: madres, 8.2-10.4 fL; sangre de cordón, 8.5 - 11.1 fL (niñas) y 8.4-11.0 fL (niños)
p Plaquetocrito normal: madres: 0.22-0.24% 36, sangre de cordón, 0.18-0.34% 38.
q Ancho de distribución de plaquetas: madres: 8.3-56.6% 36; sangre de cordón, 14.8-17.6% 38
Tabla 3 Biomarcadores séricos en sangre materna y sangre de cordón
| Suero materno Mediana (RIC) n (%) | Suero de cordón Mediana (RIC) n (%) | |
|---|---|---|
| PCR, mg/L | 15.5 (11.4-18.9) | 0.10 (0.1-0.1) |
| PCR elevada 1 | 29 (85.3%) | 0 |
| Ferritina, µg/L | 19.1 (8.4-40.6) | 101.9 (59.1-121.4) |
| Ferritina baja 2 | 18 (52.9%) | 24 (70.6%) |
| RsTf, mg/L | 3.3 (1.8-5.1) | 6.0 (5.2-10.2) |
| RsTf elevado 3 | 5 (14.7%) | 10 (29.4%) |
| Deficiencia de hierro (ferritina baja o RsTf elevado) | 20 (50.8%) | 27 (79.4%) |
| Vitamina D, nmol/L | 57.6 (48.7-74.7) | 37.8 (26.0-45.5) |
| Vitamina D baja 4 | 10 (29.4%) | 28 (82.3%) |
| Vitamina A, µmol/L | 1.04 (0.8-1.4) | 0.44 (0.38-0.51) |
| Vitamina A baja 5 | 17 (50%) | 34 (100%) |
Se reportan valores de mediana (rango intercuartílico - RIC) para variables continuas y n (%) para frecuencias.
1 PCR elevada: materna, >8.1 mg/L 33; cordón, >0.5 mg/L 34.
2 Ferritina baja: materna, <20 µg/L 35; cordón, <114 µg/L 43.
3 RsTf elevado: materno: >8.3 mg/L (Laboratorios Ramco®) ; cordón, >9.6 mg/L 43.
4 Vitamina D baja: materna y cordón, <50 nmol/L 39,40.
5 Vitamina A baja: materna y cordón, <1.05 µmol/L 41,42.
RIC: rango intercuartílico; PCR: proteína C-reactiva; RsTf: receptor sérico de transferrina
En las madres se observó anemia (23.5%), baja contenido de hemoglobina eritrocitario [bajo volumen de hemoglobina corpuscular en 26.5% y bajo volumen de hemoglobina corpuscular media en 32.3%] y elevado ancho de distribución eritrocitario-desviación estándar (ADE-DE, 44.1%); sin embargo, la mayoría de las mujeres tuvieron glóbulos rojos normocíticos (82.3%). En contraste, sólo una mujer tuvo hematocrito bajo, y el hematocrito se encontró alto en 17.6% (Tabla 2), sugiriendo la presencia de hemoconcentración. El cálculo del volumen plasmático materno indicó que todas a excepción de una mujer tuvieron el volumen plasmático por debajo de 2.8 L, correspondiente al percentil 5 para la edad gestacional. A pesar de la anemia materna, los índices eritrocitarios de cordón se encontraron normales en la mayoría de los casos, con sólo dos niños que presentaron anemia, y todos los recién nacidos tuvieron un volumen sanguíneo dentro de rangos normales (84.8 ± 0.7 mL/kg). Sin embargo, un volumen de hemoglobina corpuscular de cordón bajo (20.6%) y la presencia de hematocrito tanto bajo (14.7%) como alto (14.7%) indicaron que también pudo haber hemoconcentración en sangre de cordón. Es de anotar que un bajo volumen plaquetario medio estuvo presente en la mayoría de los recién nacidos (Tabla 2).
La deficiencia de hierro indicada por ferritina baja o RsTf elevado estuvo presente en 50.8% de las madres y en 79.4% de los recién nacidos (Tabla 3). La deficiencia de vitamina D estuvo presente en 29.4% de las madres y en 82.3% de recién nacidos, y la mitad de las mujeres tuvieron deficiencia de vitamina A, mientras todos los recién nacidos tuvieron vitamina A <1.05 nmol/L.
Con respecto a la inflamación, fue notable que entre los glóbulos blancos, sólo los eosinófilos estuvieron elevados en la mayoría de las mujeres (76.5%). Aunque los eosinófilos en sangre materna y sangre de cordón no estuvieron correlacionados (rs= 0.29, p= 0.085), el número de eosinófilos en sangre de cordón fue significativamente más alto en recién nacidos de madres con eosinofilia [mediana= 0.09, rango intercuartílico (0.05-0.11) ] comparado con mujeres con conteo de eosinófilos normal [0.05 (0.04-0.06) ]. Además, la mayoría de las mujeres tuvieron una PCR elevada usando un punto de corte conservador para el tercer trimestre del embarazo (85.3% >8.1 mg/L) (Tabla 3), pero la PCR en sangre de cordón no estuvo elevada (Tabla 3).
Modelos de regresión polinómica fraccional multivariable para medidas placentarias
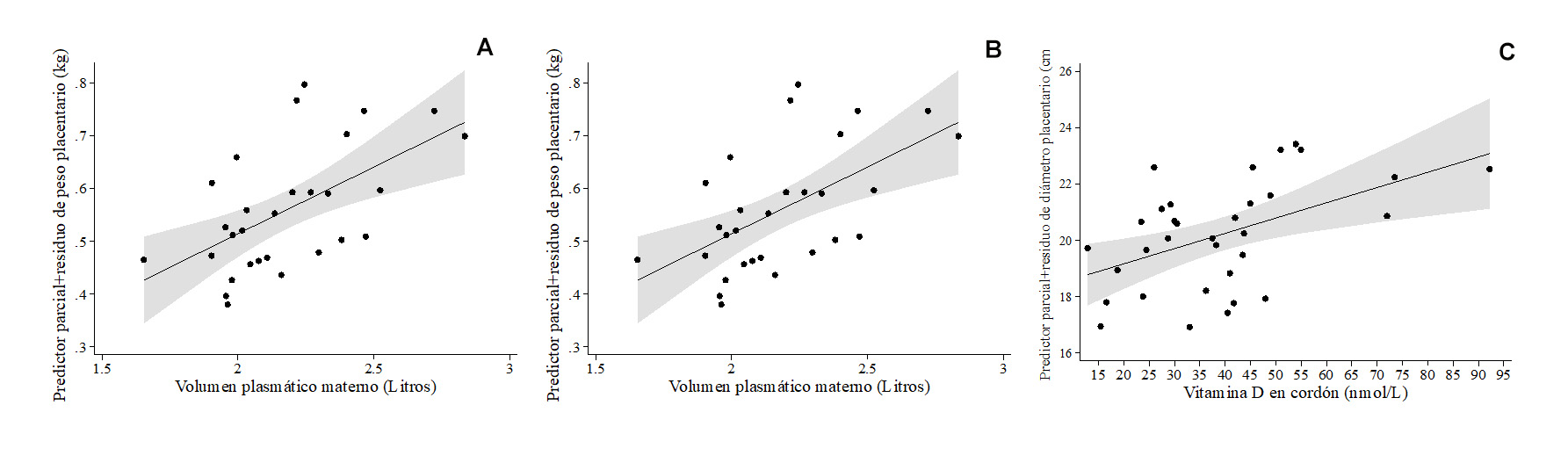
Los modelos de regresión polinómica fraccional multivariable para peso y diámetro placentario se describen en la Tabla 4. El peso placentario se asoció positivamente con el volumen plasmático materno (Tabla 4A , Figura 2A ). Una placenta de mayor diámetro se asoció con un conteo mayor de eosinófilos (Tabla 4B , Figura 2B) y con concentraciones de vitamina D en sangre de cordón más altas (Tabla 4B, Figura 2C).
Tabla 4 Modelos de regresión polinómica fraccional multivariable de medidas placentarias.
| Coef. ± DE | p | 95% IC | β | Modelo general | |
|---|---|---|---|---|---|
| A. Peso placentario, kg 1 | |||||
| t Edad gestacional, sem | -0.006 ± 0.01 | 0.700 | -0.03, 0.04 | 0.06 | R2 ajustado= 0.325 p = 0.006 |
| t Volumen plasmático materno, L | 0.25 ± 0.07 | 0.002 | 0.10, 0.40 | 0.57 | |
| Constante | 0.56 ± 0.02 | <0.0001 | 0.52, 0.60 | ||
| B. Diámetro placentario, cm 2 | |||||
| t Edad gestacional, sem | 0.24 ± 0.26 | 0.372 | -0.30, 0.78 | 0.13 | R2 ajustado= 0.374 p = 0.0008 |
| t Eosinófilos en sangre de cordón x102/mm3* | 0.21 ± 0.07 | 0.005 | 0.07, 0.34 | 0.43 | |
| t Vitamina D en sangre de cordón, nmol/L | 0.05 ± 0.02 | 0.005 | 0.02, 0.09 | 0.43 | |
| Constante | 20.19 ± 0.30 | <0.0001 | 19.58, 20.81 | ||
1 Modelo de peso placentario: factor de inflación de la varianza =1.00, número condicional =102, n=29. Variables que entraron en ≥500 repeticiones de remuestreo (bootstrap), pero que fueron excluidas por el proceso de regresión polinómica fraccional multivariable: razón neutrófilos/linfocitos materna, hemoglobina, hematocrito y ferritina, basófilos en sangre de cordón, volumen corpuscular medio, concentración de hemoglobina corpuscular media y vitamina D.
t = Variable transformada. Ecuaciones utilizadas por el proceso de regresión polinómica fraccional multivariable para la transformación de covariables:
t edad gestacional (sem) = edad gestacional - 39.4137931
t Volumen plasmático materno (L) = Volumen plasmático materno - 2.179750286
2 Modelo de diámetro placentario: factor de inflación de la varianza =1.02, número condicional=1.17, n=33. Variables que entraron en ≥500 repeticiones de remuestreo (bootstrap), pero que fueron excluidas por el proceso de regresión polinómica fraccional multivariable: conteo plaquetario materno, plaquetocrito, hemoglobina, hematocrito, volumen corpuscular medio, vitamina D y ferritina; hemoglobina en sangre de cordón, hematocrito, volumen corpuscular medio, plaquetas y basófilos.
t = Variable transformada. Ecuaciones utilizadas por el proceso de regresión polinómica fraccional multivariable para la transformación de covariables:
t Edad gestacional (sem) = edad gestacional - 39.36363636
t Eosinófilos en cordón x103/mm3= Eosinófilos en cordón - 7.757575786. *Se omitió una observación influyente.
t Vitamina D en cordón, nmol/L = Vitamina D en cordón - 39.06720609
Modelos de regresión de regresión polinómica fraccional multivariable para medidas antropométricas de los recién nacidos
Los pesos de los recién nacidos a término estuvieron dentro de rangos normales. Un menor peso del recién nacido medido en kg se asoció con hematocrito más alto (β= -0.44, no se muestra el modelo), lo cual se confirmó en el modelo de puntaje-z de peso para la edad (Tabla 5A , Figura 3A ), y un puntaje-z de peso para talla más alto se asoció con un diámetro placentario mayor (Tabla 5B , Figura 3B). Mientras que el modelo de regresión polinómica fraccional multivariable para puntaje-z de talla para la edad no mostró covariables significativamente asociadas, una talla mayor (cm) se asoció con un RsTf en sangre de cordón más alto (β= 0.37) y con menor conteo de neutrófilos maternos (β= -0.43), en un modelo que explicó 18.5% de la variabilidad de la talla del bebé (no se muestra el modelo). Dado que los neutrófilos estuvieron dentro de rangos normales en todas las madres, se calculó el punto de corte de neutrófilos maternos para la detección de puntaje-z de peso para talla <-2 en >9.5 x103/mm3. Cuyo se incluyó este punto de corte en el modelo de regresión polinómica fraccional multivariable para talla del recién nacido, los neutrófilos maternos >9.5 x103/mm3 se asociaron con menor talla del recién nacido (Tabla 5C , Figura 4A ), pero los eosinófilos maternos (Tabla 5C , Figura 4B) y una edad materna más avanzada (Tabla 5C ) se asociaron con mayor talla del recién nacido. Finalmente, una circunferencia cefálica (cm) menor se asoció con conteos plaquetarios en sangre de cordón más altos (β= - 0.36) y mayor hematocrito (β= -0.54) (no se muestra el modelo), resultados que fueron reproducidos en el modelo para puntaje-z de circunferencia cefálica para la edad (Tabla 5D , Figuras 5A-5B ).
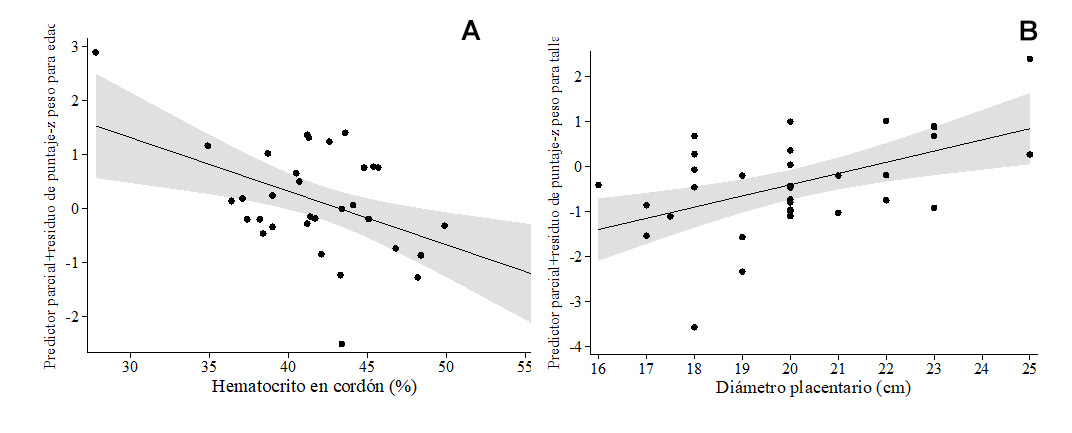
Figura 3 Líneas de regresión polinómica fraccional, ajustando para otras covariables en los respectivos modelos de las asociaciones de (A) Puntaje-z de peso para la edad y hematocrito de cordón, y (B) Puntaje-z de peso para la talla y diámetro placentario.
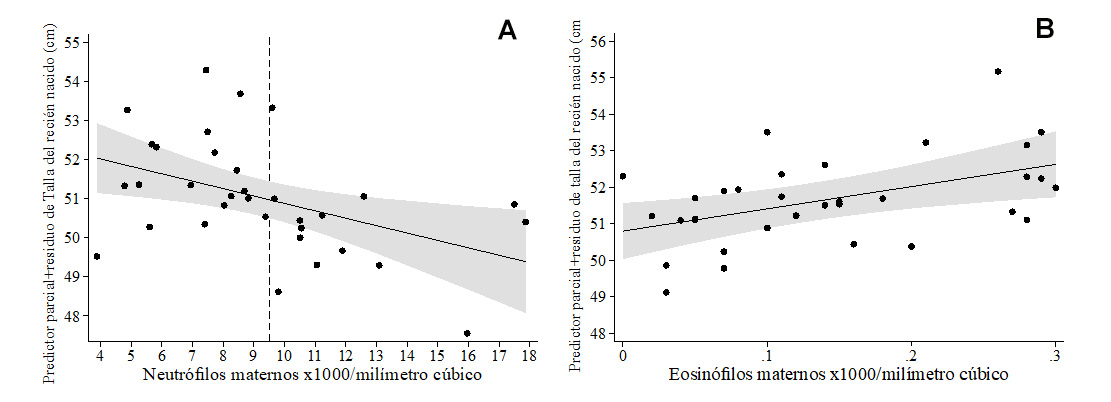
Figura 4 Líneas de regresión polinómica fraccional, ajustando para otras variables, para asociaciones de talla del recién nacido con (A) conteo de neutrófilos maternos (la línea punteada denota el punto de corte de neutrófilos para la identificación de puntaje-z de peso para la talla <-2 DE = 9.5 x103/mm3 en nuestra muestra) y (B) conteo de eosinófilos maternos.
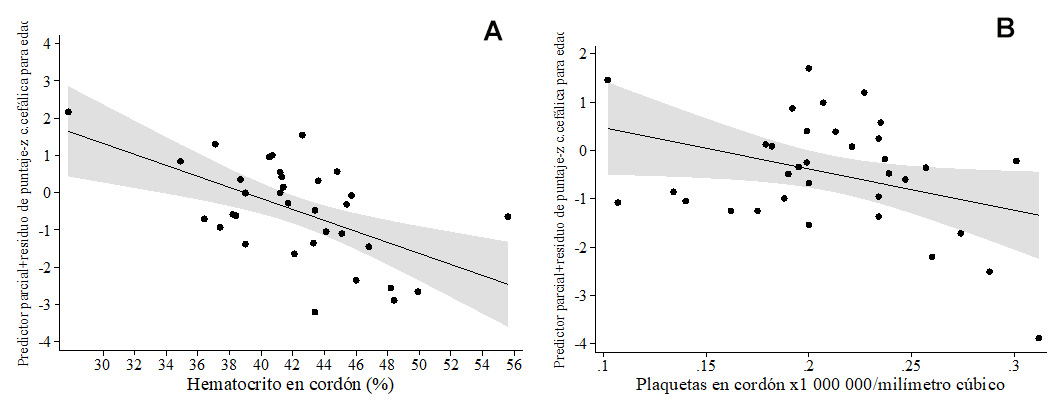
Figura 5 Líneas de regresión polinómica fraccional, ajustando para otras variables, para asociaciones del puntaje-z de circunferencia cefálica para la edad con (A) hematocrito de cordón y (B) conteo plaquetario de cordón.
Table 5 Modelos de regresión polinómica fraccional multivariable de medidas antropométricas del recién nacido.
| Coef. ± DE | p | 95% CI | β | Modelo general | |
|---|---|---|---|---|---|
| A. Puntaje-z de peso para la edad 1 | |||||
| t nodulos Placentarios (0=ninguno, 1= puntiforme, 2=plaquetas) | 0.40 ± 0.21 | 0.061 | -0.02, 0.83 | 0.31 | R2 ajustado = 0.269 p = 0.0091 |
| t Hematocrito de cordón (%) | -0.10 ± 0.03 | 0.005 | -0.17, -0.03 | -0.48 | |
| Constante | 0.11 ± 0.16 | 0.471 | -0.21, 0.44 | ||
| B. Puntaje-z de peso para la talla 2 | |||||
| t Diámetro placentario (cm) | 0.25 ± 0.07 | 0.002 | 0.09, 0.40 | 0.51 | R2 ajustado =0.237 p = 0.0024 |
| Constante | -0.37 ± 0.17 | 0.035 | -0.71, -0.03 | ||
| C. Talla al nacer (cm) 3 | |||||
| t edad gestacional, semanas | -0.19 ± 0.20 | 0.349 | -0.61, 0.22 | -0.15 | R2 ajustado = 0.435 p = 0.0004 |
| t Edad materna, años | 0.10 ± 0.04 | 0.010 | 0.03, 0.18 | 0.41 | |
| neutrófilos Maternos >9.5 x103/mm3 | -1.51 ± 0.42 | 0.001 | -2.36, -0.65 | -0.50 | |
| t Conteo de eosinófilos maternos x103/mm3 | 6.10 ± 2.21 | 0.010 | 1.57, 10.63 | 0.38 | |
| Constante | 51.66 ± 0.27 | <0.0001 | 51.11, 52.21 | ||
| D. Puntaje-z de circunferencia cefálica para la edad 4 | |||||
| Cord platelet count x106/mm3 | -8.56 ± 4.13 | 0.047 | -16.98, -0.13 | -0.32 | R2 ajustado = 0.270 p = 0.0029 |
| Hematocrito de cordón (%) | -0.15 ± 0.04 | 0.001 | -0.23, -0.06 | -0.56 | |
| Constante | -0.47 ± 0.19 | 0.019 | -0.86, -0.08 | ||
1 Puntaje-z de peso para la edad: factor de inflación de la varianza: 1.04, número condicional: 1.22, n = 33. Variables que entraron en ≥500 repeticiones de remuestreo (bootstrap), pero que fueron excluidas por el proceso de regresión polinómica fraccional multivariable: diámetro placentario; edad materna, paridad, presión arterial sistólica, neutrófilos y monocitos; en sangre de codón: monocitos, eosinófilos*, concentración de hemoglobina corpuscular media y vitamina D.
t = Variable transformada. Ecuaciones utilizadas por el proceso de regresión polinómica fraccional multivariable para la transformación de covariables: Nódulos placentarios (0=ninguno, 1=puntiforme, 2=placas)= nódulos placentarios -1
Hematocrito de cordón (%)= Hematocrito de cordón - 42.03939415
2 Puntaje-z de peso para la talla: n = 33. Variables que entraron en ≥500 repeticiones de remuestreo (bootstrap), pero que fueron excluidas por el proceso de regresión polinómica fraccional multivariable: edad materna, paridad, razón de neutrófilos/linfocitos materna, monocitos y concentración de hemoglobina corpuscular media; en sangre de cordón: plaquetas, basófilos, hematocrito, volumen corpuscular medio y concentración de hemoglobina corpuscular media.
t = Variable transformada. Ecuaciones utilizadas por el proceso de regresión polinómica fraccional multivariable para la transformación de covariables:
t Diámetro placentario (cm) = diámetro placentario- 20.13636364
3 Talla del recién nacido: factor de inflación de la varianza: 1.18, número condicional: 2.33, n = 33. Variables que entraron en ≥500 repeticiones de remuestreo (bootstrap), pero que fueron excluidas por el proceso de regresión polinómica fraccional multivariable: sexo del recién nacido, razón de neutrófilos/linfocitos materna y volumen corpuscular medio; en sangre de cordón: hemoglobina, hematocrito y volumen corpuscular medio.
t = Variable transformada. Ecuaciones utilizadas por el proceso de regresión polinómica fraccional multivariable para la transformación de covariables:
Edad gestacional (sem) = edad gestacional - 39.42424242
Edad materna (años) = Edad materna - 23.78787879
Conteo de eosinófilos maternos = Eosinófilos maternos - 0.1418181821
4 Puntaje-z de circunferencia cefálica para la edad: factor de inflación de la varianza: 1.09, número condicional: 1.34, n= 34. Variables que entraron en ≥500 repeticiones de remuestreo (bootstrap), pero que fueron excluidas por el proceso de regresión polinómica fraccional multivariable: diámetro placentario, maternal monocitos, hemoglobina corpuscular media y ancho de distribución eritrocitario-CV.
t = Variable transformada. Ecuaciones utilizadas por el proceso de regresión polinómica fraccional multivariable para la transformación de covariables:
t Conteo plaquetario en cordón x106/mm3 = Plaquetas en cordón - 0.210705881
t Hematocrito de cordón (%)= Hematocrito de cordón - 42.15588255
* Se omitió una observación influyente
Discusión
Las mujeres de comunidades indígenas están entre las poblaciones más vulnerables, y nuestra cohorte aporta evidencia de factores asociados con la salud materna y del recién nacido en la comunidad Ngäbe-Buglé. En un contexto de partos a término no complicados, reportamos inflamación y eosinofilia maternas, así como deficiencias de hierro, vitaminas A y D en la madre y el recién nacido. También reportamos la presencia de riesgo de hipertensión materna evidenciado por una presión arterial media elevada y la presencia PP baja. Los hematocritos elevados y los bajos volúmenes plasmáticos mostraron una expansión plasmática inapropiada durante el embarazo, lo cual pudo haber comprometido la perfusión placentaria y fetal. Nuestros hallazgos de bajo peso placentario para la edad gestacional en 35.3%, y de recién nacidos con bajas circunferencias cefálicas en 17.6% alertan la presencia de resultados de salud adversos del embarazo desapercibidos. Nuestros datos mostraron que indicadores de hemoconcentración tanto materna como neonatal se asociaron con menor peso placentario (menor volumen plasmático materno), y menor peso y circunferencia cefálica del recién nacido (mayor hematocrito en sangre de cordón), dejando al descubierto que la hemoconcentración es un factor de riesgo para resultados adversos del embarazo, que está siendo pasado por alto en esta comunidad indígena. Además, biomarcadores de inflamación materna (mayor número de neutrófilos) y neonatal (mayor conteo plaquetario), se asociaron con menor talla y circunferencia cefálica al nacimiento, respectivamente. En contraste, dos factores conocidos como inmuno-moduladores, la vitamina D y eosinófilos fetales más altos, se asociaron positivamente con el diámetro placentario. Finalmente, un conteo de neutrófilos materno superior a 9.5 x103/mm3 se asoció con menor talla del recién nacido, pero un conteo de eosinófilos materno mayor se asoció con mayor talla neonatal. Nuestro estudio muestra que medidas biométricas y hematológicas simples de rutina pueden ayudar a identificar recién nacidos que requieren seguimiento clínico.
Factores asociados con medidas placentarias
Los resultados adversos del embarazo tienen como mecanismo común la insuficiencia placentaria, la cual coloca al feto en condiciones de alto riesgo de hipoxia y malnutrición, no sólo en el caso de pequeño para la edad gestacional, sino también en fetos clasificados como de adecuados o grandes para la edad gestacional, donde pueden ocurrir una insuficiencia placentaria y un retardo intrauterino ‘enmascarados’ 52. En estudios que usaron el método modificado de azul de Evan para medir el volumen plasmático en mujeres latinoamericanas, un menor volumen plasmático se asoció no sólo con menor peso placentario sino también con menor peso al nacer 53,54. Además, se ha demostrado experimentalmente que el peso placentario fue menor en ratas con menor volumen plasmático comparado con controles 55,56, por lo tanto, los autores sugirieron que el bajo volumen plasmático conduce a una disminución del área de superficie de intercambio entre la madre y el feto produciendo retardo del crecimiento intrauterino (RCIU) 56. Estos estudios apoyan nuestros hallazgos de un menor peso placentario asociado con menor volumen plasmático materno, y la asociación de un menor puntaje-z de peso para talla con un menor diámetro placentario. Dada la alta prevalencia de placenta de bajo peso para la edad gestacional y la posibilidad de hemoconcentración, nuestros hallazgos apoyan la evidencia existente sobre la importancia de la expansión del volumen plasmático durante el embarazo para obtener resultados de salud placentarios y del recién nacido normales 53.
También encontramos que la vitamina D en sangre de cordón se asoció positivamente con un mayor diámetro placentario. Un estudio en Dinamarca encontró que la vitamina D en sangre de cordón en concentraciones >60 nmol/L se asoció con pesos placentarios mayores 57. En nuestro estudio, sólo tres participantes tuvieron vitamina D en sangre de cordón >60 nmol/L, y aún así, mayores concentraciones de vitamina D se asociaron con mayor peso placentario. En contraste, una cohorte de embarazadas en los Estados Unidos reportó que la vitamina D materna se asoció con mayor peso y circunferencia cefálica del recién nacido, pero no con peso placentario 58. Sin embargo, un estudio hindú mostró que una 25(OH)D en sangre de cordón insuficiente aumentó la inflamación placentaria en recién nacidos pretérmino 59. Los autores sugirieron que en su estudio, una disminución de la expresión del receptor de vitamina D y del péptido antimicrobiano catelicidina en las placentas de recién nacidos pretérmino, pudieron haber contribuido a la inflamación placentaria 59.
Sabemos que en la población de estudio había inflamación materna, ya que las concentraciones de PCR al momento del parto fueron mayores que las reportadas en otros estudios 60-62, pero la PCR no mostró asociaciones significativas con ninguno de las medidas placentarias o del recién nacido. Sin embargo, otros marcadores alternativos de inflamación, tales como los neutrófilos y eosinófilos maternos, así como las plaquetas en sangre de cordón, se asociaron con resultados de salud perinatales. Los eosinófilos de cordón mostraron estar asociados con un diámetro placentario mayor, y los eosinófilos maternos con una mayor talla al nacer. Los eosinófilos se conocen por provocar una respuesta de linfocitos T-ayudadores (Th)-2 luego de infecciones por nemátodos intestinales 63, y se ha demostrado previamente en ratones que la infección por un nematodo intestinal se asoció con una masa placentaria mayor 64. Es de anotar que nosotros describimos previamente una alta prevalencia de infecciones por nemátodos 23 y reportamos que el nematodo Ascaris se asoció con una menor inflamación medida usando PCR, en la misma población de embarazadas indígenas Ngäbe-Buglé 24, sugiriendo que las infecciones maternas por nemátodos pueden también influenciar la respuesta inflamatoria fetal, favoreciendo el crecimiento placentario y del recién nacido en esta población.
Nuestros hallazgos también sugieren que la inflamación puede estar contribuyendo a un menor peso placentario, mientras que un mejor estado de la vitamina D en el recién nacido, pudiera modular el efecto de la inflamación en las medidas placentarias, lo cual está de acuerdo con evidencia experimental reciente donde la deficiencia de vitamina D disminuyó el peso y diámetro placentarios, reguló negativamente los transportadores de nutrientes placentarios y produjo insuficiencia de la placentaria al inducir su inflamación 65.
Factores asociados con la antropometría del recién nacido
Fue interesante observar que, a pesar del rango de factores de riesgo maternos, los recién nacidos tuvieron pesos normales. Sin embargo, se observó una asociación significativa ente un mayor hematocrito y un menor peso al nacer. También, un hematocrito y conteos plaquetarios más altos en sangre de cordón se asociaron con menor circunferencia cefálica. Otros han descrito que la hemoglobina materna ≥110 g/L se asoció con recién nacidos más pequeños 66, y en embarazos con anormalidad en el índice de pulsatilidad de la arteria umbilical, un indicador de flujo útero-placentario alterado, se encontró un mayor hematocrito en sangre de cordón antes o durante el trabajo de parto 67. Sin embargo, no se encuentran estudios que se enfoquen en asociaciones entre hematocrito en sangre de cordón y antropometría del recién nacido. En recién nacidos pequeños para la edad gestacional se han descrito una hemoglobina neonatal más alta pero conteos plaquetarios menores, comparados con recién nacidos adecuados para la edad gestacional 68. Además, se ha descrito una asociación negativa entre el conteo plaquetario y el hematocrito en recién nacidos con policitemia (hematocrito >65%), en quienes un menor número de plaquetas se asoció con recién nacidos pequeños para la edad gestacional 69. Estas observaciones están de acuerdo con nuestros hallazgos de un hematocrito en sangre de cordón más alto asociado con menor peso al nacer y circunferencia cefálica, pero contrasta con la asociación de mayor conteo de plaquetas en sangre de cordón y menor circunferencia cefálica. Existe evidencia de que durante procesos inflamatorios en el embarazo se desarrolla un aumento en la producción y activación plaquetarias, llevando a un consumo de plaquetas y a un estado pro-coagulante que impacta en la microcirculación placentaria produciendo insuficiencia 70. También, hemos mostrado previamente que un plaquetocrito mayor se asoció con una PCR más alta en mujeres embarazadas y lactantes Ngäbe 24. Estos hallazgos apoyan nuestra asociación de un peso placentario menor y mayores conteos plaquetarios con menor peso al nacer.
Se sabe que el conteo plaquetario está aumentado (>450 x106/mm3) durante infecciones neonatales 71. En el presente estudio, aunque las plaquetas estuvieron dentro de rangos normales, la mayoría de recién nacidos tuvo bajo plaquetocrito y bajo volumen plaquetario. Se ha descrito que la combinación de volumen plaquetario medio y plaquetocrito bajos con un número de plaquetas alto es sugestiva de trombocitosis reactiva, usualmente secundaria a infección 72. Entonces, nuestros hallazgos de un alto número de plaquetas con menores puntajes-z de peso para la edad y de circunferencia cefálica para la edad pueden ser atribuidos a inflamación.
Nuestro hallazgo de un mayor número de neutrófilos maternos asociados con menor talla del recién nacido, continúa apoyando el posible rol de la inflamación en los resultados de salud del recién nacido. La literatura reciente ha resaltado que no solo la nutrición sino también otros factores endocrinos y de inflamación tienen un rol en la etiología del retardo del crecimiento 73, particularmente en contextos en vía de desarrollo, donde el retardo del crecimiento relacionado con la inflamación comienza in-utero74. En una población indígena en Guatemala se ha reportado la asociación de la inflamación materna subclínica con el retardo en el crecimiento de bebés lactantes 75, lo cual resalta la necesidad de revisar los puntos de corte para la detección de inflamación subclínica en comunidades vulnerables.
Fortalezas y limitaciones
La inclusión de mujeres al momento del parto como sujeto de investigación es difícil en contextos remotos donde la mayoría de las mujeres tienen un parto domiciliario. En el presente estudio exploratorio pudimos superar esta limitación, ya que las mujeres en su último mes de embarazo fueron acogidas en un albergue administrado por la iglesia, cerca del hospital regional en San Félix. Basados en la información dada por el Ministerio de Salud, determinamos que se reclutó el 65% de los partos esperados en la Comarca para el periodo de un mes entre noviembre y diciembre de 2010. A pesar del muestreo por conveniencia y del tamaño de muestra pequeño, la aplicación de técnicas estadísticas de remuestreo (‘bootstrap’) revelaron que el tamaño de muestra fue suficientemente robusto para realizar un análisis exploratorio y para identificar biomarcadores que pudieran ser usados en la detección mujeres a riesgo para resultados adversos del embarazo. Ya que más del 50% de partos son domiciliarios, es posible que las embarazadas que lograron ser atendidas en el hospital hayan sido aquellas con mayor apoyo familiar/social y con viviendas lo suficientemente cercanas a la ciudad y por tanto con menor riesgo de resultados adversos del embarazo. Entonces, la prevalencia reportada de 6.7% de bajo peso al nacer en 2010 en esta población indígena, pudo subestimar posibles resultados adversos del embarazo en aquellas mujeres que no tuvieron acceso a un parto institucional.
Otra limitación fue la falta de un servicio de patología al momento del estudio y por lo tanto no pudimos obtener un diagnóstico histológico de los nódulos placentarios. También debido a la falta de estándares internacionales para pesos placentarios, usamos una curva de percentiles de pesos placentarios derivados de una población norteamericana, donde el cordón y las membranas fueron removidas antes del pesaje, lo cual no fue hecho en nuestro estudio.
Conclusión
En comunidades indígenas con alta prevalencia de múltiples infecciones, deficiencias nutricionales e inflamación, y con acceso únicamente a laboratorios de rutina, existen limitaciones para la evaluación de la salud materno-infantil. Nuestros resultados revelaron que, en comunidades alejadas, un hematocrito elevado puede ser un biomarcador útil de madres a riesgo de hipo-perfusión placentaria y de un bajo crecimiento in-utero. También encontramos que a pesar de que pesos al nacer fueron normales, los recién nacidos tenían deficiencias en micronutrientes, las cuales requerían un seguimiento clínico post-natal cercano por ser factores de riesgo para inadecuados crecimiento y desarrollo. En conjunto, estos hallazgos evidencian que algunos exámenes de laboratorio de rutina, hasta ahora sub-utilizados, pudieran ser útiles para la evaluación de la salud materno-infantil en contextos de trabajo clínico de campo. Finalmente, nuestros hallazgos indican que un consumo más alto de vitamina D pudiera mejorar el crecimiento placentario y, de ser confirmado, debería ser recomendado y apoyado por parte de las instituciones de salud locales.
Agradecimientos
Los investigadores quieren agradecer al personal médico y de enfermería del Hospital General del Oriente Chiricano y a la Fundación Nuestra Señora del Camino, que coordina el albergue para embarazadas en San Félix, Panamá, por facilitar la captación de participantes y la recolección de los datos. La asistente de laboratorio Adelith Barría ayudó con la toma de muestras de sangre materna y de cordón, así como con la toma de las medidas placentarias. Agradecimientos especiales a las embarazadas indígenas que participaron en el estudio. Muchas gracias a la Dra. Constanza Hege por su apoyo en la traducción del artículo al español.
REFERENCIAS
1. Hoover E, Cook K, Plain R, Sanchez K, Waghiyi V, Miller P, et al. Indigenous peoples of North America: environmental exposures and reproductive justice. Environmental Health Perspectives. 2012;120(12):1645-9. DOI: 10.1289/ehp.1205422. [ Links ]
2. Wurtz H. Indigenous Women of Latin America: Unintended pregnancy, unsafe abortion, and reproductive health outcomes. Pimatisiwin. 2012;10(3):271-82. PMID: 23772229. [ Links ]
3. Anderson I, Robson B, Connolly M, Al-Yaman F, Bjertness E, King A, et al. Indigenous and tribal peoples' health (The Lancet-Lowitja Institute Global Collaboration): a population study. Lancet. 2016; 388(10040):131-57. DOI: 10.1016/S0140-6736(16)00345-7. [ Links ]
4. Sheppard AJ, Shapiro GD, Bushnik T, Wilkins R, Perry S, Kaufman JS, et al. Birth outcomes among First Nations, Inuit and Metis populations. Health Rep. 2017; 28(11):11-6. [ Links ]
5. Simonet F, Wilkins R, Luo ZC. Temporal trends in Inuit, First Nations and non-Aboriginal birth outcomes in rural and northern Quebec. Int J Circumpolar Health. 2012;71. DOI: 10.3402/ijch.v71i0.18791. [ Links ]
6. Luo ZC, Wilkins R. Degree of rural isolation and birth outcomes. Paediatr Perinat Epidemiol. 2008; 22(4):341-9. DOI: 10.1111/j.1365-3016.2008.00938.x. [ Links ]
7. O´Brien CM, Arbuckle S, Thomas S, Rode J, Turner R, Jeffery HE. Placental inflammation is associated with rural and remote residence in the Northern Territory, Australia: a cross-sectional study. BMC Pregnancy Childbirth. 2015; 15:32. DOI: 10.1186/s12884-015-0458-7. [ Links ]
8. Morgan HG. Placental malaria and low birthweight neonates in urban Sierra Leone. Ann Trop Med Parasitol. 1994; 88(6):575-80. DOI: 10.1080/00034983.1994.11812907. [ Links ]
9. Moffatt ME. Current status of nutritional deficiencies in Canadian aboriginal people. Can J Physiol Pharmacol. 1995; 73(6):754-8. DOI: 10.1139/y95-100. [ Links ]
10. Godel JC, Basu TK, Pabst HF, Hodges RS, Hodges PE, Ng ML. Perinatal vitamin A (retinol) status of northern Canadian mothers and their infants. Biol Neonate. 1996;69(3):133-9. DOI: 10.1159/000244288. [ Links ]
11. Dallaire F, Dewailly E, Shademani R, Laliberte C, Bruneau S, Rhainds M, et al. Vitamin A concentration in umbilical cord blood of infants from three separate regions of the province of Quebec (Canada). Can J Public Health. 2003; 94(5):386-90. DOI: 10.1007/BF03403568 [ Links ]
12. Rosique G J, Restrepo C MT, Manjarrés C LM, Gálvez A A, Santa M J. Estado nutricional y hábitos alimentarios en indígenas Embera de Colombia. Rev Chil Nutr. 2010;37:270-80. Doi: 10.4067/S0717-75182010000300002. [ Links ]
13. Mokdad AH, Colson KE, Zuniga-Brenes P, Rios-Zertuche D, Palmisano EB, Alfaro-Porras E, et al. Salud Mesoamerica 2015 Initiative: design, implementation, and baseline findings. Popul Health Metr. 2015;13(1):3. DOI: 10.1186/s12963-015-0034-4. [ Links ]
14. Egeland GM, Johnson-Down L, Cao ZR, Sheikh N, Weiler H. Food insecurity and nutrition transition combine to affect nutrient intakes in Canadian arctic communities. J Nutr. 2011; 141(9):1746-53. DOI: 10.3945/jn.111.139006. [ Links ]
15. Grant CC, Wall CR, Yates R, Crengle S. Nutrition and indigenous health in New Zealand. J Paediatr Child Health. 2010; 46(9):479-82. DOI: 10.1111/j.1440-1754.2010.01842.x. [ Links ]
16. Longvah T, Khutsoh B, Meshram II, Krishna S, Kodali V, Roy P, et al. Mother and child nutrition among the Chakhesang tribe in the state of Nagaland, North-East India. Matern Child Nutr. 2017; 13 (Suppl 3): e12558. DOI: 10.1111/mcn.12558. [ Links ]
17. Hirschler V, Molinari C, Maccallini G, Intersimone P, Gonzalez CD. Vitamin D levels and cardiometabolic markers in indigenous Argentinean children living at different altitudes. Glob Pediatr Health. 2019;6: 2333794x18821942. DOI: 10.1177/2333794x18821942. [ Links ]
18. Mansuri S, Badawi A, Kayaniyil S, Cole DE, Harris SB, Mamakeesick M, et al. Traditional foods and 25(OH)D concentrations in a subarctic First Nations community. Int J Circumpolar Health. 2016;75(1): 31956. DOI: 10.3402/ijch.v75.31956. [ Links ]
19. Black RE, Victora CG, Walker SP, Bhutta ZA, Christian P, de Onis M, et al. Maternal and child undernutrition and overweight in low-income and middle-income countries. Lancet. 2013;382(9890):427-51. DOI: 10.1016/s0140-6736(13)60937-x. [ Links ]
20. Gernand AD, Schulze KJ, Stewart CP, West Jr KP, Christian P. Micronutrient deficiencies in pregnancy worldwide: health effects and prevention. Nat Rev Endocrinol. 2016;12(5):274-89. DOI: 10.1038/nrendo.2016.37. [ Links ]
21. Rees WD. Interactions between nutrients in the maternal diet and the implications for the long-term health of the offspring. Proc Nutr Soc. 2019;78(1): 88-96. DOI: 10.1017/s0029665118002537. [ Links ]
22. Oh C, Keats EC, Bhutta ZA. Vitamin and mineral supplementation during pregnancy on maternal, birth, child health and development outcomes in low- and middle-income countries: a systematic review and meta-analysis. Nutrients. 2020;12(2):491. DOI: 10.3390/nu12020491. [ Links ]
23. Gonzalez-Fernandez D, Koski KG, Sinisterra OT, Del Carmen Pons E, Murillo E, Scott ME. Interactions among urogenital, intestinal, skin, and oral infections in pregnant and lactating Panamanian Ngabe women: a neglected public health challenge. Am J Trop Med Hyg. 2015;92(6):1100-10. DOI: 10.4269/ajtmh.14-0547. [ Links ]
24. Gonzalez-Fernandez D, Pons EDC, Rueda D, Sinisterra OT, Murillo E, Scott ME, et al. C-reactive protein is differentially modulated by co-existing infections, vitamin deficiencies and maternal factors in pregnant and lactating indigenous Panamanian women. Infect Dis Poverty. 2017;6(1):94. DOI: 10.1186/s40249-017-0307-1. [ Links ]
25. González-Fernández D, Pons EdC, Rueda D, Sinisterra OT, Murillo E, Scott ME, et al. Identification of high-risk pregnancies in a remote setting using ambulatory blood pressure: the MINDI Cohort. Front Public Health. 2020;8:86. DOI: 10.3389/fpubh.2020.00086. [ Links ]
26. Malik AY, Foster C. The revised Declaration of Helsinki: cosmetic or real change? J R Soc Med. 2016;109(5):184-9. DOI: 10.1177/0141076816643332. [ Links ]
27. Ministerio de Salud. Boletin estadístico 2010. Republica de Panama: Ministerio de Salud; 2011. Available from: https://www.google.com/url?sa=t&rct=j&q=&esrc=s&source=web&cd=1&ved=2ahUKEwi2ju2s3rDoAhX4g3IEHXIiBZsQFjAAegQIAhAB&url=http%3A%2F%2Fwww.minsa.gob.pa%2Fsites%2Fdefault%2Ffiles%2Fpublicacion-general%2Fanuario2010.pdf&usg=AOvVaw0Zs6zTNvI_3LG8Drrhaoma [ Links ]
28. Klabunde RE. Vascular Function. In: Taylor C, ed. Cardiovascular Physiology Concepts. Second ed. Philadelphia: Wolters Kluwer, Lippincott Williams & Wilkins, 2012:97-8. [ Links ]
29. Ayala DE, Hermida RC. Ambulatory blood pressure monitoring for the early identification of hypertension in pregnancy. Chronobiol Int. 2013; 30(1-2):233-59. DOI: 10.3109/07420528.2012.714687. [ Links ]
30. WHEC (Women's Health and Education Center). Obstetrics: Normal values in pregnancy; 2009; Available from: http://www.womenshealthsection.com/content/obs/obs025.php3 [ Links ]
31. Almog B, Shehata F, Aljabri S, Levin I, Shalom-Paz E, Shrim A. Placenta weight percentile curves for singleton and twins deliveries. Placenta. 2011; 32(1):58-62. DOI: 10.1016/j.placenta.2010.10.008. [ Links ]
32. Villar J, Cheikh Ismail L, Victora CG, Ohuma EO, Bertino E, Altman DG, et al. International standards for newborn weight, length, and head circumference by gestational age and sex: the Newborn Cross-Sectional Study of the INTERGROWTH-21st Project. Lancet. 2014; 384(9946):857-68. DOI: 10.1016/s0140-6736(14)60932-6. [ Links ]
33. WHO, CDC. Health Topics: Nutrition. Assessing the Iron Status of Populations; 2007. Available from: http://apps.who.int/iris/bitstream/handle/10665/75368/9789241596107_eng.pdf;jsessionid=B493BDCDB88C77151E5B3155A7EF1F39?sequence=1. [ Links ]
34. Abbassi-Ghanavati M, Greer LG, Cunningham FG. Pregnancy and laboratory studies: a reference table for clinicians. Obstet Gynecol. 2009;114(6):1326-31. DOI: 10.1097/AOG.0b013e3181c2bde8. [ Links ]
35. Budak YU, Polat M, Huysal K. The use of platelet indices, plateletcrit, mean platelet volume and platelet distribution width in emergency non-traumatic abdominal surgery: a systematic review. Biochem Med (Zagreb). 2016;26(2):178-93. DOI: 10.11613/bm.2016.020. [ Links ]
36. Glasser L, Sutton N, Schmeling M, Machan JT. A comprehensive study of umbilical cord blood cell developmental changes and reference ranges by gestation, gender and mode of delivery. J Perinatol. 2015;35(7):469-75. DOI: 10.1038/jp.2014.241. [ Links ]
37. Basu S, Kumar N, Srivastava R, Kumar A. Effect of severe maternal iron deficiency anemia on neonatal platelet indices. Indian J Pediatr. 2015;82(12):1091-6. DOI: 10.1007/s12098-015-1775-6. [ Links ]
38. Hay G, Refsum H, Whitelaw A, Melbye EL, Haug E, Borch-Iohnsen B. Predictors of serum ferritin and serum soluble transferrin receptor in newborns and their associations with iron status during the first 2 y of life. Am J Clin Nutr. 2007;86(1):64-73. DOI: 10.1093/ajcn/86.1.64. [ Links ]
39. Kitano T, Takagi K, Arai I, Yasuhara H, Ebisu R, Ohgitani A, et al. Elevated C-reactive protein in umbilical cord blood: Neonatal case review. Pediatr Int. 2019;61(6):583-6. DOI: 10.1111/ped.13866. [ Links ]
40. Manusevich WE, Bar-El Dadon S, Reifen R. The vicious cycle of vitamin A deficiency: A review. Crit Rev Food Sci Nutr. 2017; 57:17: 3703-3714. DOI: 10.1080/10408398.2016.1160362 [ Links ]
41. McCauley ME, van den Broek N, Dou L, Othman M. Vitamin A supplementation during pregnancy for maternal and newborn outcomes. Cochrane Database Syst Rev. 2015(10):CD008666. DOI: 10.1002/14651858.CD008666.pub3. [ Links ]
42. Balvers MG, Brouwer-Brolsma EM, Endenburg S, de Groot LC, Kok FJ, Gunnewiek JK. Recommended intakes of vitamin D to optimize health, associated circulating 25-hydroxyvitamin D concentrations, and dosing regimens to treat deficiency: workshop report and overview of current literature. J Nutr Sci. 2015;4:e23. DOI: 10.1017/jns.2015.10. [ Links ]
43. Ariyawatkul K, Lersbuasin P. Prevalence of vitamin D deficiency in cord blood of newborns and the association with maternal vitamin D status. Eur J Pediatr. 2018; 177(10):1541-5. DOI: 10.1007/s00431-018-3210-2. [ Links ]
44. Hauser RG, Kwon RJ, Ryder A, Cheng C, Charifa A, Tormey C. Transfusion medicine equations made internet accessible. Transfus Med Rev. 2020; 34(1):5-9. DOI: 10.1016/j.tmrv.2019.10.003. [ Links ]
45. Colavita D, Kim HC, Friedman DF. The sex parameter in estimation of total blood volume for pediatric erythrocytapheresis. J Clin Apher. 2019;34(6):692-9. DOI: 10.1002/jca.21748. [ Links ]
46. Nagano K, Kusaka T, Okubo K, Yasuda S, Okada H, Namba M, et al. Estimation of circulating blood volume in infants using the pulse dye densitometry method. Paediatr Anaesth. 2005;15(2):125-30. DOI: 10.1111/j.1460-9592.2005.01406.x. [ Links ]
47. Stleglitz E, Huang J. Plasmapheresis Technique; 2018. Available from: https://emedicine.medscape.com/article/1895577-technique [ Links ]
48. de Haas S, Ghossein-Doha C, van Kuijk SM, van Drongelen J, Spaanderman ME. Physiological adaptation of maternal plasma volume during pregnancy: a systematic review and meta-analysis. Ultrasound Obstet Gynecol. 2017;49(2):177-87. DOI: 10.1002/uog.17360. [ Links ]
49. Mannan H. A Practical application of a simple bootstrapping method for assessing predictors selected for epidemiologic risk models using automated variable selection. Int J Stat Appl. 2017; 7(5): 239-49. DOI: 10.5923/j.statistics.20170705.01. [ Links ]
50. Royston P, Sauerbrei W. Multivariable model-building: a pragmatic approach to regression analysis based on fractional polynomials for modelling continuous variables. Chichester, England: John Wiley; 2008. [ Links ]
51. Liu X. Classification accuracy and cut point selection. Stat Med. 2012; 31(23):2676-86. DOI: 10.1002/sim.4509. [ Links ]
52. Salavati N, Smies M, Ganzevoort W, Charles AK, Erwich JJ, Plösch T, et al. The possible role of placental morphometry in the detection of fetal growth restriction. Front Physiol. 2019; 9:1884. DOI: 10.3389/fphys.2018.01884. [ Links ]
53. Salas SP, Rosso P, Espinoza R, Robert JA, Valdes G, Donoso E. Maternal plasma volume expansion and hormonal changes in women with idiopathic fetal growth retardation. Obstet Gynecol. 1993;81(6):1029-33. [ Links ]
54. Salas SP, Rosso P. Disminución del volumen plasmático y cambios en hormonas vasoactivas en embarazadas de bajo peso. Rev Med Chil. 1998;126(5):504-10. [ Links ]
55. Roy-Clavel E, Picard S, St-Louis J, Brochu M. Induction of intrauterine growth restriction with a low-sodium diet fed to pregnant rats. Am J Obstet Gynecol. 1999; 180(3 Pt 1):608-13. DOI: 10.1016/s0002-9378(99)70262-0. [ Links ]
56. Bibeau K, Sicotte B, Béland M, Bhat M, Gaboury L, Couture R, et al. Placental underperfusion in a rat model of intrauterine growth restriction induced by a reduced plasma volume expansion. PLoS One. 2016;11(1):e0145982-e. DOI: 10.1371/journal.pone.0145982. [ Links ]
57. Lykkedegn S, Beck-Nielsen SS, Sorensen GL, Andersen LB, Fruekilde PBN, Nielsen J, et al. Vitamin D supplementation, cord 25-hydroxyvitamin D and birth weight: Findings from the Odense Child Cohort. Clin Nutr. 2017; 36(6):1621-7. DOI: 10.1016/j.clnu.2016.10.008. [ Links ]
58. Gernand AD, Simhan HN, Klebanoff MA, Bodnar LM. Maternal serum 25-hydroxyvitamin D and measures of newborn and placental weight in a U.S. multicenter cohort study. J Clin Endocrinol Metab. 2013; 98(1):398-404. DOI: 10.1210/jc.2012-3275. [ Links ]
59. Budhwar S, Verma P, Verma R, Gupta S, Rai S, Rajender S, et al. Altered cord serum 25-hydroxyvitamin D signaling and placental inflammation is associated with pre-term birth. Am J Reprod Immunol. 2020; 83(2):e13201. DOI: 10.1111/aji.13201. [ Links ]
60. Menon R, Taylor BD. Exploring inflammatory mediators in fetal and maternal compartments during human parturition. Obstet Gynecol. 2019;134(4):765-73. DOI: 10.1097/aog.0000000000003470. [ Links ]
61. Friis H, Gomo E, Mashange W, Nyazema N, Kostel P, Wieringa F, et al. The acute phase response to parturition: a cross-sectional study in Zimbabwe. Afr J Reprod Health. 2009;13(2):61-8. [ Links ]
62. Kovar IZ, Riches PG. C3 and C4 complement components and acute phase proteins in late pregnancy and parturition. J Clin Pathol. 1988;41(6):650-2. DOI: 10.1136/jcp.41.6.650. [ Links ]
63. Yasuda K, Nakanishi K. Host responses to intestinal nematodes. Int Immunol. 2018; 30(3):93-102. DOI: 10.1093/intimm/dxy002. [ Links ]
64. Starr LM, Scott ME, Koski KG. Protein deficiency and intestinal nematode infection in pregnant mice differentially impact fetal growth through specific stress hormones, growth factors, and cytokines. J Nutr. 2015; 145(1):41-50. DOI: 10.3945/jn.114.202630. [ Links ]
65. Chen YH, Liu ZB, Ma L, Zhang ZC, Fu L, Yu Z, et al. Gestational vitamin D deficiency causes placental insufficiency and fetal intrauterine growth restriction partially through inducing placental inflammation. J Steroid Biochem Mol Biol. 2020;203:105733. DOI: 10.1016/j.jsbmb.2020.105733. [ Links ]
66. Morikawa M, Yamada T, Yamada T, Koyama T, Akaishi R, Ishikawa S, et al. Antithrombin activity, platelet count, hemoglobin concentration and hematocrit value determined immediately before vaginal delivery among healthy women. Hokkaido Igaku Zasshi. 2012; 87(4-5):141-6. [ Links ]
67. Fairlie FM, Lang GD, Lowe GG, Walker JJ. Umbilical artery flow velocity waveforms and cord blood viscosity. Am J Perinatol. 1991;8(4):239-43. DOI: 10.1055/s-2007-999387. [ Links ]
68. Meberg A, Jakobsen E, Halvorsen K. Humoral regulation of erythropoiesis and thrombopoiesis in appropriate and small for gestational age infants. Acta Paediatr Scand. 1982;71(5):769-73. DOI: 10.1111/j.1651-2227.1982.tb09517.x. [ Links ]
69. Vlug RD, Lopriore E, Janssen M, Middeldorp JM, Rath ME, Smits-Wintjens VE. Thrombocytopenia in neonates with polycythemia: incidence, risk factors and clinical outcome. Expert Rev Hematol. 2015;8(1):123-9. DOI: 10.1586/17474086.2015.997705. [ Links ]
70. Dundar B, Dincgez Cakmak B, Ozgen G, Tasgoz FN, Guclu T, Ocakoglu G. Platelet indices in preterm premature rupture of membranes and their relation with adverse neonatal outcomes. J Obstet Gynaecol Res. 2018;44(1):67-73. DOI: 10.1111/jog.13484. [ Links ]
71. Cecinati V, Brescia L, Esposito S. Thrombocytosis and infections in childhood. Pediatr Infect Dis J. 2012;31(1):80-1. DOI: 10.1097/INF.0b013e318241f47a. [ Links ]
72. Syed NN, Usman M, Khurshid M. Thrombocytosis: age dependent aetiology and analysis of platelet indices for differential diagnosis. Indian J Pathol Microbiol. 2007;50(3):628-33. [ Links ]
73. Solomons NW. Vision of research on human linear growth. Food Nutr Bull. 2019;40(4):416-31. DOI: 10.1177/0379572119885475. [ Links ]
74. Prendergast AJ, Rukobo S, Chasekwa B, Mutasa K, Ntozini R, Mbuya MN, et al. Stunting is characterized by chronic inflammation in Zimbabwean infants. PLoS One. 2014;9(2):e86928. DOI: 10.1371/journal.pone.0086928. [ Links ]
75. Wren-Atilola HM, Solomons NW, Scott ME, Koski KG. Infant growth faltering linked to subclinical mastitis, maternal faecal-oral contamination, and breastfeeding. Matern Child Nutr. 2019;15(3):e12756. DOI: 10.1111/mcn.12756. [ Links ]
Recibido: 10 de Octubre de 2020; Revisado: 25 de Abril de 2021; Aprobado: 09 de Mayo de 2021











 texto en
texto en