INTRODUCCIÓN
Los metales son constituyentes naturales de las aguas estuarinas a concentraciones bajas y algunos son esenciales como elementos traza para el crecimiento de las plantas acuáticas (Peña et al., 2005). Sin embargo, pueden resultar tóxicos para diversos organismos cuando se presentan en concentraciones superiores a las consideradas normales (Cantera y Blanco, 2001). Incluso, los metales llamados esenciales que se requieren en diversas funciones metabólicas como el cobre (requerido como componente estructural de la plastocianina, molécula que hace parte de la cadena transportadora de electrones), pueden resultar igual o más tóxico que los metales no requeridos como elementos traza. El efecto del plomo y del mercurio sobre la biología de las algas se ha determinado para varias especies mediante pruebas toxicológicas en laboratorio (Whitton, 1984; Chandra y Kumar, 2003; Fu, 2011). La toxicidad de los metales pesados en las algas sigue generalmente la siguiente secuencia: Hg>Cu>Cd>Ag>Pb>Zn (Peña-Salamanca et al., 2012), la cual está determinada por la capacidad de bioabsorción de la biomasa algal y por los mecanismos asociados de facilitamiento a nivel de membrana (Holan et al., 1993; Mata et al., 2008; Peña-
Salamanca et al., 2012). Entre los efectos de los metales sobre la fisiología algal se incluye la disminución de la tasa fotosintética, en especial por la afectación de la estructura del aparato fotosintético y la degradación de los pigmentos fotosintéticos (Dinakar et al,. 2012). Esta se considera una de las medidas más directas del estado fisiológico en algas (Peña et al., 1999; González Moreno et al., 2008) y un factor determinante en la productividad de los ecosistemas (Sardi y Saavedra, 2016). Estos elementos tóxicos pueden afectar varios procesos fotosintéticos, entre los cuales se pueden mencionar la reducción en el transporte de electrones, la inhibición del consumo de oxígeno para la respiración, el bloqueo de los procesos de absorción de minerales requeridos metabólicamente, la inhibición enzimática debido al desplazamiento de iones metálicos esenciales, el desarrollo morfológico anormal y cambios ultraestructurales en la estructura de los cloroplastos (González Moreno et al., 2008). Los primeros resultados sobre el efecto del mercurio en la actividad fotosintética de las algas fueron registrados por Blinn et al. (1977), quienes investigaron los efectos del mercurio sobre las poblaciones de fitoplancton del Lago Powell en Arizona. Determinaron que una reducción del 40 % en la fotosíntesis ocurre a concentraciones a 0,06 mg/L. Por otro lado, Wang y Lewis (1997) describieron el efecto del mercurio en plantas vasculares, especialmente a concentraciones entre 0,01 y 0,1 mg/L.
Los primeros registros de los niveles de metales en la Bahía de Buenaventura se encuentran en los estudios de Ortega (1996), quien evaluó las concentraciones de plomo y mercurio en el agua de mar mediante metodologías de absorción atómica. En ese estudio se determinaron concentraciones para estos dos metales en un rango de 0,35 a 18,00 ppb para plomo y 0,30 a 18,90 ppb para mercurio. Dicho estudio atribuyó como principal fuente de contaminación por plomo a los derrames de hidrocarburos contaminados con este metal, además de los desechos como baterías y residuos sólidos arrojados al mar. Ortega (1996) estudió también la dinámica directa entre la concentración de plomo y mercurio y el estado mareal. El efecto de la dinámica mareal sobre la variabilidad de las concentraciones de compuestos tóxicos como los metales en el medio marino se ha valorado en varios ambientes costeros y se ha demostrado que puede existir una ligera tendencia a encontrarse mayores niveles de concentración de plomo en mareas bajas (Davis et al., 2003; Sari y Tuzen, 2008; Britton et al., 2016).
Para la fauna marina los niveles de toxicidad aguda y crónica se presentan a concentraciones de 668 y 25 mg/L, respectivamente. Estas concentraciones pueden ser menores dependiendo de la historia de vida de los organismos estudiados (U. S. EPA, 1980a). Woolery y Lewin (1976) observaron inhibición total de la fotosíntesis en la diatomea Peodactylum tricornulum a concentraciones de 10,0 mg/L.
El mercurio (Hg) puede ser parte de compuestos orgánicos e inorgánicos. El agua de mar contiene entre 0,03 y 2,0 mg/L de este metal. En las aguas del Pacífico las concentraciones de mercurio aumentaron desde un rango de 0,10 a 0,15 mg/L en la superficie, hasta 0,27 mg/L en grandes profundidades (U. S. EPA, 1980a). Este metal se ha reconocido como uno de los elementos metálicos más tóxicos desde hace mucho tiempo, pero sólo recientemente se ha identificado como un serio contaminante en ambientes acuáticos. En su forma elemental, líquido a temperatura ambiente, se considera relativamente inerte, pero puede ser oxidado a mercurio divalente y las bacterias pueden metilar esta forma del mercurio (Lopes et al., 2014). La forma metilada es más soluble en agua, más activa biológicamente y más tóxica para la vida acuática que la forma inorgánica divalente. El mercurio no tiene una función fisiológica conocida.
Los primeros estudios sobre el efecto del pH en la acumulación de los metales pesados afirman que a pH altos algunos elementos se precipitan como óxidos insolubles o hidróxidos, los cuales pueden limitar su disponibilidad y disminuir su toxicidad (Reed, 1989). Estudios similares realizados por Chang et al. (2000) y Méndez et al. (2009) observaron mayores adsorciones de metal a pH alto. Rengifo-Gallego et al. (2012) estudiaron el efecto de la asociación alga-bacteria (Rhodomelaceae) en el porcentaje de remoción de cromo en laboratorio y consideraron que el pH al cual las algas tuvieron un crecimiento óptimo fue de 8,0. Zhang et al. (2016) señalan que el pH es un factor principal que afecta la adsorción de los metales pesados, controla la solubilidad de hidróxidos, carbonatos y fosfatos de metales pesados, afecta la hidrólisis del metal en sedimentos y materia orgánica y provoca cambios en la carga superficial de la arcilla disuelta y en la formación de pares de iones. Todo estos son factores determinantes en la absorción posterior de los metales por los organismos.
La Bahía de Buenaventura es un importante cuerpo costero de tránsito de embarcaciones que circulan en dirección al principal puerto de carga en el Pacífico colombiano con movimientos estimados de 9 500 000 Ton/ año, (Palacios y Cantera, 2017). La Bahía se caracteriza por recibir los drenajes de los ríos Caimán, Dagua, Limones y Anchicayá, los cuales se han visto afectados por la actividad minera aguas arriba (Cantera y Blanco, 2001).
El propósito fundamental del estudio fue examinar el efecto del pH sobre la acumulación de plomo y mercurio en el alga roja B. calliptera (montagne) en la Bahía de Buenaventura, a fin de proponer su uso como organismo bioindicador de contaminación por metales en zonas costeras y su aplicación potencial en procesos de biorremediación. En consecuencia, para los experimentos de laboratorio se planteó como hipótesis que no existen diferencias significativas en las tasas de bioacumulación de plomo y mercurio en el alga para diferentes concentraciones de pH.
MATERIALES Y MÉTODOS
Recolección de material
El muestreo se llevó a cabo en la Bahía de Buenaventura, ubicada en el occidente colombiano (3° 54' N, 77° 05' W). Este cuerpo de agua se caracteriza por ser un estuario semicerrado dominado por llanuras de lodo y sedimentos de los periodos Terciario y Cuaternario (Cantera y Blanco, 2001). Su línea de costa está dominada por extensos bosques de manglar tipo ribereños y de borde, donde se destacan principalmente las especies Rhizophora spp (L), Laguncularia racemosa (L.) C.F.Gaertn, Avicenniagerminans (L) y Pelliciera rhizophorae (Planch & Triana). El régimen de mareas en esta zona es multivariable con un rango entre los tres y cuatro metros (Cantera y Blanco, 2001). En los meses de junio a septiembre del año 2004 se colecto durante el periodo de marea baja y en forma manual, 500 gramos de talos con forma de cojinetes de hasta 7 cm de largo de B. calliptera asociados a las raíces del mangle.
Tratamiento de la muestra
Se introdujo 1,5 g de alga (peso húmedo) en frascos Boeco® con capacidad de 600 mL inmersos en 200 mL de agua de mar sintética preparada (Ospina-Álvarez et al., 2006). Después de 24 horas de aclimatación se realizó una renovación del medio y la especie algal se expuso a diferentes concentraciones de mercurio o plomo. Las concentraciones de exposición para mercurio fueron 0,01 - 0,1 - 1,0 - 5,0 y 10,0 mg/L y 0,1 - 1,0 - 5,0 - 10,0 y 15,0 mg/L para plomo (Ospina-Alvarez et al., 2006). Las muestras se rotularon según el tiempo de exposición (2, 12, 24 y 96 horas respectivamente), el nivel de pH utilizado, el metal utilizado y su concentración. Cada tratamiento se efectuó por triplicado. La temperatura del agua de mar sintética en los frascos se mantuvo en el día entre 28 y 29,5 °C y en la noche entre 25 y 27 °C. El fotoperiodo fue de 12 horas de luz con una irradianza promedio de 87,5 Wm2.
Los bioensayos se realizaron a concentraciones de 0,1, 1,0, 5,0, 10,0 y 15,0 Mg/mL de plomo y 0,01, 0,1, 1,0, 5,0 y 10,0 Mg/mL de mercurio, por periodos de exposición de 0, 12, 24 y 96 horas y cuatro niveles diferentes de pH (3, 5, 8 y 10). Cada combinación se hizo por triplicado y para cada una de ellas se corrió una prueba de blanco. Las condiciones de experimentación se resumen en la Tabla 1.
Determinación de la cantidad de metal acumulado por unidad de biomasa y tasas de acumulación en B. calliptera
Las tasas se acumulación se midieron registrando la remoción del ion en el medio de cultivo y su incorporación en el tejido algal. Se hicieron mediciones en las plantas expuestas y no expuestas durante un periodo de 96 horas.
Las mediciones de metales se realizaron en el material vegetal, previamente secado durante 24 h a 70 °C, después de lo cual se digirieron las muestras del tejido con 5 mL de HNO3 al 65 % y 5 mL de H2O2 al 30 % (Chaparro et al. , 2016). Los análisis de contenido de Hg y Pb se realizaron de acuerdo con los métodos estándar (Rice et al., 2017) en un equipo de espectrofotometría de absorción atómica, expresándose todas las concentraciones del metal en Mg/g de peso seco. Los porcentajes de metal absorbido por B. calliptera a los diferentes valores de pH para cada una de las concentraciones de los metales durante todos los periodos de tiempo de los bioensayos, se determinaron por la diferencia entre la concentración inicial de exposición al metal y la concentración encontrada en el alga al finalizar el ensayo (a la cual se le restó el valor del blanco).
Con los datos obtenidos se determinó la cantidad de metal removido del medio por unidad de biomasa a partir de la ecuación q = v (Ci - Cf) / S, (Stirk y van Staden, 2000), donde q es la cantidad de metal removido (acumulado) por unidad de biomasa, v es el volumen de la solución, Ci y Cf son las concentraciones de metal inicial y final en el medio de cultivo respectivamente y S es la cantidad de alga (en peso seco) empleada en el experimento. También se calculó la tasa de acumulación de estos metales mediante la ecuación V = (Ci - Cf) / N t, donde V es la tasa de acumulación, Ci y Cf son las concentraciones de metal inicial y final en el material vegetal respectivamente, N es la cantidad de alga (en peso seco) empleada en el experimento y t el tiempo de exposición (Zou, 2014). En la Tabla 2 se presenta el diseño experimental, en el cual U equivale a una unidad experimental (doce recipientes de muestra cada uno). En cada tratamiento se tomaron tres muestras y se les determinó la concentración después 12, 24 y 96 horas de exposición.
Tabla 2 Diseño experimental utilizado para la estimación de las tasas de acumulación por unidad de biomasa de plomo y mercurio en B. calliptera

Las mediciones de metales en el agua del medio de cultivo se realizaron juntamente con las mediciones de metales en el material vegetal. El material vegetal requirió un secado previo durante 24-48 h a 105 °C, después de lo cual se digirieron las muestras del tejido con 5 ml de HNO3 al 65 % y 5 ml de H2O2 al 30 % (Luoma et al., 1982). Los análisis de los contenidos de Hg y Pb se realizaron con los extractos resultantes de la digestión, mediante espectrofotometría de absorción atómica en el Laboratorio de Productos Naturales de la Universidad del Cauca. Con los datos obtenidos se determinó la cantidad de metal removido del medio por unidad de biomasa a partir de la ecuación q = v (Ci - Cf) / S (Stirk y Staden, 2000), donde q es la cantidad de metal removido (acumulado) por unidad de biomasa, v es el volumen de la solución, Ci y Cf son las concentraciones de metal inicial y final en el medio de cultivo respectivamente y S es la cantidad de alga (en peso seco) empleada en el experimento. También se calculó la tasa de acumulación de estos metales mediante la ecuación propuesta en Harrison (1998): V = (Ci - Cf) / N t, donde V es la tasa de acumulación, Ci y Cf son las concentraciones de metal inicial y final en el medio de cultivo respectivamente, N es la cantidad de alga (en peso seco) empleada en el experimento y t el tiempo de exposición.
Análisis estadístico de los datos
Los resultados del efecto del pH sobre las tasas de absorción de metales se evaluaron usando técnicas de análisis multivariado. Se hicieron comparaciones múltiples entre los medios, los diferentes tratamientos y los niveles de dichos tratamientos usando la prueba de Tukey. Para demostrar las diferencias significativas entre los factores se aplicó el método de LSD (Least Significant Difference). La homogeneidad de las varianzas se determinó con una prueba f (Rohlf y Sokal, 1995). Las medidas se replicaron tres veces para cada tratamiento. Los valores seleccionados para el nivel de confiabilidad y error b fueron 0,95 y 0,05 respectivamente. Estos valores garantizaron la fiabilidad de los resultados y la validez de la prueba estadística para comprobar la hipótesis. El análisis estadístico se realizó con el software Statistica (2002).
RESULTADOS Y DISCUSIÓN
Patrones de acumulación de plomo
Los valores más altos de la acumulación de plomo en el tejido algal se observaron a pH 8,0 en todas las concentraciones empleadas y en todos los tiempos de exposición. Estos niveles de pH son los más cercanos a los valores de pH en el agua mar. Este resultado coincide con las observaciones obtenidas por Vizcaino et al. (2010), quienes encontraron mayor absorción de plomo en hojas y tallos de Eichhornia crassipes (montagne) al emplear soluciones acuosas de plomo por encima de pH 6,0.
Los valores más bajos en la acumulación de plomo se presentaron en el tratamiento a pH 3,0. Se observó un aumento significativo en la acumulación de plomo al incrementar la concentración y los tiempos de exposición (p < 0,05) con respecto a los demás tratamientos de pH. Para el tratamiento a pH 5,0 la acumulación máxima de plomo se alcanzó a las 96 horas de exposición y en todas las concentraciones, con excepción de los valores obtenidos para la concentración de 0,1 mg/L, en la que la acumulación de metal por gramo de alga fue menor. El comportamiento de la cinética de acumulación con respecto a la concentración en el medio y a los diferentes tratamientos de pH siguió el patrón de Michaelis-Menten, consistente en una primera fase de acumulación lineal, seguido a una fase más lenta hasta llegar a un punto de saturación o máxima bioacumulación. Estos resultados sugieren que el efecto del pH sobre B. calliptera está asociado a la capacidad diferencial de la permeabilidad de la membrana celular en el alga. Esto ha sido observado por González Moreno et al. (2008), Cuizano (2010) y Monteiro et al. (2012), cuyos resultados indican que los mecanismos de la bioacumulación del metal está regulado por dos fases. Inicialmente, la captura del metal está asociada a la actividad química de grupos funcionales presentes en la pared celular del alga y su reactividad con el metal que efectivamente se ve afectada por las condiciones del pH de la solución y es independiente de la capacidad de bioabsorción de la planta (Peña et al., 2012). Y la segunda fase está asociada a la capacidad metabólica del alga y se conoce como la fase activa, en la que intervienen procesos de facilitamiento a nivel intracelular. También se evidenció que el aumento del contenido de metal en la planta se incrementó al aumentar su concentración en el medio circundante para cada uno de los tratamientos de pH. Los datos mostraron que la cinética de bioacumulación del metal por el alga en los rangos de exposición del metal entre 0,1 y 15 mg/L fue significativamente mayor que en el resto de concentraciones y durante las primeras horas (0 a 24 hrs). Esto indica que el alga absorbe plomo de forma proporcional a la concentración a que fue expuesta y al tratamiento de pH utilizado. Este comportamiento se ha documentado para diferentes especies de algas (Cuizano, 2010) y representa una estrategia típica de organismos considerados indicadores, ya que la acumulación de metales ocurre de tal forma que la concentración en el organismo brinda información, fácilmente extraíble, sobre la concentración en el medio exterior (Fig. 1). Ospina-Álvarez et al. (2006) observaron un patrón lineal para la acumulación de plomo en Rhizoclonium riparium (Roth) con respecto a la concentración de este metal en el medio, y adjudican este hecho a que la permeabilidad de la membrana permanece constante. Este comportamiento se observa de manera más marcada para el control que para los otros tratamientos de pH, y esto pueda deberse a que en los demás tratamientos de pH, uno o más mecanismos de exclusión de plomo se activan creando una barrera a la acumulación (Zeraatkar et al., 2016). Se han demostrado varios mecanismos que limitan la acumulación de metales en algas, entre ellos la producción de quelantes o ligandos extracelulares que pueden ser exudados al medio, la producción de inhibidores metabólicos, el cierre de canales proteicos (si el proceso de transporte al interior celular es activo o pasivo mediado por proteínas), la ocupación o cambios en la afinidad de los sitios de adhesión a la pared celular y la exclusión activa de iones metálicos (Cuizano, 2010; Zeraatkar et al., 2016).
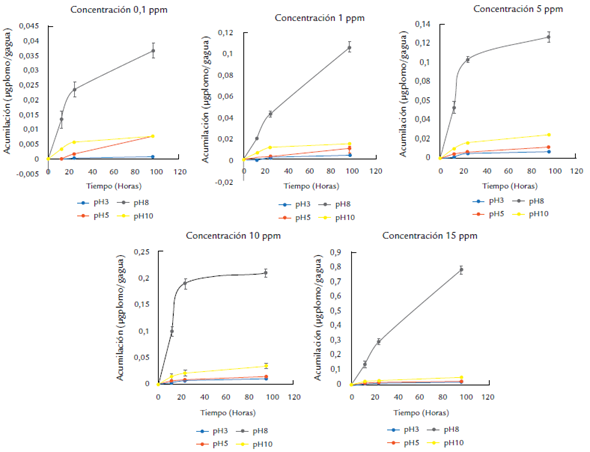
Figura 1 Comportamiento de la acumulación del plomo por unidad biomasa en B. concentraciones del metal y a diferentes valores de pH.
La figura 1 resume el comportamiento de los valores promedio de la cantidad máxima de metal acumulado por B. calliptera sometida a diferentes tratamientos de pH en un medio contaminado con plomo y confirma que existen diferencias entre el control a pH 8,0 y los demás tratamientos de pH.
Patrones de acumulación de mercurio
Los experimentos de acumulación de mercurio en B. calliptera a concentraciones de 0,01, 0,1, 1,0, 5,0 y 10,0 mg/L registraron una mayor adsorsión en el tratamiento de pH 8,0. Los valores más bajos en la acumulación de mercurio se presentaron en el tratamiento a pH 3,0, el cual mostró diferencias significativas (p < 0,05) en la acumulación de mercurio al aumentar la concentración y los tiempos de exposición. Para el tratamiento a pH 5,0 la acumulación máxima de mercurio se alcanzó a las 96 horas de exposición y en todas las concentraciones, a excepción de los valores obtenidos a la concentración de 0,01 mg/L, en la que la acumulación de este metal fue menor. A valores de pH por debajo de 3,0 los hidrogeniones inhiben los sitios de anclaje de los enlaces iónicos del metal, lo que en consecuencia disminuye la capacidad de absorción de los sitios funcionales de la pared celular en el alga (Volesky, 2001; Filote et al., 2017).
El tratamiento a pH 8,0 (control) presentó los valores más altos de acumulación de mercurio durante todo el tiempo de exposición. El aumento en la acumulación del metal en el organismo se incrementó al aumentar su concentración en el medio circundante para cada uno de los tratamientos de pH. La relación entre la bioacumulación de metal y la concentración de exposición en los rangos iniciales de concentración (0,01a 10 mg/L) siguió una cinética lineal, indicando que la bioabsorción del mercurio es proporcional a la concentración del medio expuesto. Sin embargo, a mayor tiempo de exposición y a concentraciones más elevadas del metal, sus niveles de acumulación en el alga alcanzan un valor máximo de saturación. La cinética de la acumulación del mercurio observada para el alga en este estudio sugiere la presencia de procesos de absorción pasiva que son función de la permeabilización de la membrana celular, hecho que ha sido observado por varios autores a diferentes concentraciones de metales pesados en otras plantas (Cuizano, 2010; Monteiro et al., 2012; Lee et al., 2016). Análisis más detallados sobre la dinámica de transporte y acumulación de metales a nivel celular en algas han demostrado que se requiere incluir la "velocidad de la cinética de acumulación", como ha sido observado por Monteiro et al. (2012) y Zeraatkar et al. (2016). La comprensión de estos mecanismos requiere, igualmente, dilucidar los efectos de la acumulación del metal a nivel celular, lo que permitiría identificar la trayectoria del metal en los diferentes espacios subcelulares de la planta (Pal y Rai, 2010; Montoya-Palomino et al., 2015). En el rango de las concentraciones de 5,0 a 10,0 mg/L se evidenció una disminución en la capacidad de acumulación del alga. Sin embargo, se observó que en los tratamientos a valores de pH 10,0, la acumulación en el alga presentó un aumento mayor que para los tratamientos a pH 3,0 y 5,0 respectivamente. Estos resultados sugieren la presencia de un mecanismo de exclusión diferente o su reactivación a pH diferentes. Resultados similares fueron observados por Chang et al. (2000) y Volesky (2001), quienes encontraron una mayor acumulación de este metal a pH por encima de 7,0.
La Figura 2, muestra el comportamiento de la acumulación por unidad biomasa para B. calliptera en los diferentes tratamientos de pH durante las 96 horas. Se aprecia que la acumulación máxima por unidad biomasa del alga se presenta a niveles de pH 8,0 y a una concentración de 10,0 mg/L de mercurio. Para los demás tratamientos de pH y a concentraciones de 0,01 y 0,1 mg/L, la acumulación de mercurio fue significativamente menor.
CONCLUSIONES
Los resultados del estudio permitieron evidenciar diferencias significativas de la bioacumulación de plomo y mercurio del alga B. calliptera en los tratamientos a diferentes niveles de pH. Las tasas máximas de acumulación de ambos metales en el tejido algal y en el rango de todas las concentraciones usadas en este estudio se encontraron a pH 8,0, valores que coinciden con los niveles encontrados en el agua de mar. Las diferencias del patrón de acumulación del metal en el tejido algal a bajos niveles de pH y a bajas concentraciones de los metales pueden estar relacionadas con la presencia de estrategias por fases: una fase inicial (pasiva), donde la captura del metal por parte de la planta está asociada a la reactividad química de grupos funcionales y a la permeabilidad de la membrana celular, y una segunda fase (activa) asociada a la capacidad metabólica del alga, en la que intervienen procesos de facilitamiento a nivel intracelular.
El comportamiento de la cinética de acumulación de ambos metales con respecto a la concentración en el medio y a los diferentes tratamientos de pH siguió el patrón de Michaelis-Menten, consistente en una primera fase de acumulación lineal, seguido a una fase más lenta hasta llegar a un punto de saturación o máxima bioacumulación.
El comportamiento de la acumulación de los metales en el alga obtenidos en estos ensayos demuestra la posibilidad del uso del alga roja B calliptera como posible bioindicador de la contaminación por metales pesados en ambientes costeros. Experimentos sobre la cinética de la acumulación del metal a nivel celular son necesarios para comprender en detalle los procesos de detoxificación y tolerancia de los metales por parte del alga.

















