Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Acta Neurológica Colombiana
versión impresa ISSN 0120-8748
Acta Neurol Colomb. vol.32 no.2 Bogotá abr./jun. 2016
Caso clínico
Porfiria aguda intermitente y su relación con el síndrome de encefalopatía posterior reversible: reporte de caso
Acute Intermittent Porphyria and it´s relationship with Posterior Reversible Encephalopathy Syndrome: Case Report
Alejandro Enríquez-Marulanda (1), Masaru Shinchi (2), Ana María Granados (3), Jorge Luis Orozco (2)
(1) Médico Rural de investigación de Neurociencias, Fundación Clínica Valle del Lili, Cali, Colombia; Centro de Investigaciones Clínicas, Cali, Colombia.
(2) Neurólogo Clínico, Fundación Clínica Valle del Lili, Universidad ICESI, Cali, Colombia.
(3) Neuroradióloga, Fundación Clínica Valle del Lili, Universidad ICESI, Cali, Colombia.
Recibido: 11/3/16. Aceptado: 13/5/16.
Correspondencia: Masaru Shinchi: masacali@hotmail.com.co
Resumen
Las porfirias son un grupo heterogéneo de trastornos del metabolismo en el cual hay una deficiencia enzimática específica necesaria en la biosíntesis del grupo hemo. Dentro de estas se destaca la porfiria aguda intermitente como la forma más común, que se caracteriza por episodios de exacerbación o crisis neuroviscerales. Las manifestaciones clínicas son amplias, sin embargo, la presentación con síntomas del sistema nervioso central a diferencia de los síntomas disautonómicos o neuropáticos son poco frecuentes. Reportamos un caso que resalta la relación infrecuente entre la porfiria aguda intermitente y el síndrome de encefalopatía posterior reversible.
Paciente femenina de 18 años con dolor abdominal persistente severo, hipertensión arterial, convulsiones, ceguera cortical y neuropatía axonal motora. Se le realizó una resonancia magnética nuclear (RMN) contrastada que evidenció lesiones hiperintensas corticales y cortico-subcorticales sugestivas de edema vasogénico, compatibles con síndrome de encefalopatía posterior reversible. Se hizo el diagnóstico de porfiria aguda intermitente por elevados niveles de resonancia magnética nuclear (PBG) y ácido 5-amino-levulínico (ALA) en orina y se inició tratamiento con hematina, terapia parenteral hiperglucida y el retiro de agentes porfirinogénicos. Los síntomas centrales así como los hallazgos imagenológicos se resolvieron de forma adecuada con el tratamiento.
Este caso resalta la relación inusual entre la porfiria aguda intermitente y el síndrome de encefalopatía posterior reversible, en una paciente con crisis de dolor abdominal persistente, disautonomía, convulsiones, ceguera cortical y neuropatía axonal motora, síntomas que asociados nos deben sugerir estos diagnósticos.
Palabras clave: ceguera cortical, convulsiones, dolor abdominal, neuropatía, porfiria aguda intermitente, síndrome de encefalopatía posterior reversible (DeCS).
Summary
The porphyrias are a heterogeneous group of metabolism disorders in which there is an enzymatic deficiency necessary for the pathway of heme biosynthesis. Within this group, Acute Intermittent Porphyria (AIP) is the most common disorder, characterized by episodes of neuro-visceral crisis. The clinical manifestation spectrum is wide, however symptoms originating from Central Nervous System (CNS) dysfunction are rare. We report a case that shows the infrequent relationship between AIP and Posterior Reversible Encephalopathy Syndrome (PRES)
An 18-year-old female patient presented with severe persistent abdominal pain, hypertension, seizures, cortical blindness and motor axonal neuropathy. A brain contrasted MRI evidenced a cortical and cortico-subcortical high intensity lesion suggestive of vasogenic edema in frontal, parietal and occipital lobes, compatible with PRES. A diagnosis of AIP was also made due to high levels of PBG and ALA in the urine. Treatment consisted of hematin, intravenous sugar solution and the withdrawal of porphyrinogenic agents. The CNS-related symptoms and the brain lesions shown via imaging resolved appropriately with treatment.
This case shows the unusual relationship between AIP and PRES, in a patient that presented with persistent abdominal pain, dysautonomia, seizures, cortical blindness and motor axonal neuropathy, symptoms that, as a whole, can suggest this diagnosis.
Key words: cortical blindness, seizures, abdominal pain, neuropathy, acute intermittent porphyria, posterior reversible encephalopathy syndrome (MeSH).
Introducción
Las porfirias son un grupo heterogéneo de trastornos del metabolismo heredados, en los cuales hay una deficiencia enzimática específica necesaria en algún paso de la biosíntesis del grupo hemo, lo que causa un incremento anormal de productos intermedios que se eliminan por orina o materia fecal y se depositan en diferentes tejidos1.
La porfiria aguda intermitente (PAI), es la forma más común de esta enfermedad con herencia autosómica dominante pero con penetrancia incompleta del 10-40%2,3. Hasta el momento se han descrito 390 mutaciones diferentes del gen Hidroximetilbilano Sintasa (HMBS) causal de la PAI4.
La porfiria aguda intermitente (PAI), se caracteriza por una deficiencia parcial de la enzima hydroxymethylbilane synthase (HMBS, EC 4.3.1.8), también conocida como porfobilinógeno desaminasa1,5. La mayoría de individuos con la deficiencia son asintomáticos, y cuando presentan síntomas, típicamente afecta a pacientes de sexo femenino con un inicio tardío en la adolescencia o adultez temprana.
La PAI afecta el sistema nervioso autónomo, periférico y central6-8. Los síntomas son generalmente inespecíficos e incluyen dolor abdominal, náusea, vómito, estreñimiento, hipertensión, taquicardia, alteración de la conciencia, convulsiones y síntomas neuropsiquiátricos5. Los ataques neuroviscerales empiezan con una fase pródromo que incluyen cambios comportamentales menores como ansiedad, insomnio e irritabilidad1. Estos episodios generalmente son precipitados por algunos medicamentos, alcohol, fumar, enfermedades concomitantes (infecciosas, autoinmunes), cirugía, dieta hipocalórica, cambios hormonales (ciclo menstrual y embarazo), metabólicos o por estrés, sin embargo en algunos puede no identificarse su causa5,7,9. El diagnóstico se realiza al encontrar porfobilinógeno (PBG) o el ácido 5-amino-levulínico (ALA) urinario elevado5,8.
Las manifestaciones del sistema nervioso central de la PAI, a diferencia de los síntomas disautonómicos o la neuropatía, son infrecuentes6,8,10, reportamos un caso de convulsiones y ceguera cortical en una paciente con PAI, con hallazgos imagenológicos en la resonancia magnética cerebral compatibles con síndrome de encefalopatía posterior reversible.
Presentación del caso
Mujer de 18 años de edad quien ingresa al servicio de urgencias por presentar de novo episodio convulsivo tónico-clónico generalizado con desviación de la mirada conjugada a la izquierda. Fue controlado al inicio con diazepam y se inició impregnación con fenitoína parenteral. Dos semanas antes le habían realizado una laparoscopia exploratoria en otra institución debido al dolor abdominal agudizado en los últimos días, que descartó cualquier proceso abdominal agudo. Posterior a la cirugía, el dolor abdominal continuó, requiriendo analgesia avanzada. Adicionalmente presentó estreñimiento e insomnio marcado a pesar del manejo con alprazolam y trazodona. Los familiares descartaron otros antecedentes de importancia.
Al ingresar sus signos vitales fueron FC: 101 lpm TA: 150/71 mmHg FR: 19 rpm T: 36,2°C. En el momento se encontraba somnolienta, con mucosas secas, desorientada en tiempo y lugar, podía seguir órdenes sencillas y el resto de examen neurológico era normal sin déficits focales. Al evaluar el abdomen presentó ruidos hidroaéreos disminuidos, dolor intenso a la palpación en flanco derecho y pelvis con defensa voluntaria sin signos de irritación peritoneal.
Los laboratorios iniciales evidenciaban leucocitosis y trombocitosis (leucocitos totales: 20.99x103/uL, neutrófilos: 54 %, linfocitos:36 %, monocitos: 8 %, conteo plaquetario:629 x103/uL). El resto de paraclínicos resultó normal: memoglobina: 13,3 mg/dL, hematocrito: 42 %, glucemia: 130 mg/dL, NA: 137 mEq/L, K: 4,16 mEq/L, Cl: 87 mEq/L, LDH: 291, ANA: negativo, Anti-dsDNA: negativo, ALT: 28 U/L AST: 31 U/L. Adicionalmente se realizó una punción lumbar que fue normal y un electroencefalograma que no mostró alteraciones. La radiografía de abdomen evidenció gran distensión de asas intestinales sin evidencia de obstrucción intestinal u otros hallazgos.
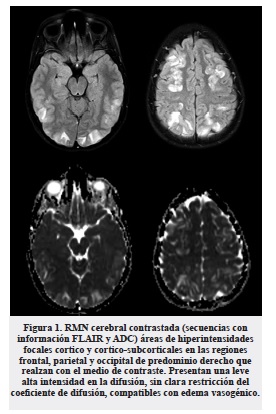
La resonancia magnética (RM) cerebral (figura 1) mostró en la secuencia FLAIR hiperintensidades focales cortico-subcorticales en las regiones frontal, parietal y occipital de predominio derecho que realzan con el medio de contraste, sin representación en las secuencias de susceptibilidad y sin restricción a la difusión en la secuencia ADC. Estos hallazgos eran compatibles con un proceso de edema vasogénico, descartando un proceso isquémico agudo o tumoral. Se concluye que las imágenes eran compatibles con el síndrome de encefalopatía posterior reversible (PRES).
En su evolución la paciente continuó presentando taquicardia persistente e hipertensión arterial a pesar del tratamiento con betabloqueadores, por lo cual fue trasladada a la unidad de cuidados intensivos, para monitoreo sistémico y control de hipertensión con nitroprusiato de sodio. El dolor abdominal era progresivo sin respuesta al manejo con altas dosis de analgésicos.
En su estancia en UCI la paciente presentó pérdida rápidamente progresiva de la visión bilateral y recurrencia del episodio convulsivo tónico-clónico generalizado que se controló con benzodiacepinas. Los signos vitales fueron T: 36°C, FC:111 lpm, FR:16 rpm, TA:165/115 mmHg, glucometría: 127 mg/dL. La curva de presión arterial en la UCI se mantenía por encima de 160/80 mmHg a pesar del manejo antihipertensivo. Al examen neurológico la paciente estaba somnolienta, pupilas isocóricas 3 mm normo-reactivas a la luz sin alteraciones en el fondo de ojo. Al evaluar la visión se encontró que en la agudeza visual la paciente era sólo capaz de contar dedos, no presentaba simultagnosia, ataxia óptica ni alucinaciones visuales. Debido a lo anterior se concluye que presentó ceguera cortical. Adicionalmente la paciente comenzó a sentir debilidad en miembros inferiores y parestesias en ellas encontrándose hipotonía muscular y debilidad proximal de los miembros inferiores 3/5, con reflejos osteotendinosos aquiliano y rotuliano disminuidos (+/++++). Se descartaron causas de hipertensión arterial secundarias con una ecografía renal normal, electrolitos séricos sin alteraciones y metanefrinas totales en orina de 552µg/24H (<900µg/24H).
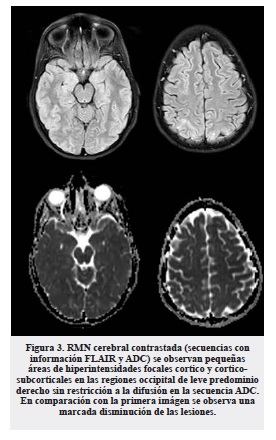
Relacionando los síntomas de dolor abdominal recurrente de los últimos 6 meses ahora con síntomas neuropáticos, disautonomia y convulsiones, se sospecha que la paciente cursa con una crisis aguda de porfiria, razón por la cual se cambió el esquema anticonvulsivo a levetiracetam, se ordenaron laboratorios específicos confirmatorios y se colocó una muestra de orina que expuesta a la luz con el tiempo tomó un color oscuro tipo “té” (figura 2). Se indicó inmediatamente terapia hiperglucida parenteral y hematina de lo cual recibió dos ciclos: la respuesta clínica fue muy rápida con recuperación completa de la agudeza visual, remisión del dolor abdominal como de la debilidad en miembros inferiores. Se realizó RM cerebral de control a los 19 días de estancia hospitalaria (figura 3) que evidencia resolución de lesiones observadas en el primer estudio.
Las pruebas confirmatorias fueron las siguientes: orina recolectada en 24 horas PBG: 7.70µG/24H (0-2 µG/24H), uroporfirinas: 169µG/24H (0-60 µG/24H), coproporfirinas: 323µG/24H (0-160 µG/24H) y ALA: 111.43 mg/24H (1.5-7.5 mg/24H).
Discusión
Existen en la literatura pocas descripciones de pacientes con PAI que han presentado cambios en la RMN cerebral compatibles con PRES7-18.
El PRES es una entidad clínicoradiológica caracterizada por cefalea, alteración del estado mental, convulsiones y ceguera cortical asociado con un patrón imagenológico reversible, que predominantemente afecta la sustancia blanca y gris de la región parieto-occipital bilateralmente19. Dentro de sus causas se destacan etiologías sistémicas tales como eclampsia, tratamiento con ciclosporina o tacrólimus en pacientes trasplantados con órganos sólidos, emergencia hipertensiva, altas dosis de quimioterapia, sepsis, falla renal, enfermedades autoinmunes, pacientes sometidos a cirugía cardiovascular, entre otros5,11,12,19-24.
Generalmente el hallazgo en las imágenes por RM cerebral son de edema vasogénico de la sustancia blanca, particularmente de los lóbulos parietal y occipital y que puede comprometer en algunos casos los núcleos de la base, tallo cerebral y cerebelo6,10. Una diferencia importante del PRES asociado a porfiria frente al PRES típico, es que en las lesiones en la porfiria presentan captación del medio de contraste sugiriendo una anormalidad de la barrera hematoencefálica13,22-24.
Clínicamente los pacientes que presentan PAI y concomitantemente un PRES, pueden presentar cefalea, convulsiones, ceguera cortical aguda y otros síntomas neurológicos focales, alucinaciones, cambios en el comportamiento (irritabilidad) y alteración de la conciencia asociado o no a elevación de las cifras tensionales10,11,22-24.
Existen varias teorías acerca de la fisiopatología del PRES21. Una de ellas es la pérdida de la autorregulación vascular cerebral del lecho capilar que conlleva a edema vasogénico10,11,21. En la PAI se han descrito varios factores que promueven esta disfunción, una de ella es el papel de la óxido nítrico sintasa, enzima tipo citocromo P-450 que requiere un grupo hemo para producir óxido nítrico (ON)11,16. Se ha propuesto que la disminución de la producción de ON cerebral durante los ataques agudos de PAI puede inducir hipertensión y vasoconstricción cerebral17. Así entonces cuando la presión arterial media es superior a 150 mmHg, los límites de la autorregulación cerebral son sobrepasados, llevando a sobredistensión pasiva de las arterias cerebrales con hiperperfusión subsiguiente y disfunción de la barrera hematoencefálica19.
Sin embargo, debido a que existen casos de pacientes con PRES sin hipertensión, se han descrito otras teorías que pudieran explicar su fisiopatología. Un ejemplo de ello es la sobreproducción de precursores de porfirina tóxicos como el ácido amino-levulínico (ALA) implicado en la disrupción de la barrera hematoencefálica, adicionalmente el ALA es una neurotoxina directa que puede contribuir a la formación de radicales de oxígeno e inhibe la bomba de Na-K-ATPasa, promoviendo la liberación incontrolada de glutamato, hecho que podría explicar el origen de las convulsiones y otros síntomas neurológicos2,17,13. Las convulsiones también podrían explicarse por alteraciones hidroelectrolíticas (hiponatremia o hipomagnesemia) asociadas o como manifestación de la propia toxicidad de la porfiria1.
A pesar de tener hipótesis con fundamentos lógicos, aún no es del todo clara la patogénesis de las manifestaciones cerebrales en PAI10. Actualmente se considera que en el PAI la hipertensión puede actuar más como un cofactor para el PRES, puesto que se estima que la activación y disfunción endotelial es considerada como la principal causa del edema vasogénico en PAI2,7,19.
Es muy importante realizar un diagnóstico oportuno tanto del PRES como de la PAI. En el caso del PRES, es una entidad reversible siempre y cuando el factor desencadenante sea controlado. En el caso de la PAI ante la sospecha se debe evitar medicamentos que provoquen y exacerben las crisis y adicionalmente se requiere iniciar el tratamiento específico con el objetivo de prevenir el desarrollo de complicaciones neurológicas severas y secuelas irreversibles3. Las crisis neuroviscerales pueden llegar a ser tan severas que pueden poner en peligro la vida del paciente3. A pesar de tener un pronóstico en general bueno en los casos en los que se realiza un tratamiento oportuno12, la mortalidad de un ataque agudo alcanza hasta un 10 %, especialmente en los pacientes no diagnosticados2. Esto se convierte en un reto para los médicos, puesto que los pacientes con PAI son difíciles de identificar y generalmente existe retraso en el diagnóstico de la enfermedad.
El tratamiento agudo de la PAI debe comenzar con el retiro de todos los factores precipitantes, seguido de hematina parenteral e infusión de solución salina normal junto a dextrosa al 5 %, evitando soluciones hipotónicas debido al alto riesgo de hiponatremia; adicionalmente s e deben instituir los tratamientos sintomáticos tales como controlar la presión arterial con betabloqueadores y la administración de opioides para el manejo del dolor12.
En cuanto al manejo farmacológico de las crisis epilépticas se deben evitar aquellos que inducen enzimas que requieren del grupo hemo como el CYP-450; dentro de los cuales se destacan la fenitoína, carbamazepina, fenobarbital, topiramato, lamotrigina y tiagabina puesto que pueden empeorar los ataques de PAI12. Se considera como opción segura para el tratamiento anticonvulsivo el levetiracetam, puesto que no tiene metabolismo hepático y no ha mostrado exacerbar las crisis agudas12.
Conclusiones
La porfiria aguda intermitente es una enfermedad infrecuente con un espectro clínico muy amplio, que debido a la poca especificidad de sus manifestaciones puede llevar a diagnóstico y tratamiento tardío, con posibles consecuencias adversas para el paciente. Este caso resalta la relación infrecuente entre la porfiria aguda intermitente y el síndrome de encefalopatía posterior reversible (PRES), en una paciente con crisis de dolor abdominal recurrente, disautonomía, convulsiones, ceguera cortical y neuropatía axonal motora, síntomas que asociados nos deben sugerir estos diagnósticos.
Conflicto de intereses
Los autores declaran no presentar conflicto de intereses.
Referencias
1. PUY H, GOUYA L, DEYBACH J-C. Porphyrias. Lancet Lond Engl. 2010;375(9718):924-37. [ Links ]
2. PISCHIK E, KAUPPINEN R. Neurological manifestations of acute intermittent porphyria. Cell Mol Biol Noisy--Gd Fr. 2009;55(1):72-83. [ Links ]
3. ELDER GH, SANDBERG S. Identifying acute porphyria in patients with acute polyneuropathy or encephalopathy. Nat Clin Pract Neurol. 2008;4(12):648-9. [ Links ]
4. COOPER D, BALL E, STENSON P, PHILLIPS A, ET AL. The Human gene mutation Database. Institute of Medical Genetics in Cardiff [Internet]. Recuperado a partir de: http://www.hgmd.cf.ac.uk/ac/index.php. [ Links ]
5. BICKNELL SG, STEWART JD. Neuroimaging findings in acute intermittent porphyria. Can J Neurol Sci J Can Sci Neurol. 2011;38(4):656-8. [ Links ]
6. KANG S-Y, KANG J-H, CHOI JC, ET AL. Posterior reversible encephalopathy syndrome in a patient with acute intermittent porphyria. J Neurol. 2010;257(4):663-4. [ Links ]
7. LAKHOTIA M, PAHADIYA HR, SINGH J, ET AL. Posterior reversible encephalopathy syndrome as a rare presenting feature of acute intermittent porphyria. Neurol India. 2015;63(4):607-9. [ Links ]
8. PAZ-ABDALA J, VERGARA M, ROMERO-VARGAS A, ET AL. Porfiria intermitente aguda, presentación de un caso en la Fundación Cardio-Infantil. Acta. Neurol Colomb. 2004;20(4):203-5. [ Links ]
9. NI J, ZHOU L-X, HAO H, ET AL. The clinical and radiological spectrum of posterior reversible encephalopathy syndrome: a retrospective series of 24 patients. J Neuroimaging Off J Am Soc Neuroimaging. 2011;21(3):219-24. [ Links ]
10. CELIK M, FORTA H, DALKILIÇ T, ET AL. MRI reveals reversible lesions resembling posterior reversible encephalopathy in porphyria. Neuroradiology. 2002;44(10):839-41. [ Links ]
11. BHAT JI, QUREESHI UA, BHAT MA. Acute intermittent porphyria with transient cortical blindness. Indian Pediatr. 2010;47(11):977-8. [ Links ]
12. ZHAO B, WEI Q, WANG Y, ET AL. Posterior reversible encephalopathy syndrome in acute intermittent porphyria. Pediatr Neurol. 2014;51(3):457-60. [ Links ]
13. MARAMATTOM BV, ZALDIVAR RA, GLYNN SM, ET AL. Acute intermittent porphyria presenting as a diffuse encephalopathy. Ann Neurol. 2005;57(4):581-4. [ Links ]
14. MUTYABA A, GARDINER E, MURPHY S. A case of blinding abdominal pain. South Afr Med J Suid-Afr Tydskr Vir Geneeskd. 2011;101(7):454-5. [ Links ]
15. SHEN F-C, HSIEH C-H, HUANG C-R, ET AL. Acute intermittent porphyria presenting as acute pancreatitis and posterior reversible encephalopathy syndrome. Acta Neurol Taiwanica. 2008;17(3):177-83. [ Links ]
16. SOYSAL A, DOGAN P, DAYAN C, ET AL. Reversible MRI findings of porphyric encephalopathy. A report of two cases. Neuroradiol J. 2008;21(5):655-9. [ Links ]
17. UTZ N, KINKEL B, HEDDE JP, ET AL. MR imaging of acute intermittent porphyria mimicking reversible posterior leukoencephalopathy syndrome. Neuroradiology. 2001;43(12):1059-62. [ Links ]
18. KING PH, BRAGDON AC. MRI reveals multiple reversible cerebral lesions in an attack of acute intermittent porphyria. Neurology. 1991;41(8):1300-1300. [ Links ]
19. FUGATE JE, RABINSTEIN AA. Posterior reversible encephalopathy syndrome: clinical and radiological manifestations, pathophysiology, and outstanding questions. Lancet Neurol. 2015;14(9):914-25. [ Links ]
20. CADAVID-ALJURE D, CAICEDO-PAREDES A, GRANADOS A, ET AL. Tacrolimus asociado a encefalopatía posterior reversible atípica y hemorragia cerebral en receptor de transplante renal. Nefrología. 2012;32(6):861-3. [ Links ]
21. GRANADOS A, BUENO J, ACOSTA D. Síndrome de encefalopatía posterior rreversible (PRES) en pacientes sometidos a cirugía cardiovascular. Rev Colomb Radiol. 2012;23(1):3432-9. [ Links ]
22. MALENA GRILLO-ARDILA, MARTÍNEZ-VELÁSQUEZ M, GRILLO-ARDILA C. Síndrome de encefalopatía posterior reversible (PRES) durante la gestación. Acta. Neurol Colomb. 2010;26(4):202-9. [ Links ]
23. GONZALEZ G. Síndrome de encefalopatía posterior reversible, ¿siempre reversible?. Acta. Neurol Colomb. 2010;26(4):173-5. [ Links ]
24. SILVA F, RUIZ P, ECHEVERRÍA L, ET AL. Sindrome de encefalopatía posterior reversible en un paciente transplantado: reporte de caso. Acta. Neurol Colomb. 2011;27(1):46-54. [ Links ]