Introducción
El embarazo y el puerperio corresponden a periodos de alto riesgo trombótico; exacerbado por el compromiso de lo que se conoce como triada de Virchow con hipercoagulabilidad, lesión endotelial y estasis de flujo venoso, así como el incremento de los factores inhibidores de la fibrinólisis, los factores de la coagulación, fibrinógeno y dímero D en preparación a los estados de sangrado y la estasis vascular dado el aumento de cerca del 50% del volumen plasmático, llevando finalmente a un desbalance en la hemostasia y la formación de trombos1.
Teniendo en cuenta los múltiples cambios fisiológicos que se dan en el puerperio y durante el embarazo, los eventos tromboembólicos pueden aumentar hasta 5-10 veces, y ser aún más frecuentes si presentan comorbilidades asociadas tales como preeclampsia, obesidad o sepsis durante la gestación2-5, haciendo que el embarazo constituya un periodo de alto riesgo para desarrollar patologías que sustancialmente pueden requerir terapia anticoagulante.
Los tres principales escenarios clínicos son: la enfermedad tromboembólica venosa, las trombofilias y las usuarias de válvulas mecánicas. En primer lugar la enfermedad tromboembólica venosa (ETV) que se define como un conjunto de alteraciones que comprenden la trombosis venosa profunda tanto de miembros superiores como inferiores, y el embolismo pulmonar. La incidencia de ETV aumenta a lo largo de todos los trimestres del embarazo, pero es más alta durante el período posparto1.
Las agencias de cooperación internacional redactan cada 15 años las razones de mortalidad materna, la última del 2015 muestra como el 14,9% de muertes maternas a nivel mundial son relacionadas con los eventos tromboembólicos2. Siendo la principal causa de muerte materna en los países desarrollados o de altos ingresos, con una incidencia en reportes oficiales de alrededor de 0,76 a 1,72 por cada 1000 embarazos, de los cuales el 50% ocurren antes de las 20 semanas de gestación. En los países de medianos y bajos ingresos los reportes no están tan claros dado que se da una tendencia a priorizar el reporte de las enfermedades más comunes como lo son la hemorragia postparto, los trastornos hipertensivos y la sepsis; tres eventos que pueden predisponer al desarrollo de enfermedades tromboembólicas, en donde el diagnóstico final de estas muertes podría ser sin lugar a duda el diagnóstico de tromboembolismo pulmonar no detectado3.
En Colombia, el perfil de las causas agrupadas de mortalidad materna muestran a los eventos tromboembólicos dentro de las 4 principales causas con un 3,6%6. Estas estadísticas colombianas han logrado mostrar grandes avances en cuanto a la reducción de la muerte materna; se evidencia una modificación en el perfil epidemiológico, según los reportes dados por el instituto nacional de salud en el 2015 los eventos tromboembólicos se empiezan a perfilar como una importante causa tanto directa como indirecta de muerte materna. Pero existe una población muy alta de pacientes que fallecen por una causa no determinada, y se sospecha que podrían estar relacionadas con esta patología7,8.
En segundo lugar; las trombofilias se dividen en heredadas y adquiridas; en donde la principal adquirida corresponde al síndrome antifosfolípido; una enfermedad autoinmune sistémica caracterizada por la presencia de trombosis venosa o arterial y/o pérdida del embarazo en presencia de anticuerpos antifosfolípidos positivos (anticoagulante lúpico, anticardiolipina y B2 glicoproteina) y el uso o no de anticoagulación en este grupo poblacional dependerá de la presencia o no de morbilidad fetal y/o trombosis asociada; en cuyo caso la elección del anticoagulante es por lo general heparina de bajo peso molecular9. Por último; pacientes usuarias de válvulas cardiacas protésicas principalmente mecánicas se asocian con un mayor riesgo tromboembólico durante el embarazo y la anticoagulación terapéutica se hace crucial para reducir el riesgo de este tipo de complicaciones; así como la elección del anticoagulante a usar que usualmente es warfarina si requiere de dosis bajas o heparina de bajo peso molecular de lo contrario como veremos más adelante10.
Las mujeres en el periodo del embarazo y/o postparto que van a requerir una terapia anticoagulante incluyen mujeres con alto riesgo de trombosis venosa profunda, mujeres con válvulas cardíacas protésicas, disfunción ventricular izquierda y algunas mujeres con pérdida fetal recurrente; siendo de suma importancia tener en cuenta la seguridad fetal y los problemas del periparto materno con el uso de los mismos (Inicio imprevisto del trabajo de parto, uso de anestesia neuroaxial, vía del parto, riesgo de sangrado); sin embargo, no se conocen estudios recientes en nuestro medio que nos aborden de una manera global e integral el mismo por lo que el objetivo de este artículo es realizar una revisión de los fármacos anticoagulantes, describir los avances en cuanto al uso y manejo de los mismos en cada uno en los principales escenarios clínicos durante la concepción, embarazo y postparto; así como dar a conocer los aspectos a tener en cuenta en las mujeres que reciben esta terapia, su seguridad durante la gestación y el papel que tiene cada uno en los diferentes escenarios clínicos más comunes durante estas etapas.
Metodología de búsqueda
La búsqueda se realizó en Pubmed y Cochrane con las palabras clave descritas: Embarazo, Anticoagulante, Válvulas protésicas mecánicas, Síndrome antifosfolípido, Tromboembolia, Trombosis. Teniendo como base artículos en español o inglés, publicados en los últimos 5 años (2013-2018). Se encontraron 324 artículos, de los cuales se excluyeron los duplicados y aquellos que no eran de acceso libre y según lo evidenciado en cada resumen. Se incluyeron revisiones sistemáticas, artículos originales, monografías y se escogieron los que permitían el acceso completo, actualizados, de cada uno de los temas escogidos tales como epidemiología, etiología, diagnóstico y tratamiento, quedando finalmente 45 referencias bibliográficas. (Ver Figura 1)
Desarrollo del tema
Anticoagulantes y su uso durante el embarazo
La terapia anticoagulante es la intervención terapéutica farmacológica que actúa en cada fase de la hemostasia con el fin de corregir aquellas causas que desencadenen la tendencia trombótica. Según la FDA (Food and Drug Administration) los medicamentos administrados durante el embarazo y el puerperio tienen una clasificación de riesgo, este; compuesto por 5 categorias cada una con su letra, en ascenso según su riesgo estimado (A, B, C, D y X), siendo la categoría A usualmente seguros en el embarazo, y los de la categoría X contraindicados por conocerse sus efectos deletéreos en el feto11.
Estos anticoagulantes pueden dividirse según su mecanismo de acción, de tal forma que se cuentan con los siguientes1,12 (Ver Figura 2).
Los inhibidores indirectos como la heparina no fraccionada (HNF), heparina de bajo peso molecular (HBPM) y fondaparinox, tienen un efecto indirecto sobre la trombina; cuya actividad está mediada por cofactores plasmáticos y ejercen su actividad anticoagulante potenciando la antitrombina (un inhibidor endógeno de diversos factores de coagulación activados). Los anticoagulantes parenterales indirectos son los más estudiados en el embarazo y lactancia, y se catalogan como categoría B (Estudios de reproducción en animales no han demostrado riesgo para el feto, no existen estudios controlados en embarazadas y se acepta su uso). Los tres anticoagulantes parenterales aprobados por la FDA, son Heparinas no fraccionadas, Heparinas de bajo peso molecular, fondaparinox y este último, usado solo en caso de contraindicación de heparina12-15. Las heparinas no cruzan la barrera fetoplacentaria ni se excretan a través de la leche materna, la HBPM tiene vida media variable, de 4 a 6 horas con 90-100% de biodisponibilidad comparada con un 30% en la HNF. Los efectos adversos se pueden dividir en 4 categorias8,13-16:
-
Asociadas a sobredosis; la principal es el sangrado que dependiendo de la cantidad del mismo puede solucionarse desde la simple suspensión del medicamento hasta el uso de antídotos como el sulfato de protamina.
Asociadas al uso prolongado; en donde por inducción de la reabsorción ósea acelerada, puede verse hasta después de 3 meses de uso, generando así osteoporosis.
Asociados a formación de complejos inmunes: El cuadro se desarrolla luego de 5 días de tratamiento con heparina en hasta el 5% de los pacientes, y se puede e puede evitarse acortando el tiempo de su utilización al imbricar precozmente la infusión de heparina con los anticoagulantes orales.
Asociado a impurezas en la mezcla en donde se puede presentar urticaria.
El uso de las HNF se reduce a aquellas pacientes con tasa de filtración glomerular menor a 30 o cuando hay un alto riesgo de sangrado que requiera una suspensión y reversión rápida de anticoagulación10.
Al ser más pequeñas que la heparina no fraccionada, las HBPM tienen menor unión celular y se depurán más lento, se absorben mejor por vía subcutánea y su unión a proteínas plasmáticas es menor, junto con una mejor dosis-respuesta. Por lo que se deduce su uso se prefiere ya que pueden usarse sin monitorización de laboratorio y tienen una relación dosis-respuesta más predecible13.
El seguimiento depende del mecanismo de acción, con HNF su monitoreo es con la medición del tiempo de tromboplastina parcial (60 a 85 segundos), mientras que con HBPM y en muy pocas ocasiones para el fondaparinox es con medición del factor anti Xa (valores normales 0.5 a 1 iu/ml) debido a su mecanismo de acción basado principalmente en cofactores de forma indirecta; generalmente en aquellas que se encuentren en escenarios de alto riesgo trombótico13. El fondaparinox es de segunda linea en casos de hipersensibilidad grave a heparinas o Trombocitopenia inducida12,14-17.
• Inhibidores de la síntesis de las proteínas vitamina K dependientes (warfarina): Si bien la warfarina es considerada categoría D en el embarazo (evidencia de daño fetal en humanos, ocasiones en las que el beneficio supera los riesgos)11, este medicamento es especialmente útil en mujeres con alto riesgo trombótico como las usuarias de válvulas mecánicas cardíacas, en donde el beneficio de su uso es mayor al riesgo según la edad gestacional y dosis16. Los antagonistas de vitamina k (AVK) cruzan la barrera fetoplacentaria generando múltiples efectos en el feto (de predominio entre la semana 6-8 de gestación); dentro de los que se encuentran el llamado síndrome fetal cumarínico, que se caracteriza por microcefalia, hipoplasia medio- facial, epífisis punteadas hipoplasia de uñas y falanges (braquidactilia) entre otros como bajo peso al nacer, convulsiones, tono muscular bajo, dificultad para desarrollarse12-17. Se consideran dosis seguras las menores a 5mg/día durante el primer trimestre de embarazo o prenatal por lo que podrían usar el medicamento y para aquellas pacientes con alto riesgo trombótico y dosis más altas a estas ( >5mg/día) se considera realizar el cambio a HBPM. Durante las 3 semanas ante parto aquellas que tomen Warfarina deben pasar a HNF o HBPM para reducir el riesgo sangrado mayor por trauma durante el parto y hemorragia fetal10,12,16,17.
• Los Inhibidores directos: (bivalirudina, argatroban) que no requieren cofactores de plasma para expresar su actividad, en donde su objetivo es la trombina. Y los inhibidores del factor Xa como el rivaroxabán, apixaban, edoxaban y el inhibidor de trombina, dabigatran, que corresponden a los nuevos anticoagulantes orales que no deben usarse durante el embarazo, o periodo de lactancia debido a mayores riesgos reproductivos en estudios con animales y datos no suficientes de seguridad en humanos18. El dabigatran y apixaban, cruzan de forma rápida la barrera fetoplacentaria generando concentraciones casi del 30-90% comparadas con las concentraciones maternas, con riesgos evidenciados en animales de alteración en la fertilidad, reducción en implantación y sangrado19,20. En cuanto al rivaroxabán, los estudios en animales han mostrado: aborto postimplantación, disminución del peso corporal fetal y aumento en la resorción ósea; sin embargo, esto a dosis 4 veces mas alta que la usada en humanos. Aunque estudios recientes de calidad limitada sugieren seguridad en mujeres que se exponen inadvertidamente al inicio del embarazo, por ausencia de alteraciones fetales y neonatales; dado la falta de evidencia, se recomienda en aquellas que quedan en embarazo, cambiar el método de anticoagulación y realizar una evaluación ecográfica detallada para evaluar el desarrollo fetal21.
En la actualidad, es mayor el uso de nuevos anticoagulantes orales (NACOS) como alternativas más seguras que los AVK. Por esto las mujeres en edad fértil, deben tener vigilancia estrecha por la evidencia limitada en cuanto su uso durante lactancia y embarazo, por riesgos descritos de embriopatía y teratogenicidad18.
Ya conociendo cuales son los anticoagulantes disponibles, su mecanismo de acción y la seguridad en el embarazo entraremos en materia con los tres escenarios clínicos mas frecuentes que requieren anticoagulación:
1. Embarazada con enfermedad tromboembólica venosa
La enfermedad tromboembólica venosa se encuentra dentro de las principales causas de muerte en países en vía de desarrollo como Colombia, superado por los trastornos hemorrágicos, hipertensivos y la sepsis; mientras que en países desarrollados está dentro las 3 principales causas de muerte4-6. Generando tambien efectos en la morbilidad materna en donde tienen condiciones de difícil manejo tales como síndrome postrombótico que puede desarrollarse hasta en el 80% de los casos, y 60% insuficiencia venosa a los 5 años de seguimiento22. La incidencia es de 0,76 a 1,72 por cada 1000 embarazos presentándose la gran mayoría en el primer trimestre, y anteparto, con un riesgo de hasta del 33% en el puerperio (mas frecuente la embolia pulmonar)5,7,23-25. La EP ocurre hasta en 25% de las TVP no tratadas, correspondiendo en el embarazo un 0.05% y una mortalidad asociada hasta del 15%24-28. Los factores que aumentan el riesgo son: edad mayor a 35 años, raza negra, obesidad y comorbilidades como: trombofilias, antecedente de trombosis, y síndrome antifosfolípido, los cuales aumentan el riesgo más de 15 veces22-24. El embarazo es un factor de riesgo independiente para enfermedad tromboembólica venosa, aun así, no se recomienda la anticoagulación terapéutica ni profiláctica de rutina, restringiéndola a eventos trombóticos o adicionales factores de riesgo para enfermedad tromboembólica venosa27-30.
La concientización alrededor de esta entidad es muy importante para poder hacer una presunción diagnostica y con esto un tratamiento empírico temprano y oportuno. Su diagnóstico en el embarazo es difícil, dado que sus síntomas son a menudo frecuentes durante la gestación como edema en miembros inferiores, disnea subjetiva y taquicardia.
Por lo tanto, la sospecha basada en disnea súbita no explicada, hemoptisis y/o dificultad respiratoria de causa no definida deben ser hallazgos de alarma para iniciar el abordaje diagnóstico1,28,29. La mayor parte de los casos se producen en extremidades inferiores con predisposición de la extremidad inferior izquierda en el 88% secundario a la compresión anatómica de la vena iliaca izquierda y arterias iliacas y ováricas derechas que cruzan, así como la desviación uterina hasta este lado. En la mayoría se generan en venas proximales y 46% originados de las venas femorales e ilíacas31.
El tratamiento de elección son las heparinas, las cuales se inician tan pronto se sospecha clínicamente y se suspenden hasta que se descarte mediante pruebas objetivas 29,30. La dosis recomendada de HBPM se debe ajustar según el peso cada 12 o 24 horas. En casos en que se requiera el uso de HNF por más de 5 días, se recomienda el recuento de plaquetas los días 4-14 y cada 72 horas con el fin de detectar eventos adversos1,27(Ver Tabla 1).
Tabla 1. Características y dosis de las heparinas en enfermedad tromboembólica venosa

Fuente: adaptado de referencias 1, 12 y 27.
El parto por cesárea duplica el riesgo de enfermedad tromboembólica venosa, y el uso de terapia anticoagulante durante el mismo no aumento el sangrado e incluso llamativamente se asoció con menor porcentaje de infecciones de sitio operatorio, por esto no se debe retrasar la cesárea en caso de emergencia según su indicación obstétrica1,22. La anticoagulación durante el periparto se ha asociado a complicaciones hemorrágicas obstétricas hasta del 12,8%, incluyendo aumento en hemorragia postparto (10%) y hematomas perineales (3%)32. Sin embargo, estos riesgos no contraindican su uso; se debe reducir los mismos con el cambio a Heparina no fraccionada y realizar suspensión previa al parto según vida media, con el fin de disminuir estos riesgos; así como conocer los tiempos necesarios para insertar o retirar un catéter para analgesia27,33(Ver Tabla 2).
Tabla 2. Tiempos entre la inserción y retiro del catéter para analgesia
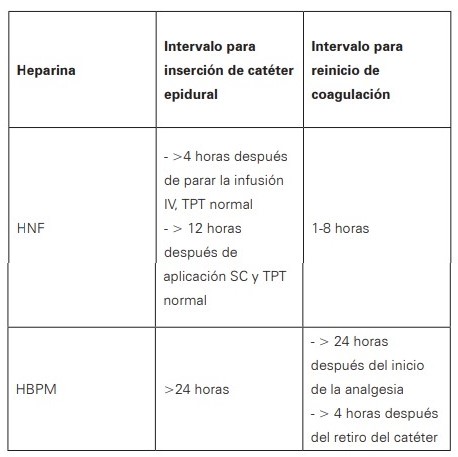
Fuente: adaptado de referencias 27 y 33.
La duración del tratamiento anticoagulante se debe dar según cada indicación durante el embarazo al menos 6 semanas postparto (mínimo 3 – 6 meses de tratamiento). En el periodo de lactancia se puede continuar el tratamiento con warfarina y/o heparina ya que no se excretan en la leche materna y no inducen algún efecto anticoagulante en lactante34,35.
2. Embarazada con trombofilias
Las trombofilias se clasifican en adquiridas y heredadas36. Factores como la hipercoagulabilidad, una carencia de antitrombina III, proteína C o proteína S, son responsables del 20% de los episodios tromboembólicos recurrentes. Se conoce que hasta en el 70% de los embarazos de pacientes con una deficiencia hereditaria de antitrombina III o déficit del factor V de Leiden pueden presentar complicaciones tromboembólicas, y hasta un tercio de las que presentan déficit de proteína C, hiperhomocisteinemia y los anticuerpos antifosfolípidos persistentes36-38.
Todas estas patologías representan un alto riesgo de complicaciones neonatales como perdida gestacional temprana/tardía, preeclampsia y abruptio de placenta36,40. Es por esto, que existe indicación para tamización de trombofilias en pacientes con factores de riesgo como: pérdida gestacional recurrente, preeclampsia grave, historia de muerte in útero o RCIU de causa no explicada36-38.
Dentro de las trombofilias adquiridas, la patología más frecuentemente asociada corresponde al Síndrome de Anticuerpos Antifosfolípido (SAF), enfermedad autoinmune caracterizada por trombosis vascular y/o morbilidad del embarazo con presencia persistente de autoanticuerpos contra las proteínas de unión a los fosfolípidos (anticuerpos anticardiolipina, AntiB2 glicoproteína y/o anticoagulante lúpico). Así mismo, puede ser clasificada en primaria (sin evidencia clínica ni paraclínica de cursar con otra condición definida) o secundaria (infecciones, neoplasias, enfermedades autoinmunes u otros). La manifestación clínica más frecuente corresponde a la trombosis venosa (65-70%). Estudios prospectivos evidencian que los fenómenos trombóticos se presentan en 5-12% durante el embarazo y puerperio, aunque en algunas cohortes, se ha evidenciado hasta un 25% de casos. La trombosis arterial también se presenta en SAF y puede ocurrir en sitios atípicos: arteria retiniana y subclavia38-40.
Aunque los anticuerpos antifosfolípidos están clínicamente vinculados al SAF, no está claro si están involucrados en la patogénesis (se sabe que hasta el 5% de los individuos sanos tienen anticuerpos positivos), y de estos, <1% desarrollarán eventos trombóticos cada año40,41.
Para el diagnóstico, se han realizado consensos por expertos para establecer los criterios clínicos y de laboratorio para poder clasificar a las pacientes; por primera vez se describieron en 1999 (Sapporo), actualizados posteriormente en el 2006 (Sydney) que son los que son más tenidos en cuenta en la literatura, aumentando el diagnóstico a un 3-9% comparados con los anteriores. Para su diagnóstico se requiere de al menos un criterio clínico y de laboratorio y que transcurra menos de 12 semanas o más de 5 años.9,39 (Ver Tabla 3).
En pacientes con SAF, se conocen factores de gravedad tales como: triple positividad, historia de evento trombótico, historia de trombosis y morbilidad obstétrica, altos títulos de anticuerpos anticardiolipina o B2 glicoproteína, así como la asociación con lupus. Se recomienda realizar una evaluación preconcepcional adecuada, ecografía mensual, ecografía Doppler desde la semana 28 cada 15 días, perfil biofísico semanal desde la semana 32 y a evaluar niveles de complemento cada trimestre9,38.
El tratamiento de estas pacientes se basa principalmente en si tiene o no antecedente de evento trombótico, en cuyo caso se recomienda el uso de dosis profiláctica de HBPM y/o ácido acetil salicílico, con el fin de reducir la pérdida del embarazo hasta en un 50% y eventos trombóticos un 40%9,38 (Ver Figura 3). Desde un 15% de las pacientes con historia de perdida gestacional recurrente con anticuerpos positivos persistentes sin tratamiento hasta un 90% tendrá nuevamente pérdida del embarazo. La combinación de HBPM + ASA a dosis bajas promueve la implantación del embrión en las etapas tempranas del embarazo, y además protege contra la trombosis de la vasculatura uteroplacentaria9,38,41.
Tabla 3. Criterios Diagnósticos para SAF

Fuente: Adaptado de Bulletins-Obstetrics, American & Gynecologists, Obstetricians. (2012). Practice Bulletin No. 132: Antiphospholipid syndrome. Obstet Gynecol. 120. 1514-1521. 10.1097/01.AOG.0000423816.39542.0f.
3. Embarazada con enfermedad cardíaca valvular
La enfermedad valvular corresponde a la principal causa de enfermedad cardíaca durante el embarazo en los países en desarrollo. La prevalencia de la misma es <1%, sin embargo, pueden aumentar el riesgo de eventos adversos maternofetales. Esta patología se asocia con alta tasa de morbimortalidad materna con requerimiento de anticoagulación permanente; un 42% tienen un parto complicado por arritmias, insuficiencia cardíaca, sangrado pre y postparto, complicaciones tromboembólicas e incluso la muerte por inadecuada anticoagulación10,16. La enfermedad cardíaca reumática es muy frecuente en los países en vía de desarrollo con una prevalencia de hasta el 90% del total de las enfermedades cardíacas, siendo las usuarias de válvulas mecánicas las que necesitan de anticoagulación permanente por su alto riesgo trombótico. La evaluación preconcepcional en estas pacientes juega un papel importante, cuando la paciente ya está embarazada, se debe individualizar el tratamiento y discutir con la paciente las diferentes opciones de anticoagulación10,42. Existen múltiples esquemas de tratamiento ya estudiados; el primero se basa en el uso de warfarina sola (dosis bajas o altas), el segundo en el uso de heparinas durante todo el embarazo y por último el esquema secuencial (Heparina+ warfarina)10,43.
El uso de warfarina durante el embarazo se asocia a una menor complicación materna dado el alto riesgo trombótico en este grupo de pacientes, mientras que las heparinas son los más seguros para el feto. Dicho esto, se recomienda la warfarina para el segundo y tercer trimestre del embarazo, y su uso en el primer trimestre se considera en aquellos casos en donde la dosis diaria es ≤ 5 mg (riesgo de embriopatía <3%). Con dosis > 5 mg/día, se conocen eventos adversos fetales cinco veces mayores así como aborto espontáneo (26,7%); por lo que es de suma importancia llegar a un acuerdo con la madre después de exponer los riesgos y beneficios del tratamiento42,43. El esquema de HNF en el primer trimestre, seguido por warfarina en el segundo y tercer trimestre, podría ser razonable para gestantes que reciben dosis altas de warfarina. Ninguno de estos tratamientos es inocuo; por su parte, el uso de heparinas puede evitar el riesgo de embriopatía, pero se asocia con incremento de trombosis valvular y embolia10,43.
En la semana 36 de gestación se sugiere realizar el cambio a algún tipo de heparina con el fin de reducir la anticoagulación fetal, ya que la warfarina cruza la placenta; si el trabajo de parto se inicia sin haber podido realizar el cambio, se debe realizar parto por cesárea para disminuir el riesgo de sangrado cerebral fetal al pasar por el canal del parto10,17,42. Los niveles anti Xa se deben monitorizar y realizar 36 horas antes del parto en aquellas pacientes con HBPM, y en aquellos con HNF la infusión se suspenderá cuatro a seis horas antes del parto y se reiniciará nuevamente cuatro a seis horas después del mismo. Los niveles de antiXa recomendados para mantener su actividad varían dependiendo de las pautas que se prefieran siendo para la sociedad americana entre 0,8-1,2 u/ml44,45.
Se debe tener en cuenta que la gran mayoría de los estudios en los que se basan las recomendaciones son con evidencia de calidad baja a moderada, ya que para la gran mayoría de de las intervenciones se encontraron un número escaso de estudios, en particular por el hecho de que los estudios no son realizados en pacientes en gestación. Es necesario realizar más estudios de investigación para comparar directamente los fármacos sistémicos entre sí y así evaluar directamente los perfiles de seguridad.
Conclusiones
El embarazo constituye un factor de riesgo importante para el desarrollo de enfermedad tromboembólica, y mujeres en edad fértil están susceptibles a presentar diferentes patologías que requieran de anticoagulación profiláctica o terapéutica, sin embargo, estos no se indican de rutina. Se hace necesario recordar que las heparinas de bajo peso molecular son el medicamento de elección para y con mayor seguridad en la mayoría de los escenarios clínicos realizando la medición de niveles antiXa en pacientes específicos (insuficiencia renal crónica, obesidad). Por otro lado, todas las pacientes con prótesis mecánicas deben recibir anticoagulación terapéutica continua con monitoreos frecuentes. En aquellas con prótesis mecánicas que se suspenda la warfarina entre la semana 6 y 12 (dosis >5 mg/día), deben recibir HNF o HBPM con dosis ajustadas.