INTRODUCCIÓN
En la actualidad, el infarto, la trombosis, la diabetes y la hipertensión se cuentan entre las 10 primeras causas de muerte en Colombia. Durante el periodo 2005 - 2011, las enfermedades cardiovasculares (ECV) fueron la primera causa de muerte en la población colombiana, con 29,69% del total de muertes, siendo una de las primeras causas de discapacidad y pérdida laboral1. El origen de estas patologías es multifactorial, con un componente genético y factores medio-ambientales que interactúan contribuyendo a la susceptibilidad individual a estas enfermedades.
Diversos estudios epidemiológicos y clínicos han logrado demostrar que los niveles elevados de triglicéridos (TAG), son un factor de riesgo independiente para ECV2,3. Estos niveles están regulados por factores genéticos y medio-ambientales, produciendo variabilidad en la población4. Una molécula involucrada en el metabolismo de los TAG es la lipoproteína lipasa (LPL), enzima que se encarga de la hidrólisis de los TAG transportados por la VLDL y el quilomicrón hasta ácidos grasos libre y glicerol, con el objetivo de aportar sustrato energético a los tejidos periféricos5. La LPL es sintetizada por los tejidos periféricos y liberada a la circulación, posteriormente se ancla al endotelio vascular adyacente unido al heparán sulfato6,7. Para llevar a cabo su actividad catalítica sobre las lipoproteínas ricas en TAG, la LPL necesita de varias moléculas entre las que se cuentan APOA5 y APOCII que permiten el anclaje y actividad de la enzima sobre los TAG presentes en las lipoproteínas6,7.
La APOA5 es una proteína de la familia de las apoproteínas, formada por 366 aminoácidos, con un peso molecular de 39 kDa. Es sintetizada en el hígado para luego aparecer en circulación asociada como dímero a lipoproteínas ricas en TAG como la VLDL, así como en la HDL. Aunque su mecanismo no es claro, funciona como activador de la LPL, contribuyendo al control de los niveles de TAG circulantes, presentes en el quilomicrón y la VLDL. El gen de la APOA5 hace parte del clúster APOA1/CIII/AIV localizado en el cromosoma 11 región q23 y está formada por cuatro exones que codifican para un marco de lectura de 1107 pb7. Cuatro polimorfismos de la APOA5 se han reportado asociados de manera diferencial a niveles anormales de TAG en humanos en diversos grupos étnicos8,9. El polimorfismo S19W (rs 3135506), incluye la sustitución de una citosina por una guanina en el nucleótido 56 del codón 19, lo que resulta en el cambio de una serina por un triptófano10, ocasionando la disminución de la actividad de la APOA5; esto lleva a una hipertrigliceridemia marcada y a un riesgo mayor para ECV10,11. Sin embargo, existen reportes sobre la no relación del polimorfismo S19W de la APOA5 con la ECV, por tanto, esta asociación no está del todo determinada12. La prevalencia de este polimorfismo ha sido estimada en un 6% en individuos caucásicos, 7% en afroamericanos y 15% en hispanos13-15.
Hasta el momento no se ha reportado la prevalencia de este polimorfismo y su relación con la hipertrigliceridemia en la población colombiana. Si se tiene en cuenta las diferencias dietarias que caracterizan nuestra cultura y la variabilidad genética producto del mestizaje, la influencia de este polimorfismo puede ser diferente para la población colombiana en relación al resto del mundo. Este estudio tuvo como objetivo explorar la relación existente en población colombiana que porta el polimorfismo S19W (Ser19Ter) y la hipertrigliceridemia, como un aporte inicial al estudio del impacto genético en el metabolismo de los lípidos.
Estudio tipo Corte Transversal, que incluyó 400 individuos con edades entre 19 y 69 años, colombianos, residentes en Bucaramanga, participantes en los estudios CARMEN (Conjunto de Acciones para la Reducción Multifactorial de Enfermedades Crónicas no Trasmisibles), e INEFAC (Incidencia de Enfermedades Cardiovasculares y de sus Factores de Riesgo), la muestra se seleccionó al azar a partir de la base de datos de CARMEN e INEFAC. Después de explicar las condiciones del ensayo y haber firmado un consentimiento informado, cada participante fue sometido a un periodo de ayuno de 10 a 12 horas, para posteriormente tomarle una muestra de sangre en tubo seco utilizada para el análisis bioquímico y en tubo EDTA como anticoagulante, para el análisis genético. El tubo seco fue centrifugado a 3000 rpm durante 15 minutos. El suero obtenido fue alicuotado y almacenado a -20°C hasta el momento de su análisis.
El proceso de análisis molecular, se inició con la extracción de ADN utilizando el kit ProFiler Forensic DNA®. Para la identificación del polimorfismo S19W (Ser19Trp) se amplificó un fragmento de 268 pb mediante técnica de PCR, utilizando como cebadores 5’-CCAGCTGTCTCCTCCCTTC-3’(F) y 5’-TCTCCGACCCTGACTTCAAC-3’(R). La identificación del polimorfismo se efectuó mediante mini secuenciación del fragmento amplificado, empleando un kit de SNaPshot Multiplex® (Applied Biosystems), utilizando un secuenciador ABI PRISM® 310 (Applied Biosystems). Los tres perfiles característicos, se identificaron en el electroferograma por el color del marcador utilizado: negro para guanina (G), azul para citosina (C) y un patrón mixto para el heterocigoto guanina citosina (GC). Para cuantificar la concentración de triacilgliceridos en la muestra se utilizó la técnica colorimétrica, enzimática, GPO/POD (Wiener). Se consideró hipertrigliceridemia cuando los niveles plasmáticos de TAG son superiores a 150 mgr/dL
El análisis de los datos obtenidos se realizó utilizando el programa de análisis genético poblacional Arlequín 3.5.1.216; para las variables continuas se calculó la media ± desviación estándar. Además, se utilizó el test de Chi2 (X2) para el análisis de las variables no continuas y para verificar el equilibrio Hardy- Weinberg (EHW), el cual permitió corroborar que los individuos se aparearon al azar.
El control de calidad de los ensayos moleculares se hizo incluyendo en todas las pruebas controles positivos y negativos (Figura 1); la correcta genotipificación fue confirmada mediante la repetición al azar de un 20% de las muestras analizadas.
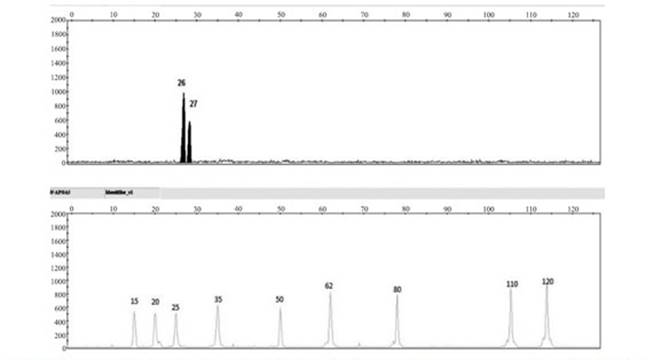
Figura1 Control positivo polimorfismo S19W (Ser19Ter). En el recuadro A se muestra los dos picos del control de 26 y 27 pb (color negro), marcados con el fluorocromo amarillo. En el recuadro B se observa en color naranja, la imagen del marcador de peso molecular (The GeneScan™ 120 Lyz® size standard)
RESULTADOS
El estudio incluyó 400 participantes, 272 (68%) hombres con edad promedio de 37,6 años. El 39,8% de los participantes (159) presentaron hipertrigliceridemia, mientras que en el 60,2% (241) se encontraron niveles normales (Tabla 1). Se determinó que los grupos analizados se encuentran en equilibrio de Hardy Weinberg. (Afectado X2=1,53; no afectado X2=0,58) lo que permitió inferir que los mismos representan la población en general.
El polimorfismo S19W (Ser19Ter) mostró tres perfiles, dos genotipos homocigotos CC y GG y uno heterocigoto CG. El genotipo CC correspondiente al mutado, presenta un pico de 27 pb, se encontró en el 2% de la muestra, y el genotipo GG correspondiente al ancestral, exhibe un pico de 26 pb, se encontró en el 73.4% del grupo analizado. El perfil heterocigoto CG se caracteriza por un pico 26 y otro de 27 pb, se detectó en el 24.6% de la población analizada (Figura 2).
Tabla 1. Concentraciones séricas de triglicéridos (TAG) de acuerdo con los genotipos de los sujetos afectados y no afectados.
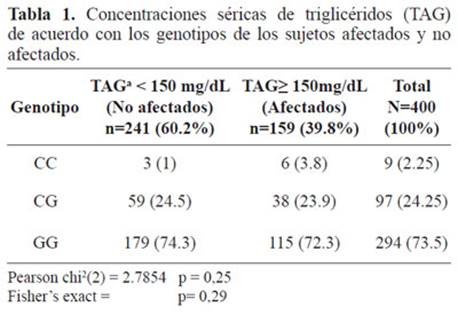
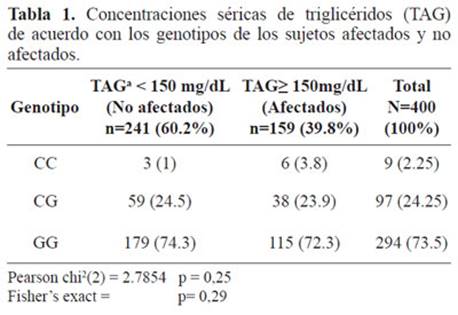

Figura 2. Electroferograma obtenido con los perfiles genéticos del amplificado del polimorfismo Ser19Trp de la ApoA5. La figura (a) muestra el perfil CC (pico en 27pb); (b) el perfil GC (picos en 26 y 27pb) y (c) el perfil GG (picos en 26 pb)
La distribución de los genotipos del polimorfismo S19W (Ser19Ter) se estableció para sujetos afectados con hipertrigliceridemia (TAG≥150 mg/dL) y no afectados. El genotipo GG fue el más frecuente en la población estudiada, tanto en afectados como no afectados, representando el 73,5% de la población estudiada, mientras el genotipo CC fue el menos frecuente para ambos grupos de individuos, representando solo el 2,2% de la población. No existen diferencias significativas en esta distribución cuando se comparan los dos grupos, (valor X2 = 2.7854, p =0.248). (Tabla 2).
Al comparar en la muestra analizada la distribución genotípica y la alélica, se encontró la forma ancestral del polimorfismo S19W (Ser19Ter), correspondiente a la forma homocigota GG, en el grupo de afectados, con un valor significativo (p= 0,002), igualmente se observó para la forma heterocigota CG (p=0.033), en los dos grupos analizados. Este hallazgo se correlaciona con lo observado en la distribución alélica de la muestra analizada, para el alelo G en el grupo de afectados el valor de p fue inferior a p<0,01. Las dos poblaciones, afectados y no afectados mostraron una distribución diferencial. (Tabla 2).
Al explorar la posible relación entre el polimorfismo Ser19Trp de la ApoA5 con los niveles elevados de TAG (≥ 150 mg/dL), se pudo demostrar la existencia de una estrecha relación entre estas dos variables (p<0,01).
DISCUSIÓN
Las enfermedades cardiovasculares representan el 29,6% del total de muertes en Colombia1, siendo las enfermedades isquémicas cardíacas la principal causa de estas muertes con un 8,16%, convirtiéndose en un problema de salud pública con carga económica para el Sistema Nacional de Salud. Las causas de las ECV son multifactoriales por tanto la prevención y el manejo clínico requiere de la identificación y control tanto de factores genéticos como medio ambientales responsables de manera directa o indirecta de su origen y progresión.
Los recientes avances en el estudio del componente genético de la ECV han contribuido a conocer mejor la historia natural de la enfermedad, y han fortalecido el interés sobre el análisis de los posibles genes implicados en su desarrollo, las variantes polimórficas de estos genes y su potencial como marcador de riesgo o de protección.
La asociación entre la hipertrigliceridemia, enfermedad cardiovascular y mortalidad ha sido controversial17,18,19. Diversos mecanismos se han propuesto para sustentar la hipertrigliceridemia como un factor de riesgo para ECV, entre los que se cuenta su asociación con niveles bajos de cHDL, el incremento en las cLDL pequeñas y densas y la insulino resistencia periférica20; adicionalmente la hipertrigliceridemia incrementa la producción de citoquinas pro inflamatorias, fibrinógeno y proteínas de la coagulación, fuertemente asociadas al aumento del riesgo de ECV21,22. La APOA5, descrita en 20016, alcanza concentraciones plasmáticas de 0,15µgr/ mL, y tienen un papel relevante en el metabolismo de los TAG. El Berkeley Lipid Study Population demostró que el polimorfismo S19W (Ser19Ter) de la APOA5 es tres veces más frecuente en varones y mujeres blancas con niveles elevados de triglicéridos al comparar con otras poblaciones similares10.
El estudio mostró que, en población colombiana, originada ésta en la mezcla de componente caucásico, negro, oriental y nativo, el genotipo GG de la ApoA5 es el más frecuente, tanto en afectados como no afectados, encontrándose en el 73,5% de sujetos analizados. El genotipo CC presentó la frecuencia más baja en ambas poblaciones, afectados y no afectados por hipertrigliceridemia (2,2%). Estos resultados no son similares a los encontrados en otras poblaciones23-27. Penachio reportó en norteamericanos e hispanos una frecuencia para el alelo mutado (C) del 15%, para caucásicos del 6%, para africanos y para americanos del 7%14. Ruiz, et al. informaron una frecuencia de 10,02% para el polimorfismo Ser19Trp (S19W), en población china, Malaya e hindú, 0,1%, 1% y 3% respectivamente. Andrade reportó que en poblaciones brasileras con componente mestizo la frecuencia del polimorfismo fue de 13,7%28, resultados que no coinciden con los obtenidos en este trabajo (73,26%), sin embargo, concuerdan con los datos reportados por el NCBI en una población de Estados Unidos (ESP) con 87,4%29.
La población estudiada se encontró en equilibrio de Hardy Weinberg, lo que permite inferir que no estaba influenciada por factores externos como deriva genética, mutación o consanguinidad de los individuos30.
Con relación a la distribución del polimorfismo S19W (Ser19Ter) de la APOA5 en el grupo de sujetos afectados con hipertrigliceridemia, se encontró que la forma homocigota GG y la heterocigota GC presentaron valores significativos (p<0,01 y p=0,03, respectivamente), resultado que concuerda con los hallazgos observados en otras poblaciones. Andrade demostró que la presencia del polimorfismo Ser19Trp del Gen de APOA5 influye significativamente en los niveles de triglicéridos y es un factor de riesgo independiente para desarrollar enfermedad coronaria28.
La importancia desde el punto de vista funcional del polimorfismo (S19W) Ser19Trp, radica en el cambio de un amino ácido hidrofílico, serina, por uno hidrofóbico, triptófano, en el péptido señal, dificultando su translocación al retículo endoplásmico, lo que sugiere que esto provoca un cambio funcional31. Todo parece indicar que la APOA5 actúa como un control para la secreción de TAG por parte del hígado32,33. La dificultad que este polimorfismo provoca en la translocación de la proteína, reduce su secreción por parte del retículo endoplásmico, disminuyendo su disponibilidad y por tanto su asociación a las lipoproteínas ricas en TAG, lo que deprime su papel regulador en el crecimiento y depuración de las VLDL y quilomicrón, que se reflejaría en la producción de VLDL excesivamente cargadas de TAG, lo que explicaría su asociación con los altos niveles plasmáticos de TAG34-36.
Los hallazgos alcanzados en este trabajo nos obligan a seguir en la búsqueda de otros posibles marcadores de riesgo que permitan detectar tempranamente a los potenciales candidatos a una hipertrigliceridemia, de manera tal que se logre realizar una intervención temprana en su estilo de vida, mejorando la calidad de la misma, y quizás lograr aumentar su expectativa de vida.
Dentro de las limitaciones de este trabajo cabe señalar que se trata de un primer abordaje de los aspectos genéticos del metabolismo de los TAG, analizando un solo polimorfismo de un gen cuyo estudio hoy en día en otras poblaciones, es fuente de nuevas publicaciones en el tema, con el objetivo claro de conocer mejor a la población afectada, de impactar en nuevas pruebas diagnósticas especialmente preventivas, siempre con el ánimo de llegar en un futuro a un número mayor de individuos involucrados. Las más recientes publicaciones muestran no solo un aumento sustancial en el número de sujetos analizados, sino como la relación existente entre diversos productos del metabolismo graso y un número creciente de marcadores genéticos de protección o riesgo, siempre con miras a tener herramientas diagnósticas predictores para selección de candidatos a campañas de prevención.
la población afectada, de impactar en nuevas pruebas diagnósticas especialmente preventivas, siempre con el ánimo de llegar en un futuro a un número mayor de individuos involucrados. Las más recientes publicaciones muestran no solo un aumento sustancial en el número de sujetos analizados, sino como la relación existente entre diversos productos del metabolismo graso y un número creciente de marcadores genéticos de protección o riesgo, siempre con miras a tener herramientas diagnósticas predictores para selección de candidatos a campañas de prevención.
CONSIDERACIONES ETICAS
El presente estudio, fue avalado por el comité de ética de la Facultad de Salud de la Universidad Industrial de Santander según acta N° 18 del 11 de octubre del 2010; es considerado de riesgo mínimo según resolución 8430 de 1993 del ministerio de salud, y los datos utilizados son de carácter anónimo para proteger la confidencialidad.















