Introducción
Las enfermedades transmitidas por vectores, de importancia para la salud pública, son un conjunto de patologías de carácter infeccioso transmitidas por insectos, los cuales pueden propagar virus, bacterias y protozoarios a los seres humanos. Las arbovirosis son enfermedades transmitidas por vectores en las que el agente infeccioso propagado es un virus, como el caso del Zika (ZIKV), el dengue (DENV), el chikunguña (CHIKV), la fiebre amarilla (YFV), entre otras 1-3. Según la Organización Mundial de la Salud (OMS), las principales enfermedades transmitidas por vectores representan alrededor del 17 % de la carga mundial estimada de enfermedades transmisibles y causan más de 700 000 muertes al año 3. Según los datos epidemiológicos presentados por el boletín arbovirus 2022 de la Organización Panamericana de la Salud, se evidencia un aumento en la cantidad de casos respecto al año 2021 en la región de las Américas, especialmente en Islas Vírgenes (R.U.), Puerto Rico, República Dominicana, Granada, Colombia y Estados Unidos 4. Para el 2021, se notificaron un total de 3 115 356 casos de enfermedad por arbovirus. De estos, 2 806 439 (90,1 %) fueron casos de dengue, 271 176 (8,7 %) casos de chikungunya, y 37 741 (1,2 %) fueron casos de Zika 4.
Los arbovirus con relevancia clínica médica tienen en común su origen: surgen de ciclos naturales en los que participan vectores de especies selváticas de artrópodos (mosquitos) y vertebrados (especialmente mamíferos y aves) como hospederos amplificadores 5. Los arbovirus pertenecen a las siguientes familias: Togaviridae (virus chikunguña, encefalitis equina y mayaro), Flaviviridae (dengue, fiebre amarilla, Zika y encefalitis del Nilo Occidental) y Bunyaviridae (encefalitis de California, hantavirus y fiebre hemorrágica bunyavirus) 6. La mayoría de los arbovirus son virus de ARN, cuya evolución rápida es consecuencia de la convergencia de tasas altas de mutación, poblaciones numerosas y tiempos de generación cortos 7.
La emergencia de los arbovirus en las poblaciones humanas se ha descrito como un proceso que ocurre paso a paso, y que comienza con una infección por contacto directo fortuito con hospederos o vectores que constituyen el reservorio natural durante el ciclo selvático. La infección puede extenderse y pasar por diversas etapas (de esporádicas a frecuentes) hasta constituir un ciclo urbano de transmisión exclusiva de persona a persona 8.
En los últimos años, las enfermedades transmitidas por vectores son responsables de aproximadamente el 17 % de la carga de patologías transmisibles en el mundo, y el 80 % de la población vive en zonas de riesgo de adquirir dichas enfermedades 9. En la región de las Américas, con la aparición de nuevas arbovirosis, como el Zika y chikunguña, sumados a los ya endémicos, como el dengue y la fiebre amarilla, representan un reto para los sistemas de salud, ya que demandan la mejora del diagnóstico clínico y de laboratorio, de la vigilancia epidemiológica y del control las poblaciones de mosquitos para prevenir la transmisión de enfermedades y evitar consecuencias graves en la población 10.
Los arbovirus pueden clasificarse en tres grupos según su aparición y ciclo de transmisión. El primer grupo incluye los virus que circulan en un ciclo urbano, causan epidemias y son endémicos en varios países. Entre ellos están el VDEN, el CHIKV y el ZIKV 9. El segundo grupo incluye a los arbovirus que tienen capacidad potencial o demostrada de transmitirse de persona a persona. Los arbovirus de este grupo pueden causar infecciones esporádicas en seres humanos por traspaso directo de los límites de su transmisión enzoótica o por vectores puente. Esto como consecuencia de que haya seres humanos que viven o trabajan muy cerca de espacios naturales en las denominadas “zonas de emergencia” 9. El tercer grupo está constituido por arbovirus con ciclos epizoóticos establecidos que abarcan la fauna salvaje o animales domésticos que actúan como hospederos o reservorios de amplificación y, de manera esporádica, afectan al ser humano como hospedero final 9.
Según la OMS, el total de casos de dengue notificados en 2022, que ascendió a 2 809 818, con 1290 fallecimientos, supone el doble de casos y casi el triple de decesos que en 2021, cuando se notificaron 1 269 004 casos y 437 decesos 11. El dengue es una enfermedad infecciosa producida por el virus del dengue (VDEN). Pertenece al género Flavivirus, de la familia Flaviviridae, Grupo Baltimore IV (virus ARN monocatenario positivo) 10. Existen cuatro serotipos: VDEN-1, VDEN-2, VDEN-3 y VDEN-4. Este virus se transmite principalmente por los mosquitos Aedes aegypti y Ae. albopictus. Cuando hay contagio, se presenta fase febril de 2 a 5 días, acompañado de dolor de cabeza intenso, sarpullido o agrandamiento de ganglios linfáticos 12.
Según la OMS, a nivel mundial, desde el 1 de enero de 2021 hasta el 7 de diciembre de 2022, 13 países de esta región notificaron a la OMS 203 casos confirmados y 252 probables, entre ellos 40 mortales (tasa de letalidad del 9 %) 13. La fiebre amarilla (YFV) es una enfermedad infecciosa causada por un virus del género Flavivirus (familia Flaviviridae), Grupo Baltimore IV (virus ARN monocatenario positivo). En las Américas, se conocen dos ciclos de transmisión: uno urbano, de tipo humano-mosquito-humano, cuyo principal vector es el mosquito Aedes aegypti; y otro selvático, en el cual actúan como vectores diferentes especies de mosquitos (Haemagogus spp. y Sabethes spp.) 14.
A nivel socioeconómico, se evidencia una relación entre la pobreza o la vulnerabilidad social y la infección por un arbovirus, ya que el estado de la cobertura de atención médica, en relación con la infección por CHIKV y DENV, es deficiente 15. Además de lo anteriormente mencionado, tener un suministro adecuado de agua (es decir, agua potable) se asoció con una menor infección por DENV; adicional a ello, se observa una relación entre la falta de drenaje en las calles y una mayor infección por DENV, al igual que la falta de saneamiento 15.
Las consecuencias del cambio climático son cada vez más evidentes, y destacan la importante interdependencia entre el bienestar de las personas y los ecosistemas. Se ha evidenciado que los cambios en el patrón de precipitación y temperatura pueden favorecer el crecimiento y expansión de artrópodos vectores, aumentando el riesgo de adquirir enfermedades de transmisión vectorial. Además, el efecto esperado del cambio climático sobre la migración humana podría aumentar el número de casos importados de enfermedades que no son endémicas en nuestro medio y que, en condiciones favorables, podrían iniciar ciclos de transmisión autóctona 16. Dados los problemas de salud que ha traído el constante uso de los insecticidas por su alta carga de compuestos químicos, se ha venido manejando la implementación de biocontroladores, siendo productos de origen biológico que actúan como antagonistas frente a microorganismos patógenos que producen daño en los cultivos 17.
Para disminuir la tasa de mortalidad asociada a enfermedades de transmisión vectorial, y el impacto que supone sobre la población, se han creado distintos mecanismos para frenar la propagación de estos vectores, incluyendo medidas de control químico y biológico. La revisión sistemática de biocontroladores para insectos vectores de la especie Aedes aegypti y Aedes albopictus tiene como objetivo presentar información actualizada de diferentes alternativas en el manejo y control de estas especies vectores, dada la capacidad para transmitir YFV y DENV. Se espera que esta revisión actualice y potencie técnicamente a los grupos de vigilancia y control de estos insectos vectores a nivel territorial y a los responsables en la toma de decisiones de acciones de promoción y prevención de enfermedades transmitidas por vectores 17.
Objetivos
Evaluar el potencial de Bacillus thuringiensis y L. sphaericus como biocontroladores de Aedes aegypti y A. albopictus, vectores de los virus del dengue y de fiebre amarilla.
Determinar la efectividad larvicida de B. thuringiensis y L. sphaericus contra Aedes aegypti y A. albopictus.
Evaluar la persistencia de B. thuringiensis y L. sphaericus en diferentes condiciones ambientales.
Estudiar los mecanismos de acción de B. thuringiensis y L. sphaericus contra Aedes aegypti y A. albopictus.
Evaluar el impacto del uso de B. thuringiensis y L. sphaericus en la transmisión del virus del dengue y de la fiebre amarilla por Aedes aegypti y A. albopictus.
Estos objetivos contribuyen a la búsqueda de soluciones seguras y efectivas para el control de Aedes aegypti y A. albopictus, vectores del virus del dengue y de la fiebre amarilla.
Métodos de control químico y biológico de las enfermedades de transmisión vectorial
Los controles químicos se basan en la aplicación de sustancias llamadas insecticidas para el control de vectores en las fases larvaria y adulta 18. El control químico de las plagas es la represión de sus poblaciones o la prevención de su desarrollo mediante el uso de estas sustancias 19. La utilización de insecticidas empeora la contaminación química del medioambiente, con el agravante de tratarse de productos de gran actividad biológica. Las mayores dosis y los menores intervalos entre aplicaciones, y entre la última aplicación y la cosecha, pueden provocar residuos tóxicos en los productos cosechados; incrementan los riesgos de intoxicaciones directas y elevan los costos del control fitosanitario 19. Los síntomas de la sobreexposición a los pesticidas van desde mareos y náuseas hasta trastornos en el desarrollo y la reproducción. Los síntomas varían en su severidad basada en el tipo, cantidad y duración de la exposición al pesticida 20. A pesar de esto, el control químico es el único método o recurso práctico para controlar las plagas. Una vez estas han sobrepasado el nivel económico de infestación, o están a punto de alcanzarlo, ejercen una rápida acción curativa, lo que permite evitar daños económicos y son, en líneas generales, de bajo costo, y su uso produce una relación costo-beneficio relativamente alto 21. Estos controles contribuyen a mantener los organismos a un nivel poblacional incapaz de causar daños a la salud. En este orden de ideas, a través de los últimos años se han venido trabajando dos químicos importantes sobre el control de insectos vectores: el temefos y el piriproxifen 22.
El temefos se encarga puntualmente de inhibir la colinesterasa, una enzima esencial para el funcionamiento del sistema nervioso de los mosquitos, mientras que el piriproxifeno inhibe el crecimiento del organismo, impidiendo su metamorfosis y reproducción 23. El uso del temefos para el control químico de larvas de mosquitos por largos periodos de tiempo contribuye a un proceso de selección de individuos resistentes, por lo cual sería inminente la aparición de resistencia a este larvicida, sin embargo, el temefos es un insecticida organofosforado residual de muy baja toxicidad para los humanos. En todo el mundo, es el larvicida más utilizado para el tratamiento focal en los programas de control de los culícidos vectores de enfermedades 24. La resistencia al temefos se establece básicamente sobre la actividad de las esterasas en larvas del tercer estadio tardío o cuarto estadio temprano, según el método adaptado para A. aegypti25.
El piriproxifen puede ser mortal en caso de ingestión y penetración en las vías respiratorias, provoca irritación ocular grave y puede provocar somnolencia o vértigo. Tiene además efectos adversos para el medio ambiente y se considera muy tóxico para los organismos acuáticos, con efectos nocivos duraderos 26.
Actualmente la OMS ha venido manejando nuevas alternativas sobre el control químico, las cuales están adaptadas a las zonas endémicas, donde estas muchas veces se encuentran en condiciones precarias 27. Estas alternativas se están comenzando a implementar, debido a que los compuestos químicos resultan nocivos a largo plazo para la salud y el ambiente. Entre las alternativas implementadas y aprobadas por la OMS están las trampas tratadas con piretroides, las cuales se han convertido en una alternativa al control químico como la fumigación. Sin embargo, ciertos vectores presentan resistencia a ello, por ende, se han manejado los larvicidas químicos y microbianos, reguladores del crecimiento de insectos (IGR) y toxinas bacterianas, cebos de azúcar atractivos dirigidos (ATSB), peces larvívoros y copépodos ciclopoides depredadores 28, 29. En un programa regular, las actividades en las cuales hay que hacer énfasis son: las acciones de movilización y comunicación social, la educación sanitaria individual, familiar, comunitaria e institucional para el cambio de conductas de riesgo relacionadas con la limpieza y tapado de los tanques de almacenamiento, el saneamiento peridomiciliario de la vivienda, la limpieza de terrenos baldíos, la reducción y eliminación de criaderos en sitios públicos y establecimientos especiales 30.
La utilización de piretroides ha generado inconvenientes en los últimos años, ya que los insectos vectores han desarrollado resistencia a esta clase de insecticida, la única aprobada por la OMS hasta la fecha, para su uso en mosquiteros. Dada a la resistencia que se ha presentado, se han venido realizando ensayos en la República Unida de Tanzania con un piretroide y clorfenapir, una clase diferente de producto químico que no se utilizaba anteriormente para el control de vectores, y mostraron una notable mejora a diferencia de los que utilizaban solamente piretroides 31.
Como se mencionó anteriormente, la utilización de cebos, específicamente con atrayentes azucarados específicos, contienen una matriz azucarada con insecticidas, y su función se basa en que los mosquitos se alimentan a través de ella mientras están protegidos contra la lluvia y el polvo y, asimismo, el insecticida presente en la trampa haga efecto y cumpla su objetivo 31.
El control de insectos vectores para el control de plagas con productos químicos presenta muchas desventajas, entre ellas, como ya se refirió, su gran coste y el riesgo de contaminación que acarrea, tanto para los alimentos como para el entorno y nuestra salud. Por ello, el control biológico de vectores se revela como una alternativa ecológica y muy eficaz, sobre todo a largo plazo. Una de las alternativas biológicas más populares para el control de plagas son los bioinsecticidas a base de Bacillus thuringiensis. Esta bacteria entomopatógena produce diferentes tipos de proteínas que son tóxicas para varias especies de insectos, ácaros y nematodos 32.
Actualmente, las principales alternativas de control biológico para las larvas de mosquitos y moscas negras se basan en toxinas bacterianas producidas por Bacillus thuringiensis (Bti) y Lysinibacillus sphaericus. La actividad larvicida de L. sphaericus se debe a la producción de una inclusión cristalina denominada toxina binaria A y B de 41,9 y 51,4 kDa, respectivamente, las cuales, al ser liberadas en el intestino de los insectos susceptibles en su fase larvaria y, tras ser solubilizada por el pH alcalino en la porción media del intestino, activan las proteasas causando deshidratación y muerte a los insectos vectores.
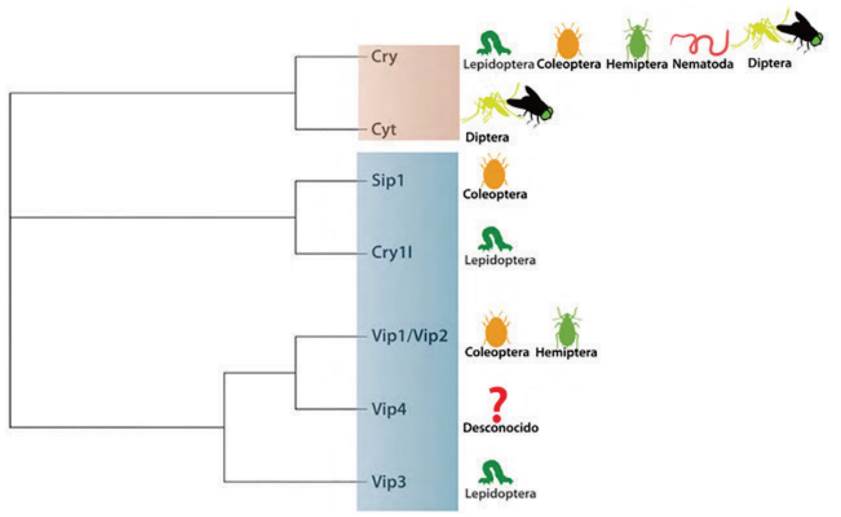
El mecanismo de acción de Bacillus thuringiensis es la producción de toxinas Cry y Cyt, específicas para las larvas de especies de estos dípteros, causando la lisis de las células epiteliales del intestino y finalmente la muerte del insecto. El principio activo de los formulados comerciales de Bti son las toxinas Cry 4 Aa, Cry4Bb, Cry11Aa y la Cyt 1 Aa; las cuatro actúan en conjunto disminuyendo la ocurrencia de poblaciones de insectos resistentes en condiciones de campo 33. La bacteria Bacillus thuringiensis, variedad israelensis H-14, es una buena alternativa en lugares donde se evidencie resistencia al temefos. El cuerpo paraesporal presente dentro de Bacillus thuringiensis var.israelensis H-14 produce toxinas y esporas vivas letales que las larvas consumen al alimentarse normalmente. Actúa sobre larvas de primero, segundo y tercer estadio.
El efecto citotóxico de Bt, así como su especificidad de huésped, se atribuyen comúnmente a toxinas paraesporales cristalinas proteicas (Cry y Cyt) producidas por bacterias en una fase estacionaria o a toxinas solubles de las familias Vip y Sip secretadas por células vegetativas. Al mismo tiempo, numerosos factores de virulencia no tóxicos de Bt han sido descubiertos, incluyendo metaloproteasas, quitinasas, antibióticos de aminopoliol y fracciones que imitan nucleótidos. Estos agentes actúan en cada etapa de la invasión de B. thuringiensis y contribuyen a las propiedades citotóxicas de las cepas de Bt, mejorando la actividad de la toxina, asegurando la evasión de la respuesta inmune del huésped y participando en la degeneración de la matriz extracelular 34. Se encontró que el Bacillus thuringiensis es capaz de sintetizar δ-endotoxinas, altamente activas contra Aedes aegypti Bora Bora, dando como resultado a las proteínas cristalinas insecticidas, las cuales se dirigen específicamente a insectos patógenos sin efectos dañinos a la salud vegetal, animal y humana. Debido a estas ventajas, varias subespecies de Bt han sido estudiadas y adoptadas para la producción comercial de bioinsecticidas. Las toxinas Cry activadas se unen a receptores celulares específicos para iniciar la lisis celular y la consiguiente muerte de las larvas 35.
Los productos basados en Bti y L. sphaericus se comercializan y se usan ampliamente en los EE. UU. y Europa, y se han desarrollado varias formulaciones diferentes. Los principales productos comerciales son los concentrados en suspensión, seguidos de los polvos humectables y, en menor medida, las formulaciones de granulado grueso. Debido a la mejor actividad residual del L. sphaericus en aguas contaminadas, se ha utilizado ampliamente contra las especies de Culex en los EE. UU., América Central, Brasil, India, Tailandia y China 36, 37.
La Mesa, Cundinamarca, es una zona muy conocida en Colombia por sus mosquitos resistentes al temefos. Este compuesto se usa comúnmente como método de control para larvas de Ae. aegypti a pesar de que más del 70 % de las poblaciones de este mosquito en Colombia son resistentes a ella. La tolerancia de las larvas al glifosato es tan preocupante como intrigante, dada la capacidad del L. sphaericus para controlar aquellas poblaciones de mosquitos que son tan resistentes a diferentes compuestos tóxicos 38.
Más allá del control químico o biológico, un concepto nuevo, como el control integrado de vectores, ha sido incorporado para el manejo de las enfermedades de transmisión vectorial 39. El concepto de IVM (Manejo Integrado de Vectores) es la combinación lógica de todos los métodos de control disponibles de la manera más eficaz, económica y segura para mantener las poblaciones de vectores en niveles aceptables. Este componente incluye todas las acciones de control (físico, químico, biológico y comportamentales) que se deberán adelantar con el fin de disminuir las poblaciones de mosquitos infectantes y de larvas en las áreas de mayor riesgo 40. Este se desarrolla como resultado de las enseñanzas extraídas del manejo integrado de plagas que se usa en el sector agropecuario; el IVM procura optimizar y racionalizar el uso de recursos y herramientas para el control de vectores 41.
Los rasgos característicos de IVM incluyen:
la selección de métodos basados en el conocimiento de la biología de vectores locales, la transmisión de la enfermedad y la morbilidad;
la utilización de una variedad de intervenciones, a menudo en combinación y sinérgicamente;
la colaboración dentro del sector de la salud, y con otros sectores públicos y privados, que repercuten en la reproducción de los vectores y sus criaderos;
la participación comprometida con comunidades e interesados locales;
un marco de salud pública reglamentario y legislativo;
el uso racional de los insecticidas y
buenas prácticas gerenciales 42.
En el mundo existen varios países donde las enfermedades de transmisión vectorial son un foco sumamente importante en la salud pública, por ende, se tuvo en cuenta el manejo integrado de vectores en los diferentes países y de la manera en que lo realizan, de acuerdo a su población y condiciones externas.
Control biológico de los insectos vectores Aedes aegypti y Aedes albopictus
Los virus del dengue se transmiten a las personas por medio de la picadura de un mosquito de la especie Aedes infectado (Ae. aegypti o Ae. albopictus). Estos mosquitos también transmiten DENV, CHIKV, y otros virus 43. Las infecciones por este virus pueden ser asintomáticas o presentar cuadros febriles indeterminados, hasta la fiebre del dengue clásico, el dengue hemorrágico o el síndrome de choque del dengue 44.
El control de la enfermedad está ligado a la erradicación del mosquito vector, el cual utiliza como criaderos pequeños depósitos de agua estancada, como llantas, latas y botellas, entre otros 45. Como la carga de arbovirus transmitidos por mosquitos, predominantemente los transmitidos por Aedes aegypti y A. albopictus, sigue creciendo a escala mundial, se requerirán nuevas herramientas de control de vectores y estrategias integradas para satisfacer las demandas de salud pública 46. Una de las alternativas para controlar el vector es a través del control biológico, en relación con las sustancias que producen el efecto tóxico después de penetrar en el organismo humano. Este control permite una evaluación más centrada y focalizada del riesgo para la salud que el control ambiental 47.
Los hongos Ascomycetes entomopatógenos, especialmente Metarhizium anisopliae y Beauveria bassiana, se han sugerido para el control de las etapas larvaria y adulta de los vectores del dengue 46. Una vez contaminados, los mosquitos dispersan el agente en contactos posteriores con superficies no tratadas. La auto diseminación puede explotar el comportamiento poligámico por el cual los machos tratados pueden contaminar a varias hembras durante el apareamiento 48. Los hongos se manifiestan en forma diferente con respecto a la infección y acción de control en las áreas donde han sido asperjados debido a la influencia de las condiciones ambientales sobre su desarrollo. La eficacia del hongo va a depender, entre otras, del tipo de suelo y de su compatibilidad en relación con otros microorganismos sinergistas y antagonistas presentes en el suelo, así como de factores abióticos. En campo, condiciones adicionales como la intensidad de la luz UV, la humedad, la temperatura y la microbiota afectan el desempeño de los entomopatógenos 49.
En Perú, uno de los países de América que reporta más casos de enfermedades de transmisión vectorial por A. albopictus y A. aegypti, se cuenta con un manejo integrado de vectores que utiliza ovitrampas (dispositivos para detectar la presencia de Aedes aegypti mediante el monitoreo de la actividad de ovoposición), larvitrampas (detección de larvas de Aedes aegypti especialmente en regiones con lluvias frecuentes) e inspección de viviendas, la cual es la más utilizada en dicho país. Esta última busca conocer la distribución del vector del dengue en una determinada área geográfica para programar las acciones de prevención y control pertinentes 50. Para que una trampa sea una herramienta eficaz para la eliminación de vectores, debe ser muy sensible y específica para la especie objetivo. Las trampas más efectivas se basan en una combinación de señales atrayentes, como la luz, el calor, la humedad, el dióxido de carbono y los productos químicos sintéticos para atraer al huésped 51. Los estudios con el uso en toda el área de ovitrampas grávidas autocidas (AGO) en Puerto Rico han mostrado una reducción del 80 % en las densidades de hembras A. aegypti por hasta 1 año 52. A medida que los sitios de oviposición naturalmente preferidos se eliminan del medioambiente, las trampas artificiales pueden volverse más efectivas para reducir las poblaciones de vectores. Sin embargo, se debe incorporar el monitoreo de rutina o la recuperación de las trampas, si ya no se usan, para evitar que las trampas se conviertan en criaderos potenciales en los programas de control a escala 53.
El método novedoso, cebos atractivos de azúcar tóxico (ATSB), se enfoca en el comportamiento de alimentación de azúcar de los mosquitos. Los mosquitos machos y hembras requieren carbohidratos para la producción de energía y la supervivencia. A menudo pueden satisfacer esta necesidad a partir de fuentes naturales como tejidos vegetales, flores, nectarios extraflorales y melaza 54. Se demostró un efecto acumulativo de los ATSB en una población de mosquitos anofelinos en un área con fuentes alternativas de azúcar, lo que provocó un retraso en la letalidad del nivel de población en comparación con las áreas pobres en azúcar. Esto sugiere su utilidad en ambientes áridos. Una sola aplicación de un ATSB afectó la densidad, la paridad y la supervivencia 55.
El éxito del control de larvas de aegypti depende de la capacidad de detectar, acceder y eliminar o tratar los sitios de reproducción domiciliarios, a menudo crípticos, una tarea desafiante y costosa que a menudo conduce a una baja cobertura. Además, su reducida eficiencia en algunas ocasiones limita su adopción generalizada 55.
La utilización de peces como control biológico es una alternativa que ha venido manejando Colombia, donde en la “gestión para la vigilancia entomológica y control de la transmisión del dengue” se menciona la utilización de especies de peces como Gambusia affinis y Poecilia reticulata. Tienen la desventaja de que pueden generar olor y sabor a pescado en el agua de uso doméstico, y los niveles de cloro en el agua iguales o mayores a 0,6 mg/L pueden ocasionar la mortalidad en los peces. Se pueden utilizar en localidades endémicas de dengue, donde existan grandes depósitos de agua permanentes, que rara vez son vaciados o lavados, con alta productividad larvaria y donde exista una buena aceptabilidad cultural de la población de la medida y se pueda mantener su introducción 55.
Existen otras alternativas de control biológico, las cuales conllevan la implementación de estrategias, las cuales no involucran la utilización de otros microorganismos, entre ellas, se encuentra la técnica del insecto estéril (TIE), la cual se basa en la liberación de insectos machos esterilizados, tradicionalmente mediante irradiación, para suprimir las poblaciones de mosquitos vectores. SIT induce mutaciones dominantes letales aleatorias en las células germinales, que actúan sobre los óvulos en la hembra para evitar la fertilización 56. Así como la TIE, se encuentra asimismo la estrategia de liberación de insectos con letalidad dominante (RIDL), que reduce las poblaciones de vectores (enfoque autolimitante) a través de individuos portadores de una construcción transgénica que actúa en la etapa larval tardía y las pupas para evitar la supervivencia. El fundamento de esta técnica se basa en que el gen efector diseñado es homocigoto, letal, dominante, reprimible y activa su propio promotor en un bucle de retroalimentación positiva, pero puede regularse mediante un activador externo. La construcción también incluye un gen informador que da como resultado que los insectos RIDL expresan un marcador fluorescente visible para facilitar la detección de individuos transgénicos e híbridos antes y después de una intervención 56.
Los virus que causan enfermedades a insectos plaga son las familias más utilizadas para su control. Estos son: Baculoviridae, Reoviridae, Poxviridae y Polydnaviridae. Al igual que las bacterias y otros entomopatógenos, los virus deben ser ingeridos para causar una enfermedad y posteriormente la muerte de los insectos plaga. De acuerdo al tipo de virus, se ven afectados sitios específicos dentro del insecto, causando pérdida de apetito, cuerpo flácido, movimiento hacia la parte superior de la planta, posiciones colgantes, y fluido que escapa del tegumento 57.
Uso de bacterias en el control de insectos vectores
Una alternativa de control mediante el uso de bacterias, es la Wolbachia, una bacteria Gram negativa que infecta principalmente artrópodos; y es por esta razón que se ha venido estudiando su uso, ya que reduce la susceptibilidad de Ae. aegypti a la infección diseminada por virus de ARN de sentido positivo, como el dengue. Sin embargo, se sabe que los virus de ARN se adaptan a las presiones antivirales. Aquí, revisamos las etapas de infección viral, donde la selección de Wolbachia podría ocurrir variantes de virus resistentes 57.
El estudio de especies bacterianas de los géneros Xenorhabdus y Photorhabdus ha sido objeto de varios grupos de investigación, con el objetivo de su uso en productos agrícolas, farmacéuticos e industriales. Estas bacterias se caracterizan por tener genes que codifican toxinas secundarias de bajo peso molecular y metabolitos con actividades insecticidas, antifúngicos y antiparasitarios 58. Se ha encontrado que la Xenorhabdus budapestensis es capaz de inhibir la hematofagia de las hembras de Aedes, debido a la presencia de fabclavinas; además, se encontró que la especie nematophila de Xenorhabdus causa un comportamiento caníbal entre las larvas de mosquito, ya que la bacteria desencadena factores bióticos que generan estrés larvario en el ambiente acuático 58.
Uso de las bacterias Bacillus sp y Lysinibacillus sp en el control biológico de insectos vectores de las especies A. aegypti y A. albopictus
Actualmente, en la salud pública, el control de vectores es de suma importancia para evitar la propagación de este tipo de patologías de alto impacto, sin embargo, una gran dificultad por superar es la atención a las comunidades afectadas que se encuentran muchas veces en zonas endémicas y remotas, dificultando la aplicación de las medidas de control. Se han adoptado nuevas medidas de biocontrol a través de insectos. Estas tienen la característica de no dejar residuos y de no ser perjudiciales para la salud humana, como tampoco para el medio ambiente 58.
Los biocontroladores son productos de origen biológico que actúan como antagonistas frente a microorganismos patógenos que producen daño en los cultivos 58. Un ejemplo es la bacteria entomopatógena Bacillus thuringiensis, capaz de producir una amplia variedad de proteínas insecticidas letales para distintos órdenes de insectos. Por su eficacia, bajo impacto ambiental negativo y alta especificidad, los insecticidas biológicos más vendidos son aquellos basados en proteínas de Bacillus thuringiensis, que actúan exclusivamente previa ingestión del insecto y no por contacto en superficie 59. Se caracteriza por ser un bacilo grampositivo, aerobio facultativo, esporulado, cuyo tamaño oscila entre 1 a 1,2 micrómetros de ancho y de 3 a 5 micrómetros de largo, nativo del suelo y catalogado como cosmopolita, la cual se ha aislado de ecosistemas como bosques tropicales y templados, zonas desérticas, sabanas, archipiélagos, frutales, suelos agrícolas, arena y cuevas en los cinco continentes. Pertenece al reino Eubacteria, a la familia Bacillaceae y al género Bacillus junto con B. cereus y B. anthracis, de los cuales se diferencian por la formación de una inclusión parasporal refringente al microscopio de contraste de fases 60.
El uso de Bti en su forma comercial, a lo largo del mundo en el control de larvas de mosquitos vectores, incluyendo A. aegypti, no muestra efectos adversos en otros artrópodos, aves, peces o mamíferos, incluyendo al ser humano, organismos que podrían estar asociados a hábitats donde se desarrollan los mosquitos. Estos resultados muestran la posibilidad de reducir poblaciones de vectores de enfermedades con un bajo impacto ambiental 60. El producto VectoMax® consiste en una mezcla bacteriana compuesta de Bacillus thuringiensis, var. israelinsis, y Bacillus sphaericus, cepa 2362, en una presentación de 10 g. Busca controlar las larvas de A. aegypti con B. thuringiensis var. israelensis y las larvas de C. quinquefasciatus con B. sphaericus61. La ingestión de este biolarvicida causa la muerte de las larvas por inanición en 24 o 48 horas, debido a que los cristales tóxicos producidos por las bacterias perforan el intestino.
Una de las características más notables de Bti es la composición compleja del cristal, que contiene protoxinas pertenecientes a la familia de toxinas Cry de 3 dominios (Cry11Aa, Cry4Ba y Cry4Aa), y la toxina citolítica (Cyt1Aa) 60. Estas protoxinas actúan en sinergia, ya que los componentes individuales exhiben menor toxicidad que el conjunto completo de componentes del cristal, que muestra la mayor acción larvicida 62. Los principales pasos del modo de acción de Bti incluyen la ingestión de los cristales por parte de las larvas, su solubilización en el intestino medio y la liberación de las protoxinas que se convierten proteolíticamente en toxinas. Posteriormente, estas toxinas activadas interactúan con los receptores del intestino medio, se insertan en las membranas y provocan la formación de poros que conducen a la permeabilidad celular y la lisis osmótica que daña el epitelio 62.
L. sphaericus posee actividad larvicida y se ha utilizado con éxito en programas de control de vectores contra el paludismo, la filariasis, la fiebre amarilla, el dengue y el virus del Nilo Occidental. Las formulaciones comercialmente disponibles que contienen esporas de L. sphaericus son: JiaBao®, VectoLex®, VectoMax®, Spherimos® y Spicbiomoss®. L. sphaericus tiene otras capacidades ambientalmente relevantes, incluida la degradación de contaminantes orgánicos como hidrocarburos y colorantes; promoción del crecimiento de las plantas mediante la fijación de nitrógeno; producción de ácido indol acético y solubilización de silicatos y fosfatos, medida por la germinación mejorada de semillas de tomate, pepino y arroz, y la adsorción de metales tóxicos (cadmio, plomo, arsénico, mercurio, cromo) y metales preciosos (oro) 62.
Lysinibacillus sphaericus ha mostrado potencial mosquitocida a través de la producción de diferentes proteínas. La proteína de la capa superficial (S-Layer), presente en esta especie bacteriana, está involucrada en los procesos normales, como la protección y la forma, pero se ha informado que tiene un papel en la acción mosquitocida 50. L. sphaericus tiene la capacidad de degradar el glifosato en dos moléculas principales, glicina y orto-fosfato, que las larvas y las bacterias pueden usar fácilmente en diferentes vías metabólicas, como fosforilación de proteínas. El aumento de la sobreexpresión de diferentes proteínas como la Mtx1-3, la quitinasa y la proteína de la capa S también aumenta la toxicidad contra Ae. aegypti, lo que puede explicar la diferencia entre las tasas de mortalidad cuando L. sphaericus y glifosato se usan solos o mezclados 62.
Para probar qué moléculas tienen el mayor efecto sobre la actividad larvicida de las toxinas producidas por L. sphaericus, los bioensayos con cepas de L. sphaericus que no son capaces de producir toxinas BinA/B pueden ayudar a comprender si la sinergia en la mortalidad de las larvas se explica por la sobreproducción de dichas toxinas o si se debe a otras proteínas como Mtx1-3, esfericolisina o quitinasas bacterianas 62.
L. sphaericus solo es efectivo contra ciertas especies de mosquitos, lo que limita su uso en el control de plagas que afectan a otros tipos de insectos. Tiene una vida útil limitada y se degrada rápidamente en el ambiente, lo que significa que su efectividad como controlador de plagas puede disminuir con el tiempo. Es sensible a las condiciones ambientales y su efectividad puede verse afectada por factores como la temperatura y el pH.
Mecanismo de acción de Bacillus y Lysinibacillus para el control biológico de los insectos vectores
El mecanismo de acción del Bt para el control biológico de insectos vectores se basa en la producción de proteínas cristalinas insecticidas, conocidas como endotoxinas o delta-endotoxinas. Estas proteínas las produce la bacteria durante la fase estacionaria de crecimiento y se encuentran en los cuerpos esporales del Bt.
Cuando un insecto vector consume plantas que han sido tratadas con Bt, las endotoxinas se liberan en el tracto digestivo del insecto. Allí, las proteínas se unen a los receptores específicos en la pared del intestino y forman poros en la membrana celular. Esto conduce a la liberación de los contenidos celulares y la muerte del insecto por efectos de la disolución de su integridad celular 64.
El efecto insecticida del Bt es muy específico, ya que las endotoxinas solo se activan contra ciertos tipos de insectos. Esto se debe a que a la proteína cristalina se le realiza un clivaje de enzimas específicas en el intestino del insecto para que sea tóxica. Además, las endotoxinas no son tóxicas para los humanos, animales u otros organismos no objetivo. El mecanismo de acción del Bt para el control biológico de insectos vectores se basa en la producción de proteínas cristalinas insecticidas que son específicas para ciertos tipos de insectos y actúan en el tracto digestivo para causar la muerte de estos.
El mecanismo de acción de L. sphaericus para el control biológico de insectos vectores, especialmente los mosquitos, se basa en la producción de proteínas toxinas binarias, conocidas como mosquitocidas. Estas proteínas son producidas durante la fase de crecimiento vegetativo de la bacteria y se liberan en el medio ambiente. Estas proteínas toxinas binarias son altamente específicas para los mosquitos y actúan en el intestino del mosquito, provocando una parálisis y la muerte del insecto 65.
Cuando un mosquito entra en contacto con las mosquitocidas producidas por L. sphaericus, las toxinas binarias se adhieren a las células epiteliales del intestino del mosquito. Allí, las proteínas se unen a receptores específicos en la membrana celular y son internalizadas en la célula. Una vez dentro de la célula, las toxinas binarias se separan y la subunidad activa se une a un receptor específico en la membrana celular del mosquito, lo que provoca la liberación de iones de sodio y potasio y la desestabilización de la célula. Como resultado, el mosquito experimenta una parálisis y finalmente muere 66.
El mecanismo de acción de L. sphaericus es altamente específico para los mosquitos, lo que minimiza su impacto en otros insectos no objetivo. Además, las mosquitocidas producidas por L. sphaericus tienen un impacto ambiental mínimo, ya que se degradan rápidamente en el medio ambiente y no acumulan residuos tóxicos.
Metodología
Se utilizaron dos cepas de Aedes aegypti: RecL y RecBti. La RecL es una cepa de referencia local que se ha mantenido en el insectario sin contacto con ningún agente de control de mosquitos desde 1996. La cepa RecBti se estableció en 2011, y las larvas de cada generación han estado expuestas continuamente a un larvicida basado en Bti durante más de 30 generaciones 67.
Los bioensayos de susceptibilidad realizados con larvas de las generaciones F5 a F30 demostraron que eran susceptibles al Bti, a pesar de la exposición continua a este agente. El índice de resistencia (RR) aumentó gradualmente de 1,6 en la generación F1 a 1,5 en la generación F30.
Se emplearon individuos de la generación F30 y la última exposición a Bti se realizó en larvas de tercer estadio F29. Las larvas F30 no fueron tratadas con Bti antes de la aparición de adultos 67.
Los resultados de este estudio sugieren que la exposición continua a un larvicida basado en Bti puede conducir a un aumento gradual de la resistencia en las poblaciones de Aedes aegypti. Sin embargo, es importante señalar que las larvas de ambas cepas fueron susceptibles al Bti, incluso en la generación F30 de la cepa RecBti. Esto sugiere que la resistencia a Bti en Aedes aegypti es un fenómeno complejo que puede estar influenciado por una variedad de factores, como la genética, el ambiente y la exposición a otros agentes de control de mosquitos 67.
Para evaluar los parámetros biológicos en dos cepas de Aedes aegypti: RecL y RecBti, las cepas se mantuvieron en el insectario bajo parámetros de crianza controlados.
Para evaluar la fecundidad, la fertilidad, el peso de las pupas, el tiempo de desarrollo, la tasa de emergencia, la proporción de sexos y la capacidad hematofágica, se realizaron los siguientes ensayos:
Eclosión: los huevos se sometieron a eclosión inducida colocándolos en un recipiente con infusión de pasto.
Crianza de larvas: las larvas se alimentaron con comida para gatos.
Emergencia: los adultos se recolectaron después de la emergencia.
Alimentación de hembras: las hembras se alimentaron con sangre de conejo desfibrinada.
Oviposición: las hembras se colocaron en jaulas con papel de filtro para oviponer.
Contaje de huevos: los huevos se contaron después de cuatro días de almacenamiento.
Puntos clave:
Los ensayos se realizaron con dos cepas de Aedes aegypti: RecL y RecBti.
Las cepas se mantuvieron en el insectario bajo parámetros de crianza controlados.
Los ensayos se realizaron para evaluar la fecundidad, la fertilidad, el peso de las pupas, el tiempo de desarrollo, la tasa de emergencia, la proporción de sexos y la capacidad hematofágica 67.
Se compararon los rasgos de vida de los individuos RecBti (F 30) y RecL criados según procedimientos anteriores. Se realizaron tres réplicas por colonia en tres experimentos independientes para analizar cada parámetro. La fecundidad se midió por el número total de huevos de 20 hembras. La fertilidad se evaluó por el número de larvas de primer estadio eclosionadas de 2 551 huevos en 24 horas. El peso de las pupas se midió en grupos de 25 y se recolectaron hasta 14 horas después de la muda, se pesaron y se mantuvieron para su emergencia. Los adultos obtenidos se utilizaron para evaluar la tasa de adultos, el tiempo de desarrollo, la proporción de sexos y la capacidad hematofágica. La tasa de adultos se determinó con 900 larvas emergidas en 15 días y se registró la proporción de sexos. La capacidad hematofágica se determinó por el porcentaje de hembras que ingirieron sangre artificial de grupos de 20 hembras por jaula 67.
Se utilizaron hembras nulíparas de 7 a 10 días de edad por cepa, que ayunaron durante 24 horas. Se colocaron entre 110 y 130 hembras por cepa en una jaula y se les alimentó con sangre de conejo desfibrinada que contenía cultivos infectados con DENV-2 o ZIKV. Otras 30 hembras por cepa, colocadas en una jaula aparte, se alimentaron con sangre de conejo desfibrinada que contenía cultivos de células no infectadas, utilizadas como grupo de control no tratado. Para preparar la harina de sangre, los cultivos celulares se congelaron y descongelaron para liberar partículas virales. Las muestras de cultivo se mezclaron con sangre de conejo desfibrinada en una proporción de 1:1 y se utilizaron para alimentar a todos los grupos experimentales simultáneamente. Después de alimentarse, solo las hembras hinchadas se transfirieron a otra jaula y se mantuvieron en condiciones estándar durante 21 días para DENV-2 y 14 días para experimentos con ZIKV, como se había descrito previamente 67.
Se realizó un análisis estadístico de los rasgos de vida de las dos cepas usando la prueba t de Student, considerando un valor de p < 0,05 para significancia. En los ensayos de susceptibilidad de virus, se evaluaron dos parámetros basados en muestras positivas para la presencia de ARN del virus. La tasa de infección (IR) se calculó dividiendo el número de muestras corporales positivas por el número total de mosquitos analizados. La tasa de infección diseminada (DIR) representa la proporción de muestras de cabezas infectadas respecto al número total de muestras de cuerpos infectados. Se utilizaron pruebas de Chi-cuadrado y de Fisher para evaluar la IR y la DIR entre las dos cepas analizadas. Además, se emplearon las pruebas de Kruskal-Wallis y Mann-Whitney para comparar el número de copias virales de ARN, siendo significativo un valor de p < 0,05. El porcentaje de hembras alimentadas y no alimentadas con sangre y células con cultivos infectados o no infectados se analizó estadísticamente mediante la prueba t de Student, considerándose significativo un p < 0,05 (67).
Ventajas y limitaciones en el uso de Bacillus sp y Lysinibacillus sp en el control biológico de insectos vectores
Bacillus thuringiensis (Bt) se presenta como una alternativa atractiva para el control de Aedes aegypti por sus claras ventajas por encima de insecticidas químicos. Es un biocontrolador efectivo y seguro 68. Bt es un agente de control biológico que se considera seguro para los humanos, los animales y el medioambiente. Es específico para ciertas plagas y no daña a los insectos beneficiosos 68. Bti es altamente efectivo en el control de las plagas, ya que produce una proteína que es tóxica para los insectos. Una vez que los insectos ingieren la proteína, se produce una parálisis del sistema digestivo y los insectos mueren 69. El costo de producción de Bti es relativamente bajo, ya que se puede cultivar a gran escala en laboratorios. Además, es posible aplicarlo de varias maneras, como pulverización foliar y como tratamiento de semillas y riego. Es fácil de implementar y no requiere equipo especializado. Es un agente de control biológico que es respetuoso con el medio ambiente y no causa daños a los organismos no objetivos, como otros insecticidas. En resumen, Bti es un biocontrol efectivo y seguro que ofrece una serie de ventajas, incluyendo su alta eficacia, bajo costo, fácil aplicación, no resistencia de las plagas, respeto al medio ambiente y seguridad para los humanos y animales.
El Bti es un biocontrolador utilizado en la agricultura para combatir plagas de insectos. Sin embargo, su uso también puede tener ciertas desventajas, entre las cuales están la especificidad. Debido a que Bti es muy específico con los insectos que ataca, eso limita su uso para el control de plagas que afectan a múltiples especies de cultivos. El uso repetido y excesivo de Bti puede provocar resistencia a las poblaciones de insectos, lo que reduce su actividad. La razón principal de la alta tasa de resistencia de los insectos es la diversidad relativamente baja de toxinas Cry (generalmente, de tipo Cry1 o tipo Cry2) que se utilizan en los cultivos Bt. A juzgar por lo anterior, es necesario ampliar los conocimientos sobre varios Bt proteínas insecticidas con baja similitud de secuencia mutua y diferencias en el modo de acción para implementarlas con éxito en la protección de cultivos 69. Además, si se aplica en exceso, puede persistir en el medio ambiente durante un largo periodo después de su aplicación, lo que traería efectos negativos en el suelo o en el agua. El Bti es un biocontrolador efectivo contra ciertas plagas de insectos, su uso debe ser cuidadosamente considerado y monitoreado para evitar posibles causas y maximizar su eficiencia.
El biocontrol con L. sphaericus es una estrategia utilizada para combatir las poblaciones de mosquitos que transmiten enfermedades como el dengue, la fiebre amarilla y el virus del Nilo Occidental 70. Las ventajas del biocontrol con L sphaericus son: es muy específico en cuanto a su objetivo, ya que solo ataca a ciertas especies de mosquitos y no afecta a otros insectos beneficiosos; es altamente efectivo en el control de poblaciones de mosquitos, especialmente en aguas estancadas como charcos, estanques y alcantarillas; es considerado seguro para el medio ambiente, los seres humanos y los animales, ya que es un microorganismo natural y no produce toxinas; los mosquitos no han desarrollado resistencia a L sphaericus, lo que significa que su efectividad como controlador de plagas no se verá comprometida con el tiempo; el biocontrol con L sphaericus es una opción de control de plagas rentable en comparación con otros métodos de control, como los insecticidas químicos, y el biocontrol con L sphaericus es una opción efectiva, segura y rentable para controlar las poblaciones de mosquitos, especialmente en áreas donde los insecticidas químicos pueden tener un impacto negativo en el medio ambiente y la salud humana 70.
A pesar de sus ventajas, el uso de L sphaericus como biocontrolador también presenta algunas desventajas para mantener su efectividad. L sphaericus es un microorganismo vivo, y su almacenamiento puede ser un desafío, ya que requiere de condiciones específicas para mantener su viabilidad y eficacia 70.
Retos para Colombia / Latinoamérica en el uso e implementación del control biológico de insectos vectores
En Colombia, el control de Aedes aegypti se lleva a cabo mediante la utilización de insecticidas para el control de adultos en casos de incremento de arbovirosis. Las campañas educativas dirigidas a la comunidad sugieren la aplicación de larvicidas en los depósitos de agua potable de uso doméstico. Los larvicidas utilizados son el organofosforado temefos, la bacteria Bacillus thuringiensis, variedad israelensis, y los inhibidores de síntesis de quitina. Sin embargo, el temefos ha sido el larvicida más utilizado en el país y, a raíz de ello, la población de A. aegypti ha generado resistencia 71.
En Colombia, existe una falta de conciencia y capacitación sobre el control biológico de insectos vectores, lo que dificulta su adopción por parte de agricultores y comunidades locales que podrían beneficiarse de él. Se requiere una mayor difusión y capacitación sobre esta técnica para su adopción efectiva en el país. Adicionalmente, los agentes de control biológico necesarios para el control de insectos vectores no están disponibles en la región o son demasiado costosos para adquirir. Además, se requiere de personal especializado para la producción y liberación de estos agentes. La falta de políticas públicas y apoyo gubernamental limita la investigación y el desarrollo de tecnologías relacionadas con el control biológico de insectos vectores. En algunos casos, la regulación gubernamental también puede ser un obstáculo para la liberación de agentes de control biológico 72, 73, 74.
El dengue es una enfermedad transmitida por mosquitos que afecta a millones de personas en todo el mundo, incluyendo Colombia. Para erradicar el dengue en Colombia, el Gobierno y las organizaciones de salud pública han establecido varios objetivos, entre los que se incluyen 75:
Prevención de la reproducción del mosquito Aedes aegypti: la eliminación de los criaderos de mosquitos, como los recipientes con agua estancada, es una de las medidas más efectivas para prevenir la reproducción del mosquito Aedes aegypti.
Educación en salud pública: es importante que las comunidades sean educadas sobre los riesgos del dengue y las medidas que pueden tomar para prevenir la enfermedad, como el uso de repelente de insectos, la eliminación de recipientes de agua estancada y el uso de mosquiteros.
Detección temprana y tratamiento adecuado: los objetivos de salud pública también incluyen mejorar la capacidad de los sistemas de salud para detectar y tratar los casos de dengue de manera oportuna y efectiva.
Vigilancia epidemiológica: es esencial contar con sistemas de vigilancia epidemiológica efectivos para monitorear la incidencia de la enfermedad y detectar brotes de dengue en las comunidades.
Control vectorial: el uso de insecticidas y la eliminación de los criaderos de mosquitos son medidas importantes para controlar la población de mosquitos y prevenir la propagación del dengue 76, 77.
Los objetivos de salud pública en Colombia para erradicar el dengue incluyen la prevención de la reproducción del mosquito, la educación en salud pública, la detección temprana y el tratamiento adecuado, la vigilancia epidemiológica y el control vectorial 78.
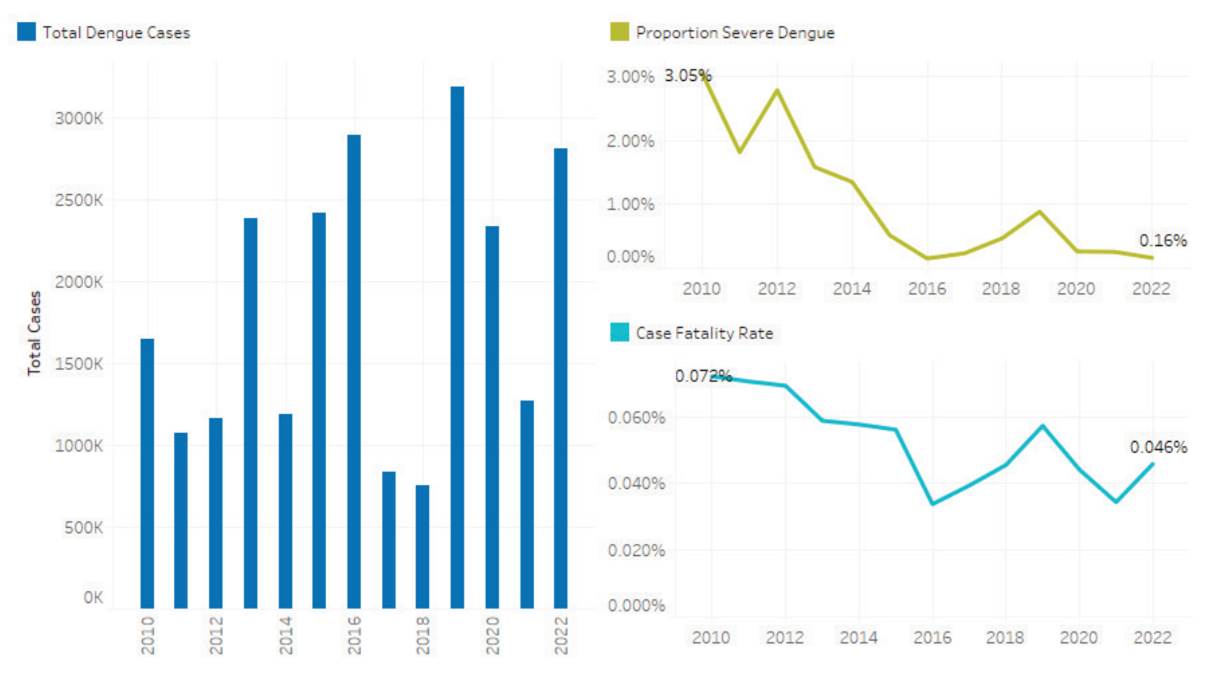
A nivel mundial, en comparación con el año anterior, hay un crecimiento. El mayor número de casos de dengue en la región lo han reportado los siguientes países: Brasil con 2 363 490 casos (84,0 %), Nicaragua con 97 541 casos (3,5 %), Perú con 72 851 casos (2,6 %), Colombia con 69 497 casos (2,5 %), and México con 59 918 casos (2,1 %) 79.
En Colombia, según el Instituto Nacional de Salud, la incidencia de casos para el año 2022 tuvo un aumento, siendo el Departamento del Casanare el de más casos 80.
Fuente: Boletín Anual Arbovirosis 2022
Figura 2 Gráfica comportamiento casos de dengue a nivel mundial
Tabla 1 Territorios con más casos de dengue en Colombia
| Departamentos | Dengue | Dengue Grave | Total | |||
|---|---|---|---|---|---|---|
| No. | % | No. | % | No. | % | |
| Casanare | 2 612 | 11,4 | 25 | 6,0 | 2 637 | 11.3 |
| Meta | 2 200 | 9,6 | 7 | 1,7 | 2 207 | 9.5 |
| Sucre | 1 367 | 6,0 | 32 | 7,7 | 1 399 | 6.0 |
| Cali | 1 366 | 6,0 | 18 | 4,3 | 1 384 | 5.9 |
| Barranquilla | 1 236 | 5,4 | 32 | 7,7 | 1 268 | 5.4 |
| Norte de Santander | 1 130 | 4,9 | 18 | 4,3 | 1 148 | 4.9 |
| Bolívar | 1 063 | 4,6 | 26 | 6,2 | 1 089 | 4.7 |
| Cesar | 1 048 | 4,6 | 16 | 3,8 | 1 064 | 4.6 |
| Córdoba | 997 | 4,4 | 28 | 6,7 | 1 025 | 4.4 |
| La Guajira | 902 | 3,9 | 38 | 9,1 | 940 | 4.0 |
| Tolima | 899 | 3,9 | 11 | 2,6 | 910 | 3.9 |
Fuente: elaboración propia, datos recopilados del INS.
La evidencia presentada a partir de los estudios de eficacia sugiere que Bti puede ser eficaz para controlar las etapas inmaduras de los mosquitos vectores del dengue en una variedad de criaderos.
El efecto letal es rápido y normalmente elimina todas las formas inmaduras de los contenedores tratados en 24 h, con un efecto residual que oscila entre 2 y 4 semanas 81.
Tabla 2 Recopilación de estudios sobre biocontrol con Bti
| Referencia | Ubicación | Objetivo | Formulación Bti | Grupos de control | Resultados | Conclusiones |
|---|---|---|---|---|---|---|
| Suarez, Ayala y Nelson 82 | Colombia | Evaluar la formulación granulada de Bt H-14 en condiciones de laboratorio y de campo contra Aedes aegypti. | Bti H-14 granulado Potencia no reportada Fabricante no informado. | Sin tratamiento de 4 enfriadores por evaporación y 6 llantas desechadas. | Reducción a las 4 semanas: Enfriadores por evaporación: 0,25 g/m2 = 46,3 % 0,5g/m2 = 100% 1,0g/m2 = 100% Neumáticos desechados: 0,25 g/m2 = 47,7 % 0,5g/m2 = 100% 1,0g/m2 = 100% | La formulación fue más eficaz a una dosis de 0,5 g/ m2yla actividad larvicida persistió hasta por 4 semanas. Bt H-14 puede usarse para controlar el dengue, pero se necesitan estudios gue examinen la eficacia relativa y la rentabilidad. |
| Fernández 83 | Singapur occidental. | determinar la persistencia yactividad biológica de los extractos de Bti después de más de tres décadas en almacenamiento, así como evaluar y comparar la toxicidad de sus endotoxinas reconstituidas contra larvas deA. aegypti. | Se seleccionaron y reactivaron veinte extractos de fermentación almacenados HD-567 y HD500, el complejo esporas-cristal fue obtenido y purificado por el método de coprecipitación lactosa-acetona. | Estimación de la LD5O y LD98 de los extractos almacenados 3501 y 3260 comparativamente con el control Vectobac | Todos los extractos almacenados probados presentaron toxicidad a la dosis más alta utilizada (1000 ppm) y los extractos 3260 y 3501 aún presentaron actividad larvicida en dosis tan bajas como 0.01 ppm. La cepa HD-500 recuperada del extracto 3260 fue el insecticida más eficaz (CL50 = 0,0014 mg/l) seguido de 3501 (CL50 = 0,0037 mg/l). Particularmente destacables estas cepas recuperadas que aumentaron su potencia larvicida 100 y 1000 veces respectivamente, siendo incluso más efectivas que la mayoría de los productos comerciales. Los perfiles de proteínas revelaron una menor presencia de toxinas sinérgicas Cyt en los extractos almacenados. | Los datos obtenidos demuestran que cristales proteicos de Bti pueden prolongar su toxicidad durante la vida útil o en condiciones de campo bajo condiciones específicas. |
| Reyes et al. 84 | Panamá | Evaluar la bioeficacia de los formulados Vectobac® 37 WG, Natular® DT y el grado técnico temefos contra tres poblaciones de Ae. aegypti y Ae. albopictus de la provincia de Panamá. | a) Larvicidas biológicos · Formulado VectoBac® 37 WG (Bacillus thuringiensis var. israliensis) cepa AM 65-52 al 37.4 % suministrado por Sumintomo Chemical Latin America · Formulado Natular® DT (Mezcla de spinosyn Ayspinosyn Bal 7.48%) Se deriva de la fermentación de Saccharopolyspora spinosa suministrado por Clarke Mosguito Control Products, Inc. b) Larvicida guimico · Temefos: Grado técnico Supelco® (95.0%) suministrado por PESTANAL® I Sigma-Aldrich. | Se realizaron búsquedas activas de fases inmaduras de (larvas y pupas) de Ae. aegypti y Ae. albopictus junto al personal de control de vectores, en criaderos localizados en intradomicilio y peridomicilio de las viviendas y talleres, entre las 8:00 a.m. y las 12:00 p.m., durante los meses de enero a junio y de septiembre | e las comparaciones de mortalidad entre las cepas de Ae. aegypti VC, Ae. aegypti CO y Ae. aegypti RA, se demostró la bioeficacia del insecticida Vectobac® 37 WG contra las poblaciones de Ae. aegypti expuestas a CL50, lo gue lo destaca su alta efectividad expresada al 73% de mortalidad, con respecto al Natular® y temefos, superando el umbral de respuesta de los valores medios de mortalidad probada con la cepa de referencia Ae. aegypti Rock. Evaluaciones realizadas en Honduras manifestó bioeficacia a concentraciones operativas (0.5 - 5 mg/L) de Bacillus thuringiensis var israelensis Vectobac® 37 WG contra larvas de Ae. aegypti de estadio III y IV | La aplicación generalizada de Vectobac WG en hábitats larvarios específicos puede proporcionar control de los vectores del dengue. |
| Ocampo et al. 85 | Cali, Colombia | Evaluar dos métodos de control de A. aegypti que puedan ser utilizados por la comunidad: ovitrampas letales y briquetas Bti. | Briquetas Bactimos (7000 UIT/mg) Productos químicos de la cumbre. | Se seleccionó al azar una cuadra de cada uno de los 4 barrios para no recibir insecticida, solo educación (control ambiental, vaciado de tinajas de agua). | Los índices entomológicos obtenidos durante el período de intervención no fueron significativamente diferentes entre los grupos de tratamiento y los controles. Durante todo el periodo de estudio (341 visitas), sólo un tanque de agua tratado con Bti resultó positivo para larvas. Los contenedores positivos consistieron principalmente en plantas en agua y contenedores pequeños. Las briquetas Bti no se utilizaban habitualmente en el 40 % de las viviendas. | La educación previa a la intervención y la gestión ambiental pueden haber contribuido a la falta de efecto observado con las intervenciones. La disminución de la densidad de pupas no eliminó la presencia de mosquitos adultos en los hogares a un nivel suficiente para prevenir la transmisión, lo que sugiere que es posible que se requiera una zona de amortiguamiento más grande para abordar los sitios de reproducción fuera de las áreas residenciales. El uso de briquetas Bti puede haber inducido a la gente a cambiar el agua con más frecuencia. |
Conclusiones
El control integrado de vectores es un reto de escala mundial. Este se ha venido trabajando en los últimos años, pero ha presentado un reto, ya que las condiciones de las zonas endémicas, y el acceso a ellas, han complicado su proceso; sin embargo, las nuevas alternativas, las cuales incluyen la aplicación de controles biológicos, han demostrado que su eficacia es alta, pero que a nivel económico presentan un costo elevado.
La constante utilización de químicos ha generado efectos adversos a largo plazo a nivel ambiental, incluyendo tanto las plantas cercanas a estas fumigaciones, como a los animales, los cuales hacen parte del ecosistema y resultan ser afectados por las altas concentraciones de toxinas; y es que no solo lo anteriormente mencionado presenta un gran reto, sino el hecho de que las nuevas generaciones de insectos vectores han venido desarrollando resistencia a estos químicos, y por ende, su control ha sido complejo en los últimos años.
Tanto a nivel mundial como en Colombia, se puede observar que el último año hubo un incremento en el número de casos. Una de las posibles causas es la falta de información y creación de políticas públicas. Se requiere una mayor participación de entes gubernamentales para evitar que virus como este estén presentes en la población. A partir de los múltiples estudios que se han realizado con los biocontroladores Bti, podemos observar que es muy eficiente. No obstante, la falta de información en la población no ha permitido que se utilice en todas las regiones. Se evidencia que uno de los retos para Colombia es acceder al control biológico y erradicar los pesticidas que no solamente causan daño a los habitantes sino también al ambiente.