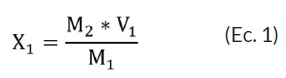INTRODUCCIÓN
El sector avícola ha tenido un creciente avance, gracias a la acción conjunta de genética, nutrición, sanidad y manejo [1]. Sin embargo, la presión de los mercados por una mayor demanda de este producto, genera la búsqueda de animales con un crecimiento rápido y con una mayor calidad de carne [2]. Esto crea inconvenientes en el manejo de grandes poblaciones, especialmente la parte sanitaria, que hace uso intensivo de los antibióticos promotores de crecimiento como medios para controlar la proliferación de microorganismos patógenos [3].
La introducción de promotores de crecimiento (APC-antibióticos en dosis subterapéuticas) en la alimentación animal no sólo influye en las poblaciones microbianas intestinales y sus actividades, sino que además, afectan el metabolismo del animal y alteran específicamente la función intestinal [4-6]. Junto a lo anterior, el uso indiscriminado de los antibióticos ha producido graves problemas sobre el control de las enfermedades de origen bacteriano, ya que en los últimos años se ha incrementado la aparición de microorganismos resistentes, que dificulta su manejo sanitario en humanos y animales [7].
Como respuesta a este problema, la investigación ha centrado sus esfuerzos en la búsqueda de nuevas alternativas que promuevan una producción más limpia, sin el uso de aditivos que pongan en riesgo la salud humana y animal [8]. Esto incluye mejorar las normas de bioseguridad y manejo en las producciones avícolas, aplicando un programa de vacunación, haciendo selección genética y realizando la búsqueda, desarrollo y utilización de nuevos aditivos nutricionales como los probióticos, prebióticos, oligosacáridos, ácidos orgánicos, entre otros [9]. Estos aditivos permiten el control del establecimiento de una microbiota benéfica en los animales, además de la disminución paulatina de enteropatógenos, mejorando la producción animal y disminuyendo el riesgo para la salud humana [10-12].
Estudios realizados recientemente han demostrado que las bacterias ácido lácticas muestran características adecuadas para el control de estos microorganismos patógenos [13], sin embargo, la verificación y evaluación de estos microorganismos debe ser rigurosa con el fin de encontrar información adecuada y pertinente para los fines que se propone su utilización [14].
En respuesta a lo anterior, los organismos probióticos se han microencapsulado con el fin de aumentar la supervivencia a través del tracto gastrointestinal y con ello, garantizar una mejor colonización del organismo huésped [15], esperando que mejore la viabilidad de L. plantarum como agente probiótico y permita mejorar los parámetros productivos del pollos de engorde.
Por lo anterior, la investigación busca determinar el efecto del suministro de L. plantarum microencapsulado sobre los parámetros productivos, la respuesta inmune y la bioquímica sanguínea del pollo de engorde.
MÉTODO
La investigación se realizó en las instalaciones del laboratorio PROBIOTEC FORAPIS de la Universidad de Nariño ubicada en la ciudad de Pasto a una altura de 2600 msnm, 14°C y una humedad relativa del 65%.
Cepa y condición de cultivo
Las condiciones para L. plantarum se tomaron de Orbes et al. [16], quienes encontraron la fase exponencial a las 14 horas con un crecimiento de 6,6 x 108 UFC/150 mL en medio MRS. En esta investigación se usó Lactobacillus plantarum ATCC 8014, la cual se reconstituyó de acuerdo con la casa comercial.
Después de 24 h de la reconstitución, se confirmó el crecimiento y desarrollo para luego repicar con asa de argolla por el método de estrías en cajas de agar MRS comercial con azul de anilina, e incubar por 24 horas a 37°C. Todos los procedimientos de manejo de la cepa se realizaron en cámara de flujo laminar tipo II. Se evaluó la morfología macroscópica y microscópicamente con el uso de la coloración de Gram, procedimiento que fue realizado cada 15 días para verificar la viabilidad de la cepa.
Cultivo del inóculo de Lactobacillus plantarum
Se inoculó una asada del cultivo en un Erlenmeyer que contenía 40 mL de caldo MRS comercial estéril. Se incubó por 24 horas a 37°C. Nuevamente se realizó un repique de 4 mL de este caldo a otros 40 mL de caldo MRS comercial y se incubó en las condiciones antes mencionadas.
Para realizar el ajuste se tomó lo descrito en Jurado-Gámez et al. [17] quienes tomaron en cuenta un valor de 10% v/v para el inicio de la fermentación. Después, se calculó el número de bacterias por mL. Del caldo MRS con el inóculo se tomó 1 mL y se vertió en 9 mL de solución de agua peptonada, cuando se presentó mayor población de la establecida, se adicionó caldo estéril de la siguiente manera:
M1= población o densidad celular que se debe ajustar.
M2= 0,125 densidad óptica equivalente a 1,50 x 108 bacteria/mL. Densidad utilizada primera fermentación.
V1= 1 mL volumen proveniente del inóculo total (10/90).
X1= cantidad que contiene M2.
V2= lo que se agrega a 1 mL para ajustar a 1,50 x 108 bacterias/mL.
V3= 100 mL cantidad total del inóculo
X2= cantidad de caldo MRS comercial estéril que se agrega a V3 para ajustar la población el valor de M2
Se halla X1:
M1 ---------- M2
M2 ---------- X1
Ahora se encuentra V2:
Finalmente, se obtiene el valor de X2
El valor de X2, es la cantidad que se debe agregar para ajustar la población.
Microencapsulación
Obtención de biomasa microbiana. La cepa se conservó en crioviales (con glicerol al 1%) a una temperatura de -20ºC. Para su uso, se activó mediante incubación a 37°C en caldo MRS por 24 h en condiciones aerobias. En cada caso, la biomasa al final de la fase exponencial se recuperó por centrifugación (5000 rpm) a 4°C y el sobrenadante se descartó. Finalmente, las células fueron lavadas con una solución estéril de NaCl al 0,85% p/v y conservadas en refrigeración (6± 2°C) hasta su uso.
Encapsulación de L. plantarum. Para este procedimiento se tuvo en cuenta la metodología descrita por Rodríguez et al. [21]. Se preparó un inóculo con 400 mL al 15% p/v de L. plantarum (60 g de Maltodextrina y 60 g de Inulina en 280 mL de inóculo bacteriano previamente ajustado) en relación 1:1 p/p, que fue agitado hasta homogenizar.
Se utilizó el equipo de secado por aspersión (Secador Spray Bilon 6000s®), con una temperatura de entrada de 170°C y una temperatura de salida entre 65 y 67°C con ciclo completo de 2 h y 30 min. El material microencapsulado se empacó en recipientes plásticos oscuros estériles y se almacenaron a temperatura ambiente (20± 2°C) para su posterior utilización.
Estudio del microencapsulado. La cepa microencapsulada se evaluó en viabilidad, eficiencia y las características físicas: humedad, actividad de agua, solubilidad y humectabilidad [18]. De igual manera, se evaluaron las características estructurales, morfología y tamaño del microencapsulado. Finalmente, se evaluó la exposición a condiciones gastrointestinales simuladas de acuerdo con Coppola y Gil [19]: pH 3, concentraciones de 0,1 (Ta) y 0,3% (Tb) de bilis; y concentraciones de 0,5 (Ta) y 1% (Tb) de sales biliares, más un testigo (Tc) para ambos tratamientos.
Inoculación del alimento balanceado. Una vez establecida la carga microbiana mediante el ajuste del inóculo, la bacteria ácido láctica se adicionó por aspersión a una concentración de 20% p/v, para luego realizar el mezclado y finalmente se incubó a 37°C por 24 h [16]. Al final, se conservó a temperatura ambiente y en bolsas de cierre hermético.
Evaluación en pollos de engorde
Se utilizaron 300 pollos machos de un día de edad (Ross 308 AP). Los animales se alojaron en jaulas de la clínica veterinaria Carlos Martínez Hoyos perteneciente a la Universidad de Nariño. Los pollos se mantuvieron a una temperatura de 30°C, que disminuyó a 21°C al final del experimento. La humedad estuvo entre 50 y 65%. Durante los primeros 7 días, los pollos tuvieron luz las 24 h, para luego ir disminuyendo gradualmente hasta 12 h. El experimento se realizó de los 7 a los 35 días. La primera semana fue de adaptación a las raciones experimentales, con un suministro de agua ad libitum.
Los animales se distribuyeron de manera aleatoria en cuatro grupos de 60 aves cada uno. El primer grupo fue alimentado con una dieta comercial sin aditivos (T0); el segundo, dieta comercial con probiótico comercial (T1, consorcio); el tercero, dieta comercial con Lactobacillus plantarum microencapsulado (T2) y el cuarto, dieta comercial con Lactobacillus plantarum sin microencapsular (T3). Las aves fueron alimentadas dos veces al día, de acuerdo con las especificaciones de la casa comercial.
Se midió el consumo de materia seca (CMS), la ganancia de peso (GP) y la conversión alimenticia (CA). De igual manera, se determinaron los metabolitos sanguíneos, triglicéridos y colesterol mediante los protocolos establecidos por los kit de Biositem® y proteínas totales mediante refractómetro.
Al final del periodo experimental se sacrificaron 10 aves por grupo y se tomaron muestras del tracto gastrointestinal, que se colocaron en formol buferado al 10% para fijación por 24 h, luego se hizo corte de duodeno, yeyuno e íleon y se colocaron en cassettes para inclusión de tejidos debidamente rotulados, se les realizó inclusión en parafina y coloración de hematoxilina y eosina. En los micropreparados se establecieron los parámetros histológicos hipertrofia e hiperplasia de las células epiteliales.
La tinción diferencial utilizada en el estudio fue la coloración con Alcian Blue, que fue ajustada a un pH de 2,5 a 3,0. Para determinar la cantidad de moco producido por las células caliciformes, las áreas se estimaron entre la capa más interna de mucosa y la más externa de la misma, de 5 campos intestinales diferentes en cada animal, se usó como lectura en objetivo de 40X usando un microscopio Nikon Eclipse 80i, camera infinity y el software ImagePro Plus 5.0 software (Media Cybernetics, Silver Spring, MD, USA) para la descripción de alteraciones microscópicas a Jubb et al. [20].
Para establecer la relación cripta-vellosidad en el intestino delgado, la longitud de la vellosidad se calculó midiendo la distancia entre la punta de la vellosidad y su base, excluyendo la cripta. Este procedimiento se hizo en cada uno de los grupos experimentales.
Para histoquímica se emplearon marcadores monoclonales inmunohistoquímicos de uso en humanos CD3 y CD79a a los bloques de parafina del tracto gastrointestinal de los animales para evaluar la expresión de linfocitos T y B del tejido linfoide asociado al intestino GALT.
Microscopia electrónica de barrido. Las muestras del segmento conservado en alcohol al 90° se analizaron mediante la técnica del Laboratorio de Microscopia electrónica de la Universidad de Caldas, utilizando el protocolo para el procesamiento de este tipo de muestras definido por dicho Laboratorio. También, se tomó registro fotográfico para evidenciar el resultado.
Análisis estadístico
En todas las variables se determinó estadística descriptiva. El crecimiento a diferentes concentraciones de sales biliares y bilis se evaluó mediante un diseño completamente al azar (DCA) con tres tratamientos: Ta 0,3% de sales biliares, Tb 0,5% de sales biliares y Tc crecimiento sin sales biliares (testigo), cada tratamiento contó con 8 réplicas. Para la variable bilis, se usó el mismo diseño y número de réplicas por tratamiento (Ta: bilis al 0,3%, Tb con bilis al 0,5% y Tc sin bilis).
Los parámetros zootécnicos (CMS, GP y CA) y bioquímicos (triglicéridos, colesterol y proteínas totales) se evaluaron mediante un diseño completamente al azar con 4 tratamientos (60 aves cada uno), 3 repeticiones por tratamiento (20 aves por repetición) y se muestreó de manera aleatoria a 5 animales por réplica para un total de 15 animales muestreados por tratamiento. Se determinó diferencias mediante la prueba paramétrica Tukey a un nivel de significancia del 95%.
RESULTADOS
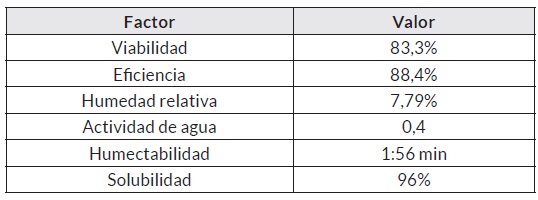
Los resultados de la microencapsulación de Lactobacillus plantarum se pueden observar en el cuadro 1. Los valores indican una buena viabilidad del microencapsulado; al respecto, Rodríguez et al. [18] encontraron porcentajes de 84 y 96% de viabilidad para L. rhamnosus y L. casei respectivamente. Por otra parte, Montes [21] tuvo una viabilidad de 46,53% para L. casei, valor más bajo al encontrado en esta investigación.
La eficiencia se encuentra por debajo de lo reportado por Chen et al. [22] con valores entre 96,5 y 97,85%. Sin embargo, Parra [23] indica que este parámetro se ve influenciado por factores como la masa molecular del polímero, tamaño y microporosidad de la esfera y características físico-químicas del principio activo, factores que podrían explicar los resultados obtenidos.
Para el caso de la humedad, el valor encontrado es mayor al de otros autores [24-25], lo que demuestra que es necesario trabajar más sobre este parámetro. Al respecto, Dinkçi et al. [26] mencionan que la humedad en un microencapsulado debe mantenerse entre 3,5 y 4,0%, ya que puede presentar problemas de conservación durante su vida útil.
La humectabilidad tiene un menor tiempo, en comparación al estudio de Montes [21] ; este autor menciona que la lenta rehidratación tiene un efecto positivo sobre la viabilidad de las cepas microencapsuladas, lo que sugeriría que se necesita mejorar su contextura con otros materiales microencapsulantes.
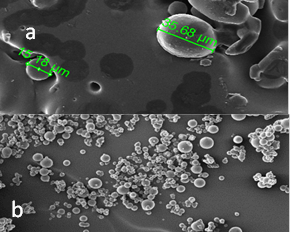
El tamaño y la morfología se observan en las figuras 1. En cuanto al tamaño de partícula se encontraron valores de 15,18 a 35,68 µm. Los estudios muestran que el tamaño del microencapsulado influye sobre la viabilidad de la bacteria [27]. Ramos et al. [27] manifiesta que tamaños entre los 2 y 100 µm se consideran adecuados para una microencapsulación, ya que si son demasiados grandes dificulta la liberación de la cepa y si son muy pequeños, su protección no será efectiva. Por ello, los resultados encontrados tienen un efecto positivo sobre la microencapsulacion de L. plantarum.
Para la simulación de condiciones gastrointestinales, el crecimiento, a pH 3 por 24 h, mostró un crecimiento de 6,4 x 109, valor indicador de que la cepa láctica muestra resistencia a las condiciones ácidas; si se tiene en cuenta que el pH gastrointestinal de las aves puede llegar hasta 3 o incluso menos, la bacteria tiene altas posibilidades de sobrevivir microencapsulada y con ello atravesar la porción inicial de tracto digestivo [28].
Para el caso de bilis y sales biliares los resultados se pueden observar en la figura 2. No se encontraron diferencias significativas entre los tratamientos (p>0,05). Esto demuestra que el crecimiento en condiciones gastrointestinales simuladas no se ve afectado. Al respecto, estudios realizados por Chen et al. [29] indican que las bacterias ácido lácticas microencapsuladas presentan mejor crecimiento en condiciones de pH alto (básico), debido a la capa protectora que las recubre, de esta manera se garantiza la viabilidad de la cepa, para su posterior liberación en un ambiente menos agresivo.
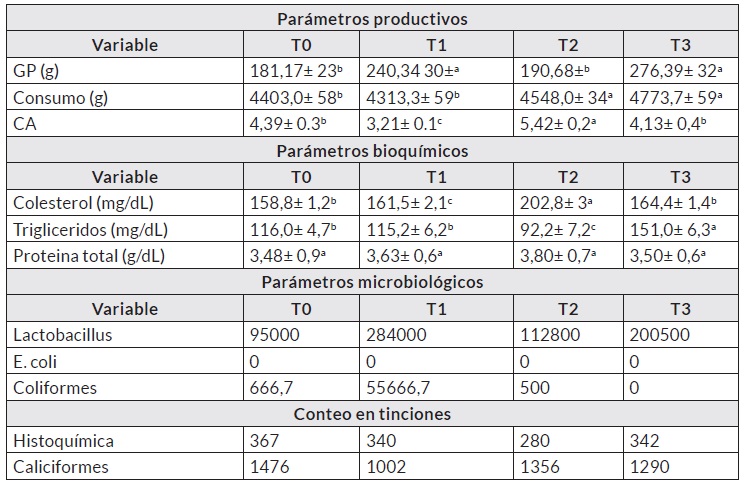
Los resultados de los parámetros productivos se puede observar en el cuadro 2, encontrando diferencias significativas entre los tratamientos (p< 0,05) y se observa un mayor crecimiento en los tratamientos probióticos comercial y L. plantarum sin microencapsular.
Estos resultados indican que el suministro de probióticos en la alimentación de pollos de engorde muestra ser benéfico para los rendimientos productivos. En cuanto al consumo, se encontraron resultados similares y la conversión alimenticia muestra como el tratamiento con probiótico comercial (T2) tienen mayor eficiencia en la transformación del alimento.
A pesar de observarse diferencias entre los parámetros bioquímicos, los valores se encuentran dentro del rango normal de la especie, por lo que no se puede tener información concluyente sobre los efectos de los organismos probióticos sobre los parámetros bioquímicos evaluados.
Como era de esperarse, los parámetros microbiológicos demostraron un incremento de la población microbiana en los tratamientos con el suministro de probióticos, ya sea en consorcio (probiótico comercial) como cepas individuales (L. plantarum). Al respecto, Manes-Lazaro et al. [30] mencionan que la presencia de organismos probióticos en el tracto gastrointestinal de las aves tiene un efecto benéfico para su salud. Entre estos beneficios se encuentra la exclusión competitiva, el antagonismo hacia otras cepas, especialmente patógenas la estimulación inmune del hospedero y producción de biocinas [31]. Con lo anterior, se puede determinar que algunas de las mejoras en los parámetros zootécnicos pueden ser el resultado de la correcta colonización de los probióticos en el tracto de los pollos de engorde evaluados.
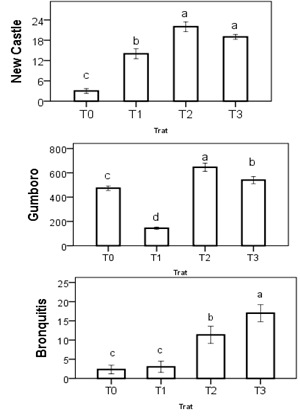
Los resultados para títulos se observan en las figuras 3. Se encontró una mayor seroconversión para los tratamientos con administración de L. plantarum (T2 y T3), lLo que demuestra un efecto positivo de la bacteria. En el caso de Gumboro y bronquitis muestran resultados similares, ya que T2 y T3 presentan los mayores valores de seroconversión.
Los resultados demuestran que es una ventaja la utilización de L. plantarum en la estimulación del sistema inmunitario de los pollos de engorde; factor que tendrá efectos benéficos para el sistema de producción.
En otros estudios se ha demostrado que la utilización de cepas probióticas permite la estimulación del sistema inmunológico del animal huésped, estos efectos se han observado en aves y cerdos, lo que corrobora los resultados obtenidos. Sin embargo, se necesita continuar con la investigación, ya que este tipo de resultados aún no son concluyentes para la comunidad científica y se hace necesario realizar otro tipo de pruebas para determinar su efectividad [32-33] .
Los resultados para coloración e histoquímica de células caliciformes se pueden observar en la figura 4 y cuadro 2. Se encontró que las células caliciformes fueron marcadas con la técnica Alcian blue y con ello se puede realizar conteo de este ellas. De igual manera, la inmunomarcación fue positiva para los tejidos de pollos de engorde, lo que se convierte en una herramienta más para investigar los efectos probióticos en este tipo de animales.

Figura 4. Inmunohistoquímica en intestino delgadocoloración de Alcian Blue para células caliciformes. a: Tinciónde Alcian blue para caliciformes; b: inmunohistóquimica.
Se observa que los mayores valores para ambas variables se pueden observar en el tratamiento T0 (sin probiótico). Estos resultados no se pueden explicar de manera adecuada, dado que se esperaría que los tejidos de animales con administración de probióticos debieran tener el mayor conteo, sin embargo, dado que la técnica recién inicia en la identificación de células de pollo de engorde, se hace necesario continuar investigando para obtener información más contundente.
CONCLUSIONES
Los resultados indican que la administración de Lactobacillus plantarum tiene efectos positivos sobre los parámetros productivos ganancia de peso, consumo de alimento y conversión alimenticia. Aunque el suministro muestra diferencias en los parámetros bioquímicos, estos valores están dentro del rango para la especie. De igual manera, se incrementan la respuesta inmune del hospedero. Finalmente, el método de microencapsulado y la matriz usada para recubrir la cepa mantiene la viabilidad de la bacteria.