Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Colombiana de Ciencias Químico - Farmacéuticas
versión impresa ISSN 0034-7418versión On-line ISSN 1909-6356
Rev. colomb. cienc. quim. farm. v.40 n.1 Bogotá ene./jun. 2011
Artículo de Investigación Científica
Purificación y determinación de carbohidratos en la vicilina de Canavalia ensiformis
Purification and carbohydrate determination of vicilin from Canavalia ensiformis
Patricia Martínez 1, Marta Lucía Pabón2, Diego Armando Gómez3, Sonia Luz Albarracín4.
1 Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia, sede Bogotá, D. C., Colombia. Correo electrónico:pmartinezm@unal.edu.co
2 Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia, sede Bogotá, D. C., Colombia. Correo electrónico: mlpabonr@unal.edu.co.
3 Laboratorio de Química Teórica y Computacional, Instituto de Tecnología Química CSIC, Universidad Politécnica de Valencia, Valencia, España, Av. Los Naranjos s/n. Código postal: 46022. Correo electrónico: dagomez@itq.upv.es.
4 Laboratorio de Neurobioquímica, Departamento de Nutrición y Bioquímica, Pontificia Universidad Javeriana, Bogotá, D. C., Colombia, carrera 7a No. 40-62, edificio 54, laboratorio 304 A. Fax: 3208320-4059. Correo electrónico: albarra@javeriana.edu.co.
Recibido para evaluación: 7 de febrero de 2011. Aceptado para publicación: 18 de marzo de 2011.
RESUMEN
Este estudio reporta la purificación y determinación de carbohidratos en la vicilina de Canavalia ensiformis( Jack bean). La vicilina se purificó por precipitación isoeléctrica a pH 6,4 y 4,8, cromatografía de intercambio iónico (DEAE-Sephadex A-50) y cromatografía de afinidad (Con A -Sepharosa 4B). La pureza de la proteína se verificó por SDS-PAGE y su identidad se confirmó por espectrometría de masas empleando la técnica de ionización MARLDI (desorción-ionización con láser asistida por una matriz) en un espectrómetro de tiempo de vuelo (TOF) obteniéndose un espectro de masas característico de la proteína (PMF) (MALDI-TOF-PMF). La oxidación de residuos glicosídicos en la vicilina demostró la presencia de carbohidratos en la proteína, lo cual se corroboró por deglicosilación enzimática con Péptido N-glicosidasa F (PNGasa F) y por el método de Dubois, el cual mostró un contenido de carbohidratos del 4,03% en la proteína. Estos resultados muestran, por primera vez, la presencia de glicósidos en la vicilina de Canavalia ensiformis. El proceso de purificación de la vicilina de la semilla de Canavalia ensiformis, desarrollado en este trabajo, permitió obtener la proteína con un grado de pureza muy superior al descrito previamente en la literatura.
Palabras clave: vicilina, Canavalia ensiformis, glicosilación, leguminosas.
SUMMARY
This study reports the purification and carbohydrate determination of vicilin from Canavalia ensiformis ( Jack bean). The vicilin was purified by isoelectric precipitation at pH 6.4 and 4.8, ion exchange chromatography (DEAE-Sephadex A-50) and affinity chromatography (Con A -Sepharosa 4B). Protein identity was confirmed by mass spectrometry (MALDI-TOF-PMF) (Matrix assisted laser desorption ionizationtime of flight-Peptide mass fingerprinting) and purification was confirmed by sdspage. Oxidation of glycosylated moiety in pure vicilin demonstrates the presence of carbohydrates in the protein. The presence of carbohydrates in the pure vicilin fraction was confirmed by enzymatic deglycosylation by Peptide N-glycosidase F (PNGasa F) and by Dubois' method, finding a 4.03% carbohydrate content in such protein. These results demonstrate for the first time the presence of glycosides in C. ensiformis vicilin. The purification process of vicilin seed of Canavalia Ensiformis used in this study allowed us to obtain a protein with a high degree of purity, superior to the ones described in the literature.
Key words: vicilin, Canavalia ensiformis, glycosylated form of vicilin, leguminosae.
INTRODUCCIÓN
En las semillas de leguminosas se encuentran presentes varios tipos de proteínas entre las cuales se hallan las proteínas de reserva. Dichas proteínas son globulinas, las cuales se clasifican de acuerdo con su coeficiente de sedimentación en dos tipos: globulinas 11S o leguminas y globulinas 7S o vicilinas, siendo generalmente más abundantes las vicilinas (1). Aunque frecuentemente se utilizan nombres triviales para identificar estas proteínas, dependiendo de la especie de la cual provengan, los términos leguminas (11S) y vicilinas (7S) son comúnmente usados (1, 2, 3, 4).
Los estudios más recientes sobre vicilinas de leguminosas están orientados hacia la investigación de su efecto antimicrobial (5), su participación en la resistencia de semillas al ataque por insectos (6) y como alérgeno presente en alimentos (7, 8, 9). Igualmente, debido al valor nutricional de estas proteínas, se han realizado estudios sobre sus propiedades fisicoquímicas, funcionales y estructurales (10, 11, 12).
Las vicilinas son trímeros cuyas subunidades tienen una Mr alrededor de 45-55 kDa (13, 14) y en la mayoría de los casos las subunidades no están unidas por puentes disulfuro (1). Estas proteínas son frecuentemente glicosiladas (1, 2, 4), con un contenido de azúcares neutros de menos del 2% al 5% y hexosaminas de menos del 0,2% al 1,2% (1). Algunas subunidades 7S son modificadas postranslacionalmente por rompimiento proteolítico de ciertos enlaces peptídicos. Los péptidos resultantes pueden ser estabilizados en los oligómeros por interacciones no covalentes y se evidencian cuando los oligómeros purificados son desnaturalizados y los péptidos resueltos por electroforesis (2).
En C. ensiformis se ha reportado la presencia tanto de leguminas como de vicilinas siendo más abundante la fracción de vicilinas (15, 16, 17). La vicilina de Canavalia ensiformis, denominada "Precursor de Canavalina"", constituye cerca del 50% de la proteína soluble total (16), es un trímero constituido por unidades estrechamente relacionadas pero no necesariamente idénticas en secuencia con una Mr de 47-50 kDa (14, 16, 17, 18) y un ión Zn+2 (16), las cuales no se encuentran unidas por enlace disulfuro (17). El tratamiento del "Precursor de Canavalina" con enzimas proteolíticas produce un derivado proteolítico al que se denomina "Canavalina", el cual se encuentra constituido por dos cadenas polipeptídicas altamente asociadas denominadas cadenas A y B (14, 16, 19). La Mr de la molécula nativa es aproximadamente de 142.000 Da (18) y el modelo de su estructura tridimensional se construyó teniendo en cuenta el estudio cristalográfico de su derivado proteolítico (Canavalina) y la secuencia deducida de la proteína nativa (14, 16, 18, 20). Sin embargo, no se ha establecido si la vicilina de Canavalia ensiformis se encuentra glicosilada y además la proteína aislada en varios trabajos, muestra en todos los casos, un perfil electroforético complejo (1, 15, 16, 17), indicando un bajo grado de pureza de ésta.
En las semillas maduras de las leguminosas, las proteínas de reserva se encuentran depositadas en estructuras vacuolares características denominadas cuerpos proteicos en los cuales se encuentran también las lectinas (15, 21, 22). La localización común de las proteínas de reserva y las lectinas puede deberse a que estas últimas desempeñan algún papel en el mecanismo de almacenamiento de las proteínas de reserva (15, 23, 24), el cual no está aún claramente establecido. No obstante, los estudios bioquímicos conducentes al esclarecimiento de dicho mecanismo requieren el uso de preparaciones puras de vicilina, lo cual no se ha logrado hasta el momento con todas las especies de leguminosas. En este trabajo se desarrolló un método de purificación de la vicilina de Canavalia ensiformis que permite obtener la proteína con un alto grado de pureza.
En esta publicación se describe la extracción, purificación y determinación de la presencia de carbohidratos en la vicilina de Canavalia ensiformis obtenida a partir de semilla madura.
METODOLOGÍA
Materiales y reactivos
Las semillas maduras de C. ensiformis se colectaron en el municipio de Silvania, Cundinamarca (Colombia). Las semillas se lavaron y se secaron al aire a temperatura ambiente y se molieron hasta obtener un polvo fino. La harina obtenida se desengrasó con éter de petróleo, se secó a temperatura ambiente y se utilizó como material de partida para la extracción de la vicilina.
Los eritrocitos de conejo fueron suministrados por el Laboratorio de Hematología de la Facultad de Veterinaria de la Universidad Nacional de Colombia.
Se usaron los siguientes reactivos: de SIGMA-ALDRICH (Saint Louis, Missouri, EE. UU.): Concanavalina A (Con A) de alta pureza, acetonitrilo (ACN), ditiotreitol (DTT), ácido trifluoroacético (TFA), streptavidina-peroxidasa 80% proteína, tween 20, leupeptina grado bioquímico, etilénglicol grado espectrofotométrico 99+%, ovoalbúmina 98%, metil α-D-manopiranósido 99% (Me α-D-Man), ponceau S, albúmina sérica bovina (BSA) 96%, sepharose 4B-activada con bromuro de cianógeno, metaperyodato de Sodio >99,55, biotina hidrazina 98% y β-mercaptoetanol (β-ME) para electroforesis. De BIORAD (Hércules, California, EE. UU.): 3,3'-Diaminobencidina (DAD) y membrana de nitrocelulosa (0,2 µm). De Pharmacia (Estocolmo, Suecia): Dietilaminoetil Sephadex A-50 (DEAE-Sephadex A-50). De Boehringer Mannheim GmbH (Mannheim, Alemania): N-glicosidasa F (Peptido N-glicosidasa F) o (PNGasa F) y CompleteTM (coctel inhibidor de proteasas). De Calbiochem (Darmstadt, Alemania): Biotin-XNHS > 90%. De GIBCO BRL (Carlsbad, California, EE. UU.): los marcadores de pesos moleculares en los siguientes rangos: 14,4-94,0 kDa, 14,0-97,0 kDa y marcadores preteñidos en el rango de 14,1-215,1 kDa.
Extracción de la vicilina
El extracto crudo de la semilla se preparó a partir de la harina desengrasada, con base en los métodos descritos por Wenzel et al. (23) y Morita et al. (25). Una muestra de 20g de harina se homogenizó con 100 mL de Tris-HCl 50 mM, pH 8,0, NaCl 100mM, NaN3 0,02% y dos pastillas de inhibidor de proteasas CompleteTM. La extracción se realizó a 4°C y luego se centrifugó (18.000 rpm, 20 min, 4 °C) para remover el material insoluble. El residuo se extrajo una vez más con la solución amortiguadora de extracción citada anteriormente (1:5 p/v). Los sobrenadantes provenientes de la primera y segunda extracción se unieron y su pH se ajustó a 5,0 con ácido acético 1M, se dejó en reposo una noche a 4 °C y se centrifugó (18.000 rpm, 20 min, 4 °C). El residuo, correspondiente a las proteínas de reserva, se suspendió en Tris-HCl 50mM, pH 8,0, NaCl 200 mM, NaN3 0,02% durante una hora a 4 °C y el pH se ajustó a 8,0 con NaOH 1M.
Purificación de la vicilina
Precipitación isoeléctrica
La suspensión de la etapa anterior se centrifugó (18.000 rpm, 30 min, 4 °C) y el sobrenadante se sometió a precipitación isoeléctrica a pH 6,4 y 4,8 como lo describen Morita et al. (25). La precipitación a pH 4,8 produjo la fracción de vicilina, la cual fue suspendida y homogenizada a 4 °C en solución amortiguadora de fosfatos 100 mM, pH 8,0, NaCl 0,1M, NaN3 0,02% (PBS) y dializada contra la misma solución. Esta fracción se clarificó (18.000 rpm, 30 min, 4 °C) y el sobrenadante dializado contra NH4HCO3 50mM constituyó lo que se denominó "fracción cruda de vicilina", la cual fue cuantificada por el método modificado de Bradford (26) utilizando BSA como estándar, analizada por SDS-PAGE (27), y almacenada a -70 °C.
Cromatografía en DEAE Sephadex A-50
Una muestra de 4 mg de la "fracción cruda de vicilina" se aplicó sobre una columna de DEAE Sephadex A-50 (1,0 x 12,0cm) previamente equilibrada con solución amortiguadora de fosfatos 15mM, pH 8,0 en presencia de NaCl 0,2M, NaN3 0,02% y leupeptina 10mM. La elución se realizó con un gradiente lineal de NaCl 0,2-2,0M, a una velocidad de flujo de 0,3 mL/min, se recogieron fracciones de 3,5 ml y se midió la conductividad de cada una de ellas. Los picos eluidos se dializaron contra NH4HCO3 50mM, se cuantificaron utilizando bsa como estándar y se analizaron por electroforesis (27).
Cromatografía de afinidad en Con A -Sepharosa 4B
A 5,0 g de Sepharosa 4B activada con bromuro de cianógeno se acoplaron 144mg de Con A de acuerdo con la metodología descrita (28). La proteína eluida de la columna de DEAE Sephadex A-50 se aplicó sobre este soporte previamente equilibrado con Tris HCl 20mM, pH 7,2, NaCl 150mM, CaCl2 1mM, MnCl2 1mM (TBS)-NaN3 0,02%. La elución se realizó a una velocidad de flujo constante de de 0,3mL/min, empleando como eluyentes: A: TBS-NaN3 0,02%- leupeptina 10µM (tampón A); B: tampón A-etilén glicol 33% (v/v); C: tampón A-etilén glicol 33% (v/v)-Me α-D-Man 0,3M. La proteína eluida con C, denominada fracción pura de vicilina, se dializó contra NH4HCO3 50mM, se cuantificó utilizando BSA como estándar (26) y se analizó por electroforesis (27).
La elución de las proteínas de cada una de las columnas cromatográficas se monitoreo a 220 y 280nm y cuando fue necesario se evaluó la presencia de Con A por su actividad eritroaglutinante (29).
Análisis por MALDI-TOF-PMF
Las bandas obtenidas por page-sds de la fracción cruda de vicilina se cortaron y se lavaron con agua y ACN (30). Las proteínas se redujeron con DTT y se alquilaron con yodoacetamida en carbonato de amonio y luego se sometieron a digestión con tripsina toda la noche a 37 °C de acuerdo con Backstrôm et al. (31). Después de la digestión en el gel con tripsina, la muestra se cargó sobre una micropipeta tip (C18 Zip Tip; Millipore, Bredford, MA), se lavó diez veces con 10 mL de TFA 0,1% y se eluyó con 1 mL de ACN 50%/TFA 0,1%. El análisis se llevó a cabo utilizando ácido α-ciano-4-hidroxicinámico como matriz (10 mg/mL en acn 50%/TFA 0,1% v/v), mezclando volúmenes iguales de muestra y matriz y colocando 1 mL de la mezcla sobre una placa de muestreo estándar MALDI de acero inoxidable con 96 pozos. El análisis de los péptidos se realizó en un espectrómetro de masas de tiempo de vuelo Voyager- de STR de Applied Biosystems (Framingham, MA), equipado con un láser de nitrógeno (337 nm; ancho de pulso: 3ns; frecuencia de repetición: 20 Hz). Los datos de masa recolectados durante el análisis por MALDI-TOF-PMF se procesaron y se cargaron en el software de búsqueda Mascot (http://www.matrixscience.com/) usando los siguientes parámetros de búsqueda: i) modificaciones fijas: carbamidometilación de cisteínas, ii) modificaciones variables: oxidación de metioninas, iii) valores de masas: monoisotópicos, iv) masa proteica: no restringida, v) tolerancia masa del péptido: Â ± 100 ppm, vi) estado de carga del péptido: 1+ y vii) máximos rompimientos perdidos: uno. Los péptidos se identificaron comparando los datos experimentales con la base de datos del NCBI (National Center for Biotechnology Information) para plantas verdes.
Electroforesis en geles de poliacrilamida
La electroforesis (page-sds) se realizó a temperatura ambiente en geles de poliacrilamida al 12% (8 x 5 cm) de 0,75 mm de grosor, empleando el método de Laemmli en condiciones no reductoras (27). Las muestras de proteína se desnaturalizaron por calentamiento a 90 °C durante 5 min. Cuando fue necesario el análisis de la fracción de vicilina en condiciones reductoras, se incluyó β-mercaptoetanol en la solución amortiguadora empleada para preparar la muestra. Las bandas de proteína se visualizaron por tinción con azul de coomassie R-250 al 0,2% p/v en una mezcla de ácido acético, metanol, agua (1:10:20). La densitometría de los geles se realizó en un analizador de imágenes UB Gel Doc 1000 de BIO RAD, empleando el programa de software "Molecular Analyst" versión 1,5 de BIO RAD.
Determinación de α-manosidasa en la vicilina
Se determinó de acuerdo con la metodología descrita por Li et al. (32), empleando 43 y 258 µg de proteína y siguiendo la hidrólisis del sustrato durante 30-60 min de reacción.
Detección de carbohidratos en la vicilina
Sobre un gel de poliacrilamida-SDS al 12% se sembraron las siguientes muestras: fracción pura de vicilina (8,3µg), ovoalbúmina (control positivo de glicosilación) (6,0µg) (33) y marcador de pesos moleculares. Esta secuencia de aplicación se repitió dos veces más con el fin de tener tres grupos de proteínas para realizar posteriormente los siguientes tratamientos: a) determinación de carbohidratos en muestras oxidadas, b) muestras no oxidadas y c) control de transferencia a la membrana de nitrocelulosa. La electroforesis se realizó, según Laemmli (27), en ausencia de agente reductor y luego el gel se electrotransfirió a una membrana de nitrocelulosa (34) por 28min a temperatura ambiente aplicando 2 mA/cm2 a corriente constante en una cámara de transferencia semiseca (Trans-blot sd Semi-dry transfer cell. BIO RAD).
Después de la transferencia, el gel se tiñó con azul de coomassie R-250 al 0,2%p/v en una mezcla de ácido acético, metanol, agua (1:10:20) y la membrana de nitrocelulosa se lavó con agua desionizada, se secó al aire y se dividió en tres segmentos: A, B y C, de acuerdo con los tres grupos de proteínas sembradas originalmente en el gel para los diferentes tratamientos a realizar.
Sobre el segmento A se procedió a detectar la presencia de carbohidratos en las proteínas por oxidación con metaperyodato de sodio y posterior incubación con hidrazina biotinilada (35), streptavidina-peroxidasa y DAB, de acuerdo con la siguiente metodología: la membrana de nitrocelulosa se incubó con metaperyodato de sodio 30mM en solución amortiguadora de acetato 100 mM pH 5,5 y posteriormente con hidrazina biotinilada 25 x 10-5 mM en solución amortiguadora de acetato 100mM pH 5,5. Luego la membrana se bloqueó con bsa (1,3% p/v en PBS) y se incubó con streptavidina- peroxidasa (0,5µg/mL en PBS). Cada una de las incubaciones se realizó durante una hora a temperatura ambiente, con agitación suave y en la oscuridad. Después de cadatratamiento la membrana se lavó con PBS tres veces (5 min). El revelado se realizó con DAB (0,5 mg/mL en tbs) en presencia de H2O2 al 0,03%, durante 5 min a temperatura ambiente.
El segmento B de la membrana de nitrocelulosa se sometió al mismo tratamiento del segmento A, omitiéndose el proceso de oxidación con metaperyodato de sodio, a cambio del cual se incubó con solución amortiguadora de acetato 100mM pH 5,5.
El segmento C de la membrana de nitrocelulosa (control de transferencia) se reveló con rojo ponceau (0,5% p/v en ácido acético 1% v/v).
Cuantificación de carbohidratos en la vicilina
Se realizó por el método de Dubois (36) estandarizado a escala micro por Almanza (37).
Deglicosilación enzimática de la vicilina
La deglicosilación se llevó a cabo con N-Glicosidasa F (PNGasa F) con base en la metodología descrita por Tarentino et al. (38), con algunas modificaciones. La mezcla de reacción enzimática contenía 50µg de la fracción pura de vicilina, β- mercaptoetanol 10mM, Tris-HCl 50mM pH 8,6 y 1.200 miliunidades de PNGasa F en un volumen total de 100 µL. La mezcla se incubó a 37°C durante 18 horas y posteriormente la enzima se inactivó por enfriamiento a 0°C durante una hora. Las muestras de proteína tratadas enzimáticamente se dializaron exhaustivamente contra NH4HCO3 50mM a 0°C, se liofilizaron y se analizaron por PAGE-SDS (27). Como control del protocolo de deglicosilación se utilizó ovoalbúmina, la cual se sometió al mismo tratamiento empleado con la fracción de vicilina.
La ausencia de carbohidratos en las proteínas tratadas con PNGasa F se corroboró transfiriéndolas a una membrana de nitrocelulosa y sometiéndolas al proceso de oxidación con metaperyodato de sodio para posterior detección de los productos de oxidación, siguiendo la metodología ya descrita.
RESULTADOS Y DISCUSIÓN
Extracción de vicilina
El conjunto de los sobrenadantes de la primera y segunda extracción (extracto crudo total de la semilla de Canavalia ensiformis) mostró por PAGE-SDS (figura 1a, carril 2) bandas a 60,3 y 51,3 kDa, correspondientes a leguminas y vicilinas, para cuyas subunidades se reportan masas moleculares relativas de 50-67 y 45-55 kDa, respectivamente (2, 17, 39). Se observaron, además, las tres bandas características de la Con A a 29,5, 17,4 y 13,8 kDa, correspondientes a la proteína madura y a los fragmentos α y β resultantes del procesamiento postranslacional de la proteína (40). La actividad eritroaglutinante de este extracto confirmó la presencia de la lectina.

El análisis por densitometría del carril 2 de la figura 1(a) mostró que la banda correspondiente a la vicilina (a 51,3 kDa) corresponde a un 50% de la proteína soluble total, mientras que la de Con A (a 29,5 kDa) constituye el 28%, lo que concuerda con lo reportado para Canavalia ensiformis (16, 40, 41, 42, 43, 44).
El tratamiento a pH 5,0 precipitó las proteínas de reserva cuyo control electroforético mostró predominantemente la banda correspondiente a la fracción de vicilina a 51,3 kDa, la de la legumina a 60,3 kDa y varias bandas de menor intensidad entre las cuales se observa una banda débil a 26,3 kDa (figura 1b, carril 2), pero no presentó las bandas características de la Con A, lo que indicó que la precipitación a pH 5,0 con ácido acético 1M eliminó la lectina de la fracción de proteínas de reserva, lo que se corroboró por la ausencia de actividad eritroaglutinante.
Purificación de vicilina
La purificación de vicilina de Canavalia ensiformis se resume en la tabla 1.
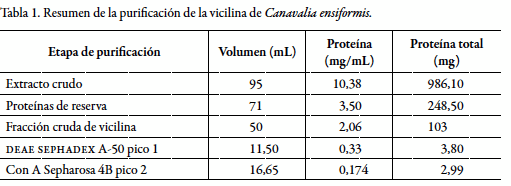
La "fracción cruda de vicilina" (figura 1b, carril 3) obtenida por precipitación a pH 4,8, presentó predominantemente una banda a 50,1kDa, proteínas contaminantes de alto peso molecular (por encima de 60 kDa) y dos bandas adicionales a 25,7 y 24,0 kDa. Las bandas de 50,1, 25,7 y 24,0 kDa se analizaron por MALDI-TOF-PMF y los espectros de masas obtenidos se cargaron en el software de búsqueda MASCOT, obteniéndose los resultados que se presentan en la tabla 2.
El espectro de masas (PMF) de la banda de 50,1 kDa se comparó con el del precursor de Canavalina de Canavalia ensiformis y Canavalia gladiata y con el de las cadenas A y B de Canavalina de Canavalia ensiformis (tabla 2). La puntuación de 200 obtenida con el precursor de Canavalina de Canavalia ensiformis, indica que la banda de 50,1kDa presenta un patrón característico de péptidos igual al del precursor de Canavalina de Canavalia ensiformis, lo que confirma que esta banda corresponde a la vicilina de Canavalia ensiformis.
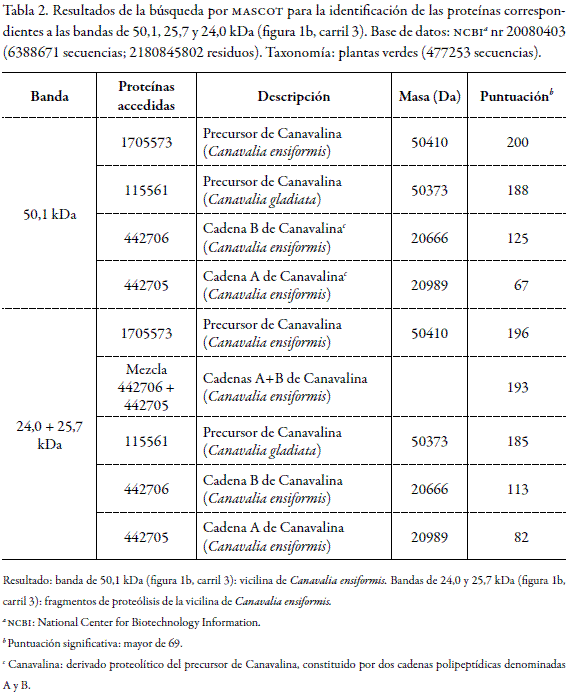
El espectro de masas (PMF) de la mezcla de las bandas de 24,0 y 25,7kDa se comparó con el del precursor de Canavalina de Canavalia ensiformis y Canavalia gladiata, con el de la mezcla de las cadenas A y B de Canavalina de Canavalia ensiformis y con el de cada una de las cadenas A y B de Canavalina de Canavalia ensiformis (tabla 2). Los valores de puntuación más altos se obtuvieron con el precursor de Canavalina de Canavalia ensiformis y con la mezcla de las cadenas A y B de Canavalina de Canavalia ensiformis, lo que indica que las bandas de 24,0 y 25,7 kDa corresponden a las cadenas A y B de Canavalina de Canavalia ensiformis, es decir, a los fragmentos de proteólisis de la vicilina.
El tratamiento de la "fracción cruda de vicilina" con β-mercaptoetanol al 10%p/v para realizar la electroforesis no afectó la Mr de la banda a 50,1kDa correspondiente a la vicilina (figura 1c, carriles 1 y 2), lo que mostró que esta proteína no contiene subunidades unidas por enlace disulfuro, lo que corresponde a una característica estructural típica de las vicilinas (1, 17).
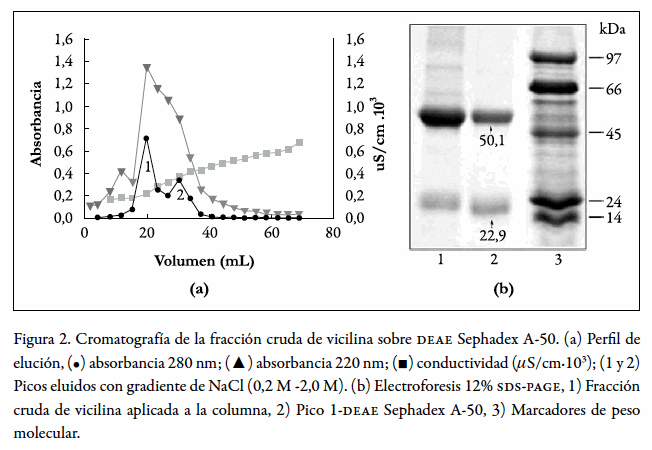
La cromatografía de la "fracción cruda de vicilina" en DEAE-Sephadex A-50 produjo dos picos de acuerdo con la absorbancia a 280 nm, los cuales se numeran en la figura 2a como 1 y 2. La mayoría de la proteína eluyó en el primer pico, el cual mostró por page-sds (figura 2b, carril 2) una banda fuerte a 50,1 kDa correspondiente a la vicilina y otra a 22,9kDa correspondiente a los fragmentos de proteólisis de la vicilina. Esta cromatografía eliminó las proteínas contaminantes de alto peso molecular presentes en la fracción cruda de vicilina, como se observa en el control electroforético (figura 2b, carriles 1 y 2), pero no eliminó los fragmentos de proteólisis alrededor de 24kDa, los cuales según el análisis por densitometría constituyen el 30% de la proteína total.
Dado que Marcus et al. en 1989 (44) eluyeron la vicilina de Canavalia ensiformis de una columna de Con A-Sepharosa empleando metil α-D-manósido en el tampón de elución, se intentó utilizar este sistema para purificar la fracción de vicilina. La cromatografía sobre Con A-Sepharosa, del pico 1 eluido de la columna de DEAE Sephadex A-50, produjo un pico mayoritario al incluir Me α-D-manósido en el tampón de elución (figura 3a, pico 2), el cual presentó por electroforesis (figura 3b, carril 1) una banda predominante a 51,3 kDa correspondiente a la vicilina y una tenue a 25,1 kDa correspondiente a los fragmentos de proteólisis. El análisis densitométrico de esta muestra reveló que la banda de 51,3 kDa corresponde al 93% de la proteína total aplicada al gel y la de 25,1 kDa al 7%; relación que se mantuvo aun cuando se sobrecargó el gel con proteína para realizar la electroforesis (resultado no mostrado), lo que indicó que esta cromatografía disminuyó los fragmentos de proteólisis asociados a la fracción de vicilina, pero no los eliminó totalmente. Estos resultados confirman la ocurrencia natural de proteólisis en las vicilinas generando péptidos de menor tamaño que se asocian no covalentemente a los oligómeros puros (2).
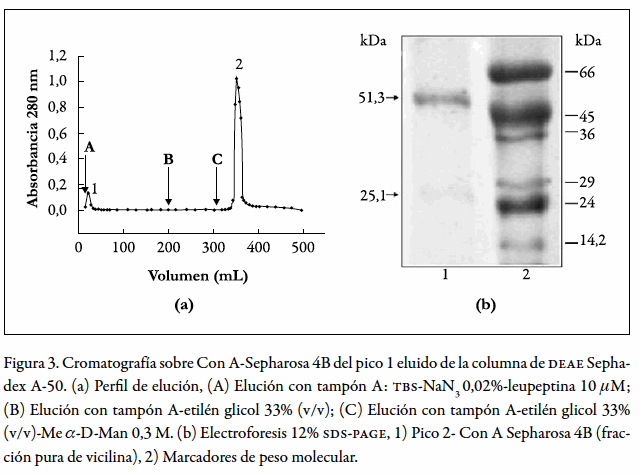
La vicilina de Canavalia ensiformis aislada en varios trabajos muestra, en todos los casos, un perfil electroforético complejo en el que predomina la banda alrededor de 50 kDa correspondiente a la vicilina y varias bandas de mayor o menor peso molecular (1, 15, 16, 17).
Con base en lo anterior, se puede concluir que la preparación de vicilina obtenida en este trabajo es de alta pureza, puesto que su perfil electroforético muestra predominantemente la banda de 51,3kDa que corresponde a la vicilina y constituye el 93% de la proteína total y adicionalmente, sólo una banda débil a 25,1 kDa correspondiente a los fragmentos de proteólisis, los cuales constituyen sólo el 7% de la proteína total (figura 3b, carril 1). A esta muestra se le denominó fracción pura de vicilina o vicilina pura.
Dado el alto grado de pureza de la preparación de vicilina obtenida en este trabajo, se quiso evaluar si en ella era posible detectar actividad de α-manosidasa, puesto que Smith et al. (16) y McPherson et al. (45) mencionan la presencia de una substancial actividad de α-manosidasa en la fracción de vicilina de Canavalia ensiformis.
Empleando 43µg de la fracción pura de vicilina y siguiendo el curso de la reacción enzimática durante 30min, no fue posible detectar actividad de α-manosidasa, por lo que se decidió aumentar la cantidad de proteína (258 µg) y el tiempo de reacción (60min), con el fin de poder detectar la actividad en caso de que sólo se tuviesen trazas de la enzima en la proteína aislada, o que su actividad fuese muy baja, pero aún bajo estas condiciones no se detectó actividad.
La imposibilidad de detectar actividad de α-manosidasa en la fracción pura de vicilina y la ausencia de las bandas características de la enzima a 64-68 y 44-49kDa (16, 17, 46, 47) en el control electroforético (figura 3b, carril 1), indicaron la ausencia de esta proteína, lo que corroboró la pureza de la fracción de vicilina de C. ensiformis obtenida en este trabajo, lo cual no se había logrado hasta el momento de acuerdo con lo reportado en la literatura (1, 15, 16, 17).
Detección decarbohidratos en la vicilina
La figura 4 muestra la detección de carbohidratos en la vicilina. La banda correspondiente a la vicilina reveló con dab (figura 4a, carril 1), al igual que la ovoalbúmina empleada como control positivo de glicosilación (figura 4a, carril 2) y las proteínas glicosiladas del marcador de pesos moleculares (BSA, ovoalbúmina y lisozima (48, 49, 50)) (figura 4a, carril 3, bandas a 71,4, 44,2 y 14,1 kDa, respectivamente). Los tratamientos de control (figuras 4b y 4c), mostraron que la oxidación y la transferencia fueron adecuados. En la membrana (b), en la que no se realizó la oxidación de proteínas, no se observaron las bandas correspondientes a la vicilina (figura 4b, carril 1) ni a la ovoalbúmina (figura 4b, carril 2); tampoco se apreció el revelado característico de glicoproteínas en las proteínas glicosiladas del marcador de pesos moleculares. En la membrana (c), se aprecia que tanto la vicilina (figura 4c, carril 1) como la ovoalbúmina (figura 4c, carril 2) transfirieron a la membrana de nitrocelulosa, al igual que las proteínas del marcador de pesos moleculares (figura 4c, carril 3). Además, la tinción con azul de coomassie del gel transferido no reveló la presencia de proteína residual en el gel (resultado no mostrado). Estos resultados indicaron que con la metodología utilizada no se presentaron falsos positivos.
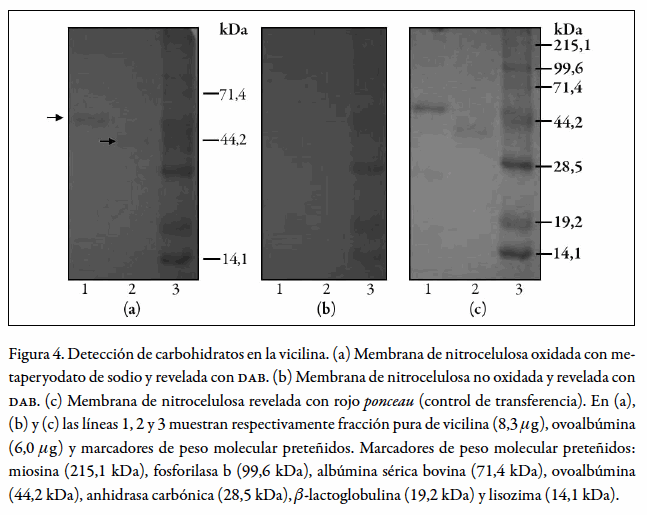
La presencia de carbohidratos en la fracción pura de vicilina se corroboró por el método de Dubois (36) estandarizado a escala micro por Almanza (37), encontrándose un contenido de carbohidratos del 4,03% (tabla 3), valor cercano al reportado para la fracción de vicilina de P. vulgaris y G. max (4,5-5,5% y 4,8-5%, respectivamente) (1).

Las vicilinas aisladas de leguminosas son proteínas frecuentemente glicosiladas (1, 2, 14). Sin embargo, la literatura no describe la presencia de carbohidratos en la vicilina de C. ensiformis, a excepción de Samour (17), quien hace referencia a un exiguo contenido de carbohidratos en dicha fracción. Por tanto, estos resultados demuestran por primera vez la presencia de glicósidos en la vicilina de Canavalia ensiformis.
Deglicosilación enzimática de la vicilina
La fracción pura de vicilina tratada con 1.200 miliunidades de PNGasa F mostró un aumento de la migración electroforética (figura 5, carril 1) con respecto a la muestra no tratada enzimáticamente (figura 4, carril 2), indicando esto que la proteína fue deglicosilada. Un resultado similar se obtuvo con la ovoalbúmina empleada como control de deglicosilación, la cual presentó una movilidad electroforética ligeramente mayor en el caso de la muestra tratada enzimáticamente (figura 5, carril 3), con respecto a la no tratada (figura 5, carril 4). Estos resultados se corroboraron transfiriendo las proteínas a membrana de nitrocelulosa, sobre la cual se determinó la presencia de carbohidratos. Las proteínas tratadas enzimáticamente no revelaron la presencia de carbohidratos (resultados no mostrados).
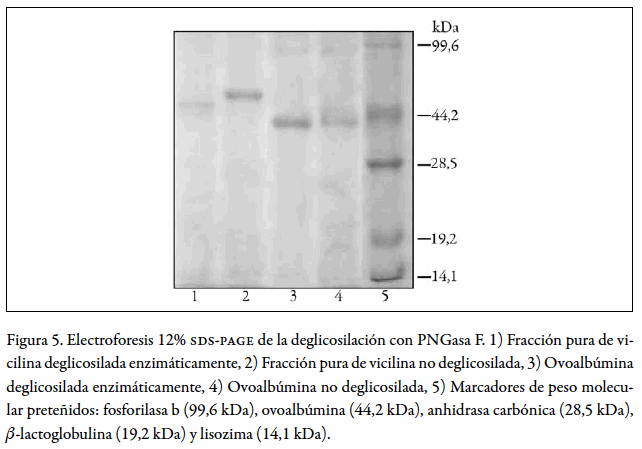
La deglicosilación de la fracción pura de vicilina con PNGasa mostró N-glicosilación de la proteína, lo cual corresponde al tipo de glicosilación normalmente presente en las vicilinas (3) y sugiere que la vicilina aislada en este trabajo corresponde a una de las isoformas a las que hace referencia Smith (16), la cual está glicosilada. Esto es consistente con el hecho de que el núcleo de oligosacáridos de las globulinas 7S puede ser modificado postranslacionalmente, durante el transporte intracelular de la proteína, bien sea por remoción o adición de residuos de azúcares, tal como sucede en la vicilina de Phaseolus vulgaris (Phaseolina), la cual presenta subunidades con diferentes patrones de glicosilación (3).
CONCLUSIONES
El proceso de purificación de la vicilina de la semilla de Canavalia ensiformis desarrollado en este trabajo, el cual consiste en la precipitación isoeléctrica de la vicilina a partir del extracto de proteínas de reserva de la semilla, seguido de cromatografías sucesivas en DEAE-Sephadex A-50 y Con A Sepharosa 4B, permitió obtener la proteína con un grado de pureza muy superior al descrito previamente en la literatura, conteniendo predominantemente vicilina correspondiente al 93% de la proteína total y adicionalmente sólo un 7% de fragmentos de proteólisis. La ausencia de actividad de α-manosidasa en esta fracción confirmó el grado de pureza de la preparación.
La presencia de carbohidratos en la vicilina fue puesta en evidencia por cromatografía de afinidad sobre Con A-Sepharosa y corroborada por los métodos de Dubois, oxidación de residuos glicosídicos de glicoproteínas seguido de la detección de los productos de oxidación y deglicosilación enzimática. Esto muestra, por primera vez, la presencia de glicósidos en la fracción de vicilina de Canavalia ensiformis.
AGRADECIMIENTOS
A la Universidad Nacional de Colombia, a la Facultad de Ciencias y al Departamento de Química, por facilitar el desarrollo de este trabajo.
Al Doctor Gerardo Pérez, del Departamento de Química de la Universidad Nacional de Colombia, por permitir la realización del trabajo experimental en su laboratorio, facilitando equipos, instalaciones y reactivos para el desarrollo del trabajo.
Al Doctor Leopold Ilag, del Laboratorio Arrhenius, del Departamento de Química Analítica, de la Universidad de Estocolmo, por el análisis de las muestras por MALDI-TOF-PMF.
Al Doctor Mario Amzel, del Departamento de Biofísica y Biofísica Química de la Universidad de Johns Hopkins, por sus valiosas sugerencias y comentarios críticos.
A los Doctores Carmen María Romero y Luis Blanco del Departamento de Química de la Universidad Nacional de Colombia, por su valiosa orientación y sugerencias.
A la Doctora Luz Mary Salazar del Departamento de Química de la Universidad Nacional de Colombia, por su apoyo incondicional y valiosas sugerencias.
BIBLIOGRAFÍA
1. E. Derbyshire, D.J. Wright, D. Boulter, Legumin and vicilin, storage proteins of legume seeds, Phytochem., 15, 3 (1976). [ Links ]
2. N.C. Nielsen, R. Bassaner, T. Beaman, en "The biochemistry and cell biology of embryo storage proteins", editado por B.A. Larkins, I.K. Vasil, Kluwer Academic Publishers, Dordrecht, The Netherlands, 1996, p. 151. [ Links ]
3. M.A. Shotwell, B.A. Larkins, en "The biochemistry of plants", editado por A. Marcus, Academic Press Inc., New York, 1989, vol. 15, pp. 298-345. [ Links ]
4. R.L. Freitas, A.R. Teixeira, R.B. Ferreira, Vicilin-type globulins follow distinct patterns of degradation indifferent species of germinating legume seeds, Food Chem., 102, 323 (2007). [ Links ]
5. S.F.F Ribeiro, A.P. Agizzio, O.L.T. Machado, A.G.C. Neves-Ferreira, M.A. Oliveira, K.V.S. Fernandes, A.O. Carvalho, J. Perales, V.M. Gomes, A new peptide of melon seeds wich shows sequence homology with vicilina: Partial characterization and antifungal activity, Scientia Horticulturae, 111, 339 (2007). [ Links ]
6. M.P. Sales, L.B.S. Andrade, M.B. Ary, M.R.A. Miranda, F.M. Teixeira, A.S. Oliveira, K.V.S. Fernandes, J. Xavier-Filho, Perfomance of bean bruchids Callosobruchus maculates and Zabrotes subfasciatus (Coleoptera: Bruchidae) reared on resistant (IT81D-1045) and susceptible (Epace 10) Vigna unguiculata seeds: Relationship with trypsin inhibitor and vicilina excretion, Comparative Biochemistry and Physiology, Part A, 142, 422 (2005). [ Links ]
7. A. Barre, C. Sordet, R. Culerrier, F. Rancé, A. Didier, P. Rougé, Vicilin allergens of peanut and tree nuts (walnut, hazelnut and cashew nut) share structurally related IgE-binding epitopes, Molecular immunology, 45, 1231 (2008). [ Links ]
8. M. Wensing, A.C. Knulst, S. Piersma, F. O'Kane, E.F. Knol, S.J. Koppelman, Patients with anaphylaxis to pea can have peanut allergy caused by cross-reactive IgE to vicilina (Ara h1), J. Allergy Clin. Immunol., 111, 420 (2003). [ Links ]
9. E. Fasoli, E.A. Pastorello, L. Farroli, J. Scibilia, G. Aldini, M. Carini, A. Maroco, E. Boschetti, P.G. Righetti, Searching for allergens in maize kernels via proteomic tools, J. Proteomics., 72, 501 (2009). [ Links ]
10. C.-H. Tang, X. Sun, S.-W. Yin, Physicochemical, functional and structural properties of vicilina-rich protein isolates from three Phaseolus legumes: Effect of heat treatment, Foods Hydrocolloids, 23, 1771 (2009). [ Links ]
11. C.-H. Tang, L. Cheng, C.-Y. Ma, Thermal aggregation, amino acid composition and in vitro digestibility of vicilina-rich protein isolates from three Phaseolus legumes: A comparative study, Food Chem., 113, 957 (2009). [ Links ]
12. C.-H. Tang, C.-Y. Ma, Heat-Induced modifications in the functional and structural properties of vicilina-rich protein isolate from kidney (Phaseolus vulgaris L.) bean, Food Chem., 115, 85 (2009). [ Links ]
13. R. Casey, C. Domoney, N. Ellis, Legume storage proteins and their genes, Oxf. Surv. Plant Mol. Cell. Biol., 3, 1 (1986). [ Links ]
14. T.-P. Ko, J.D. Ng, A. McPherson, Three-dimensional structure of canavalin from Jack bean (Canavalia ensiformis), Plant. Physiol., 101, 729 (1993). [ Links ]
15. W. Einhoff, G. Fleischman, T. Freier, H. Kummer, H. Rudiger, Interactions between lectins and other components of leguminous protein bodies, Biol. Chem. Hoppe-Seyler, 367, 15 (1986). [ Links ]
16. S.C. Smith, S. Johnson, J. Andrews, A. McPherson, Biochemical characterization of canavalin, the major storage protein of Jack bean, Plant Physiol., 70, 1199 (1982). [ Links ]
17. R.H. Sammour, J.A. Gatehouse, J. Gilroy, D. Boulter, The homology of the major storage protein of jack bean (Canavalia ensiformis) to pea vicilin and its separation from α-D-mannosidase, Planta, 161, 61 (1984). [ Links ]
18. M.E. Green, N. Kirkland, J.D. Ng, Effect of a mutation at arginine 301 on the stability, crystal quality and the preliminary crystallographic analysis of recombinant canavalin from Canavalia ensiformis, J. Cryst. Growth, 232, 387 (2001). [ Links ]
19. J.B. Summer, S.F. Howell, The isolation of a fourth cristallizable jack bean globulin trough the digestion of Canavalin with trypsin, J. Biol. Chem., 113, 607 (1936). [ Links ]
20. J.D. Ng, T. Stinchcombe, T.P. Ko, E. Alexander, A. McPherson, pcr cloning of the full length cdna for the seed canavalin from the jack bean plant, Canavalia ensiformis, Plant. Mol. Biol., 3, 147 (1992). [ Links ]
21. M. Wenzel, H. Rudiger, Interactions of pea (Pisum sativum L.) lectin with pea storage proteins, J. Plant Physiol., 145, 191 (1995). [ Links ]
22. R. Bollini, M.J. Chrispeels, Characterization and subcelular localization of vicilina and phytohemagglutinin, the two major reserve proteins of Phaseolus vulgaris L., Planta, 142, 291 (1978). [ Links ]
23. M. Wenzel, H. Gers-Barlag, A. Schimpl, H. Rudiger, Time course of lectin and storage protein biosynthesis in developing pea (Pisum sativum) seeds, Biol. Chem. Hoppe-Seyler, 374, 887 (1993). [ Links ]
24. T.W. Hamelryck, J. Bouckaert, D.-T. Minh-Hoa, G. Strecker, A. Imberty, E. Fernández, L. Wyns, M.E. Etzler, Carbohydrate binding, quaternary structure and a novel hydrophobic binding site in two legume lectin oligomers from Dolichus biflorus, J. Mol. Biol., 286, 1161 (1999). [ Links ]
25. S. Morita, M. Fukase, M. Yamaguchi, Y. Fukuda, Y. Morita, Purification, characterization and crystallization of single molecular species of β -conglicinin from soybean seeds, Biosci. Biotech. Biochem., 60, 866 (1996). [ Links ]
26. T. Zor, Z. Selinger, Linearization of the Bradford Protein Assay increases its Sensitivity: Theorethical and experimental studies, Anal. Biochem., 236, 302 (1996). [ Links ]
27. U.K. Laemmli, Cleavage of structural proteins during the assembly of the head of bacteriophage T4, Nature, 227, 680 (1970). [ Links ]
28. C. Sutton, en "Protein purification methods: A practical approach", editado por E.I.V. Harris, S. Angal, Oxford University Press, New York, 1995, pp. 284-286. [ Links ]
29. Y. de Navarro, G. Pérez, Detección y caracterización preliminar de lectinas presentes en semillas de leguminosas, Rev. Colomb. Quím., 8, 25 (1978). [ Links ]
30. R. Rial-Otero, R.J. Carreira, F.M. Cordeiro, A.J. Moro, H.M. Santos, G.Vale, I. Moura, J.L. Capelo, Ultrasonic assisted protein enzymatic digestion for fast protein identification by matrix-assisted laser desorption/ionization time of flight mass spectrometry sonoreactor versus ultrasonic probe, J. Chromatogr. A., 1166, 101 (2007). [ Links ]
31. D. Backstrôm, M. Moberg, J.R. Sjôberg, J. Bergquist, R. Danielsson, Multivariate comparison between peptide mass fingerprints obtained by liquid chromatography-electrospray ionization-mass spectrometry with different trypsin digestion procedures, J. Chromatogr. A, 1171, 69 (2007). [ Links ]
32. Y.T. Li, S.C. Li, α-mannosidase, β-N-Acetyl hexosaminidase and β-Galactosidase from jack bean meal, Meth. Enzymol., 28, 702 (1972). [ Links ]
33. K. Ito, T. Ishimaru, F. Kimura, N. Matsudomi, Importance of N-glycosylation positioning for secretion and folding of ovoalbumin, Biochem. Biophys. Res. Commun., 361, 725 (2007). [ Links ]
34. P. Hossenlopp, M. Binoux, Use of peptide ligands for the detection of binding proteins by western blotting, en "Protein blotting", editado por B.S. Dunbar, Oxford University Press, New York, 1996, pp. 169, 171-175. [ Links ]
35. G.T. Hermanson, "Bioconjugate techniques", Academic Press, San Diego, 1996, pp. 114-117, 390-392. [ Links ]
36. M. Dubois, K.A. Gilles, J.K. Hamilton, F. Smith, Colorimetric method for determination of sugars and related substances, Anal. Chem., 28, 350 (1956). [ Links ]
37. M. Almanza, "Purificación y caracterización parcial de la lectina presente en las semillas de Galactia lindenii", tesis de grado, Universidad Nacional de Colombia, 1999, p. 72. [ Links ]
38. A.L. Tarentino, C.M. Gómez, T.H. Plummer, Jr., Deglycosylation of asparaginelinked glycans by Peptide: N-Glycosidase F, Biochemistry, 24, 4665 (1985). [ Links ]
39. J.C. Pernollet, J. Mossé, Structure and location of legume and cereal seed storage proteins, en "Seed proteins", editado por J. Daussant, J. Mossé, J. Vaughan, Academic Press Inc., New York, 1983, pp. 155-191. [ Links ]
40. D. J. Bowles, D. J. Pappin, Traffic and assembly of Concanavalin A, tibs, 13, 60 (1988). [ Links ]
41. D.J. Bowles, S.E. Marcus, D.J.C. Pappin, E. Eliopoulus, P.R. Maycox, J. Burges, Post-Translational processing of Concanavalin A precursors in jack bean cotyledons, J. Cell Biol., 102, 1284 (1986). [ Links ]
42. P.S. Sheldon, J.N. Keen, D.J. Bowles, Purification and characterization of N-Glycanase, a Concanavalin A binding protein from jack bean (Canavalia ensiformis), Biochem. J., 330, 13 (1998). [ Links ]
43. S.E. Marcus, J. Burgess, P.R. Maycox, D.J. Bowles, A study of maduration events in jack beans (Canavalia ensiformis), Biochem. J., 222, 265 (1984). [ Links ]
44. S.E. Marcus, P.R. Maycox, D.J. Bowles, Con A-Binding polypeptides in jack bean cotyledons, Phytochem., 28, 333 (1989). [ Links ]
45. A. McPherson, S.C. Smith, Identification of canavalin as a proteolytically modified form of jack bean α-mannosidase, Phytochem., 19, 957 (1980). [ Links ]
46. D.J. Bowles, J. Andralojc, S. Marcus, Identification of an endogenous Con A binding polypeptide as the heavy subunit of α-Mannosidase, Febs Letters, 140, 234 (1982). [ Links ]
47. D.J. Bowles, M.F. Chaplin, S.E. Marcus, Interaction of Concanvalin A with native and denatured forms of jack bean α-D-Mannosidase, Eur. J. Biochem., 130, 613 (1983). [ Links ]
48. T. Irimura, H. Kawashima, Detection and characterization of glycoprotein carbohydrate chains after electrophoretic separation, en "Protein blotting: A practical approach", editado por B.S. Dunbar, Oxford University Press, New York, 1994, pp. 157-159. [ Links ]
49. P. Jackson, Fluorophore-labelled saccharide electrophoresis for the analysis of glycoproteins, en "Gel electrophoresis of proteins: A practical approach", editado por B.D. Hames, Oxford University Press, New York, 1998, pp. 269-292. [ Links ]
50. J. Trudel, A. Asselin, Detection of a glycosylated form of hen egg white lysozyme, Biochem. Cell. Biol., 73, 307 (1995). [ Links ]














