Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Colombiana de Entomología
versión impresa ISSN 0120-0488versión On-line ISSN 2665-4385
Rev. Colomb. Entomol. v.37 n.2 Bogotá jul./dic. 2011
Sección Agrícola
ARN interferente: Potenciales usos en genómica funcional y control genético de Hypothenemus hampei (Coleoptera: Scolytinae)
RNA interference: potential uses on functional genomics and genetic control of Hypothenemus hampei (Coleoptera: Scolytinae)
CAROLINA AGUILERA G.1, BEATRIZ E. PADILLA H.2, CLAUDIA P. FLÓREZ R.3, JOSÉ D. RUBIO G.4 y JOSÉ R. ACUÑA Z.5
1 Candidata M.Sc. Universidad Nacional de Colombia, sede Medellín. CENICAFE. Disciplina de Mejoramiento Genético. Planalto, Km 4 vía antigua Chinchiná-Manizales. Caldas, Colombia. carolina.aguilera@cafedecolombia.com.
2 Bacterióloga. CENICAFE. Disciplina de Mejoramiento Genético. Planalto, Km 4 vía antigua Chinchiná-Manizales. Caldas, Colombia. beatrizelena.padilla@cafedecolombia.com.
3 Ph.D. CENICAFE. Disciplina de Mejoramiento Genético. Planalto, Km 4 vía antigua Chinchiná-Manizales. Caldas, Colombia claudia.florez@cafedecolombia.com.
4 M.Sc. Entomología. CENICAFE. Disciplina de Mejoramiento Genético. Planalto, Km 4 vía antigua Chinchiná-Manizales. Caldas, Colombia. josed.rubio@cafedecolombia.com.
5 Ph.D. CENICAFE. Disciplina de Mejoramiento Genético. Planalto, Km 4 vía antigua Chinchiná-Manizales. Caldas, Colombia. Ricardo.Acuna@cafedecolombia.com. Autor para correspondencia.
Recibido: 11-nov-2010 - Aceptado: 22-sep-2011
Resumen: Los organismos eucarióticos, incluidos los insectos, poseen un mecanismo para el silenciamiento de genes específicos mediante pequeñas secuencias de ARN de doble cadena (ARNdc), proceso conocido como ARN de interferencia (ARNi). El objetivo de esta investigación fue implementar esta herramienta para evaluar genes candidatos que puedan usarse como estrategia genética de control de la broca del café. Se utilizó una metodología de ingesta de gotas con diferentes ARNdc y diferentes concentraciones depositadas en la cavidad preoral de larvas de primer instar de la broca. Luego, las larvas se criaron en una dieta artificial suplementada con los respectivos ARNdc. Previamente, se comprobó la efectividad de la ingesta por vía oral mediante dos estrategias de control: a) ingesta de un compuesto fluorescente (Calcofluor®) en el tracto digestivo del insecto y b) ingesta de una mezcla comercial de inhibidores de proteasas. Los genes seleccionados para el silenciamiento fueron los que codifican en la broca las proteínas mananasa, xilanasa, citocromo P450 mono-oxigenasa (2 genes), ATPasa D, α-tubulina y actina. Se encontró que los ARNdc de los citocromos P450 produjeron el mayor efecto causando una mortalidad de las larvas de un 64% y 52% respectivamente, seguido de los ARNdc de los genes mananasa y xilanasa, con un porcentaje de mortalidad de 37% y 33%, respectivamente, para la máxima concentración evaluada.
Palabras clave: ARNi. Mananasa. Xilanasa. Citrocromos P450.
Abstract: Eukaryotic organisms, including insects, have a mechanism for specific gene silencing by short sequences of double-stranded RNA (dsRNA), such a process is known as RNA interference (RNAi). The objective of this research was to follow up this technique to screen candidate genes for the genetic control of the coffee berry borer Hypothenemus hampei. A methodology of feeding by oral drops containing different dsRNAs and dsRNAs´ dosages that were placed in the preoral cavity of first instar larvae was used. Then, the larvae were reared on an artificial diet supplemented with the respective dsRNA. Previously, we verified the effectiveness of the dsRNA feeding using two control strategies: a) intake of a fluorescent compound (CalcofluorTM) and b) intake of a commercial mixture of protease inhibitors. The genes coding for mannanase, xylanase, cytochrome P450 mono-oxygenase (two genes), ATPase D, α-tubulin and actin, expressed in the coffee berry borer, were selected for silencing. We found that dsRNA of cytochromes P450 produced the greatest effect, causing larval mortality of 64% and 52% respectively, followed by dsRNA of mannanase and xylanase, with a mortality rate of 37% and 33%, respectively, for the highest concentration tested.
Key words: RNAi. Mannanase. Xylanase. Cytochromes P450.
Introducción
El café (Coffea arabica L.) es el producto agrícola más importante en Colombia. Más de 500.000 familias lo cultivan en alrededor de 869.000 hectáreas y sus ingresos provienen de la venta de la semilla (Chaves y Riley 2001). Los aspectos sanitarios del cultivo son una de las principales preocupaciones de los caficultores para garantizar una buena productividad, una excelente calidad y asegurar sus ingresos.
La Broca del café Hypothenemus hampei Ferrari, 1867 (Coleoptera, Scolytidae) es el insecto más perjudicial para las plantaciones de café a nivel mundial. Es un insecto que apareció en Colombia en el año de 1988 y desde entonces su control ha sido un difícil reto debido a su hábito de permanecer oculto dentro de los frutos de café, en donde logra alimentarse y reproducirse causando daños en cuanto al peso de la semilla, la disminución de la calidad del café y finalmente la pérdida total del fruto (Baker 1999). Adicionalmente Colombia presenta condiciones favorables para la permanencia de la broca debido a la distribución variable de las floraciones y sus cosechas a lo largo del año, así como de la continuidad de la caficultura a lo largo de las tres cordilleras Central, Occidental y Oriental con altitudes comprendidas entre 1100 a 2000 m (Camayo y Arcila 1997).
No es recomendable el uso de insecticidas como medida de control de H. hampei por su impacto ambiental en el ecosistema cafetero (Bustillo 2008). Además el uso de insecticidas solo resulta eficiente cuando la broca está penetrando en el fruto y el producto está en contacto con el insecto, ya que una vez en el interior de la almendra, ningún insecticida ofrece control satisfactorio (Villalba et al. 1995). Por estas razones y debido al gran impacto de este insecto sobre la caficultura colombiana, es necesario disponer de alternativas para el control de esta plaga y evitar daños para el ecosistema causados por el uso indiscriminado de la productos químicos (Cadena 1991). En el Centro Nacional de Investigaciones de Café (CENICAFE), se ha implementado un manejo integrado de la broca (MIB), que incluye prácticas amigables con los agroecosistemas cafeteros tales como el control cultural, el control biológico y el seguimiento de las poblaciones a través de muestreos para ayudar en la toma de decisiones de control acertadas (Bustillo et al. 1998).
La broca es un insecto que se alimenta exclusivamente de la semilla madura del café, la cual está compuesta principalmente por carbohidratos (48-60%), proteínas (10%), lípidos (12%), ácidos orgánicos y cafeína (1%) (Wolfrom et al. 1965; Clifford 1985). Los carbohidratos están en forma de galactomananos (25%), arabinogalactanos (17%) y celulosa (7%), (Fischer et al. 2001). En el genoma de la broca se identificó el gen de una endo-mananasa que se expresa en el intestino del insecto y permite la hidrólisis del galactomanano en moléculas simples de manosa. También se identificó el gen de una xilanasa encargada de la hidrólisis de compuestos estructurales de la pared celular. De igual forma se han identificado las secuencias de tres genes correspondientes a la familia de las citocromo P450 mono-oxigenasas involucradas en el metabolismo de compuestos xenobióticos presentes en el grano de café. Con base en estos resultados, es de interés conocer el efecto del silenciamiento de estos genes sobre el ciclo de vida de la broca, con el fin de identificar blancos moleculares que puedan ser utilizados en un futuro control genético de esta plaga del café.
La técnica de ARN de interferencia (ARNi) descrita por Fire et al. (1998) se ha convertido en una estrategia importante en los estudios de genómica funcional en insectos porque permite el silenciamiento post-transcripcional de genes en respuesta a la introducción de ARN de doble cadena (ARNdc) (Vanhecke y Janitz 2005). Esta herramienta, además de representar un alternativa tecnológica para estos estudios, también contribuye al desarrollo de estrategias altamente selectivas para el control de insectos (Zhou et al. 2008). Para ello, el insecto debe ser capaz de introducir autónomamente las moléculas de ARNdc por medio de alguno de estos mecanismos: i) a través de los ortólogos de la proteína transmembrana SID-I previamente caracterizada en Caenorhabditis elegans Maupas, 1900 (Rhabditida, Rhabditidae), de la cual se sabe que interviene en el proceso de captura de ARNdc; ii) Por medio de una vía en donde la ATPasa H+ vacuolar desempeña un papel importante (Huvenne y Smagghe 2010). Baum et al. (2007), evidenciaron el potencial uso de ARNi para el control de insectos en la protección de cultivos y reportaron la reducción en el daño causado por el gusano de la raíz del maíz Diabrotica virgifera virgifera LeConte, 1868 (Coleoptera, Chrysomelidae) sobre plantas de maíz modificadas genéticamente con ARNdc del gen ATPasa H+. Otros estudios que incluyen el suministro de ARNdc vía ingestión oral, indican que existe un amplia gama de organismos blanco de diferentes ordenes de insectos, varios genes candidatos y métodos de alimentación que demuestran la gran aplicación de ARNdc y el potencial de la técnica ARNi (Bautista et al. 2009).
En esta investigación se propone implementar una metodología de ingestión por vía oral de ARNdc que permita la evaluación de genes candidatos que puedan utilizarse como estrategia genética de control de la broca del café.
Materiales y Métodos
El trabajo se realizó en los laboratorios del Centro Nacional de Investigaciones de Café (CENICAFE) de la Federación Nacional de Cafeteros de Colombia, en la Sede de la vereda Planalto, Municipio de Chinchiná, Departamento de Caldas.
Material entomológico. La unidad de cría de parasitoides Biocafé suministró granos de café pergamino infestados con H.hampei. Estos granos de café se mantuvieron con una humedad del 45%, en condiciones de oscuridad, a temperatura promedio de 27°C y humedad relativa del 65-75%. Huevos de la broca extraídos de estos granos se colocaron en una dieta artificial descrita por Portilla (1999). Esta dieta se mantuvo en cajas multipozos donde los individuos inoculados completaron su ciclo hasta llegar a pupa. Este último estadio corresponde al estadio final de evaluación.
Comprobación de la ingesta de un compuesto fluorescente. Se tomaron 10 larvas en segundo instar (L2) y a cada una de ellas se le aplicó en la cavidad preoral una gota de 5 μl de una solución de Calcofluor® al 0,5 %. Este fluorocromo se utilizó como control positivo y produjo una tinción fluorescente en el tracto digestivo del insecto al unirse a compuestos de celulosa y quitina presentes en la dieta. La comprobación de la ingesta se realizó mediante la disección de los tractos digestivos y la observación al estereomicroscopio de fluorescencia. Como control negativo se realizó el mismo procedimiento utilizando una gota de agua destilada sin el compuesto fluorescente.
Ingesta de una mezcla inhibidores de proteasas. La validación funcional del método de ingestión se realizó utilizando una mezcla de inhibidores de proteasas de amplio espectro (CompletetTM, Hoffmann-La Roche) incluidos en la dieta artificial y evaluados en tres concentraciones (0,13 mg/ ml, 0,26 mg/ml y 0,53 mg/ ml). La dieta se sirvió en cajas multipozos (2 ml de dieta/pozo) y se colocaron 20 huevos por cada pozo. Cada pozo se sirvió por duplicado y tres días después de la inoculación, cuando los huevos eclosionaron, se aplicó en la cavidad preoral de cada larva L1 una gota de 5 μl de solución con los inhibidores de proteasas en las tres concentraciones. Como control se implementó el mismo procedimiento sin adicionar inhibidores de proteasas disueltos. Las larvas llegaron al estadío pupa 12 días después de iniciar el ensayo, momento en el que se evaluó la dieta de forma destructiva. Para esta evaluación se vació el contenido de dieta de cada pozo, se hizo un conteo de los individuos sobrevivientes al tratamiento y un registro de los estadíos que habían alcanzado.
Síntesis de ARN doble cadena. La síntesis de los ARNdc se realizó siguiendo las recomendaciones del sistema T7 RiboMAXTM Express RNAi System (Promega, MA, USA). Se diseñaron 28 oligonucleótidos iniciadores para los genes en estudio, cuatro por cada gen, dos de los cuales contienen en sus extremos 5´ una secuencia del promotor T7 para la unión de la enzima T7 ARN polimerasa que cataliza la síntesis de los ARN de doble cadena (Tabla 1). Las secuencias utilizadas para el diseño de los oligos se obtuvieron de los ADN complementarios (ADNc) de una librería de expresión construida previamente a partir del ARN mensajero (ARNm) de tractos digestivos de larvas en segundo instar de la broca. Se seleccionaron las secuencias de genes involucrados la digestión de los principales carbohidratos del grano de café (mananasa, xilanasa y Citocromos-P450) y en funciones constitutivas del metabolismo del insecto (actina, α-tubulina y ATPasa D). Para el diseño de los iniciadores se empleó el programa Primer 3® (v. 0.4.0). Los fragmentos esperados para cada uno de los genes fueron: mananasa (304 pb), xilanasa (302 pb), ATPasa D (308 pb), α-tubulina (300 pb), actina (300 pb) y dos citocromos-P450 (301 pb y 309 pb, respectivamente). Inicialmente se realizó una amplificación a partir de ADN genómico de larvas L2, extraído con el sistema DNAeasy (Qiagen, MD;USA). Para la amplificación de los fragmentos se emplearon dos combinaciones de oligos iniciadores, la primera con el iniciador en sentido específico de cada gen y un iniciador antisentido conteniendo la cola del promotor T7. La segunda combinación con el oligo-iniciador conteniendo la cola del promotor T7 y el oligo antisentido específico de cada gen. Posteriormente se sintetizaron los ARNdc con la enzima T7 ARN polimerasa, contenida en el Kit, se removió la cadena de ADN y las cadenas sencillas de ARN y finalmente se purificaron los ARNdc de acuerdo con las especificaciones del manual. La integridad y concentración del ARNdc se evaluó mediante electroforesis en geles de agarosa.
Bioensayos con ARN doble cadena en larvas de la broca. Esta evaluación se realizó con base en la metodología establecida para la ingesta de los inhibidores de proteasas. Se preparó la dieta adicionando en cada pozo 30μg y 60μg de ARNdc respectivamente, para el silenciamiento de los genes de mananasa, xilanasa, citocromos P450 y ATPasa D, 60μg para el silenciamiento del gen actina y 5,5μg para el silenciamiento del gen α- tubulina. Debido a que no fue posible sintetizar grandes cantidades de ARNdc para este último gen, se evaluó en menor cantidad con respecto a los ARNdc de los otros genes. La dieta se sirvió en cajas multipozos (2ml de dieta/pozo). Se inoculó cada pozo con 20 huevos previamente extraídos de los granos de café. Cada evaluación se realizó por duplicado y transcurridos tres días después de la inoculación, cuando los huevos eclosionaron y llegaron a larvas L1, se aplicó en la cavidad preoral de cada larva una gota de agua destilada suplementada con cada uno de los ARNdc sintetizados. Como control del ensayo se utilizó el mismo procedimiento pero a las gotas no se les adicionó ARNdc. Las larvas continuaron con su alimentación hasta convertirse en pupas, aproximadamente 12 días después de iniciar el ensayo. En este tiempo se evalúo la dieta de forma destructiva. Para esta evaluación se vació el contenido de dieta de cada pozo, se hizo un conteo de los individuos sobrevivientes al tratamiento y un registro de los estadíos que habían alcanzado.
Análisis estadístico. Para establecer las diferencias entre tratamientos que incluyen ARNdc se realizó un análisis de varianza al 95% de confiabilidad. Para determinar el tratamiento de mayor efectividad con respecto al porcentaje de mortalidad del insecto se utilizó la prueba de comparación de medias de Duncan (5%). Estos procedimientos estadísticos se realizaron mediante el programa estadístico SAS® versión 9.0 System Analysis Software. (SAS Institute Inc., Cary, NC, USA.)
Resultados y Discusión
Implementación del método de ingestión. Los experimentos de control de la ingesta por vía oral utilizando compuestos marcadores (fluorescentes e inhibidores de proteasas) permitieron concluir que las gotas depositadas en la cavidad preoral de las larvas de la broca son ingeridas y pasan a lo largo de su tracto digestivo con lo que se valida este procedimiento para la evaluación de moléculas de ARNdc. El compuesto fluorescente Calcofluor se evidenció en los tractos digestivos de las larvas sometidas al tratamiento cuando fueron observadas al microscopio de fluorescencia. El compuesto se dispersó a lo largo de todo el tracto digestivo de las larvas (Figs. 1 A-C). Si bien en el tejido control se observa una fluorescencia basal, es evidente la diferencia en intensidad respecto al tejido con el tratamiento. Algunos compuestos en el tracto digestivo del insecto pueden ser excitados con la luz y emitir algún tipo de fluorescencia natural. La mezcla de inhibidores de proteasas (Complete- TM) resultó ser efectiva para alterar el normal desarrollo y crecimiento de las larvas de la broca. Esta mezcla ya había sido evaluada en varias especies de insectos manifestándose en porcentajes de mortalidad significativamente altos (Chen 2008). Al evaluar las tres concentraciones de la mezcla de inhibidores de proteasa (0,13mg/ml, 0,26 mg/ml y 0,53 mg/ ml), se encontró un 85% de mortalidad en la mayor dosis aplicada (0,53 mg/ml), el 15% sobreviviente no llegó a estado L2 en el momento de la evaluación. (Fig. 2). Los porcentajes de mortalidad se corrigieron respecto al control negativo del experimento. A medida que se aumentaba la concentración de la mezcla de inhibidores de proteasas, disminuía el porcentaje de larvas L1 que pasaron a L2 y se incrementaba el porcentaje de mortalidad (Fig. 2).
Efecto del silenciamiento genético. Los productos de la síntesis de cada ARNdc se verificaron por electroforesis en geles de agarosa. Los fragmentos tenían el tamaño esperado entre 300 pb y 350 pb para cada ARNdc (Fig. 3).
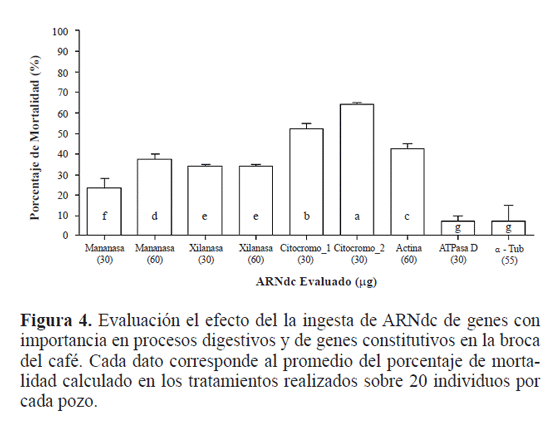
Los bioensayos con dietas conteniendo los ARNdc produjeron mortalidades que van desde el 10% hasta el 60%. El análisis de varianza de los datos de la mortalidad corregida con el control en cada uno de los tratamientos y por cada gen mostró diferencias entre las concentraciones y entre cada ARNdc sin embargo no existen diferencias entre las dos concentraciones con el ARNdc xilanasa, y entre el tratamiento con los ARNdc de actina y ATP-asa D (F=448,14; df=27; P<0,0001). Los ARNdc de los genes de citocromo P450 fueron los mejores tratamientos, ya que produjeron porcentajes de mortalidad de 64% y 52%, seguido a estos se encuentran los ARNdc de mananasa y xilanasa con un porcentaje de mortalidad de 37% y 33% respectivamente, para la máxima concentración (60 μg). (Fig. 4).
La teoría de la defensa química propone que la alta concentración de cafeína en las hojas jóvenes, frutos y botones florales del café actúa como defensa para proteger a los tejidos blandos de los agentes patógenos y herbívoros (Ashihara et al. 2008). Se ha demostrado que la fumigación de hojas de tomate con una solución al 1% de cafeína, disuade a la alimentación de gusanos picudos del tabaco, mientras que el tratamiento de las hojas de repollo y de orquídeas con soluciones de 0,01-0,1% de la cafeína actúa como un neurotóxico y mata o repele las babosas y los caracoles. Pruebas convincentes de la teoría de la defensa química han sido recientemente obtenidas con plantas transgénicas de tabaco productoras de cafeína (Uefuji et al. 2005). El papel de la cafeína como una defensa química para el café contra la broca H. hampei también ha sido investigado aunque no se observó relación entre la resistencia y el contenido de cafeína en experimentos en los que las semillas de varias especies de café con diferentes niveles de cafeína fueron expuestos a insectos adultos. Se sugirió que la broca ha desarrollado una adaptación para manejar los efectos tóxicos de la cafeína (Guerreiro et al. 2003). Es probable que un organismo como la broca, que es capaz de crecer específicamente en las semillas del café, pueda metabolizar compuestos xenobióticos presentes en la semilla, como la cafeína (1,5% p/v), entre otros (Gokulakrishnan et al. 2005).
Nuestros resultados demuestran que el mecanismo de ARN de interferencia sobre los genes de citocromo P450 oxigenasas, cuya expresión es específica del tracto digestivo de la broca del café, tuvo un efecto significativo sobre la mortalidad (64% y 52%) y sobre el crecimiento de las larvas, en las cuales se evidenció un retraso (datos no mostrados). Considerando que la dieta artificial con la que se alimentaron las larvas de la broca está hecha principalmente con semillas molidas de café, es probable que la absorción de los ARNdc correspondientes a los genes que codifican estas enzimas hayan interferido con su síntesis alterando significativamente el metabolismo de compuestos xenobióticos de la dieta. En consecuencia, las larvas no pueden metabolizar estos compuestos, retrasan su crecimiento, se intoxican y algunas mueren.
El efecto del silenciamiento de los genes mananasa y xilanasa fue menor, comparado con los citocromo P450 y la actina, pero significativo. Es posible que dosis mayores de ARNdc de estos genes tenga efectos mayores sobre la mortalidad de las larvas. El galactomanano es el principal polisacárido de la semilla del café por lo que su descomposición en azúcares simples sería un factor nutricional determinante en la dieta de las larvas. El análisis del transcriptoma del aparato digestivo de la broca ha demostrado una significativa expresión genética de genes que codifican enzimas glicohidrolíticas, entre las que se identificaron amilasas, galactosidasas, mananasas y xilananas (datos no publicados). Por tal motivo, es de esperarse que el silenciamiento del gen mananasa provoque un efecto antinutricional significativo debido a la incapacidad de las larvas de metabolizar estos polisacáridos.
Aunque todavía no se ha determinado con precisión el papel de las xilanasas en la digestión del grano de café, el silenciamiento de este gen produjo porcentajes de mortalidad significativos lo que implicaría un rol funcional de la xilanasa similar al de la mananasa. El xilano o los carbohidratos con residuos de xilosa, que serían los potenciales substratos de la enzima, no se han identificado plenamente en la semilla del café, aunque se conoce que la hidrólisis ácida de los carbohidratos de la semilla produce concentraciones bajas de xilosa (Redgwell et al. 2006). La posibilidad de utilizar inhibidores enzimáticos proteicos de alguna de estas glico-hidrolasas o la producción de plantas transgénicas expresando los ARNdc de estos genes se unen como alternativa para el control genético de la broca del café. En el caso de las xilanasas se han identificado inhibidores de la enzima en semillas de trigo y otros cereales. Bioensayos con dietas artificiales usando un inhibidor de xilanasa, XIP-I produjeron el 60% de mortalidad de larvas L2 de la broca (datos no publicados).
La estrategia de suministro por vía oral de ARNdc ha sido ampliamente usada en estudios de silenciamiento génico, en su mayoría con el fin de crear nuevas tecnologías para el control de plagas. Baum et al. (2007) observaron mortalidades significativas y reducción en la masa corporal larval en individuos de D. virgifera virgifera, alimentados en dietas artificiales con moléculas silenciadoras de los genes V-ATPasa subunidad A, D y E. Usando técnicas moleculares cuantitativas demostraron que el efecto de mortalidad puede atribuirse a la disminución en la expresión de los genes blanco, es decir, a su silenciamiento específico. Adicionalmente establecieron un sistema de transformación de plantas de maíz que expresaran los ARNdc efectores y en experimentos in vivo observaron una significativa reducción en los niveles de infestación de raíces por parte del gusano (Baum et al. 2007). Del mismo modo en otros insectos de varios órdenes se han determinado diversos efectos fisiológicos derivados de la ingestión de este tipo de moléculas. Mao et al. (2007) demostraron la baja regulación de los genes CYP6AE14 y Glutatión-S-transferasa por Northern blot y la susceptibilidad de individuos de Helicoverpa armigera Hübner, 1805 (Lepidoptera, Noctuidae) al gossypol. Por su parte, y empleando el Lepidóptero Plutella xylostella Linnaeus, 1758 (Lepidoptera, Plutellidae) como modelo, Bautista et al. (2009) suministraron gotas ARNdc del gen CYP6BG1 a larvas alterando su resistencia a permetrina y lograron determinar una reducción del 98% en la expresión de este gen por medio de qPCR. Adicionalmente a esta evidencia, otros estudios realizados por Kumar et al. (2009) y Griebler et al. (2008), sugieren que el método de suministro por vía oral de ARNdc desencadena el proceso de silenciamiento génico especifico de ARNi. Lo anterior permite argumentar que la estrategia ARNi podría ser utilizada como alternativa de control de insectos vía expresión de ARNdc en la planta (Huvenne y Smagghe 2010).
Agradecimientos
Los autores agradecen al Ministerio de Agricultura y Desarrollo Rural de Colombia por la financiación de esta investigación. A la unidad de cría de parasitoides de Biocafé por el suministro del material entomológico.
Literatura citada
ASHIHARA, H.; SANO, H.; CROZIER, A. 2008. Caffeine and related purine alkaloids: Biosynthesis, catabolism, function and genetic engineering. Phytochemstry 69: 841-856. [ Links ]
BAKER, P.S. 1999. La broca del café en Colombia. Informe final del proyecto MIP para el café DFID-Cenicafé-CABI Bioscience (CNTR 93/1536 A). Chinchiná, Colombia, DFID. 154 p. [ Links ]
BAUM, J.; BOGAERT, T.; CLINTON, W.; HECK, G.R.; FELDMANN, P.; ILAGAN, O.; JOHNSON, S.; PLAETINCK, G.; MUNYIKWA, T.; PLEAU, M.; VAUGHN, T.Y.; ROBERTS, J. 2007. Control of coleopteran insect pests through RNA interference. Nature Biotechnology 25: 1322-1326. [ Links ]
BAUTISTA, M.A.M.; MIYATA, T.; MIURA, K.; TANAKA, T. 2009. RNA interference-mediated knockdown of a cytochrome P450, CYP6BG1, from the diamondback moth, Plutella xylostella, reduces larval resistance to permethrin. Insect Biochemistry Molecular Biology 39:38-46. [ Links ]
BUSTILLO P, A. 2008. Aspectos sobre la broca del café, Hypothenemus hampei, en Colombia. pp. 388-418. En: Bustillo P, A.E. (Ed.). Los insectos y su manejo en la caficultora colombiana. Federación Nacional de Cafeteros. Chinchiná. Colombia. 466 p. [ Links ]
BUSTILLO, A.E.; CÁRDENAS, R.; VILLALBA, D.A.; BENAVIDES, P.; OROZCO, J.; POSADA, F.J. 1998. Manejo Integrado de la Broca, Hypothenemus hampei (Ferrari), en Colombia. Cenicafe, Chinchiná, Colombia. 134 p. [ Links ]
CADENA, G.G. 1991. Sostenibilidad de la producción cafetera, el control de plagas y enfermedades. Ensayos Sobre Economía Cafetera 4 (6): 19-26. [ Links ]
CAMAYO, G.; ARCILA, J. 1997. Desarrollo floral del cafeto en condiciones de la zona cafetera colombiana (Chinchiná - Caldas). Cenicafé , Avances técnicos, No. 245. Chinchiná, Colombia. 8 p. [ Links ]
CHAVES, B.; RILEY, J. 2001. Determination of factors influencing integrated pest management adoption in coffee berry borer in Colombian farms. Agriculture, Ecosystems and Environment 87: 159-177. [ Links ]
CHEN, M-S. 2008. Inducible direct plant defense against insect herbivores: A review. Insect science 15: 101-114. [ Links ]
CLIFFORD, M. N.; IN, M. N.; CLIFFORD, K. C. 1985. Chemical and physical aspects of green coffee and coffee products. Wilson (eds), pp. 305-374. [ Links ]
FIRE, A.; XU,S.; MONTGOMERY, M.K.; KOSTAS, S.A.; DRIVER, S.E.; MELLO, C.C . 1998. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature 391(6669): 806-11. [ Links ]
FISCHER, M.; REIMANN, S.; TROVATO, V.; REDGWELL, R.J. 2001. Polysaccharides of green Arabica and Robusta coffee beans. Carbohydrate Research 330: 93-101. [ Links ]
GRIEBLER, M.; WESTERLUND, S.A.; HOFFMANN, K.H.; MEYERING- VOS, M. 2008. RNA interference with the allatoregulating neuropeptide genes from the fall armyworm Spodoptera frugiperda and its effects on the JH titer in the hemolymph. Journal of Insect Physiology 54: 997-1007. [ Links ]
GUERREIRO, O.; MAZZAFERA, P. 2003. Caffeine and resistance of coffee to the berry borer Hypothenemus hampei (Coleoptera: Scolytidae). Journal of Agricultural and Food Chemistry 51: 6987-6991. [ Links ]
GOKULAKRISHNAN, S.; CHANDRARAJ, K.; SATHYANARAYANA, N. GUMMADI. 2005 Microbial and enzymatic methods for the removal of caffeine. Enzyme and Microbial Technology 37: 225-232. [ Links ]
HUVENNE. H; SMAGGHE, G. 2010. Mechanisms of dsRNA uptake in insects and potential of RNAi for pest control: A review. Journal of Insect Physiology 56: 227-235. [ Links ]
KUMAR, M.; GUPTA, G.P.; RAJAM, M.V.2009. Silencing of acetylcholinesterase gene of Helicoverpa armigera by siRNA affects larval growth and its life cycle. Journal of Insect Physiology 55: 273-278. [ Links ]
MAO, Y.B.; CAI,W.J.; WANG, J.W.; HONG, G.J.; TAO, X.Y.; WANG, L.J.; HUANG, Y.P.; CHEN, X.Y. 2007. Silencing a cotton bollworm P450 monooxygenase gene by plant-mediated RNAi impairs larval tolerance of gossypol. Nature Biotechnology 25: 1307-1313. [ Links ]
PORTILLA, M. 1999. Desarrollo y evaluación de una dieta artificial para la cría de Hypothenemus hampei. Revista Cenicafé (Colombia) 50(1): 24-38. [ Links ]
REDGWELL, R.J; FISHER, M. 2006. Coffee carbohydrates. Mini review. Brazilian Journal of Plant Physiology 18(1): 165-174. UEFUJI, H.; TATSUMI, Y.; MORIMOTO, M.; KAOTHIENNAKAYAMA, P.; OGITA, S.; SANO, H. 2005. Caffeine production in tobacco plants by simultaneous expression of three coffee N-methyltransferases and its potential as a pest repellant. Plant Molecular Biology 59: 221-227. [ Links ] [ Links ]
VANHECKE, D.; JANITZ, M. 2005. Functional genomics using high throughput RNA interference. Drug discovery Today: Targets 10: 205-212. [ Links ]
VILLALBA, D.A.; BUSTILLO, A.E.; CHAVEZ, B. 1995. Evaluación de insecticidas para el control de la broca del café en Colombia. Revista Cenicafé (Colombia) 46 (3): 152-163. [ Links ]
WOLFROM, M. L.; PATIN, D. L. 1965. Carbohydrates of the coffee bean. IV. An arabinogalactan. Journal of Organic Chemistry 30: 4060-4063. [ Links ]
ZHOU, X.; WHEELER, M.M.; OI, F.M.; SCHARF, M.E. 2008. RNA interference in the termite Reticulitermes flavipes through ingestion of double-stranded RNA. Insect Biochemistry and Molecular Biology 38: 805-815. [ Links ]